一种25-羟基维生素D解离液、检测方法、应用及试剂盒与流程
一种25-羟基维生素d解离液、检测方法、应用及试剂盒
技术领域
1.本发明涉及到免疫层析检测技术领域,尤其是涉及到一种25-羟基维生素d解离液、检测方法、应用及试剂盒。
背景技术:
2.普遍认为血清25-羟基维生素d的高低可以反映维生素d的储存水平,并与维生素d缺乏的临床症状相关,因此25-羟基维生素d是维生素d缺乏临床症状的早期诊断的主要依据。而血清中的25-羟基维生素d主要与25-羟基维生素d结合蛋白(vdbp)结合,要检测25-羟基维生素d首先需要的就是解离。把25-羟基维生素d从vdpb中解离出来。
3.解离液首先将25-羟基维生素d从25-羟基维生素d结合蛋白中解离出来,目前vd解离方法有以下几种,但都具有相应的技术缺陷。
4.(1)强酸强碱法,通过过高或者过低的ph值,使维生素d结合蛋白变性或者发生构象的变化,从而失去与维生素d的结合能力,释放出来,但该方法获取的维生素d缓冲液由于ph问题不利于下一步与vd抗体的免疫反应。
5.(2)蛋白酶水解法,向样本中加入蛋白酶,使维生素d结合蛋白水解,释放维生素d。但该方法的缺陷为水解时间过长,违背了快速检测试剂盒开发的初衷。
6.(3)有机溶剂溶解法,利用相似相溶的原理,使用乙醇或乙腈提取沉淀蛋白,除去沉淀,回收含有待测25 羟基维生素d的上清液进行检测,但是该方法不能通过自动化完成,检测误差也较大。
7.(4)vd结合蛋白水解法,向样本中加入蛋白酶,使维生素d结合蛋白水解,从而释放维生素d。该方法的缺陷为酶水解时间过长,导致整个检测过程时间长。
8.(5)组合方法,目前较为常用的方法为使用ph3.8-4.8的试剂和5-30%dmso、液体有机酰胺、0.5-5%的短链醇钟提取维生素d。该方法含有dmso为剧毒物质,具有生物安全性风险。
9.现有技术cn 109738252 b公开一种25-羟基-维生素d解离液,该解离液包括:作为缓冲液的磷酸盐、beta-巯基乙醇、异硫氰酸胍、edta-2na、sds和tween-20。其中,该解离液可高效解离样本中结合态的维生素d,反应时间短,释放彻底,中性ph条件下进行反应,对后续反应影响小等优点。但该解离液中作为主要成分的异硫氰酸胍和edta均价格昂贵,试剂成本高不利于大量生产,且该解离液主要作用于化学发光法,对荧光免疫层析法有影响;另一方面解离时间相对较长。
10.现有技术cn 105556313 b涉及至少一种氟代烷基表面活性剂和至少一种具有1至4个碳原子的醇用于从维生素d结合蛋白解离维生素d和/或维生素d代谢物的用途,并且还涉及包含至少一种氟代烷基表面活性剂和至少一种具有1至4个碳原子的醇的溶液。该发明还提供了体外检测并定量生物样品中的维生素d和/或至少一种维生素d代谢物的方法,该方法包括使用至少一种氟代烷基表面活性剂和使用至少一种具有1至4个碳原子的醇,以从维生素d结合蛋白解离待检测的维生素d和/b或其一种或多种代谢物。但该发明的氟代烷基
表面活性剂均价格昂贵,试剂成本高;且氟代烷基表面活性剂难以在常温下保存,需要冰袋运输,运输难度成本高;另一方面,部分氟代烷基被分类为危险化学品,具有生物安全性风险。
11.现有技术cn 110749664 a公开了一种25-羟基维生素d结合蛋白的解离方法,包括以下步骤:配制母液,取血清样本,添加母液,涡旋1min混匀,然后将混合液静置5min后放入离心机离心;然后取所得溶液的上清液,加入乙醇,涡旋混匀,然后将混合溶液静置,将得到的溶液放入离心机,离心完成后,取上清液置入新的离心管中,使用氮气吹干仪吹干,然后加分离流动相复溶混匀,进行lc-ms/ms检测即可。该发明溶液使用一定浓度的二硫苏糖醇,可以使待分析物25-羟基维生素d很好的分离出来,能够提高25-羟基维生素d的检测结果,进一步确定维生素d的整体含量情况,同时二硫苏糖醇具有强还原性,提高了25-羟基维生素d在纯化提取过程中的稳定性。但该发明操作复杂,耗费时间长,解离时需要多种专业仪器,难以应对各种场景;且主要应用于lc-ms/ms检测,解离液对荧光免疫层析法有影响。
12.现有技术cn 113884687 b公开了一种用于检测人血液样本中25-羟基维生素d含量的解离剂,由edta二钠、二甲基乙醇胺、二甲基甲酰胺、异硫氰酸胍、全氟辛酸和缓冲液组成;所述缓冲液为磷酸盐缓冲液。上述技术方案中用于血液样本检测的维生素d的解离剂,解离充分,解决了国产25-羟基维生素d检测试剂盒灵敏度低于进口试剂盒的问题,检测结果准确,测定值cv小,操作简单,反应时间短,释放彻底,加入样本后1-2分钟即可解离,且中性缓冲液不影响解离后的免疫反应,可匹配快速检测试剂盒的应用;保证了对血清中25-羟基维生素d浓度的精确检测。但该发明全氟辛酸为氟代烷基表面活性剂,价格昂贵,试剂成本高;且难以在常温下保存,需要冰袋运输,运输难度成本高。
技术实现要素:
13.针对现有技术中操作复杂、检测时间过长的问题,本发明的目的之一是提供一种25-羟基维生素d解离液。
14.为了实现上述目的,本发明提供以下技术方案:一种25-羟基维生素d解离液,按重量份计,包括4-8份盐酸胍和2-4份碳酸丙烯酯,其ph值为7.0~9.0。
15.在25-羟基维生素d解离过程中,盐酸胍通过形成和解离蛋白结构中的肽键使得vdbp蛋白发生随机卷曲,使得蛋白质失去其活性结构,发生可逆性变性。而碳酸丙烯酯的极性结构使得肽键解离之后的各部分氨基酸残基发生松散现象,进一步分离,并且通过削弱疏水键、形成氢键聚合物减少vdbp蛋白的所需的解离能,使得n-d(自然-变性)反应向解离的方向大幅度偏移,使得盐酸胍的解离效果更加充分,解离所需时间更短。二者协同作用,提高解离效率。
16.优选的,还包括0.24份-0.73份tris缓冲液、1-3份壬基酚聚氧乙烯醚(np-40)、0.1-2份三(2-羧乙基)膦(tcep)、0.1-2份二乙烯三胺五乙酸五钠(dtpa-5na)。
17.np-40是表面活性剂,裂解全血样本中的细胞膜,使维生素d结合蛋白与反应物质充分混合,同时使vdbp变性,且可常温保存,减少解离时间,增加准确度。
18.dtpa-5na 作为络合剂,可使变性后的vdbp聚集沉淀,同样增加vdbp解离效率以及维生素d释放量,防止解离出的维生素d再次与vdbp结合,增加解离的维生素d的量,减少解
离时间,增加准确度。
19.tcep则是作为一种还原剂,其作用是解离蛋白结构中的二硫键,使得盐酸胍-碳酸丙烯酯体系能进一步影响蛋白质的内部结构,提高解离效率。
20.一种稀释液,按重量份计,包括0.24份-0.73份tris缓冲液、0.5-3份c13-15醇聚氧乙烯醚、0.1-2份tetronic1307(s9)、0.02-1份proclin300、0.2-2份tx-100,ph为7.4~8.8。
21.在此稀释液体系中,c13-15醇聚氧乙烯醚作为大分子表面活性剂,可以降低水的表面张力,由于其结构使得25羟基维生素d聚集,在保护25-羟基维生素d稳定性的同时,也可以促进25-维生素d与层析膜上抗体的结合,增加试剂卡的准确性。
22.tetronic 1307(s9)则可以通过特有的结构,可以与血液中其他物质结合,降低血液中的基质效应,降低假阳的可能性,提高试剂卡准确性。
23.本发明的目的之二是提供一种25-羟基维生素d的检测方法。
24.一种检测25-羟基维生素d的方法,包括如下步骤:a、取上述解离液与全血样本混匀,震荡1-3min后加入上述稀释液,混匀得到样本;b、取样本滴入到25-羟基维生素d检测试剂卡上,反应时间为10-15min;c、将试剂卡放入荧光免疫分析仪中进行检测,并读取数据,通过荧光强度(计算出的t/c值,即t线测得的信号值与c线测得的信号值之比)得出25-羟基维生素d的含量。
25.优选的,所述25-羟基维生素d检测试剂卡包括 pvc衬板、硝酸纤维素膜、结合垫、样本垫和吸水垫。
26.优选的,所述样品垫用样品垫处理液处理之后才能添加于试剂卡上,所述样品垫处理液包括tris缓冲液、海藻糖、bsa和tx-100。tris缓冲液为抗体蛋白与维生素d结合提供稳定的离子环境,通过离子间作用力防止抗体蛋白自身发生积聚。海藻糖与bsa通过与抗体蛋白结合防止抗体蛋白发生水解失活并且保护其不被解离液中成分影响从而失去检测活性影响实验结果,tx-100通过减少表面张力是液体更快的在试剂卡上移动,同时与维生素d的结合更充分。
27.所述硝酸纤维素膜上含有t线和c线,通过喷金划膜仪制备。所述t线通过将t线包被物喷涂于硝酸纤维素膜上加工而成。所述c线通过将c线包被物喷涂于硝酸纤维素膜上加工而成。
28.优选的,用于处理c线和t线的包被物包括:t线包被物包括tris缓冲液、海藻糖、bsa和抗25-羟基维生素d抗体蛋白,c线包被物包括tris缓冲液、海藻糖、bsa和羊抗鼠igg抗体蛋白。
29.t线上的抗25-羟基维生素d抗体蛋白通过与维生素d结合与时间分辨荧光微球标记抗25-羟基维生素d抗体蛋白结合,使其停留在硝酸纤维素膜t线。维生素d越多,t线停留的时间分辨荧光微球越多,荧光强度越高,通过检测荧光强度计算出的t/c值(t线测得的信号值与c线测得的信号值之比)可以检测维生素d含量。
30.羊抗鼠igg抗体蛋白通过与时间分辨荧光微球标记鼠igg蛋白结合,使其停留在硝酸纤维素膜c线,通过c线的荧光强度计算出的t/c值(t线测得的信号值与c线测得的信号值之比)可以检测维生素d含量优选的,所述结合垫喷涂有荧光标记物,所述荧光标记物包括时间分辨荧光微球标记的抗25-羟基维生素d抗体蛋白、时间分辨荧光微球标记鼠igg蛋白。
31.荧光标记物在适当刺激下可以发出荧光,通过检测荧光强度可以测量维生素d含
量。时间分辨荧光微球标记的抗25-羟基维生素d抗体蛋白与维生素d结合,通过维生素d可以与硝酸纤维素膜t线上的抗25-羟基维生素d抗体蛋白结合。时间分辨荧光微球标记鼠igg蛋白可以与硝酸纤维素膜c线上的羊抗鼠igg抗体蛋白结合。
32.本发明的目的之三是提供一种25-羟基维生素d解离液的应用。
33.本发明要求保护上述的25-羟基维生素d解离液在解离或者检测25-羟基维生素d中的应用。
34.本发明要求保护上述的25-羟基维生素d解离液在制备解离或者检测25-羟基维生素d试剂中的应用。
35.本发明还要求保护一种解离或者检测25-羟基维生素d试剂盒,包含上述的25-羟基维生素d解离液。
36.下面对本发明做进一步的解释:在vd解离的过程中,np-40作为一种常用去垢剂,在足够高的浓度下,每个分子的极性亲水区域朝向极性溶质(水),而疏水区域聚集在一起,形成一个具有疏水核心的热力学稳定的胶束。去垢剂胶束的疏水核心区域与蛋白质的疏水表面结合,形成可溶性的蛋白质-去垢剂复合物。在这个过程破坏细胞的双极脂质膜,从而释放和溶解膜结合蛋白解离细胞膜,释放出细胞中的25羟基维生素d蛋白与vdbp的聚合物,增加其与盐酸胍-碳酸丙烯酯发生反应的几率,以此增加解离效率和解离出维生素d的含量。基于上述与蛋白质疏水表面结合的原理,np-40同样在一定程度上能造成vdbp的变性失活,同样可以增加离效率和解离出维生素d的含量。
37.tcep则是作为一种还原剂,其作用是解离蛋白结构中的二硫键,使得盐酸胍-碳酸丙烯酯体系能进一步影响蛋白质的内部结构,提高解离效率。在盐酸胍-碳酸丙烯酯-tcep蛋白变性剂体系下,np-40进一步使得vdbp发生变性,失去与25-羟基维生素d结合的能力,进一步释放出游离的25羟基维生素d。dtpa-5na 作为络合剂,通过离子键结合与vdbp形成热力学更稳定的离子状态,可使变性后的vdbp聚集沉淀,同样增加vdbp解离效率以及维生素d释放量。组分之间通过协同作用,加速25-羟基维生素d的解离效率。
38.其次,在本发明解离液应用于荧光免疫层析法的过程中,本发明提供其他试剂如样品垫处理液、包被液,其中的海藻糖、bsa可以保护检测所需的抗体蛋白不被解离液中成分影响从而失去检测活性影响实验结果,从而保证试验的准确性。
39.与现有技术相比,本发明的有益效果如下:1.常温保存解离液,利于运输于保存,提高检测准确率。
40.2.本发明更加方便快捷,并且准确度和特异性提高,对维生素d的最低检出限提高,假阳性概率减少,可用于25-羟基维生素d体外检测。
41.3.本发明解离时间大幅缩短,可有效提高检测效率。
42.4.本发明提供的检测试剂盒,与市场上与化学发光发操作简单、与lc-ms相比设备价格更加低廉,与酶联免疫法相比灵敏度和特异性高。
附图说明
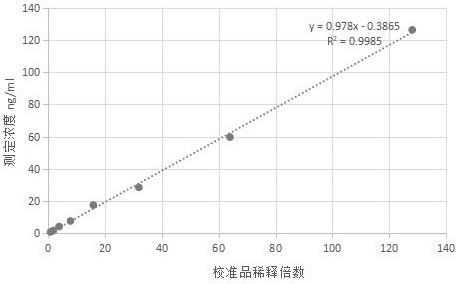
43.图1表示25-羟基维生素d检测试剂卡;图2表示本发明的方法线性范围实验结果。
具体实施方式
44.以下将结合实施例来详细说明本发明。需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
45.实施例11、试剂的制备(百分数均为百分比质量分数):解离液:将ph值为7.4、浓度为40mmol/l的tris缓冲液与盐酸胍、np-40、tcep、碳酸丙烯酯、dtpa-5na混合, 其中,所述解离液中盐酸胍的含量为5%、np-40的含量为1.5%、tcep的含量为0.5%、碳酸丙烯酯的含量为3%、dtpa-5na含量为0.3%。
46.稀释液:将ph值为7.4、浓度为40mmol/l的tris缓冲液与proclin300、tx-100、c13-15醇聚氧乙烯醚、proclin 300混合,其中,所述稀释液中proclin的含量为 0.02%、tx-100的含量为0.8%、c13-15醇聚氧乙烯醚的含量为0 .8%、tetronic 1307的含量为1%。
47.荧光微球工作液:将ph值为7.4、浓度为40mmol/l的tris缓冲液与酪蛋白酸钠、海藻糖、bsa、荧光微球标记的抗25-羟基维生素d抗体蛋白混合,控制所得荧光微球工作液中酪蛋白酸钠的含量为 0 .2%、海藻糖的含量为1%、bsa的含量为2%、荧光微球标记的抗25-羟基维生素d抗体蛋白的含量为1.5ug/ml。
48.t线包被液:将ph值为7.4、浓度为40mmol/l的tris缓冲液与海藻糖、bsa、荧光微球标记的抗25-羟基维生素d抗体蛋白混合,控制所得t线包被液中海藻糖的含量为1.5%、bsa的含量为2%、荧光微球标记的抗25-羟基维生素d抗体蛋白的含量为1.0ug/ml。
49.c线包被液:将ph值为7.4、浓度为40mmol/l的tris缓冲液与海藻糖、bsa、羊抗鼠igg抗体蛋白混合,控制所得c线包被液中海藻糖的含量为1.5%、bsa的含量为2%、羊抗鼠igg抗体蛋白的含量为0.8ug/ml。
50.样品垫处理液:将ph值为7.4、浓度为40mmol/l的tris缓冲液与海藻糖、bsa、tx-100,控制所得荧光微球工作液中所述稀释液中海藻糖的含量为2%、bsa的含量为1%、tx-100的含量为0.8%。
51.2、测定25-羟基维生素d含量如图1所示,从左至右分别是样品垫、结合垫、硝酸纤维素模、吸水垫,并且样品垫部分覆盖与结合垫上,结合垫部分覆盖于硝酸纤维素膜上,吸水纸同样部分覆盖于硝酸纤维素膜上。
52.将上述荧光微球工作液喷涂于金标结合垫上,将上述t线包被液、c线包被液喷涂于nc膜上,用上述样品垫结合液处理玻纤膜。然后将所得的金标结合垫、nc膜、样品垫、吸水纸与pvc板共同组装成25-羟基维生素d检测试剂卡。
53.向生物样本(具体是全血样本)中分别添加25-羟基维生素d标准品,得到25-羟基维生素d浓度分别为0、1、3、10、20、55、125ng/ml的校准品。取15μl校准品加入到60μl解离液中,震荡混匀1-3min。向解离后样本中加入240ul稀释液,混匀。
54.取80μl加入稀释液后样本加入到检测卡的加样孔中,在室温(25℃)条件下反应10-15min,得到校准品的反应检测卡。
55.将所述校准品的反应检测卡放入荧光免疫分析仪进行检测,得到反应检测卡的荧光强度(即校准品的荧光强度),并计算得到t/c值(t线测得的信号值与c线测得的信号值之比),利用校准品中25-羟基维生素d的浓度与t/c值绘制校准曲线,将校准曲线写入id卡,录
入荧光免疫分析仪(金浩峰khf01)。
56.取15μl生物样本(具体是全血样本)作为待测样本,与60μl解离液混合,震荡混匀1-3min。向解离后样本中加入240ul稀释液,混匀。
57.取80μl加入稀释液后样本加入到检测卡的加样孔中,在室温(25℃)条件下反应10-15min,得到待测样本的反应检测。
58.将所述待测样本的反应检测卡放入荧光免疫分析仪进行检测,根据校准曲线和反应检测卡的荧光强度(即待测样本的荧光强度),得到生物样本中25-羟基维生素d的含量。
59.实施例2添加成分对解离时间的影响准备10个25-羟基维生素d待测样本,用本发明所提供解离液配方以及相关工作液制成的试剂卡按照“实施例1中的测定25-羟基维生素d含量”中的方法进行测试,其中,解离时间分别为30s、1min、5min,再用市面上a产品(厦门为正生物科技股份有限公司的25-轻基维生素d测定试剂盒)按照产品说明书描述对待测样本进行测试,其中,解离时间设为5min、10min、15min。此外,用与本发明的解离液相比不含盐酸胍、碳酸丙烯酯、np-40、tcep、dtpa-5na的解离液配方制成的六组试剂卡对待测样本进行测试,其中,解离时间设为5min、10min、15min。共测定这五种情况下在不同解离时间下的待测样本浓度(ng/ml),以此各个配方验证解离时间对测定结果的影响。作为补充实验,用市面上产品a解离液与本发明所提供相关工作液制备的试剂卡按照“实施例1中的测定25-羟基维生素d含量”中的方法进行测试,其中解离时间设为5min、10min、15min。综上所述,本实施例共提供实施例1例,对比例8例,其中包括产品a,以及产品a解离液与本发明所提供试剂卡组合。
60.对比例1的解离液:将ph值为7.4、浓度为40mmol/l的tris缓冲液与np-40、tcep、dtpa-5na混合, 其中,所述解离液中np-40的含量为1.5%、tcep的含量为0.5%、dtpa-5na含量为0.3%。
61.对比例2的解离液:将ph值为7.4、浓度为40mmol/l的tris缓冲液与np-40、tcep、碳酸丙烯酯、dtpa-5na混合,其中,所述解离液中np-40的含量为1.5%、tcep的含量为0.5%、碳酸丙烯酯的含量为3%、dtpa-5na含量为0.3%。
62.对比例3的解离液:将ph值为7.4、浓度为40mmol/l的tris缓冲液与盐酸胍、np-40、tcep、dtpa-5na混合, 其中,所述解离液中盐酸胍的含量为5%、np-40的含量为1.5%、tcep的
含量为0.5%、dtpa-5na含量为0.3%。
63.对比例4的解离液:将ph值为7.4、浓度为40mmol/l的tris缓冲液与盐酸胍、碳酸丙烯酯、tcep、dtpa-5na混合, 其中,所述解离液中盐酸胍的含量为5%、碳酸丙烯酯的含量为3%、tcep的含量为0.5%、dtpa-5na含量为0.3%。
64.对比例5的解离液:将ph值为7.4、浓度为40mmol/l的tris缓冲液与盐酸胍、np-40、碳酸丙烯酯、dtpa-5na混合, 其中,所述解离液中盐酸胍的含量为5%、np-40的含量为1.5%、碳酸丙烯酯的含量为3%、dtpa-5na含量为0.3%。
65.对比例6的解离液:将ph值为7.4、浓度为40mmol/l的tris缓冲液与盐酸胍、np-40、tcep、碳酸丙烯酯混合, 其中,所述解离液中盐酸胍的含量为5%、np-40的含量为1.5%、tcep的含量为0.5%、碳酸丙烯酯的含量为3%。
66.其他试剂与实施例1相同。
67.作为补充实验,对比例7用市面上产品a解离液与本发明所提供相关工作液制备的试剂卡按照“实施例1中的测定25-羟基维生素d含量”中的方法进行测试。
68.由表1-表5可知,市场上产品a以及去除实施例1中的核心成分之后的对比例的配方都是在解离10min之后,十五分钟左右达到稳定,而本发明可以在1min内达到产品a10min的效果,并且从5min结果中浓度只有小幅度增加来看,在1min左右,解离已经充分完成。不仅如此,解离出的维生素d浓度也有小幅度增加。由此可见,相比现有技术,本发明大幅度提高了解离效率,缩短解离时间,小幅度增加解离出的维生素d的含量。而去除次要成分的3组对比例显示,充分解离时间仍在10min之后,并且解离出的维生素d含量也明显减少,但相比于去除核心成分的3组对比例又有所增加。说明次要成分在本发明配方中亦有发挥了重要作用。因此,试验证明本发明成分之间发挥了协同作用,共同增加了解离效率与解离出维生素d的量。
69.实施例3方法重复性试验和方法准确性试验以样本加标10ng/ml和80ng/ml作为待测样本,按照“实施例1中、测定25-羟基维生素d含量”中的方法进行测试,其中,每个样本平行测定10次,计算所得检测结果的变异系数。
70.由表6可知,样本浓度为10ng/ml和80ng/ml时,重复性试验所得检测结果的变异系数不超过10%,证明本发明提供的方法精密度高。
71.方法准确性试验以国际参考物srm 972a作为待测样本,用本发明所提供解离液配方以及相关工作液制成的试剂卡按照“实施例1中、测定25-羟基维生素d含量”中的方法进行测试,共平行测定5次,计算相对偏差。再用市面上a产品按照产品说明书描述对待测样本进行测试。此外,用对比例1-3提供解离液以及相关工作液制成的三组试剂卡对待测样本进行测试。共测定这五种情况下在不同解离时间下的待测样本浓度(ng/ml),以此验证各个配方的准确度。
72.由表7可知,测值与标识值的相对偏差不超过
±
7.00%,远低于
±
10%,证明该试剂盒准确性良好。不仅如此,在与其他配方或者市面上产品a倾向对偏差均大于所选定实施例1的原始配方,说明发明对试剂盒准确度有明显提高。
73.实施例4方法线性范围实验和方法检出限验证取高值样本分别按2倍、4倍、8倍、16倍、32倍、64倍及128倍进行稀释,按照“实施例1中、测定25-羟基维生素d含量”中的方法进行3次重复测试,计算平均值,将测定浓度的平均值与浓度倍数用最小二乘法进行直线拟合,计算线性相关系数r。
74.由表8和图2可知,本发明试剂盒具有较宽的线性范围,线性范围达到[1,120]ng/ml,且相关系数r》0.995,说明拟合数据相关性良好。
[0075]
方法检出限验证取5个浓度接近检出限的待测样本,按照“实施例1中、测定25-羟基维生素d含量”中的方法进行3次重复测试,统计未检出概率。
[0076]
由表9可知,未检出概率《5%,本发明试剂盒检出限不高于1ng/ml。
[0077]
上述实施例阐明的内容应当理解为这些实施例仅用于更清楚地说明本发明,而不用于限制本发明的范围,在阅读了本发明之后,本领域技术人员对本发明的各种等价形式的修改均落入本技术所附权利要求所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1