一种测定血清中人源UKLK1的ELISA方法与流程
一种测定血清中人源uklk1的elisa方法
技术领域
1.本发明涉及一种测定血清中人源抗体的elisa方法,尤其涉及一种测定血清中人源uklk1的elisa方法,属于生物医药技术领域。
背景技术:
2.人尿激肽原酶(u-klk1)主要成分为激肽原酶,系从人尿中提取精制的一种由238个氨基酸组成的糖蛋白。激肽原酶(kiniogenase)又叫激肽释放酶(kallikrein),是激肽原酶-激肽系统(kks)的一个组成成员。kks在激肽乳动物中广泛存在,与体内多个信号系统有密切的联系。kks系统的组成有以下几个部分: 激肽原、激肽原酶、激肽、激肽酶、激肽受体和激肽原酶抑制剂。激肽原在激肽原酶的作用下,释放出激肽。激肽通过与激肽受体结合,产生下泳的信号传导途径,发挥各种生理功能。激肽可被激肽酶降解。激肽原酶可被激肽酶制剂所抑制。
3.激肽原酶分为血浆激肽原酶(pk)和组织激肽原酶(tk)。血浆激肽原酶存在于血浆中。组织激肽原酶广泛存在于人体肝、肾、脑等器官和唾液、血浆、关节液、脑脊液等各种体液中。组织激肽原酶的分布比血浆激肽原酶广泛,主要在组织中合成。这一类激肽原酶在人体中已经发现15种,位于同一染色体上,但是只有组织型激肽原酶1(hk1)具有催化激肽原水解产生激肽的作用。其催化的活性位点组氨酸、天冬氨酸和丝氨酸分别位于hk1编码基因的1、3、5外显子。人尿激肽原酶(尤瑞克林),实际上就是分泌到尿液的组织型激肽原酶1(hk1)。
4.hk1最早发现在肝中合成,其英文名kallikrein,就是取希腊文“肝”的词根而起的,即在肝里产生的蛋白酶。血浆中的hk1主要来自肾,其次是动脉平滑肌细胞和中性粒细胞,另外一些细胞也释放hk1。人尿里的激肽原酶有50%是有活性的,另50%是以酶原形式存在。一价或二价阳离子抑制人尿激肽原酶的活性。
5.hk1是酸性蛋白,pi约4.0,分子量24-45kd,长238aa,单链。肝与肾的组织激肽原酶1在162位具有多态性。唾液腺的组织激肽原酶1在121位和162位也具有多态性。klk1蛋白产物具有三个天冬氨酸连接的n糖链和三个o糖链,糖基占20%。糖链上的唾液酸对该酶的热稳定性起到重要作用。hk1以前体的形式(preprokallikrein)产生,信号肽长17个aa。preprokallikrein从细胞中分泌出来时,信号肽被切掉,成为酶原形式(prokallikrein)。从酶原形式到活性形式,prokallikrein要被切掉7个氨基酸。这个过程可能发生在细胞内的高尔基体或分泌泡内;也可能发生在细胞外,即分泌出细胞后,被激活的组织激肽原酶所激活,或被其它有胰酶特性的酶激活。血浆激肽原酶和纤溶酶都可激活hk1,但效率不高。因此,血浆中的hk1以三种形式存在:活性形式、酶原形式,还有一种形式是与α1-抗胰蛋白酶结合的复合体形式。
6.市场上尤瑞克林(uklk1)用于轻-中度急性血栓性脑梗死的作用靶点是激肽释放酶-激肽系统(kallikrein-kinin system,kks)。研究表明,在脑缺血急性期,kks激活参与侧支小血管的迅速开放,改善缺血区血流灌注并抑制神经细胞的凋亡;在脑缺血恢复期,
kks激活对缺血区血管新生和神经元再生具有促进作用,kks还可减少梗死后的细胞凋亡、减弱脑内的氧化应激反应、增加胶质细胞的存活和迁移。尤瑞克林是从尿液中提取出的一种组织性激肽释放酶(tissue kallikrein,tk),它通过催化激肽原产生胰激肽、之后在激肽酶1的作用下产生一个九肽调节物,从而靶向性的作用于缺血部位的b1受体,选择性地扩张脑部细微动脉,改善缺血区的血供和氧供;同时还能促进缺血区新生血管的生成。
7.在世界范围内,急性缺血性脑卒中(ais)仍是导致死亡和残疾的主要原因。而最严重的后果则是由于脑底动脉环(willis环)内的主要分支血管堵塞造成的。当前,针对大血管闭塞,西方国家主要的治疗策略是通过使用机械或药物方法(例如,组织血浆激活剂;tpa)去除有问题的血凝块来快速恢复血流。klk1负责生成激肽(缓激肽和胰激肽),促进局部血管扩张和长期血管形成。此外,klk1现已被临床用于直接治疗包括ais在内的与局部血流障碍相关的多种疾病。目前,中国已经批准从人尿中分离出的一种人klk1用于ais的亚急性治疗。
8.市场上的现有试剂盒均为重组human klk1,对uklk1特异性不好,从而导致无法正确测定。
技术实现要素:
9.本发明的目的是针对现有技术存在无法正确测定uklk1的缺陷,提出一种测定血清中人源uklk1的elisa方法,提高检测特异性与灵敏度。
10.本发明通过以下技术方案解决技术问题:首先是定量测定血清中uklk1的elisa方法,包括如下步骤:步骤1)用抗人uklk1 抗原包微孔板(anti-uklk1),得到包被后的微孔板;步骤2)将待测uklk1样品加入抗原包被的微孔板中孵育结合,形成“抗原-抗体”复合物;步骤3)加入uklk1(labelled uklk1)检测抗体,所述抗原包被的微孔板中与抗原-抗体复合物孵育结合,形成“抗原-抗体-检测抗体”复合物;步骤4)加入streptavidin-hrp标记的亲和素所述抗体包被的微孔板中与“抗原-抗体-检测抗体”复合物孵育结合,形成“抗原-抗体-检测抗体-sa-hrp标记的亲和素”复合物,加入底物tmb显色;步骤5)终止液终止反应,测定od值;步骤6)通过uklk1标准曲线计算待测样品在血清中uklk1浓度。
11.以上方法的步骤1)中,所述uklk1抗源浓度为0.5μg/ml~2.5μg/ml;优选地,所述uklk1的浓度为1μg/ml;用anti-uklk1抗原包微孔板,得到包被后的微孔板在4~8℃放置≥16小时,放置后的微孔板加入封闭液,并且在37℃孵育2小时;步骤2)中,所述己知uklk1抗体浓度配制在混合小鼠血清标准曲线范围,75pg/ml~8000pg/ml;质量控制样品范围400~4000ng/ml。
12.步骤3)中,所述labelled uklk1检测抗体浓度为0.5μg/ml~4μg/ml;优选地,所述labelled 2μg/ml。
13.步骤4)中,所述sa-hrp标记的亲和素1:50~1:800;优选地,所述sa-hrp标记的亲和素1:200。所述加hrp酶的底物(tmb)入显色时间5~20分钟;优选地,所述tmb底物显色时
间5分钟。
14.步骤5)中,所述加入终止液时间5分钟内,在450nm(参比波长620nm)处用酶标仪测定吸光度值(od值)。
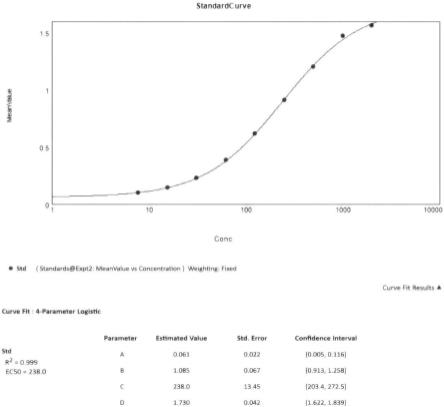
15.步骤6)中,通过uklk1标准曲线计算待测样品在血清中uklk1浓度,如下:已知标准曲线,qc及血清样品中uklk1浓度计算通过microsoft excel 2010软件获取uklk1标准曲线浓度对数,然后通过simaplot10.0软件分别获取uklk1标准曲线浓度对数作为x和y轴制作标准曲线并进行logistic四参数拟合。
16.f=d + (a
‐
d)/(1+10^((x
‐
logc)*b)),(权重=1/y^2)获得方程参数后按标准曲线拟合方程(如上),用microsoft excel 2010计算生物样品中的浓度。
17.进一步地,以上方法的步骤2~4);加入样品后,在37℃孵育1小时。所述封闭液为2%bsa/pbs,样品稀释液为1%bsa/pbs/0.05% tween-20。
18.本发明进一步提供定量测定血清中uklk1的elisa方法的应用,包括在uklk1药物监测,uklk1工艺开发以及uklk1生产的应用。
19.根据现在市场现有elisa的方法或者试剂盒,本发明针对人源抗原与uklk1孵育结合,然后加入标记klk1检测抗体,再加入sa-hrp标记的亲和素加,形成抗原-抗体-检测抗体-hrp标记的亲和素复合物,来提高血浆浓度测定灵敏度。并且通过方法学进行了论证。内容包括标准曲线,精密度和准曲度,稀释线性与钩状效应,基质效应与回收率,稳定性。其有益效果是:检测灵敏度高、误差小、特异性高,能够正确、有效地定量pk与tk抗体在血清中浓度,可以用于临床前pk与tk样品,也可以用于临床样品测定(方法微调整),缩短项目进程,尽早进入临床阶段,应用范围可扩大至人血清。
附图说明
20.图1为本发明uklk1在大鼠血清中标准曲线图,图中横坐标为标准曲线理论浓度(pg/ml),横坐标为标准曲线测定浓度(pg/ml)。
21.图2为本发明uklk1在大鼠血清中稀释线性(样品最高稀释倍数32000)。
实施方式
22.以下结合具体实施例对本发明的技术方案做进一步说明,应理解,这些实施例只是为了举例说明本发明,具体数值为典型值,而非以任何方式限制本发明的范围。在本发明中所使用的术语,除非另有说明,一般具有本领域普通技术人员通常理解的含义。
23.在以下实施例中,未详细描述的各种过程、方法和试剂是本领域中公知的常规方法和产品。
24.名词解释:ar:analytical recovery分析回收率cal:calibrator标准曲线conc:concentration浓度cv:coefficient of variation变异系数bsa:bovine serum albumin , 牛血清蛋白
d,d:day天elisa:enzyme-linked immunosorbent assay酶联免疫分析方法ft:freeze thaw冻融g:gram or g-force克h,h,hr:hour小时lloq:lower limit of quantification定量下线uloq:upper limit of quantification定量上线hqc:high quality control sample高浓度质控样品id:identification识别kg:kilogram千克lqc:lower quality control sample低浓度质控样品m:molar摩尔m:minute分钟mg:milligram亳克ml:milliliter亳升mqc:medium quality control sample中浓度质控样品n:number of values included in statistics统计数na:not applicable不适用ng:nanogram纳克nm:nonomolar纳摩pg:picogram皮克qc:quality control sample质控样品r2:correlation coefficient相关系数re/bias:relative error,相对误差;rt:room temperature室温sd/s.d.:标准差;μl:microliter微升μm:micromolar微摩μg:microgram微克v:volume体积w:week周od:optical density光密度对比例1r&d duoset elisa kit (cat #dy2337-05(5 plates) foe test human kallikrein11:1 根据elisa kit 用途介绍:试剂盒适用于development of sandwich elisa to measure natural and recombinant human kallikrein1。如大部分cell culture supernate,serum and plasma samples。
25.1:2 试剂盒提供试剂:
1:2:1: streptavidin-hrp1:2:2: mouse anti-human kallikrein 1 capture antibody1:2:3: biotinylated goat anti-human kallikrein 1 detection antibody1:2:4: recombinant human kallikrein1 standard1:3: 根据试剂盒实验步骤,用1:2:4与uklk1配制在大鼠血清标准曲线:标准曲线浓度分别为3000,1500,750,375,188,93.8与46.9pg/ml,blank。
26.1:4: 结果如下:表1 用试剂盒中重组kallikrein1标准品在大鼠血清准品配制标准曲线
27.表2 用human uklk1标准品在大鼠血清准品配制标准曲线
28.对比例2:cusabio human kallikrein1(klk1) elisa kit (cat #csb-e11437h foe test human kallikrein12:1 根据elisa kit 用途介绍:试剂盒适用于定量测定人源kallikrein 1浓度在血浆、血清和组织中。
29.2:2:1: hpr-avidin2:2:2: coated assay plate2:2:3: biotin antibody2:2:4: standard1:3: 根据试剂盒实验步骤,用2:2:4与uklk1配制在试剂盒稀释液与大鼠血清标准曲线:标准曲线浓度分别为50,25,13,6.25,3.125,1.5625与0.78125ng/ml,buffer, mix blank。
30.2:4: 结果如下:表3 klk1与uklk1在缓冲液/大鼠血清配制标准曲线
31.对比例3 125
i-uklk1在sd大鼠血清中的样品测定1: 实验准备:1:1: 未标记受试物与标记受试物:uklk1与
125
i-uklk11:2:实验结果-hplc分样结果通过hplc制备分离后对各馏分进行伽马计数检测,结果显示
125
i-尤瑞克林的放射性出峰在约9min,游离碘的放射性出峰在14min。
32.2: 实验过程:2:1: 6只(m) sd大鼠2:2: 受试物:
125
i-uklk12:3: 给药途径: i.v2:4: 给药剂量:6.75μg/kg2:5: 给药剂量:20uci2:6: 6只sd 大鼠给予
125
i-uklk1后于1min、2min、5min、10min、15min、20min、30min、1h、2h、、4h、6h、8h经眼眶采血(约0.2ml) ,edta抗凝(每管10μl),在4℃和3000rpm条件下离心10min分离血清。用交叉采血的方式进行血液采集,每个时间点3只。
33.2:7 hplc-分样结果血浆样品通过hplc制备分离后对各馏分进行伽马计数检测,结果显示给药后1min,5min、10min主要在原型药(9min)或(6.7min)出峰位置观察到放射性峰;给药后15min与血浆蛋白结合的复核物(6.7min)和游离碘的出峰位置都看到明显的放射性峰;17min以后主要在游离碘位置看到放射性峰。
34.对比例4基于lc-ms/ms的uklk1检测方法开发实验目的:大鼠血清中uklk1征肽段的定量检测方法开发。
35.实验材料:大鼠皮下给药0.15、0.3pna/kg及静脉给药0.15pna/kg后0.083、0.25、0.5h冻存血浆样本,2%bsa-pbst溶液,标记抗体,包被抗体。
36.实验设计:尤瑞克林经盐酸胍变性,胰蛋白酶酶解后生成特征肽段,经高分辨质谱分析选择肽段ltepadtitdavk和qadedyshdlmllr作为特征肽段用于后续定量分析。优化变性条件(甲酸水与异丙醇进行沉淀,然后浓缩、干燥,再用100ul 0.1%fa水溶液复溶、离心、取上清)和胰蛋白酶浓度(200μl至0.5ml螺口管中,每支样品管中加入1% bsa溶液3μl,混合均匀后,瞬离,45℃,真空浓缩至干,加入酶,进行酶切作用。血浆样品经spe处理(hlb小柱,0.1%tfa淋洗,水洗脱除盐,以100μl乙腈:水8:2洗脱)后于triple quad 5500+检测。
37.实验结果:检测下限为0.15pna(约25μg/ml)讨论:反应体系中的盐浓度对特征肽段的响应影响较大,适当降低盐酸胍和dtt的浓度可以提高特征肽段的响应。尤瑞克林特征肽段不呈线性关系,样品稀释后,稀释关系与响应也不成线性关系。当增加血浆用量,以提高绝对进样浓度,试图降低检测下限时,特征肽段的丰度急剧降低,可能与血浆参与酶解反应有关。
38.实施例
39.如图1与表4~16所示,一种测定血清中人源uklk1的elisa方法,包括以下步骤:1 实验准备1.1把恒温培养箱调至37℃。
40.1.2将洗涤液瓶充满洗涤缓冲液,清空废液瓶,冲洗洗板机。
41.2 实验操作2.1 包被抗原将抗原(anti-klk1) 1mg/ml用1xpbs液稀释至1μg/ml。将稀释好的抗原(anti-klk1)加入板内,每孔100μl。用封板膜贴好,封严,放置于4℃过夜(≥16h)。
42.2.2 封闭板将过夜包被的板用洗板机洗涤pbst(0.05%tween/pbs) 4次(300μl/well)。拍尽残液。每孔加入300μl封闭缓冲液(1%bsa/pbs),用封板膜贴好,封严37℃放置2h。
43.2.3 标准品标曲点稀释用100%小鼠血清将己知浓度标准品(gq001)稀释至100μg/ml,以此作为首浓度;然后空白大鼠血清稀释到10μg/ml,然后从10μg/ml稀释到2μg/ml,再从2μg/ml分别稀释8000pg/ml,5000pg/ml,2500pg/ml,1000pg/ml,500pg/ml,250pg/ml,125pg/ml,62.5pg/ml与31.25pg/ml,包括首浓度2μg/ml在内共10个梯度,末浓度为31.25pg/ml,编号分别为1-10;再用稀释缓冲液将1-10分别稀释25倍,依次标记为c1-c10,另外做阴性对照,即直接用稀释缓冲液将空白大鼠血清稀释25倍,编号为c11。标准曲线锚定点分别为;2μg/ml与31.25pg/ml。
44.2.4 标准品质控点稀释将标准品分别用100%空白大鼠血清稀释成2μg/ml,然后从2μg/ml分别稀释: hqc 4000pg/ml,mqc 1500pg/ml,gmqc 400pg/ml,lqc 100pg/ml,再用稀释缓冲液将以上四个浓度依次分别稀释25倍,编号依次为qc1,qc2,qc3,与qc4。
45.2.5 加样与孵育样品将2.3和2.4中稀释好的样品从上至下加入板中,每个浓度2复孔,复孔横向排列,每孔100μl,用封板膜贴好,封严37℃放置2h。用洗板机洗涤4次,拍尽残液。
46.2.6 检测抗体(labelled uklk1)板内加入labbelled uklk1检测抗体;用稀释缓冲液稀释至1μg/ml,每孔100μl,用封板膜封严,37℃放置1h。用洗板机洗涤4次,拍尽残液。
47.2.7 孵育二抗板内加入用稀释缓冲液稀释为1:200(v/v) sa-hrpp抗体,每孔100μl。用封板膜封严,37℃放置1h。用洗板机洗涤4次,拍尽残液。
48.2.8 显色
板内加入tmb底物,每孔100μl,37℃避光反应5min。用1m h2so4终止反应,每孔100μl,用酶标仪读取吸光值,波长为450nm,参比波长为620nm。
49.2.9 数据分析与计算通过microsoft excel 2010软件获取标准曲线浓度对数,然后通过simaplot10.0软件获取标准曲线浓度对数和od值平均值作为x和y轴制作标准曲线并进行logistic四参数拟合。
50.f=d + (a
‐
d)/(1+10^((x
‐
logc)*b)),(权重=1/y^2)获得方程参数后按标准曲线拟合方程(如上),用microsoft excel 2010计算浓度。
51.浓度回算:取复孔的平均od值,代入标曲后回算出浓度的log值,进而得出回算浓度值。
52.2.10用空白混合(f/m) 大鼠制备血清样品(标曲、质控)表 4 uklk1在大鼠血清中标准曲线样品配制
53.表 5 uklk1 在大鼠血清中质控样品配制
54.表6 uklk1标准曲线各浓度点的统计结果
55.*:std01和std09作为锚定点,仅做标准曲线拟合使用表7样品的统计结果
56.表8准确度与精密度的统计结果
57.表9释线性结果
58.p.s: 按cde指导原则中接受标准:回算浓度在标准曲线的lloq和uloq之间的序列稀释样品的平均准确度偏差不超过预期浓度的
±
20%(lloq水平不超过25%)。线性工作范围内有80%稀释样品在以上标准内,则认为稀释线性是可接受的。
59.表10特异性
60.表11选择性
61.表12大鼠血清中uklk1预处理后工作台1h、2h和4h稳定性
62.表13大鼠血清中uklk1在2-8℃冷藏稳定性
63.表14大鼠血清中uklk1在24h室温稳定性
64.表15大鼠血清中uklk1在≤-65℃ 1次和2次和3次冻融稳定性
65.表16大鼠血清中uklk1≤-65℃ 3个月长期稳定性
时没有钩状效应。
69.p.s: 按cde指导原则中接受标准:回算浓度在标准曲线的lloq和uloq之间的序列稀释样品的平均准确度偏差不超过预期浓度的
±
20%(lloq水平不超过25%)。线性工作范围内有80%稀释样品在以上标准内,则认为稀释线性是可接受的。
70.1.4 选择性选择性验证主要考察10个个体基质,数据见表11,每个个体基质考察lloq(62.5pg/ml)uloq(5000pg/ml)2个浓度与blank的样品,结果显示,10个个体在blank中的回算结果均为bql;在lloq(62.5pg/ml)理论浓度相比相对偏差率(%bias)分别为-1.2%,-3.2%,-0.6%,-0.6%,0.1%,-3.6%,3.9%,0.4%,0.6%,0.3%。在uloq(5000pg/ml)水平下,与理论浓度相比对偏差率(%bias)分别为2.1%,1.4%,-0.5%,-1.3%,0.9%,-1.6%,-1.9%,0.1%,3.6%,4.2%。
71.实验结果表明10个个体基质配制的验证样品回算浓度的分析在可接受范围内。
72.1.5 特异性特异性验证数据见表10。在hqc(4000pg/ml)、lqc(150pg/ml)和blank(0 pg/ml)验证样品中分别加入100000、10000 pg/ml的人igg后,hqc水平测得的uklk1的平均回收率分别为85.95%和81.95%,lqc浓度水平测得的uklk1的平均回收率分别为101.62%和103.06%,blank浓度水平测得的uklk1均为bql。当小鼠血清中分别存在100000和10000 pg/ml的人igg时,验证样品的分析对偏差率(%bias)基本符合可接受标准,人igg对uklk1的测定没有影响。
73.1.6 冻融稳定性验证样品的反复冻融稳定性实验数据见表15,结果表明冻融1次时,hqc(4000 pg/ml)和lqc(150pg/ml)稳定性样品与理论浓度相比对偏差率(%bias)分别为4.5%和2.2%。冻融2次时,与理论浓度相比对偏差率(%bias)分别为1.4%和2.0%。冻融3次时,与理论浓度相比正确率%bias分别为5.0%和-1.1%。
74.结果显示,血清样品在冻融3次时,冻融因素对结果的影响在可接受范围内。
75.1.7 实验台稳定性实验台稳定性验证实验主要考察了验证样品于3种实验条件下的稳定性:稀释液预处理质控样品后放置于2~8
º
c 1hr、2hr与4hr,2~8
º
c与室温放置24hr,验证结果见表12和表13,在2~8
º
c存放24hr的相对偏差率(%bias) lqc(150pg/ml) 和hqc(4000pg/ml)分别为1.4%和1.9%。验证样品在室温放置24hr的相对偏差率(%bias) lqc(150pg/ml)和hqc(4000pg/ml)分别为0.2%和1.9%。稀释液预处理质控样品后,放置2~8
º
c放置1hr、2hr与4hr的相对偏差率(%bias) lqc(150pg/ml)和hqc(4000pg/ml)分别为1.9%和1.0%,1.3%和0.1%,3.5%和-5.8%。结果显示,大鼠血清验证样品在稀释液预处理质控样品后,于2~8℃放置1hr、2hr、4hr,测定结果的影响在可接受范围内。样品在2~8
º
c条件下放置24hr,对测定结果的影响在可接受范围内。样品在室温条件下放置24hr,对测定结果的影响在接受范围内。
76.1.8 长期稳定性长期稳定性主要考察验证样品在≤-65℃条件下,样品贮存92天的稳定性条件下的稳定性,确保生物样品经此条件保存后的可靠性。长期稳定性验证结果见表16。
77.lqc(150pg/ml)和hqc(4000pg/ml)稳定性样品≤-65℃条件下,样品贮存92天的稳
定性%bias分别为1.8%和1.9%。
78.结果显示,样品在≤-65℃条件贮藏92天对样品的测定结果的影响在可接受范围内。
79.结论:市场上现有试剂盒均为重组human klk1(对比例1-2),所以对uklk1特异性不好,从而导致无法正确测定。另外对比例3:结果显示同位素
125
i-uklk1在sd大鼠血清中的样品测定给药后15min与血浆蛋白结合的复核物(6.7min)和游离碘的出峰位置都看到明显的放射性峰20min要在游离碘位置看到放射性峰。对比例4 lc/ms/ms 结果显示灵敏度只有25μg/ml。实施例1用人源klk1做抗原,用三明治的elisa方法测定uklk1在大鼠血清浓度范围5000pg/ml~62.5pg/ml。
80.除上述实施外,本发明还可以有其他实施方式。凡采用等同替换或等效变换形成的技术方案,均落在本发明要求的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1