一种25羟基维生素D检测试剂盒的制作方法
一种25羟基维生素d检测试剂盒
技术领域
1.本发明涉及体外诊断技术领域,具体的说,涉及一种25羟基维生素d检测试剂盒。
背景技术:
2.早在20世纪30年代初,科学家研究发现,多晒太阳或食用紫外光照射过的橄榄油、亚麻籽油等可以抗软骨病,并将该活性组分命名为维生素d。维生素d是人和家畜、家禽生长、繁育、维持生命和保持健康必不可少的营养必需物质。
3.从膳食和皮肤两条途径获得的维生素d与血浆α-球蛋白结合被转运至肝脏后,首先在肝细胞内质网和线粒体中,经25-羟化酶作用,变成25-羟基维生素d。血清25-羟基维生素d的高低可以反映人体维生素d的储存水平,并且与维生素d缺乏的临床症状是相关的。
4.目前,常用的25羟基维生素d的检测方法有化学发光法、酶联免疫法、电化学发光法等,这些检测方法大部分耗时较长,操作繁琐,且需要大型仪器设备,不利于实现检测的“普遍化”。相比之下,免疫层析法操作简便、快捷,不需要额外的仪器设备,可实现检测基层化,方便在基层医院、诊所以及偏远地区进行使用。
技术实现要素:
5.本发明的目的在于提供一种25羟基维生素d检测试剂盒,具有携带方便、操作简单、灵敏度及符合率高、稳定性强等优点,适合家庭自测以及基层诊所、无大型仪器设备的医疗机构,有利于实现社会化、普遍化检测,提高民众身体素质。
6.为实现上述目的,本发明采用的技术方案如下:一种25羟基维生素d检测试剂盒,包括试纸条,试纸条包括pvc板,pvc板上从左到右依次包括吸水区、反应区、连接桥、释放区、加样区,连接桥为聚氨酯、玻璃纤维、纤维素、聚酯膜中的一种。
7.作为一种优化方案,所述连接桥为纤维素。
8.作为一种优化方案,所述连接桥的制备方法包括如下步骤:取纤维素浸泡于40ml处理溶液中静置24h,35℃条件下烘干12h,裁切到所需宽度。
9.作为一种优化方案,所述处理溶液包括pbs缓冲溶液20-50mm、bsa 0.2-1%、pvp 0.5%-1.2%、吐温20 0.2%-1%、曲拉通0.2-1.5%。
10.作为一种优化方案,所述处理溶液包括pbs缓冲溶液30mm、bsa 0.6%、pvp 0.5%、吐温20 0.5%、曲拉通0.8%。
11.作为一种优化方案,所述连接桥的长度为6mm。
12.作为一种优化方案,所述吸水区的一端搭接在反应区的一端上,连接桥的一端搭接在反应区的另一端上,释放区的一端搭接在连接桥的另一端上,加样区的一端搭接在释放区的另一端上。
13.作为一种优化方案,所述连接桥与反应区搭接宽度为0.7-1mm,释放区与连接桥搭接宽度为1mm。
14.作为一种优化方案,所述吸水区为吸水纸,反应区为包被有25羟基维生素d抗原的
硝酸纤维素膜,释放区为固相有25羟基维生素d抗体的金标固相垫,加样区为样品垫。
15.作为一种优化方案,所述吸水区的长度为22mm,反应区的长度为20mm,释放区的长度为5mm,加样区的长度为14mm,吸水区与反应区搭接宽度为1mm,加样区与释放区搭接宽度为1.5-2mm。
16.本发明采取以上技术方案,具有以下优点:本发明通过增加经过特殊处理的连接桥,延长抗原抗体的反应通道,增加抗原抗体反应时间,以此大大提高检测试剂的敏感性,本发明具有携带方便、操作简单、灵敏度及符合率高、稳定性强等优点,适合家庭自测以及基层诊所、无大型仪器设备的医疗机构,有利于实现社会化、普遍化检测,提高民众身体素质。
17.下面结合附图和具体实施方式对本发明作进一步说明。
附图说明
18.图1为本发明一种25羟基维生素d检测试剂盒中试纸条的结构示意图;图2为对比例中试纸条的结构示意图。
19.图中,1-吸水区,2-反应区,3-连接桥,4-释放区,5-加样区,6-pvc板。
具体实施方式
20.下面将结合实施例对本发明的实施方案进行详细描述,实施例中未注明具体条件,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市场购买获得的常规产品。
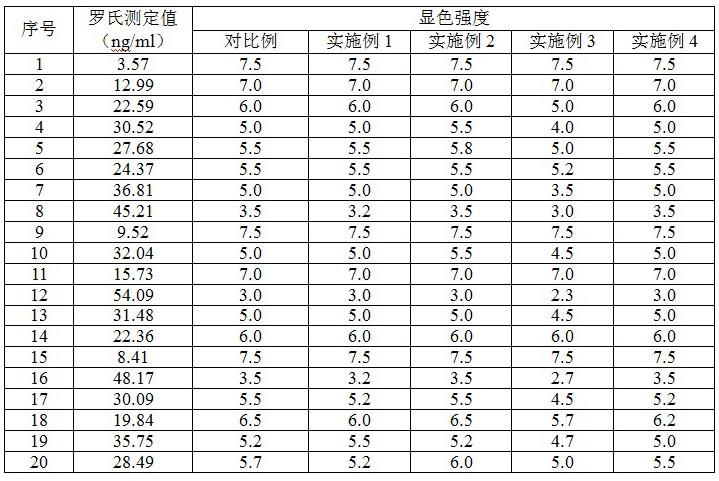
21.所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例,基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
22.以下实施例中所有百分数均为质量百分数。
实施例1
23.如图1所示,一种25羟基维生素d检测试剂盒,包括试纸条,试纸条包括pvc板6,pvc板6上从左到右依次包括吸水区1、反应区2、连接桥3、释放区4、加样区5,吸水区1的一端搭接在反应区2的一端上,连接桥3的一端搭接在反应区2的另一端上,释放区4的一端搭接在连接桥3的另一端上,加样区5的一端搭接在释放区4的另一端上,吸水区1为吸水纸,反应区2为包被有25羟基维生素d抗原的硝酸纤维素膜,释放区4为固相有25羟基维生素d抗体的金标固相垫,加样区5为样品垫,连接桥3为聚氨酯。连接桥3的长度为6mm,吸水区1的长度为22mm,反应区2的长度为20mm,释放区4的长度为5mm,加样区5的长度为14mm,吸水区1与反应区2搭接宽度为1mm,连接桥3与反应区2搭接宽度为0.7-1mm,释放区4与连接桥3搭接宽度为1mm,加样区5与释放区4搭接宽度为1.5-2mm。
实施例2
24.如图1所示,一种25羟基维生素d检测试剂盒,包括试纸条,试纸条包括pvc板6,pvc
板6上从左到右依次包括吸水区1、反应区2、连接桥3、释放区4、加样区5,吸水区1的一端搭接在反应区2的一端上,连接桥3的一端搭接在反应区2的另一端上,释放区4的一端搭接在连接桥3的另一端上,加样区5的一端搭接在释放区4的另一端上,吸水区1为吸水纸,反应区2为包被有25羟基维生素d抗原的硝酸纤维素膜,释放区4为固相有25羟基维生素d抗体的金标固相垫,加样区5为样品垫,连接桥3为玻璃纤维。连接桥3的长度为6mm,吸水区1的长度为22mm,反应区2的长度为20mm,释放区4的长度为5mm,加样区5的长度为14mm,吸水区1与反应区2搭接宽度为1mm,连接桥3与反应区2搭接宽度为0.7-1mm,释放区4与连接桥3搭接宽度为1mm,加样区5与释放区4搭接宽度为1.5-2mm。
实施例3
25.如图1所示,一种25羟基维生素d检测试剂盒,包括试纸条,试纸条包括pvc板6,pvc板6上从左到右依次包括吸水区1、反应区2、连接桥3、释放区4、加样区5,吸水区1的一端搭接在反应区2的一端上,连接桥3的一端搭接在反应区2的另一端上,释放区4的一端搭接在连接桥3的另一端上,加样区5的一端搭接在释放区4的另一端上,吸水区1为吸水纸,反应区2为包被有25羟基维生素d抗原的硝酸纤维素膜,释放区4为固相有25羟基维生素d抗体的金标固相垫,加样区5为样品垫,连接桥3为纤维素。连接桥3的长度为6mm,吸水区1的长度为22mm,反应区2的长度为20mm,释放区4的长度为5mm,加样区5的长度为14mm,吸水区1与反应区2搭接宽度为1mm,连接桥3与反应区2搭接宽度为0.7-1mm,释放区4与连接桥3搭接宽度为1mm,加样区5与释放区4搭接宽度为1.5-2mm。
实施例4
26.如图1所示,一种25羟基维生素d检测试剂盒,包括试纸条,试纸条包括pvc板6,pvc板6上从左到右依次包括吸水区1、反应区2、连接桥3、释放区4、加样区5,吸水区1的一端搭接在反应区2的一端上,连接桥3的一端搭接在反应区2的另一端上,释放区4的一端搭接在连接桥3的另一端上,加样区5的一端搭接在释放区4的另一端上,吸水区1为吸水纸,反应区2为包被有25羟基维生素d抗原的硝酸纤维素膜,释放区4为固相有25羟基维生素d抗体的金标固相垫,加样区5为样品垫,连接桥3为聚酯膜。连接桥3的长度为6mm,吸水区1的长度为22mm,反应区2的长度为20mm,释放区4的长度为5mm,加样区5的长度为14mm,吸水区1与反应区2搭接宽度为1mm,连接桥3与反应区2搭接宽度为0.7-1mm,释放区4与连接桥3搭接宽度为1mm,加样区5与释放区4搭接宽度为1.5-2mm。
27.对比例:如图2所示,试纸条包括pvc板6,pvc板6上从左到右依次包括吸水区1、反应区2、释放区4、加样区5。
28.选择血清样本20例,试剂采用罗氏(25羟基维生素d检测试剂盒,ac-57f1)试剂对对比例和实施例1-4进行比对。
29.结果表明,实施例1-4较对比例灵敏度有明显提升,其中,实施例3即连接桥3选用纤维素时灵敏度提升最明显。纤维素具有最紧密的孔隙,聚酯膜其次,而玻璃纤维则最为松散。小孔径的折叠结构存在较低的渗透性,渗透速度较低,由于纤维素堆积垫中的小孔所引起的堆积效果和较长的相互作用时间,使得更多的目标分析物与偶联垫上的抗体相互作用,因此可以观察到测试结果的信号增强。
实施例5
30.一种25羟基维生素d检测试剂盒的制备方法,包括连接桥3的制备方法,连接桥3的制备方法包括如下步骤:取25*30cm纤维素浸泡于40ml处理溶液中静置24h,35℃条件下烘干12h,裁切到所需宽度。处理溶液包括pbs缓冲溶液20mm、bsa 0.5%、pvp 0.7%、吐温20 0.5%、曲拉通0.5%。
31.pbs缓冲溶液具有调整适宜ph缓冲作用,可以充分保证生物活性;bsa一般作为稳定剂,起到“稳定”和“载体”的作用;pvp、吐温20、曲拉通用作表面活性剂,不仅具有良好的不解离性,起到一定的助溶作用,而且能抑制大分子的自动聚合,提高稳定性。
实施例6
32.一种25羟基维生素d检测试剂盒的制备方法,包括连接桥3的制备方法,连接桥3的制备方法包括如下步骤:取25*30cm纤维素浸泡于40ml处理溶液中静置24h,35℃条件下烘干12h,裁切到所需宽度。处理溶液包括pbs缓冲溶液30mm、bsa 0.5%、pvp 0.7%、吐温20 0.5%、曲拉通0.5%。
33.pbs缓冲溶液具有调整适宜ph缓冲作用,可以充分保证生物活性;bsa一般作为稳定剂,起到“稳定”和“载体”的作用;pvp、吐温20、曲拉通用作表面活性剂,不仅具有良好的不解离性,起到一定的助溶作用,而且能抑制大分子的自动聚合,提高稳定性。
实施例7
34.一种25羟基维生素d检测试剂盒的制备方法,包括连接桥3的制备方法,连接桥3的制备方法包括如下步骤:取25*30cm纤维素浸泡于40ml处理溶液中静置24h,35℃条件下烘干12h,裁切到所需宽度。处理溶液包括pbs缓冲溶液40mm、bsa 0.5%、pvp 0.7%、吐温20 0.5%、曲拉通0.5%。
35.pbs缓冲溶液具有调整适宜ph缓冲作用,可以充分保证生物活性;bsa一般作为稳定剂,起到“稳定”和“载体”的作用;pvp、吐温20、曲拉通用作表面活性剂,不仅具有良好的不解离性,起到一定的助溶作用,而且能抑制大分子的自动聚合,提高稳定性。
实施例8
36.一种25羟基维生素d检测试剂盒的制备方法,包括连接桥3的制备方法,连接桥3的制备方法包括如下步骤:取25*30cm纤维素浸泡于40ml处理溶液中静置24h,35℃条件下烘干12h,裁切到所需宽度。处理溶液包括pbs缓冲溶液50mm、bsa 0.5%、pvp 0.7%、吐温20 0.5%、曲拉通0.5%。
37.pbs缓冲溶液具有调整适宜ph缓冲作用,可以充分保证生物活性;bsa一般作为稳定剂,起到“稳定”和“载体”的作用;pvp、吐温20、曲拉通用作表面活性剂,不仅具有良好的不解离性,起到一定的助溶作用,而且能抑制大分子的自动聚合,提高稳定性。
38.实验1:选择血清样本20例,试剂采用罗氏(25羟基维生素d检测试剂盒,ac-57f1)试剂对实施例5-8进行比对。
39.测试结果表明,pbs缓冲溶液浓度为30mm时可提供最适宜的缓冲环境,更有利于抗原抗体反应。
实施例9
40.一种25羟基维生素d检测试剂盒的制备方法,包括连接桥3的制备方法,连接桥3的制备方法包括如下步骤:取25*30cm纤维素浸泡于40ml处理溶液中静置24h,35℃条件下烘干12h,裁切到所需宽度。处理溶液包括pbs缓冲溶液30mm、bsa 0.2%、pvp 0.7%、吐温20 0.5%、曲拉通0.5%。
41.pbs缓冲溶液具有调整适宜ph缓冲作用,可以充分保证生物活性;bsa一般作为稳定剂,起到“稳定”和“载体”的作用;pvp、吐温20、曲拉通用作表面活性剂,不仅具有良好的不解离性,起到一定的助溶作用,而且能抑制大分子的自动聚合,提高稳定性。
实施例10
42.一种25羟基维生素d检测试剂盒的制备方法,包括连接桥3的制备方法,连接桥3的制备方法包括如下步骤:取25*30cm纤维素浸泡于40ml处理溶液中静置24h,35℃条件下烘干12h,裁切到所需宽度。处理溶液包括pbs缓冲溶液30mm、bsa 0.6%、pvp 0.7%、吐温20 0.5%、曲拉通0.5%。
43.pbs缓冲溶液具有调整适宜ph缓冲作用,可以充分保证生物活性;bsa一般作为稳定剂,起到“稳定”和“载体”的作用;pvp、吐温20、曲拉通用作表面活性剂,不仅具有良好的不解离性,起到一定的助溶作用,而且能抑制大分子的自动聚合,提高稳定性。
实施例11
44.一种25羟基维生素d检测试剂盒的制备方法,包括连接桥3的制备方法,连接桥3的制备方法包括如下步骤:取25*30cm纤维素浸泡于40ml处理溶液中静置24h,35℃条件下烘干12h,裁切到所需宽度。处理溶液包括pbs缓冲溶液30mm、bsa 1%、pvp 0.7%、吐温20 0.5%、曲拉通0.5%。
45.pbs缓冲溶液具有调整适宜ph缓冲作用,可以充分保证生物活性;bsa一般作为稳定剂,起到“稳定”和“载体”的作用;pvp、吐温20、曲拉通用作表面活性剂,不仅具有良好的不解离性,起到一定的助溶作用,而且能抑制大分子的自动聚合,提高稳定性。
46.实验2:选择血清样本20例,试剂采用罗氏(25羟基维生素d检测试剂盒,ac-57f1)试剂对实施例9-11进行比对。
47.测试结果表明,实施例10即选用0.6% bsa时的灵敏度最优。
实施例12
48.一种25羟基维生素d检测试剂盒的制备方法,包括连接桥3的制备方法,连接桥3的制备方法包括如下步骤:取25*30cm纤维素浸泡于40ml处理溶液中静置24h,35℃条件下烘干12h,裁切到所需宽度。处理溶液包括pbs缓冲溶液30mm、bsa 0.6%、pvp 0.5%、吐温20 0.5%、曲拉通0.5%。
49.pbs缓冲溶液具有调整适宜ph缓冲作用,可以充分保证生物活性;bsa一般作为稳定剂,起到“稳定”和“载体”的作用;pvp、吐温20、曲拉通用作表面活性剂,不仅具有良好的不解离性,起到一定的助溶作用,而且能抑制大分子的自动聚合,提高稳定性。
实施例13
50.一种25羟基维生素d检测试剂盒的制备方法,包括连接桥3的制备方法,连接桥3的制备方法包括如下步骤:取25*30cm纤维素浸泡于40ml处理溶液中静置24h,35℃条件下烘干12h,裁切到所需宽度。处理溶液包括pbs缓冲溶液30mm、bsa 0.6%、pvp 0.8%、吐温20 0.5%、曲拉通0.5%。
51.pbs缓冲溶液具有调整适宜ph缓冲作用,可以充分保证生物活性;bsa一般作为稳定剂,起到“稳定”和“载体”的作用;pvp、吐温20、曲拉通用作表面活性剂,不仅具有良好的不解离性,起到一定的助溶作用,而且能抑制大分子的自动聚合,提高稳定性。
实施例14
52.一种25羟基维生素d检测试剂盒的制备方法,包括连接桥3的制备方法,连接桥3的制备方法包括如下步骤:取25*30cm纤维素浸泡于40ml处理溶液中静置24h,35℃条件下烘
0.5%、曲拉通0.5%。
59.pbs缓冲溶液具有调整适宜ph缓冲作用,可以充分保证生物活性;bsa一般作为稳定剂,起到“稳定”和“载体”的作用;pvp、吐温20、曲拉通用作表面活性剂,不仅具有良好的不解离性,起到一定的助溶作用,而且能抑制大分子的自动聚合,提高稳定性。
实施例17
60.一种25羟基维生素d检测试剂盒的制备方法,包括连接桥3的制备方法,连接桥3的制备方法包括如下步骤:取25*30cm纤维素浸泡于40ml处理溶液中静置24h,35℃条件下烘干12h,裁切到所需宽度。处理溶液包括pbs缓冲溶液30mm、bsa 0.6%、pvp 0.5%、吐温20 1%、曲拉通0.5%。
61.pbs缓冲溶液具有调整适宜ph缓冲作用,可以充分保证生物活性;bsa一般作为稳定剂,起到“稳定”和“载体”的作用;pvp、吐温20、曲拉通用作表面活性剂,不仅具有良好的不解离性,起到一定的助溶作用,而且能抑制大分子的自动聚合,提高稳定性。
62.实验4:选择血清样本20例,试剂采用罗氏(25羟基维生素d检测试剂盒,ac-57f1)试剂对实施例15-17进行比对。
63.测试结果表明,实施例16即选用0.5%吐温20时的灵敏度最优。
实施例18
64.一种25羟基维生素d检测试剂盒的制备方法,包括连接桥3的制备方法,连接桥3的制备方法包括如下步骤:取25*30cm纤维素浸泡于40ml处理溶液中静置24h,35℃条件下烘干12h,裁切到所需宽度。处理溶液包括pbs缓冲溶液30mm、bsa 0.6%、pvp 0.5%、吐温20 0.5%、曲拉通0.2%。
65.pbs缓冲溶液具有调整适宜ph缓冲作用,可以充分保证生物活性;bsa一般作为稳
定剂,起到“稳定”和“载体”的作用;pvp、吐温20、曲拉通用作表面活性剂,不仅具有良好的不解离性,起到一定的助溶作用,而且能抑制大分子的自动聚合,提高稳定性。
实施例19
66.一种25羟基维生素d检测试剂盒的制备方法,包括连接桥3的制备方法,连接桥3的制备方法包括如下步骤:取25*30cm纤维素浸泡于40ml处理溶液中静置24h,35℃条件下烘干12h,裁切到所需宽度。处理溶液包括pbs缓冲溶液30mm、bsa 0.6%、pvp 0.5%、吐温20 0.5%、曲拉通0.8%。
67.pbs缓冲溶液具有调整适宜ph缓冲作用,可以充分保证生物活性;bsa一般作为稳定剂,起到“稳定”和“载体”的作用;pvp、吐温20、曲拉通用作表面活性剂,不仅具有良好的不解离性,起到一定的助溶作用,而且能抑制大分子的自动聚合,提高稳定性。
实施例20
68.一种25羟基维生素d检测试剂盒的制备方法,包括连接桥3的制备方法,连接桥3的制备方法包括如下步骤:取25*30cm纤维素浸泡于40ml处理溶液中静置24h,35℃条件下烘干12h,裁切到所需宽度。处理溶液包括pbs缓冲溶液30mm、bsa 0.6%、pvp 0.5%、吐温20 0.5%、曲拉通1.5%。
69.pbs缓冲溶液具有调整适宜ph缓冲作用,可以充分保证生物活性;bsa一般作为稳定剂,起到“稳定”和“载体”的作用;pvp、吐温20、曲拉通用作表面活性剂,不仅具有良好的不解离性,起到一定的助溶作用,而且能抑制大分子的自动聚合,提高稳定性。
70.实验5:选择血清样本20例,试剂采用罗氏(25羟基维生素d检测试剂盒,ac-57f1)试剂对实施例18-20进行比对。
71.测试结果表明,实施例19即选用0.8%曲拉通时的灵敏度最优。
72.通过实验1-5数据表明,实施例5-20数据与罗氏测定值一致性好,证明本发明符合率较高。
73.为验证本发明25羟基维生素d检测试剂盒的稳定性,将实施例19进行实时稳定性、高温破坏稳定性、运输稳定性实验。
74.实验6:取实施例19试纸条分别于2℃、常温条件下放置6、12、18、24月,检测血清样本10例,检测结果如下。
75.测试结果表明,实施例19试纸条分别于2℃、常温条件下放置6、12、18、24月,检测结果一致,确定实施例19实时稳定性为24个月。
76.实验7:取实施例19试纸条分别于45℃条件下放置30d、60d和90d、55℃条件下放置30d和60d,与常温放置比对,检测血清样本10例,检测结果如下。
77.测试结果表明,实施例19试纸条分别于45℃条件下放置30d、60d和90d、55℃条件下放置30d和60d,与常温放置下检测结果一致,得出高温破坏稳定性符合要求。
78.实验8:取实施例19试纸条分别于-20℃、55℃条件下放置7d、15d,与常温放置比对,检测血清样本10例,检测结果如下。
79.测试结果表明,实施例19试纸条分别于-20℃、55℃条件下放置7d和15d,与常温放置7d、15d检测结果一致,得出运输稳定性符合要求。
80.通过实验6-8数据表明,本发明具有良好的稳定性。
81.最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,实施方式的举例,其中未详细述及的部分均为本领域普通技术人员的公知常识,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1