外泌体侧向层析定量检测方法、生物传感器和试剂盒
本发明涉及生物医学领域,尤其涉及外泌体侧向层析定量检测方法、生物传感器和试剂盒。
背景技术:
1、对生物液体中存在的循环生物标志物进行定量分析,通常称为液体活检,在临床上具有微创或无创诊断和管理癌症的潜力,这主要是受癌症发病率和患病率上升的推动。大量的生物材料已被用于液体活检,包括循环肿瘤细胞、循环蛋白质、无细胞核酸、代谢物和肿瘤细胞外囊泡。其中,外泌体是纳米级(30-150纳米)的细胞外实体,几乎由所有类型的细胞产生,并含有从其母体细胞继承的多种关键成分,包括蛋白质、核酸、代谢物、脂质等。更重要的是,外泌体的特点是高丰度(>109颗粒/毫升)和在所有体液中的出色稳定性。这些突出的特点共同使外泌体成为了癌症无创诊断和预后的理想选择,比上述那些传统的循环生物标志物优越得多。靶向外泌体的表面膜蛋白是基于外泌体的液体活检的主要策略,在western印迹分析、酶联免疫吸附试验、流式细胞仪以及新兴的光学和电化学方法中被广泛采用。这些方法的检测原理大多涉及单个表面外泌体生物标志物或多个外泌体生物标志物与生物识别元件(如抗体、诱导剂)的特定相互作用。然而,这些方法的检测性能由于不同来源的外泌体中蛋白质生物标志物的共同表达和它们的细微差别而受到影响。因此,直接在复杂的生物样本中对外泌体进行替代性的定量工具是迫切需要的,这能够用于微创或无创的癌症诊断。
2、基于外泌体的癌症诊断的理想策略是量化癌症特定的外泌体,而不是那些表面外泌体生物标志物。由于外泌体含有多种表面膜蛋白,因此可以通过其外泌体表面蛋白的线性组合来定义特定来源的单个外泌体。现有技术开发了光学和电化学生物传感平台,用于同时量化临床样本中的多种癌症特异性生物标志物,具有较高的灵敏度和出色的特异性。然而,很少有研究针对同时测定那些表达在同一外泌体上的特异性生物标志物进行量化。对临床样本中的外泌体进行量化的困难在于利用其分子特征对单个外泌体的精确定义。
3、拉曼光谱是强大的分析工具,可对生物样品(如外泌体)进行成分分析。它能以分子特异性、非破坏性、对水不敏感、出色的多路复用能力和较少的样品制备,对外泌体进行基于全知的分子分析。拉曼光谱的多变量光谱解混分析可以识别和量化复杂生物样品中的纯成分。事实上,多变量光谱解混分析已经成功用于确定各种高光谱图像中的分子组成和空间分布。
技术实现思路
1、基于现有技术存在的上述缺陷,本发明提供了通过结合纸质侧流条(lfs)生物传感器和多变量光谱解混分析对血清外泌体进行定量的表面增强拉曼光谱(sers),而不是量化外泌体蛋白。首先构建了分别来自skbr-3和mcf-7乳腺癌细胞的两种不同外泌体--skbr和mcf外泌体的sers光谱,然后将其作为光谱未混合辅助量化分析外泌体的基本光谱。本发明的sers-lfs生物传感器能够对血清外泌体进行绝对定量,两种外泌体的检测极限都低至~106个颗粒/毫升。本发明进一步举例说明了这一策略在直接来自乳腺癌患者的血清外泌体的定量双联检测中的应用。结果发现,没有接受手术的her2+和luminala型乳腺癌患者分别富含血清中的skbr和mcf外泌体。这些乳腺癌患者的手术治疗伴随着血清中skbr或mcf外泌体的明显减少。这些结果表明,结合sers-lfs生物传感器和多变量光谱解混技术,利用临床样本中外泌体的强大定量能力,在乳腺癌亚型分析和治疗监测方面具有巨大潜力。
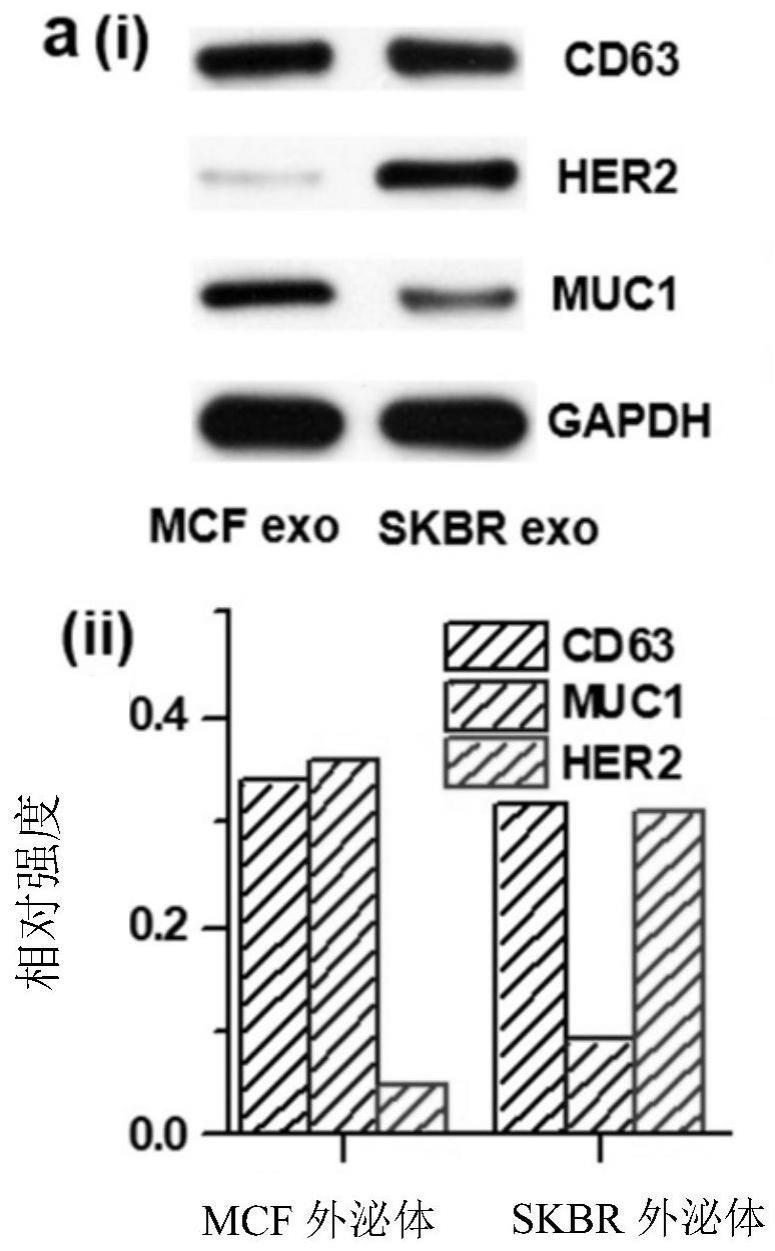
2、本发明提供了定量的表面增强拉曼光谱-侧流条(sers-lfs)生物传感器,通过对人类血清样本中的癌症外泌体进行量化,并在多变量光谱解混合的辅助下,对乳腺癌进行准确的无创分型和手术效果评估。本发明的设计主要基于单个外泌体的基本sers光谱,用于直接对血清样品中的外泌体进行定量分析,这些光谱是由与其表面外泌体蛋白相关的sers光谱的加权组合构建的。本发明方法的独特优势在于对癌症分子亚型特征的外泌体进行量化,而不是对以前报道的方法中通常实施的那些表面外泌体生物标志物进行量化。作为概念验证,选择了两种不同的乳腺癌细胞系--skbr-3和mcf细胞,分别得出skbr-3和mcf-7细胞的细胞外泌体(表示为skbr外泌体和mcf外泌体)。skbr-3和mcf细胞显示出不同的表面外泌体蛋白her2和muc1的表达水平,这两种蛋白已被广泛用于模拟her2+和luminala型乳腺癌亚型,两种光谱不同的sers探针--her2和muc1探针具有不同的光谱特征,被设计用来特异性地识别外泌体蛋白her2和muc1。单个外泌体(skbr或mcf外泌体)的sers光谱由her2和muc1探针的sers光谱的加权总和定义。利用sers、lfa、作为癌症生物标志物的外泌体和多变量光谱解混的巨大优势,本发明的方法可以对临床样本中的多个外泌体进行定量检测,具有很高的灵敏度和选择性,可用于精确的癌症诊断。
3、本发明第一方面提供了外泌体侧向层析定量检测方法,所述检测方法包括如下步骤:
4、s1.构建单个外泌体的表面增强拉曼光谱:将skbr-3外泌体和mcf-7外泌体分别在her2探针和muc1探针的等摩尔溶液中孵化,收集来自skbr-3外泌体和mcf-7外泌体光谱的sers数据集,得到两种外泌体的基谱;
5、s2.分别构建单个外泌体随浓度变化的标准曲线:测量不同已知浓度的单个外泌体的拉曼图谱,与外泌体基谱进行最小二乘法拟合,计算得到外泌体载荷,该载荷与外泌体浓度相关,依照载荷构建标准浓度曲线;
6、s3.得到待测混合样本的拉曼光谱数据集,对数据进行多元分析和光谱解混:通过多元曲线分辨-偏最小二乘法拟合算法进行光谱解混,得到每种外泌体的载荷;
7、s4.将得到的载荷值带入到标准浓度曲线中,得到每个外泌体的实际浓度。
8、本发明选择了两个乳腺癌细胞系skbr-3和mcf-7细胞来分离细胞外泌体,因为它们具有不同的分子特征,而且它们已被广泛采用来模拟her2+和luminala型乳腺癌亚型。
9、sers数据的多元分析和光谱解混是在matlab r2022a(mathworks)上进行的。600-1650厘米范围内的原始sers数据,进行光谱预处理,去除宇宙尖峰和背景减法。首先用多变量曲线解析-替代最小二乘法(mcr-als)算法进行光谱解混,将复杂的光谱分解成具有定量贡献的纯成分光谱,这可以用来重建感兴趣的外泌体的sers光谱。在mcr-als模型中,混合物的sers光谱(specmix)可以描述如下。
10、
11、其中speci是ith成分的sers光谱,其贡献为ai(i=1,2,...,n),e代表光谱噪声(实验误差)。复杂光谱中存在的成分数量(n)是由主成分分析(pca)分析决定的。在mcr-als算法中,当连续两次迭代的实验值和计算值之间的残差的相对标准差<0.1%时就达到了收敛。本发明利用基于mcr-als的光谱解混来实现成分光谱,然后重建单个外泌体的sers光谱。以上述获得的所有单个外泌体的sers光谱为基本光谱,本发明利用标准的最小二乘法定量测定了复杂矩阵中多个外泌体的浓度。
12、统计分析是在matlab r2022a中实现的。除非另有说明,所有实验均为一式三份。结果以平均值±标准差(s.d.)表示,差异的统计学意义用wilcoxon秩和检验来计算。
13、作为优选的实施方式,所述her2探针和muc1探针的构建方法具体包括:
14、以金纳米星作为质子基底,以硅作为保护层,分别用两个不同的拉曼探针分子5,5'-二硫双(2-硝基苯甲酸)和4-巯基苯甲酸编码,编码产物进一步分别与her2检测适配体和muc1检测适配体共轭,得到her2和muc1探针。
15、进一步地,sers探针的制备方法包括:为了制作光谱不同的sers探针,10μm的两种不同的拉曼分子--dtnb和4-mba分别加入到15ml的0.77μg/mlausts的去离子水中。在磁力搅拌下于25℃混合30分钟后,将反应溶液在7000rpm下离心以除去未结合的拉曼分子。将单独用dntp和4-mba修饰的austs重新分散在15ml去离子水中,同时在磁力搅拌下滴加150μl氢氧化铵和30μlmptms。反应在30℃下进行了8个小时,将反应液离心并至少用去离子水洗涤三次,得到了两种单独用dtnb和4-mba编码的sers纳米粒子--aust@dtnb@sio2 nps和aust@mba@sio2 nps。
16、将上述获得的sers nps分散在1.0ml乙醇中,其中含有16μl tepsa和7.0mg mpeg-硅烷。在磁力搅拌4小时后,获得tepsa/mpeg共修饰的sers nps,并先后用乙醇和去离子水洗涤,然后分散在磷酸盐缓冲盐水(pbs,ph 7.4)中,加入edc和sulfo-nhs都为2.0mg/ml。涡旋该混合物并在磁力搅拌下在25℃下保持30分钟,在4000rpm下离心,丢弃上清液。将得到的颗粒分散在1.0ml pbs中,预先加入10μl 100mm k2co3和7.0μl 0.1nm的适配体(her2检测适配体用于dtnb编码的sers nps,muc1检测适配体用于mba编码的sers nps)。在4℃孵育过夜后,加入50μl 2.0mg/ml bsa以防止非特异性蛋白质吸附。最后,将反应混合物以4000rpm离心,用pbs洗涤三次,得到的颗粒为her2检测适配体结合的dtnb编码的sers nps和muc1检测适配体结合的mba编码的sers nps,以下分别表示为her2探针和muc1探针。her2探针和muc1探针在4℃下保存在0.25ml洗脱缓冲液中,该缓冲液由0.5%bsa、10%蔗糖、0.1%pvp和1.0%tween-20在pbs中制成,最终浓度为260μg/ml。
17、作为优选的实施方式,所述her2检测适配体的dna序列为5'-nh2-(ch2)6-ttt gggccg tcg aac acg agc atg gtg cgt gga cct agg atg acc tga gta ctg tcc-3'。
18、作为优选的实施方式,所述muc1检测适配体的dna序列为5'-nh2-(ch2)6-ttt ttgcag ttgatc ctt tggataccc tgg-3'。
19、作为优选的实施方式,所述金纳米星的构建方法具体包括:
20、步骤1.制备金纳米种子:将稀释的氯金酸水溶液与柠檬酸钠水溶液、硼氢化钠溶液搅拌反应,加入pvp继续搅拌,得到金纳米种子溶液;
21、步骤2.制备金纳米星:将haucl4水溶液与pvp和dmf溶液混合,适时加入金纳米种子溶液,纯化后即得金纳米星。
22、进一步地,制备金纳米种子:将0.5ml 50mm氯金酸水溶液加水稀释为90ml,然后快速加入2ml 38.8mm柠檬酸钠水溶液,随后再缓慢加入1ml新配制的硼氢化钠溶液(硼氢化钠溶解在38.8mm柠檬酸钠水溶液中,浓度为0.075wt%),反应溶液在室温下搅拌过夜。之后5.0g pvp加入到50ml金纳米种子溶液中,在室温下搅拌24小时即可得到所需的金纳米种子溶液。
23、进一步地,制备金纳米星:首先,金纳米星是用种子介导的生长方法合成的。在一个典型的合成中,将82μl的50mm haucl4水溶液加入到含有1.5g pvp的15mldmf中。一旦溶液从浅黄色变成无色,立即引入上述pvp封端的金种子,最终浓度为57nm。反应在室温下持续了3个小时,产生了表明形成了金纳米星的深蓝色溶液。金纳米星通过连续的离心和用去离子水和乙醇洗涤至少两次而被纯化,结果金纳米星被储存在去离子水中,浓度为0.77微克/毫升。
24、本发明第二方面提供了一种生物传感器。
25、作为优选的实施方式,所述生物传感器至少包括样品垫、共轭垫、t线、c线吸收垫和底板,所述t线负载cd63捕获适配体,c线负载her2捕获适配体和muc1捕获适配体,所述共轭垫为玻纤材料并负载结合了检测适配体的her2探针和muc1探针的等摩尔比溶液。
26、进一步地,在sers-lfs条中,样品和共轭垫,t线和c线的nc膜,以及吸收垫被有序地组装在塑料粘合剂pvc底板上,每两个相邻的垫子之间有2.0毫米的重叠。nc膜上的t线和c线的距离为6毫米。
27、t线上的负载cd63(0.2μg/mm)捕获适配体;
28、c线负载0.2μg/mm的固定比例为1:1的her2和muc1捕获适配体;
29、共轭垫:用250μl总浓度的her2和muc1探针的等摩尔混合物,以50μl/cm的速度均匀地分散在共轭垫上
30、nc膜预处理:用100μg/ml链霉亲和素对t线和c线进行预修饰。
31、作为优选的实施方式,所述cd63捕获适配体的dna序列为:5'-biotin-tt cac cccacc tcg ctc ccg tgacac taatgc ta-3'。
32、作为优选的实施方式,所述muc1捕获适配体的dna序列为5'-biotin-tt ttc cagggtatc caaaggatcaac tgc-3'。
33、作为优选的实施方式,所述her2捕获适配体的dna序列为5'-biotin-tt ttg cagttgatc ctt tggataccc tgg-3'。
34、作为优选的实施方式,所述nc膜的类型为mdi cnpc-ss12、whatman ff120hp或pallvivid 90。
35、作为优选的实施方式,所述生物传感器还包括溶解样品的缓冲体系。
36、所述缓冲体系中可包括tween-20。在所述缓冲体系中,tween-20的质量百分比可为0.25-2.0%,例如0.25%、0.5%、1.0%、1.5%和2.0%,优选为1.0%。
37、作为优选的实施方式,所述t线中,cd63捕获适配体的负载量可为0.1-0.4μg/mm,例如0.1μg/mm,0.2μg/mm,0.3μg/mm和0.4μg/mm。
38、作为优选的实施方式,所述共轭垫中,her2探针和muc1探针的等摩尔比溶液中,sers探针的总浓度可为38-390μg/ml,例如38、75、130、260和390μg/ml。
39、用sers-lfs生物传感器对细胞外泌体和人血清外泌体进行测试。在优化实验之后,本发明评估了sers-lfs生物传感器的分析性能,以分别检测细胞外泌体和血清外泌体。用250μl最佳总浓度的her2和muc1探针的等摩尔混合物,以50μl/cm的速度均匀地分散在共轭垫上。t线和c线用100μg/ml链霉亲和素进行预修饰,然后分别用cd63捕获适配体和her2和muc1捕获适配体的等摩尔混合物进行包被,共轭垫和处理过的nc膜在37℃下干燥1小时。将组装好的垫子切成3.0mm宽的条状,使用前保存在25℃的干燥器中。
40、通过将skbr3外泌体或mcf-7外泌体以不同浓度加入pbs或由50%fbs在pbs中制成的血清中,制成不同浓度的细胞外泌体样品。为了检测临床血清外泌体,直接使用从人类血清样本中分离的血清外泌体。一百微升的细胞或血清外泌体被滴在样品垫上。孵化15分钟后,对试纸进行sers测量。每个实验都是一式三份,最后的结果是三次测量的平均数据。
41、本发明第三方面提供了外泌体侧向层析定量检测试剂盒。
42、本发明第四方面提供了所述检测方法、生物传感器和试剂盒在检测目标分析物方面的用途。
43、与现有技术相比,本发明具有以下有益效果:
44、1.本发明通过构建了分别来自skbr-3和mcf-7乳腺癌细胞的两种不同外泌的sers光谱,然后将其作为光谱未混合辅助量化分析外泌体的基本光谱;
45、2.本发明制备的sers-lfs生物传感器能够对血清外泌体进行绝对定量,两种外泌体的检测极限都低至~106个颗粒/毫升,经临床实验,乳腺癌患者的手术治疗伴随着血清中skbr3或mcf-7外泌体的明显减少,表明结合sers-lfs生物传感器的多变量光谱解混技术和对临床样本中外泌体的强大定量能力,在乳腺癌亚型分析和治疗监测方面具有巨大潜力;
46、3.本发明的检测方法不仅仅是可分析两种外泌体,还可用于定量分析多种外泌体。
- 还没有人留言评论。精彩留言会获得点赞!