一种生物或化学膜片的响应监测装置
本发明属于生物或化学膜片领域,具体涉及一种生物或化学膜片的响应监测装置。
背景技术:
1、离子通道是允许离子通过通道孔的成孔膜蛋白。它们的功能包括建立静息膜电位,通过控制离子流过细胞膜来塑造动作电位和其他电信号,控制离子流过分泌细胞和上皮细胞,以及调节细胞体积。离子通道存在于所有细胞的膜中。因此,检测离子电流对监测通道开放和细胞活性至关重要。
2、人工脂质双层是利用提取的纯磷脂成分在体外重构的脂质双层膜。区别于细胞丰富的亚细胞结构,这种重构的脂质双层拥有简单可控的成分、稳定的寿命和电学特性及丰富的重构方式,包括黑色磷脂膜(blm),支撑磷脂双层(slb)、栓系双层磷脂膜(t-blm)、囊泡、液滴界面双层及纳米圆盘等。人工脂质双层膜的应用推动了亚细胞水平的细胞活动监测和机制探索。
3、随着微纳米技术的发展和对细胞生命活动的了解深入,研究发现机械激励对细胞的分化和衰老等过程起着至关重要的作用。机械调制作用于细胞或细胞膜片的机理十分丰富但仍未获得统一,包括热、空化、膜充电、膜构象和膜孔、膜通道激活等。因此,理解机械激励的作用于细胞活动的潜在激励至关重要。目前常用的机械激励方式是利用谐振器位于溶液中振动产生的声流作用,但这种方式不可控变量较多,因此开发一种能够以沿着基底水平传导声波并作用于目标细胞或细胞膜片的结构具有重要意义。
4、膜片钳技术是电生理学中的一种实验室技术,用于研究单个分离的活细胞、组织切片或细胞膜片中的离子电流。该技术特别适用于神经元、心肌细胞、肌纤维、胰腺β细胞等可兴奋细胞的研究,也可用于特制巨原生质球中细菌离子通道的研究。其中膜片钳中最常用是电压钳技术和电流钳技术。记录模式通常包含四种,细胞贴附记录、内面向外记录、外面向内记录和全细胞记录。早期的手动膜片钳操作难度高,对实验操作人员具有较高的技术要求,通量低,工作量大。
5、随着技术的发展,全自动膜片钳仪器孕育而生。配合微流控技术和电气系统的自动化控制,系统可自动完成传统手动膜片钳全细胞记录过程中封接和破膜的过程。这免除了这些操作的复杂与困难。这两个优点使得膜片钳技术的工作效率大大提高了。自动膜片钳经历过三个发展阶段,包括flip-tip翻转技术、seal-chip技术和population patchclamp(ppc)技术。尽管如此,但目前这些技术都是以整体细胞或从细胞上机械分离的膜片作为研究对象,无法用于重构的脂质双层膜及细胞膜片中重构的通道蛋白电信号监测。
技术实现思路
1、本发明提供了一种生物或化学膜片的响应监测装置,该装置能够高效的同时检测多个重构的脂质双层膜。
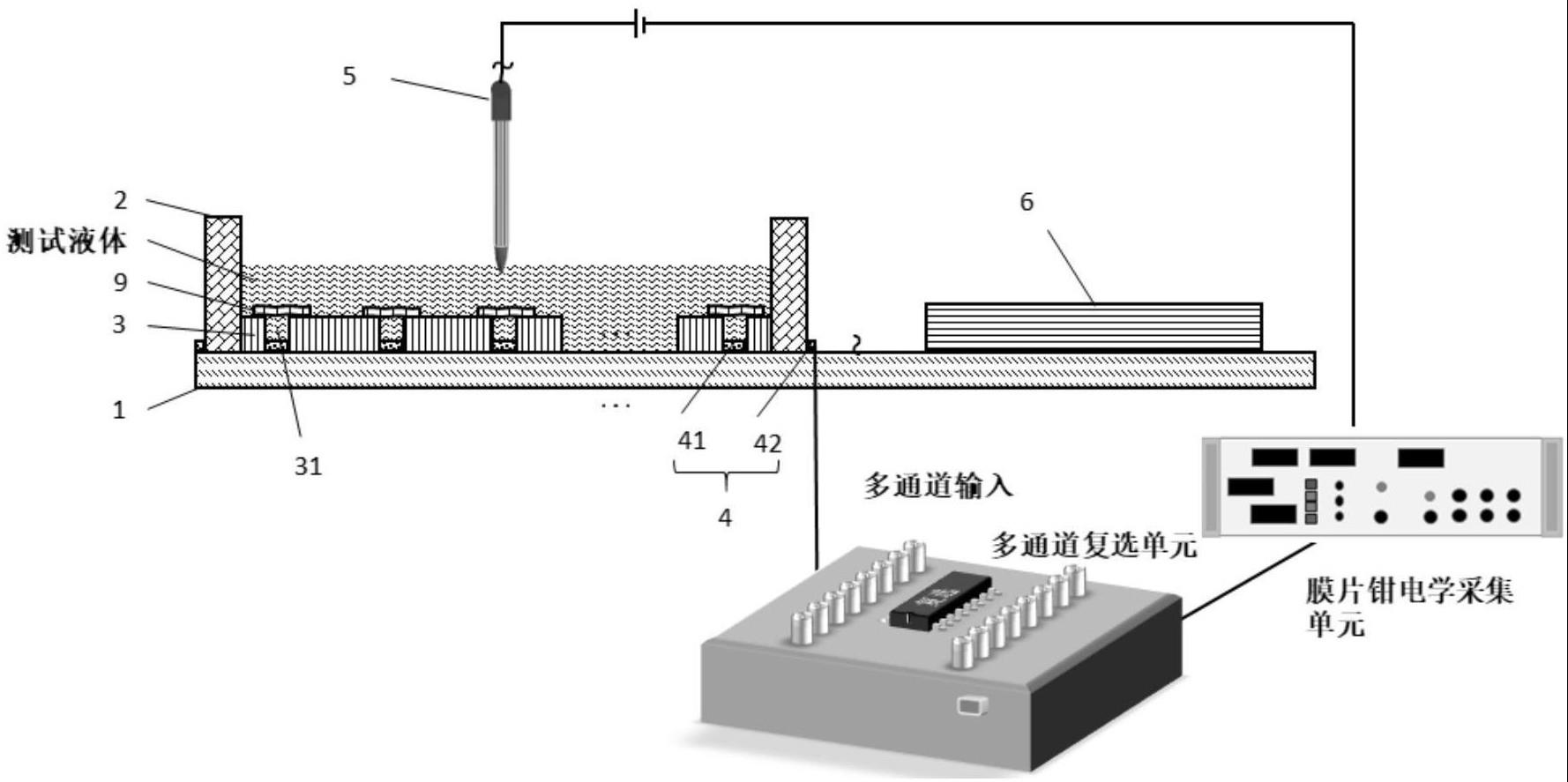
2、本发明具体实施例提供一种生物或化学膜片的响应监测装置,其特征在于,包括:
3、电绝缘基板;
4、贮液腔体,所述贮液腔体位于电绝缘基板上,所述贮液腔体内贮存测试液体;
5、微井结构层,所述微井结构层位于测试液体内,且位于电绝缘基板上,所述微井结构层内具有多个微井,每个微井顶端放置重构生物膜片或化学膜片;
6、多个底电极,每个底电极适配在一个所述微井底部,并位于所述电绝缘基板上表面,每个底电极分别与多通道复选单元连接;以及
7、顶电极,所述顶电极的一端位于生物或化学膜片上方且浸入测试液体内,所述顶电极的另一端与多通道复选单元连接;
8、通过所述多通道复选单元调控不同的底电极以达到测量指定的重构生物膜片或化学膜片的电信号的目的。
9、进一步的,本发明具体实施例提供一种生物或化学膜片的响应监测装置还包括谐振器,所述谐振器位于电绝缘基板上,且与贮液腔体相隔设置,通过所述谐振器输出的横向声波对生物或化学膜片进行机械激励。
10、进一步的,本发明具体实施例提供一种生物或化学膜片的响应监测装置还包括微流通道,所述微流通道位于底电极和微井结构层间,所述微流通道的一端与微井相连,所述微流通道的另一端与气泵相连,所述气泵产生负压,通过微流通道将负压作用在生物或化学膜片上,从而实现对生物或化学膜片的机械激励。
11、进一步的,所述微流通道的制备方法,包括:
12、在电绝缘基板上进行图案化沉积得到底电极;
13、在另一个电绝缘基板上沉积结构层,在结构层上进行刻蚀得到微井结构层,所述微井结构层内具有微井阵列和与微井阵列中每个微井相连的初始微流通道;
14、将得到的微井结构层与底电极键合得到位于底电极和微井结构层间的微流通道。
15、进一步的,所述重构生物膜片为含有重构通道蛋白的高阻封接生物膜片。
16、进一步的,所述底电极包括多个微井底电极和对应的底电极pad,所述微井底电极与对应的底电极pad通过导线相连,每个微井底电极位于对应的微井的底部,所述多个底电极pad通过多通道复选单元与顶电极相连,通过多通道复选单元控制微井底电极的开关,从而能够同时获得多个指定的生物或化学膜片的电信号。此外,也可以通过时分复用实现一个采集单元对多个采集目标的同时采集。
17、进一步的,所述微井结构层通过激光雕刻、光刻、激光直写或光刻加工完成,光刻加工过程中使用的光刻胶为正胶、负胶或柔性的光刻胶,所述微井的形状为圆形、三角形、多边形中一种或多种组合。
18、进一步的,所述底电极的制备方法,包括:
19、(1)通过lift-off工艺在电绝缘基板上旋涂光刻胶,通过第一光刻板进行曝光、显影得到图案化底电极和导线,然后蒸镀金属和去除光刻胶得到底电极的金属层和导线;
20、(2)在步骤(1)得到的底电极的金属层和电绝缘基板暴露的表面上再次旋涂光刻胶,通过第二光刻板对底电极的金属层的位置进行曝光、显影,在暴露的底电极的金属层上电镀保护层得到底电极。
21、进一步的,所述微井的制备方法,包括:
22、将通过第二光刻板对底电极的金属层所在位置进行曝光、显影,从而将在光刻胶上形成的孔洞作为微井,将存留的光刻胶作为微井结构层。
23、进一步的,对微井结构层表面进行亲水或疏水修饰,从而实现对不同生物或化学膜片的粘附作用。
24、本发明的特点是:1、如采用柔性器件设计,则全部的加工材料都可以采用柔性材料,使得加工的装置整体可以弯曲。2、如采用带有流道的刚性微井设计,则可以使得重构的膜片响应来自流道中的不同负压(通过流道接口实现负压)或来自谐振器的机械声波激励。3、微井式设计相比贯穿孔结构在结构上更加稳定和简单。此外,微井材料的不同使得微井具有不同的亲疏水特性,用于不同的膜修饰。4、图形化的微井可以通过加工方式来自定义尺寸,赋予单通道监测的可能(没有通道的话电阻很大,电流下,有通道,电流相应变大,表征加进去,水溶性的蛋白)。5、图形化的微井加工方法和每个微井的独立寻址(底电极连接在复选芯片上,可以测试不同的结果),使得大批量阵列化监测变为可能。6、粘附的谐振器能使得基底振动并将振动传递到底部电极的阵列出用于激励。7、这种机械激励与传感目标区域分离的设计,区别于传统的使用声表面波、体波声流和空穴涡旋等方式不产生明显的声流和声辐射力,通过激励粘附于的井结构层表面的膜片实现对膜片的刺激。
25、与现有技术相比,本发明的有益效果为:
26、本发明通过设立多个独立的微井,且每个微井均具有独立的底电极,使得每个微井能够独立寻址,从而通过对每个微井结构适配的一个底电极的控制,能够高效的获得多个指定的重构的生物或化学膜片的电信号响应。并且能够通过观察电信号的变化能够监测到生物或化学膜片是否成功重构有单通道蛋白通道,并通过微井能够直观观察到荧光材料,从而检测更为高效。
27、本发明通过在电绝缘基板上,与微井结构层相隔设置的谐振器,使得生物或化学膜片能够受到合适强度的,可控的兰姆波,从而能够模拟真实环境下对生物或化学膜片的机械激励。
28、本发明通过设定微流通道,通过向微流通道的一端输入负压,能够与谐振器相结合对生物或化学膜片进行更为多样的机械激励。
29、本发明提供的高阻封接的重构的生物或化学膜片中具有重构的单通道蛋白,使得微流控通道在施加负压的同时用于收集透过膜片上通道的物质。
- 还没有人留言评论。精彩留言会获得点赞!