一种基于细胞内可溶性蛋白含量检测表面活性剂对细菌的生物毒性的方法
本发明涉及生物毒性检测领域,尤其是涉及一种基于细胞内可溶性蛋白含量检测表面活性剂对细菌的生物毒性的方法。
背景技术:
1、多环芳烃(polycyclic aromatic hydrocarbons,pahs)的结构是由两个及以上的苯环构成的稠环化合物,是通过人类或者自然活动产生的,且在环境中分布广泛。多环芳烃对人、植物以及动物具有危害,主要体现在其“三致”作用即致癌、致畸、致突变,可以通过水、大气、食物链等一系列途径进入到人体中,进入人体中会对人体产生危害甚至会诱发癌症。在所有的治理方式中,微生物修复是去除环境中多环芳烃的主要手段。然而多环芳烃水溶性低、生物可利用性差的特点延缓了多环芳烃的降解过程,成为多环芳烃污染微生物治理的主要限制因素。表面活性剂的加入能够有效克服这一因素的限制,但同时也会对微生物产生一定程度的毒性作用,从而对多环芳烃的降解过程产生相应的抑制作用。因此,需要一种能够在多环芳烃降解过程中表面活性剂生物毒性的检测方法,以便为多环芳烃降解过程中确定适宜的强化浓度提供依据。
技术实现思路
1、本发明要解决的技术问题是提供一种基于细胞内可溶性蛋白含量检测表面活性剂对细菌的生物毒性的方法;通过将富集培养并离心重悬后细菌菌液和待测表面活性剂鼠李糖脂混合,得到混合液;将反应体系于恒温振荡培养箱中振荡培养48h后,通过将菌液离心重悬并加入naoh,经高温煮沸后细胞裂解后与考马斯亮蓝g-250原液混合测试混合液的吸光度,根据吸光度计算细胞内可溶性蛋白的含量来评价表面活性剂的生物毒性。
2、一种基于细胞内可溶性蛋白含量检测表面活性剂对细菌的生物毒性的方法,包括以下步骤:
3、1)将富集培养并离心重悬后的细菌菌液和待测表面活性剂混合,得到混合液;
4、2)将反应体系于恒温振荡培养箱中振荡培养48h;
5、3)将菌液离心重悬并加入naoh,高温煮沸后细胞裂解;
6、4)与考马斯亮蓝g-250原液混合测试混合液的吸光度;
7、5)通过蛋白质浓度标准曲线计算各个吸光度对应的可溶性蛋白含量,检测表面活性剂的生物毒性。
8、上述的一种基于细胞内可溶性蛋白含量检测表面活性剂对细菌的生物毒性的方法,步骤1)中,所述的细菌为坚强芽孢杆菌(bacillus firmus),鞘氨醇单胞菌属(sphingomonas sp.)、无色杆菌属(achromobactersp.)、红球菌属(rhodococcussp.)、芽孢杆菌属(bacillus sp.)、分枝杆菌属(mycobacterium sp.)、伯克霍尔德杆菌属(burkholderia sp.)、假单胞菌属(pseudomonas sp.)中的一种或多种,所述的表面活性剂为鼠李糖脂,壬基酚聚氧乙烯醚、聚氧乙烯月桂醚、吐温80、二烷基硫酸钠、十六烷基三甲基溴化铵、直链烷基苯磺酸钠,生物表面活性剂如海藻糖脂、槐糖脂、脂肽中的一种或多种。
9、上述的一种基于细胞内可溶性蛋白含量检测表面活性剂对细菌的生物毒性的方法,步骤1)中,所述的细菌菌液为是将坚强芽孢杆菌分散在无菌水中得到的,od600=0.8~1.0。
10、上述的一种基于细胞内可溶性蛋白含量检测表面活性剂对细菌的生物毒性的方法,步骤1)中,细菌菌液是将培养得到的坚强芽孢杆菌离心分离,用无菌水洗涤两次之后再用无菌水分散后得到;离心机转速是4000rpm,时间为10min;洗涤的转速是4000rpm,时间是5min。
11、上述的一种基于细胞内可溶性蛋白含量检测表面活性剂对细菌的生物毒性的方法,步骤2)中,转速为150rpm,温度为30℃;
12、上述的一种基于细胞内可溶性蛋白含量检测表面活性剂对细菌的生物毒性的方法,步骤3)中,naoh的浓度为1mol/l,naoh与菌液的体积比为1:10,裂解温度为100℃,裂解时间为15min;
13、上述的一种基于细胞内可溶性蛋白含量检测表面活性剂对细菌的生物毒性的方法,步骤4)中,所述吸光度为在595nm波长处测定吸光度;
14、上述的一种基于细胞内可溶性蛋白含量检测表面活性剂对细菌的生物毒性的方法,步骤5)中,蛋白质浓度标准曲线通过牛血清蛋白测定。
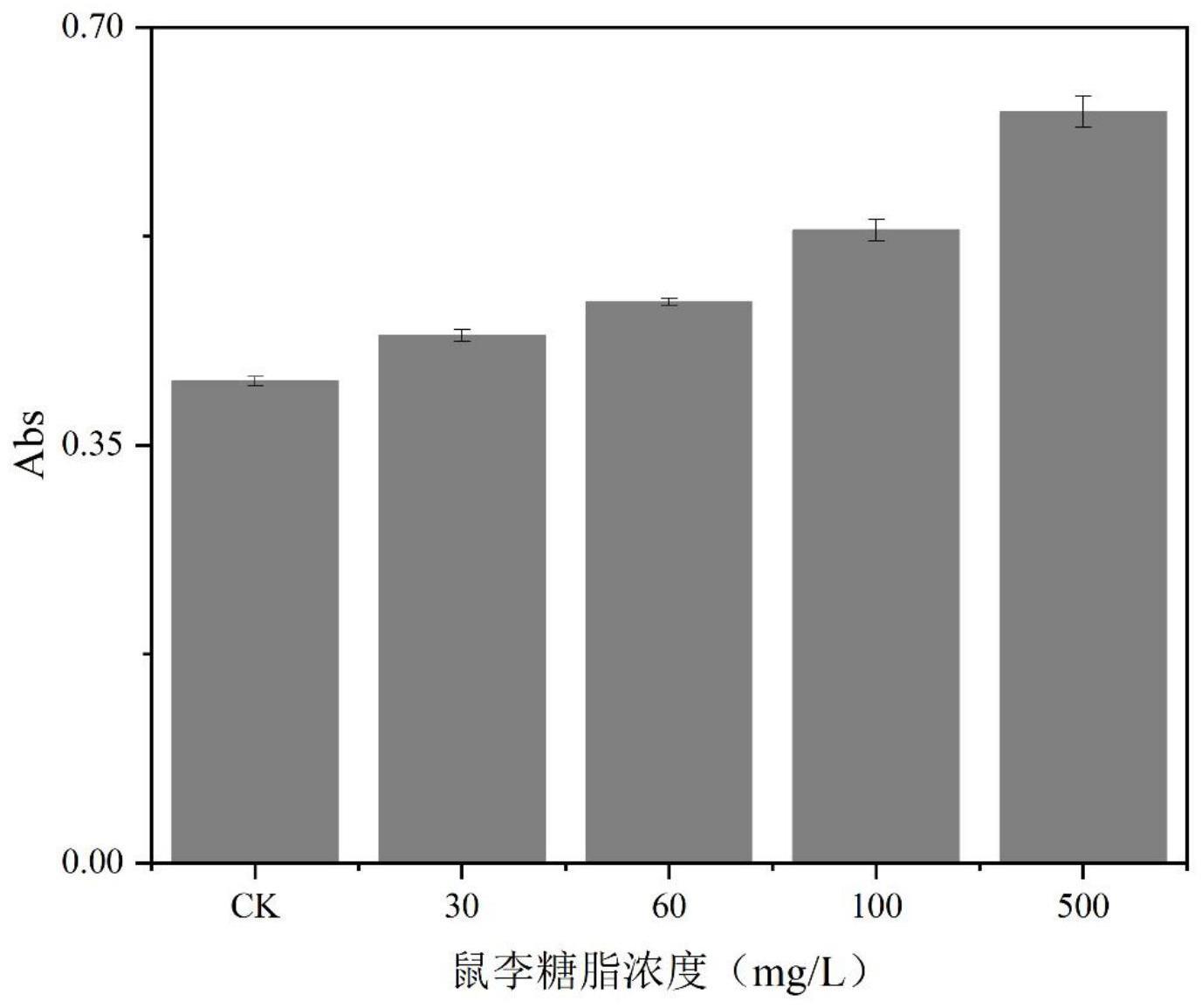
15、坚强芽孢杆菌(bacillus firmus)【1.16095】是于2020年9月购于中国普通微生物菌种保藏管理中心(cgmcc),隶属于中国科学院微生物研究所。该中心联系方式为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,电话为010-64807596。
16、坚强芽孢杆菌培养基为传统的牛肉膏蛋白胨培养基:取1.5g牛肉膏、5g蛋白胨、2.5g氯化钠和7.5~10g琼脂溶于500ml去离子水中,调节ph至7.4~7.6,于高压蒸汽灭菌锅中121℃灭菌20min,自然冷却,即可使用。富集培养基为lb培养基:取5g胰蛋白胨、2.5g酵母提取物和5g氯化钠溶于500ml无菌水中,于高压蒸汽灭菌锅中121℃灭菌20min,自然冷却。
17、可溶性蛋白是微生物重要的物质,它们的增加和积累能提高细胞的保水能力,对细胞的生命物质及生物膜起到保护作用。当外界环境中有毒物质的浓度增大时,细胞内的可溶性蛋白质含量也会出现明显的变化。因此,细胞内可溶性蛋白质的含量可以作为评价某一待测物质对于微生物毒性大小的依据。
18、考马斯亮蓝g-250测定蛋白质含量属于染料结合法的一种。考马斯亮蓝g-250在酸性溶液中的游离状态呈红褐色,当它与蛋白质结合后变为蓝色,前者最大吸收波长为465nm,后者为595nm。在一定蛋白浓度范围内(0.01-1.0mg/ml)蛋白质-色素结合物在595nm波长下的光吸收与蛋白质含量成正比,故可用于蛋白质的定量分析。蛋白质和考马斯亮蓝g-250结合2min左右达到平衡,反应迅速,其结合物在室温下1h内保持稳定。
19、在实际检测时,可取等量的菌液到多个试管,往各试管中加入不同浓度的待测表面活性剂,使数个试管中待测物质的浓度形成梯度差。之后按照上面步骤分别测定吸光度,通过比较吸光度的大小来评价待测表面活性剂的生物毒性。吸光度越大,表明细胞内可溶性蛋白含量越多,待测表面活性剂对细菌的生物毒性越大;吸光度越小,表明细胞内可溶性蛋白含量越少,待测表面活性剂对细菌的生物毒性越小。可设置对照组作为评价基底,对照组试管中加入无菌水来替代待测物质。
20、实际检测待测物质时,通过观察吸光度有无变化、变化大小来判断有无毒性、毒性大小。本方法可适用检测任意多环芳烃降解过程中的表面活性剂。
21、本发明带来的有益效果为:
22、(1)本发明通过借助考马斯亮蓝的显色作用,测定不同浓度的表面活性剂处理的细菌在595nm下的吸光度大小,并通过牛血清蛋白测定的标准曲线计算细菌细胞内蛋白质含量,从而评价不同浓度的表面活性剂对于细菌的毒性大小。该过程的实验周期较短,所需要的药品种类较少,操作较为简便,具有大规模工程应用的前景,因此具有良好的经济效益。
23、(2)本发明选用的表面活性剂具有更高的生物降解性、消化性和生物相容性,其应用于污染环境的修复时不会对环境造成二次污染,因此具有良好的环境效益。
24、(3)本发明在探究不同浓度表面活性剂对于细菌毒性大小的基础上,可以结合细菌对于多环芳烃降级率的变化,筛选最佳浓度的表面活性剂,进而强化细菌对于多环芳烃的生物降解,该发明在水环境污染的生物修复领域能更创造更大的经济和环境效益。
- 还没有人留言评论。精彩留言会获得点赞!