一种基于网状DNA纳米结构放大组装的聚集诱导发光生物传感方法及其应用
本发明涉及生物分析,具体是一种基于网状dna纳米结构放大组装的聚集诱导发光生物传感方法及其应用。
背景技术:
1、生物传感器作为一种重要的体外、体内分析检测工具,被广泛应用于疾病诊断、食品分析及环境监测等各种领域。其中,荧光光谱法因其具有高灵敏度、低破坏性和广泛的生物学应用价值等优点,通常被用于各种生物传感及成像方法的信号转导策略构建。然而,由于荧光生物传感通常会受到聚集诱导猝灭(acq)效应的影响,因而使得许多传统方法不得不基于“signal-off”信号转导模式而构建,通常灵敏度不高。尽管近年来不少研究人员通过使用猝灭剂来实现荧光团信号的预抑制发展了不少“signal-on”信号输出模式,但是这类方法通常设计复杂,而且往往存在较高的背景信号的干扰。
2、2001年,唐本忠教授提出的聚集诱导发光(aie)技术为有效解决上述问题,发展具有超低背景的高灵敏荧光生物传感策略提供了可能。尽管该技术目前已在不少分析物的生物传感领域得到一定应用,但是这些方法基本上都是基于目标物与aie探针在纯有机溶液或有机溶剂占比较高的有机-水混合溶液中,由静电吸附和亲疏水等弱相互作用引起的aie分子内运动受限(rim)来激活其光致发光而构建的,因此不仅选择性和生物兼容性较差,而且需要复杂的分子探针合成。
3、在生物传感中,标记法通常能够实现高特异性、高灵敏度信号输出。与传统抗体相比,基于selex技术筛选出来的核酸适配体不仅具有广泛的目标物识别能力,而且具有优良的稳定性和方便的末端修饰性质,因而十分有利于性能优良的标记型均相生物传感方法的构建。同时,其功能核酸性质还使得人们可以方便利用目标物特异性识别引起的相关核酸构象变化来发展各种性能优良的核酸信号放大技术,以很好避免传统生物传感领域中复杂的功能纳米探针制备及繁琐的多步分离洗涤操作。
4、尽管近年来各种四苯乙烯(tpe)衍生物的合成为基于aie核酸标记的生物传感策略的构建提供了可能,但是由于简单的双链核酸杂交产物对tpe单元的自由旋转和振动的约束能力有限,因而其aie信号增强不够明显,近年来在生物传感领域关注不多。值得注意的是,核酸的可编码碱基性质还使得人们可以在watson-crick氢键作用基础上进行各种dna纳米结构的可控组装。这样,不仅可以利用其纳米限域效应来有效提高均相反应动力学效率,而且也为精确调控aie分子的聚集行为提供了可能。
5、本技术就是在上述现有技术的基础之上,提出了一种基于网状dna纳米结构放大组装的聚集诱导发光生物传感方法,并成功将该方法应用于实际检测中。
技术实现思路
1、本发明的目的就是基于聚集诱导发光具有超低背景以及高灵敏度的优点,且核酸生物标记生物传感方法能够实现高特异性、高灵敏度信号输出的特性,结合二者的优点,提供一种基于网状dna纳米结构放大组装的聚集诱导发光生物传感方法,该方法灵敏度高,重复性和稳定性好,可同时用于卡那霉素残留的准确检测和半定量筛查,具有很好的应用价值。
2、为实现上述发明目的,本发明是通过以下技术方案来实现的:
3、本发明提供的一种基于网状dna纳米结构放大组装的聚集诱导发光生物传感方法,包括以下步骤:
4、(1)dna链的预处理
5、取6个pv管并分别编号为#1、#2、#3、#4、#5、#6,向#1pv管中加入10μl浓度为8μm寡核苷酸单链ap、p1、p2、p3;所述寡核苷酸单链ap的碱基序列为5’-att ttt tac gta agggct cca act ggg gga caa cct tgt cca agt ggt ctt gag gtt gta gtt gga gacgtaaaaaa-3’;p1的碱基序列为5’-gga caa ggt tgt ccc agt tgg agcttacgtaaaaaaaaaa-3’;p2的碱基序列为5’-cct caagac cac ttacaaaaaaaa aa-3’;p3的碱基序列为5’-acg tct ccaactacaaaaaaaaaaa-3’;
6、向#2pv管中加入10μl浓度为50μm的哑铃型探针r1,所述哑铃型探针r1的碱基序列为5’-gct ttc cataca gca gtg acg taa gct ccaact ggaaag cgc aaa gga agg gag tgttgtagt tgc ccc ccatccacc ttt gc-3’;
7、向#3pv管中加入10μl浓度为50μm的哑铃型探针r2,所述哑铃型探针r2的碱基序列为5’-gcaaac gcc cgg gca gtg gtaagt ggt ctt gag cgt ttg ccg ttt cgt agg gagtgt tgtagt tgc ccc ccg ctg ccgaaacg-3’;
8、向#4pv管中加入10μl浓度为50μm的哑铃型探针r3,所述哑铃型探针r3的碱基序列为5’-gca gtg ttg tag ttg gagacg cac tgc gca gtg ttg tag ttg gagacg cac tgc-3’;
9、向#5pv管中加入10μl浓度为100μm的寡合苷酸单链s3、lock-6g,所述寡合苷酸单链s3的碱基序列为5’-ggc cgg caaaaaaaa gga gtg ttg tag ttg gag acg cac tgc atccac ctt tgc gctaac gcc cgg gcagtgacg taagct ccaact cgt ttg ccg ttt cgt-3’;lock-6g的碱基序列为5’-ggg ggg caactacaacac tccaacaac aac ttt ttt ttg ccg gcc-3’;
10、向#6pv管中加入10μl浓度为100μm的寡合苷酸单链s4、lock-6g,所述寡合苷酸单链s4的碱基序列为5’-ggc cgg caaaaaaaa gga gtg ttg tag ttg gag acg cac tgc gctgcc gaa acg gca ttc cat aca gca gtg gta agt ggt ctt gag gga aag cgcaaagga-3’;lock-6g的碱基序列为5’-ggg ggg caactacaacac tccaac aacaac ttt ttt ttg ccg gcc-3’;
11、向每个pv管中加入浓度为10mm ph=7.4的三(羟甲基)氨基甲烷缓冲溶液稀释至上述浓度,所述三(羟甲基)氨基甲烷缓冲溶液中含有10mm tris、100mmnacl、10mm mgcl2;将#1、#2、#3、#4、#5、#6pv管中的溶液均加热至95℃,保持5min后缓慢降温2h至室温,分别得到稳定的几种结构ap/p1-p2-p3、r1、r2、r3、ds3、ds4溶液备用;
12、再向#2、#3、#4管中分别加入5μl的40u/μl t4 dna连接酶和5μl的t4 dna连接酶反应缓冲溶液,在20℃下放置12h以上,分别得到哑铃形核酸d1、d2、d3,并储存备用;
13、(2)聚集诱导发光探针的制备和纯化
14、取1支pv管并编号为#7,向pv管中加入198μl浓度为200μm的寡合苷酸单链sd-dbco和2μl浓度为80mm的[1-(4-叠氮甲基苯基)-1,1,2-三苯基]乙烯,所述寡合苷酸单链sd-dbco的碱基序列为5’-gga gtg ttg tag ttg-ch2ch(ch2oh)(ch2)4nhco(ch2)5co-dbco-3’,二者混匀后在室温下放置24h以上;加入4μl浓度为3m醋酸钠溶液和4μldnacarrier,振荡后加入1ml无水乙醇,在4℃、12000r/min的条件下离心15min并移去上清液,再加入100μl的70%乙醇,振荡后在4℃、12000r/min的条件下离心5min再次移去上清液;接着将样品溶解于ph=5.4的三乙基乙酸铵缓冲溶液中,将溶解后的溶液在制备型高效液相色谱中进行纯化,固定相为c-18制备色谱柱,流动相选择乙腈和ph=5.4的三乙基乙酸铵缓冲溶液,乙腈在通入溶液后35min内将比例从4%提高到60%;向采集得到的溶液中加入4μl的3m醋酸钠溶液,振荡后加入2.5倍体积的无水乙醇,振荡后再在4℃、12000r/min的条件下离心5min并移去上清液,之后加入100μl的70%乙醇,振荡后接着在4℃、12000r/min的条件下离心5min并再次移去上清液;最后用ph=7.4的三(羟甲基)氨基甲烷缓冲溶液溶解沉淀,所述三(羟甲基)氨基甲烷缓冲溶液中含有10mm tris、100mm nacl和10mm mgcl2,即得聚集诱导发光探针dtpe,保存在4℃的冰箱中备用;
15、(4)均相识别及扩增部分
16、取7支pv管,向每支pv管中加入10μl浓度为1μm的经步骤(1)退火处理后的寡核苷酸结构ap/p1-p2-p3溶液,再向每个pv管中分别加入30μl含有kana浓度梯度为0、0.75×10-4ng/ml、1×10-4ng/ml、5×10-4ng/ml、1×10-3ng/ml、5×10-3ng/ml、0.01ng/ml、0.05ng/ml、0.1ng/ml、0.5ng/ml和1ng/ml的10mm ph=7.4的三(羟甲基)氨基甲烷缓冲溶液;再向每支pv管中加入20μl浓度为2.5u/μl的核酸外切酶iii溶液,在37℃条件下涡旋反应100min,接着将每支pv管中的溶液加热到65℃保持10min,使核酸外切酶iii失活;之后,再向每支pv管中加入10μl浓度55nm的d1、d2、d3溶液、10μl浓度为2u/μl的phi29聚合酶溶液、10μl浓度为25mm的dntp、10μl浓度为4u/μl的nb.btsi内切酶溶液、20μlphi29聚合酶缓冲液和20μlrcutsmart缓冲液,于37℃条件下涡旋反应2h;最后将每支pv管中的溶液加热到80℃保持10min,使phi29聚合酶和nb.btsi内切酶失活;最后再向每支pv管中加入10μl浓度25μm的ds3、ds4溶液、10μl浓度100μm的dtpe溶液,于37℃条件下涡旋反应90min,即可得到长链复合物[s1/ds3/ds4/s2]n;
17、(4)标准溶液中卡那霉素含量的测定
18、利用荧光分光光度计测定溶液在激发波长为318nm时,发射波长为460nm的强度值,以建立强度变化值与kana浓度之间的定量关系;
19、(5)样品中kana含量的检测
20、取处理后的样品溶液30μl代替kana标准溶液,其余步骤与步骤(3)和(4)一致,反应后利用荧光分光光度计测定溶液激发波长为318nm时发射波长为460nm的强度值,根据步骤(4)中得到的强度变化值与卡那霉素浓度之间的定量关系,计算出样品溶液中kana的含量。
21、本发明还提供了一种基于网状dna纳米结构放大组装的聚集诱导发光生物传感方法在检测样品中卡那霉素含量中的应用。
22、本发明中所述步骤中所有dna的溶剂均使用高温高压灭菌后的超纯水(≥18.2mωcm)配制。
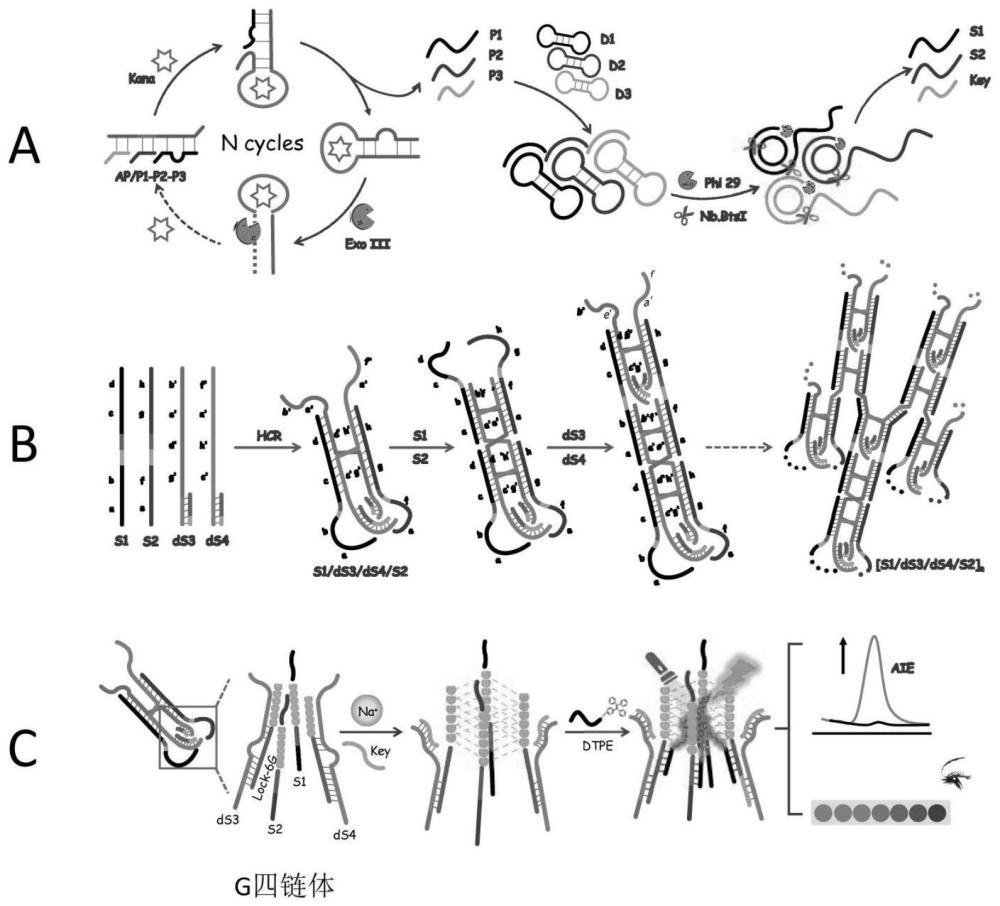
23、本发明的工作原理是:参见附图1的步骤a,通过双链探针(ap/p1-p2-p3)的核酸适配体区域将卡那霉素(kana)靶向捕获,利用这种特异性结合使双链探针ap/p1-p2-p3发生构象变化释放出单链引物p1、p2和p3。ap链发生构象变化,形成含有3’粘性末端的发夹结构,从而使得核酸外切酶iii被激活,消化发夹探针ap的核酸适配体序列,将kana释放出来,被更多的双链探针ap/p1-p2-p3捕获,进行不断的循环扩增。经此释放出的大量p1、p2和p3与哑铃型模板探针d1,d2和d3分别杂交,在phi29 dna聚合酶的作用下发生滚环扩增,由于在d1,d2和d3中预先设计了能被nb.btsi切刻酶识别和作用的位点,这会将滚环扩增释放的长链切刻为大量重复的单链s1,s2和key链。参见附图1的步骤b,进一步引入双链ds3和ds4,它们由较长单链s3和s4分别和较短单链lock-6g杂交而成,我们在ds3,ds4,s1和s2中设计了可以互相杂交的脚点。具体来说,s1可以在它的第一和第三脚点与ds3的第三和第一脚点分别杂交,在第二和第四脚点与ds4的第四和第二脚点分别杂交;s2可以在它的第二和第四脚点与ds3的第四和第二脚点分别杂交,在第一和第三脚点与ds4的第三和第一脚点分别杂交,进而触发四条dna支架间的杂交链式反应,从而实现不断的杂交循环扩增并生长成具有重复单元结构的长链复合物[s1/ds3/ds4/s2]n多向结构。同时,我们还在ds3,ds4,s1和s2中设计了一段富g序列以及它们下游的信号输出脚点,这使得杂交链式反应产物的每个重复单元的内部都能够形成四分子间平行g-四链体的结构并捕获聚集诱导发光探针。其中,ds3和ds4的富g序列和信号输出脚点我们设计在lock-6g中,而s1和s2的富g序列和信号输出脚点设计在它们的中游。为了确保lock-6g不会在未出现目标物识别的情况产生背景信号干扰,我们使得其富g序列和信号输出脚点先和s3、s4杂交,保持封闭状态,当经由滚环扩增的单链key被放出时,它可以与封闭lock-6g富g序列和信号输出脚点的s3、s4杂交,实现链置换,将富g序列和信号输出脚点释放出。最终引入聚集诱导发光探针dtpe,它会和ds3,ds4,s1和s2它们各自的信号输出脚点杂交,将具有aie效应的四苯乙烯荧光团拉近g-四链体结构,一方面使得多个aie分子聚集,另一方面g-四链体的强大碱基堆积力作用极大限制了四苯乙烯分子的振动,使得荧光信号得到增强,从而可以在此基础上构建该方法的荧光信号转导策略,参见附图1的步骤c。由于聚集诱导发光探针很低的背景信号,高灵敏的荧光信号输出,以及设计的核酸循环策略的级联信号放大作用,我们在此基础上成功发展了一种性能优良的聚集诱导发光可视化生物传感方法。
24、本发明开创性地利用aie核酸探针构建了基于核酸适配体检测卡那霉素的新策略,不同于常规的荧光探针,本方法无需猝灭剂即可实现“signal-on”响应。在aie传感领域,目前主要研究仍然集中于非标记型aie探针的设计和应用,几乎没有除简单静电作用、疏水堆积等弱相互作用力之外的靶向识别分析方法,这导致众多的方法开发还停留在设计合成复杂的aie探针分子,或者是在非生理环境中实现分析应用。本技术一方面利用g-四链体的强碱基堆积力和四足脚点造成的aie分子的强分子受限和精准聚集,很好实现了高灵敏aie信号输出;另一方面利用水相介质中核酸适配体的靶向识别功能和基于高特异性dna组装的核酸放大策略构建,很好确保了该方法的高选择性,实现了生理介质下更宽的检测范围和更高的分析灵敏度。从纳米结构上说,本技术中的dna纳米网状结构采用了交叉的杂交链式组装,常规的杂交链式反应形成的纳米线或者纳米网往往长度较短,空间结构稀疏,不能很好产生限域效应来有效增强均相反应动力学速率。由于本技术的交叉杂交链式反应可以组装出相对密集的均匀纳米网,因而可以更好的实现分析方法的信号增强和分析效率提高。
25、本发明基于网状dna纳米结构放大组装的聚集诱导发光生物传感方法也可以用于检测其它抗生素,只需要根据待测抗生素的相关性质选择相应的核酸适配体,并对图1a中相关的dna链的碱基序列进行适当修改,即可实现对其它抗生素的检测。
- 还没有人留言评论。精彩留言会获得点赞!