一种基于多组学分析揭示乙酰化修饰在银杏类黄酮生物合成中的重要性的方法
本发明属于生物,具体涉及一种基于多组学分析揭示乙酰化修饰在银杏类黄酮生物合成中的重要性的方法。
背景技术:
1、黄酮类化合物是植物中主要的次生代谢产物之一,在植物生命活动中发挥着重要作用。它们具有增强免疫力等药用功能,还具有抗癌和抗衰老活性,已用于预防和治疗心血管疾病(koes,r.,verweij,w.&quattrocchio,f.flavonoids:acolorful model for theregulation and evolution of biochemical pathways.trends plant sci.10,236–242(2005).)。黄酮类化合物是以c6-c3-c6为基本碳骨架结构的化合物,由两个苯环(a环和b环)与中间的三个碳原子连接而成。目前,已经鉴定出9000多种黄酮类单体(tahara,s.ajourney oftwenty-five years through the ecological biochemistry of flavonoids.biosci.biotechnol.biochem.71,1387–1404(2007).)。黄酮类化合物根据其结构的不同可分为不同的亚类,如黄酮类化合物、黄烷醇、查尔酮、异黄酮、二氢黄酮、黄烷酚、黄烷酮和花青素(panche,a.n.,diwan,a.d.&chandra,s.r.flavonoids:anoverview.j.nutr.sci.5,e47(2016).)。黄酮类化合物的生物合成途径相对固定,苯丙烷代谢途径(ko00940)是生物合成的初始途径。然后通过一系列反应途径产生不同的类黄酮,如类黄酮生物合成途径(ko00941)、花青素生物合成途径(ko00942)、异类黄酮生物合成通路(ko00943)以及黄酮和黄酮醇生物合成途径(ko00944)(mao,j.et al.integratedanalysis of the transcriptome and metabolome reveals genes involved interpenoid and flavonoid biosynthesis in the loblolly pine(pinus taeda l.).frontplant sci.12,729161(2021).)。
2、银杏是世界上现存最古老的树种之一,具有生长缓慢、对环境胁迫、微生物病虫害抵抗力强的特点。它被广泛用作观赏树和药用树,尽管它是中国本土最重要的经济树种之一,但它种植在世界各地的温带和亚热带地区(liu,h.l.et al.ahighly dense geneticmap for ginkgo biloba constructed using sequence-basedmarkers.frontplantsci.8,1041(2017).)。银杏叶提取物富含大量次生代谢产物,如类黄酮、酚类、萜内酯和异戊二烯。其中,黄酮类化合物和萜内酯是最主要的药用活性成分,广泛用于治疗和预防各种疾病(eisvand,f.,razavi,b.m.&hosseinzadeh,h.the effects ofginkgo biloba on metabolic syndrome:a review.phytother.res.34,1798–1811(2020).)。迄今为止,银杏提取物已成为制药、保健品和化妆品中最受欢迎的成分之一,银杏叶制剂已成为全球领先的植物药物(eisvand,f.,razavi,b.m.&hosseinzadeh,h.theeffects of ginkgo biloba on metabolic syndrome:areview.phytother.res.34,1798–1811(2020).)。目前,已鉴定出约40种银杏黄酮类化合物,其中大部分以糖苷和甲基化物的形式存在,包括黄酮类化合物、二氢黄酮、黄酮醇及其糖苷和双黄酮类化合物(kim,m.s.etal.ginkgo biloba l.extract protects against chronic cerebral hypoperfusion bymodulating neuroinflammation and the cholinergic system.phytomedicine 23,1356–1364(2016).)。银杏叶中黄酮类化合物含量低,黄酮类化合物的生物合成和积累机制不清楚,提取过程复杂,严重阻碍了黄酮类化合物研究的深入和银杏叶在新药、食品、保健品中的进一步开发利用。因此,有必要阐明银杏中黄酮类化合物的生物合成机制。
3、蛋白质翻译后修饰(ptms)发生在不同的氨基酸侧链或肽键上,通常由酶活性介导(liu,x.,yang,s.,yu,c.w.,chen,c.y.&wu,k.histone acetylation and plantdevelopment.enzymes 40,173–199(2016).)。赖氨酸乙酰化(kac)是原核生物和真核生物中的主要ptm之一,由赖氨酸乙酰转移酶(kats)和赖氨酸脱乙酰酶(kdacs)催化(zhang,k.,sridhar,v.v.,zhu,j.,kapoor,a.&zhu,j.k.distinctive core histone post-translational modification patterns in arabidopsis thaliana.plosone.2,e1210(2017).)。kac是通过kat催化的乙酰基从乙酰辅酶a转移到赖氨酸的ε-氨基侧链而产生的,并被kdac逆转(zhou,y.,yang,p.,zhang,f.,luo,x.&xie,j.histone deacetylase hda19interacts with histone methyltransferase suvh5 to regulate seed dormancy inarabidopsis.plant biology22,1062–1071(2020).)。在植物中,kat分为四个家族,p300/creb(camp-responsive element-binding protein)-binding protein family(cbp),tata-binding protein-associated factor family(tafii250),general controlnonrepressible 5-related n-terminal acetyltransferase family(gnat)和moz,ybf2/sas3,sas2,and tip60 family(myst)。kdac包括三个家族:reduced potassiumdependence 3/histone deacetylase(rpd3/hda1),silent information regulator 2(sir2)和histone deacetylase 2(hd2)(pandey,r.et al.analysis of histoneacetyltransferase and histone deacetylase families of arabidopsis thalianasuggests functional diversification of chromatin modification amongmulticellular eukaryotes.nucleicacidsres.30,5036–5055(2002).)。kac,包括非组蛋白kac和组蛋白kac,通过在赖氨酸残基上可逆添加乙酰基来调节蛋白质的定位和活性以及蛋白质-蛋白质和蛋白质-核酸的相互作用,有助于蛋白质组的功能多样性,并参与转录、翻译,以及在原核细胞和真核细胞中的代谢(narita,t.,weinert,b.t.&choudhary,c.functions and mechanisms ofnon-histone protein acetylation.nat.rev.mol.cellbiol.20,156–174(2019).)。黄曲霉毒素生物合成途径中的脂肪酸合成酶α和β被乙酰化,从而影响黄曲霉毒素的生物合成(lv,y.proteome-wideprofiling of protein lysineacetylation in aspergillusflavus.plos one 12,e0178603(2017).)。在梨(pyrusspp.)中,乙烯响应转录因子pperf9通过组蛋白去乙酰化抑制pprap2.4和ppmyb114的表达,从而抑制花青素的生物合成(ni,j.et al.the ethylene-responsive transcriptionfactor pperf9 represses pprap2.4 andppmyb114via histone deacetylation toinhibit anthocyanin biosynthesis in pear.plant cell 14,koad077(2023).)。非组蛋白kac的首次研究晚于组蛋白kac,因此,关于植物非组蛋白kac的报道很少。
4、目前,在银杏中已经鉴定出一些参与类黄酮合成途径的结构基因,并通过体外酶活性和转基因实验对其功能进行了验证(xu,f.et al.isolation,characterization,andfunction analysis of a flavonol synthase gene from ginkgobiloba.molbiolrep.39,2285–2296(2012).)。尽管在转录水平上对银杏类黄酮代谢的调控已经有了广泛的研究,但对翻译后的调节机制(如乙酰化修饰)知之甚少。因此,本研究旨在通过对银杏根、茎和叶的转录组、代谢组、蛋白组和赖氨酸乙酰组进行综合分析,阐明赖氨酸乙酰化修饰对类黄酮生物合成和代谢的影响机制,试图从多组学的角度解释乙酰化在类黄酮积累中的作用。我们的研究结果将有助于进一步探索植物类黄酮代谢调控机制以及银杏类黄酮产业的发展。
技术实现思路
1、本发明的目的是针对现有的问题,提供了一种基于多组学分析揭示乙酰化修饰在银杏类黄酮生物合成中的重要性的方法。
2、本发明是通过以下技术方案实现的:
3、一种基于多组学分析揭示乙酰化修饰在银杏类黄酮生物合成中的重要性的方法,包括如下步骤:
4、(1)植物材料准备:
5、选择的是生长在长江大学植物园四个月大的‘家佛手’银杏幼苗,分别收集银杏幼苗的根、茎、叶,清洗干净后迅速吸干表面水分,然后立即置于液氮中,最后储存于-80℃的冰箱中用于进一步分析;
6、(2)代谢样品提取:
7、1)生物样品放置于冻干机中真空冷冻干燥;
8、2)利用研磨仪30hz研磨1.5min至粉末状;
9、3)称取100mg的粉末,溶解于1ml 70%甲醇提取液中;
10、4)每30min涡旋一次,每次持续30s,共涡旋6次,样本置于4℃冰箱过夜;
11、5)12000rpm离心10min后,吸取上清,用微孔滤膜过滤样品,并保存于进样瓶中,用于uplc-ms/ms分析;
12、(3)rna提取、illumina测序和转录组数据分析:
13、1)使用rna-seq的rna提取试剂盒提取银杏根、茎、叶的总rna;
14、2)委托武汉迈特维尔生物科技有限公司对原始数据进行cdna合成、对原始数据进行cdna文库归一化、第二代测序和组装,trinity组装的转录序列用作后续分析的参考序列,使用rsem软件将从illumina hiseq高通量测序平台获得的干净读数映射到参考序列,然后标准化为fpkm作为测量转录物表达水平的指标,以|log2fc|≥1和fdr<0.05标准筛选差异表达基因(deg),并根据go和cog数据库和kegg途径进行分析,以获得不同组织间deg的详细描述;
15、(4)银杏组织的比较蛋白质组学分析:
16、1)蛋白提取:
17、使用液氮将样品研磨至粉末,然后在各组样品中加入粉末4倍体积酚抽提缓冲液超声裂解,加入等体积的tris-hcl缓冲液(ph 8.0)平衡酚,4℃,5500g离心10min,取上清转移至新的管子中并加入5倍体积的0.1m乙酸铵/甲醇混合溶液,混匀后置于-20℃或-80℃环境中过夜沉淀,蛋白沉淀分别用甲醇和丙酮洗涤2-3次,最后沉淀用8m尿素进行复溶,利用bca蛋白浓度测定试剂盒进行蛋白浓度测定;
18、2)胰酶酶解:
19、各样品蛋白取等量进行酶解,用裂解液将体积调整至一致,缓慢加入终浓度20%三氯乙酸(tca),涡旋混匀,4℃沉淀2h,4500g,离心5min,弃上清,用预冷的丙酮洗涤沉淀2-3次,晾干沉淀后加入终浓度200mm的四乙基溴化铵缓冲溶液(teab),超声打散沉淀,以胰蛋白酶:蛋白=1:50的比例加入胰蛋白酶,酶解过夜,加入二硫苏糖醇(dtt)使其终浓度为5mm,56℃还原30min,之后加入碘乙酰胺(iaa)使其终浓度为11mm,室温避光孵育15min;
20、3)生物信息学分析:
21、使用maxquant(v.1.6.15.0)搜索引擎对照ginkgo_biloba_3311数据库对所得的ms/ms数据进行处理,并通过uniprot(www.uniprot.org.br)在swiss-prot数据库中进行肽段鉴定。uniprot-goa(http://www.ebi.ac.uk/goa/)、interpro domain(http://www.ebi.ac.uk/interpro/)和kegg通路数据库用于注释已鉴定蛋白质的go功能、结构域和蛋白质通路,并对go功能、kegg途径和蛋白质结构域进行了功能富集分析,使用wolf psort软件预测所鉴定蛋白质的亚细胞定位;以|log2fold change|≥1.5(p<0.05)为标准,鉴定差异表达蛋白(deps);
22、(5)赖氨酸乙酰组分析:
23、1)蛋白质提取和胰蛋白酶消化的步骤(4)所述,将肽段溶解在ip缓冲溶液中,转移上清液至提前洗涤好的乙酰化树脂中,放置于4℃环境的旋转摇床上,温和摇晃并过夜孵育;
24、2)孵育结束后依次使用ip缓冲溶液洗涤树脂4次,去离子水洗涤2次;
25、3)最后使用0.1%三氟乙酸洗脱液,将树脂结合的肽段洗脱下来,共洗脱3次,收集洗脱液并真空冷冻抽干;
26、4)抽干后按照c18 ziptips说明书除盐,真空冷冻抽干后供液质联用分析;
27、5)二级质谱数据使用maxquant 1.6.15.0进行检索。检索参数设置:数据库为ginkgo_biloba_3311(41309条序列),添加了反库以计算随机匹配造成的假阳性率(fdr),并且在数据库中加入了常见的污染库,用于消除鉴定结果中污染蛋白的影响;酶切方式设置为trypsin/p;漏切位点数设为4;肽段最小长度设置为7个氨基酸残基;肽段最大修饰数设为5;first search和main search的一级母离子质量误差容忍度分别设为20.0ppm和20ppm,二级碎片离子的质量误差容忍度为20.0ppm,将半胱氨酸烷基化carbamidomethyl(c)设置为固定修饰,可变修饰为['acetyl(protein n-term)','oxidation(m)','acetyl(k)'],定量方法设置为lfq,蛋白鉴定、psm鉴定的fdr都设置为1%;
28、(6)载体构建与定点突变:
29、1)利用基因序列合成了c3h、f3’5’h和ccoaomt的全长编码序列;
30、2)通过将aag改为cag产生c3hk422q和f3'5'hk367q、f3'5'hk392q的定点突变;将aaa改变为caa产生ccoaomt的ccoaomtk144q的定点突变,利用突变蛋白以模拟c3h、f3'5'h和ccoaomt的乙酰化修饰;通过将aag改为agg产生c3hk422r和f3'5'hk367r、f3'5'hk392r的定点突变;将aaa改为aga产生ccoaomtk144r的定点突变,以模拟c3h、f3'5'h,和ccoaomt蛋白的去乙酰化修饰;
31、3)将野生型和突变型c3h、f3′5′h和ccoaomt cds克隆到pet-sumo载体中,带有noti和cpoi限制位点;
32、4)然后使用0.1mm异丙基β-d-硫代半乳糖苷(iptg)作为诱导剂,在大肠杆菌rosetta菌株中表达重组的c3h-his-sumotag、f3'5'h-his-ssumotag和ccoaomt-his-sumotag蛋白,并纯化该蛋白用于后续分析;
33、(7)蛋白质印迹分析:
34、为了检测c3h、f3'5'h和ccoaomt重组蛋白乙酰化的存在,使用10μl样品的纯化蛋白进行免疫检测;
35、(8)去乙酰化酶抑制剂处理及总黄酮含量的测定:
36、1)以4个月大的银杏幼苗作为研究对象,共选择36株长势一致的独立幼苗进行tsa抑制剂处理;
37、2)用30ml处理液喷洒每个幼苗的叶片,每24h处理一次,共处理3次,每个处理有三个生物重复,每个重复处理四棵银杏幼苗;
38、3)在第三次处理24h后收集根、茎和叶的组织样本,并用冷蒸馏水冲洗,然后立即将其冷冻在液氮中,并在-80℃的冰箱中储存,用于进一步分析;
39、4)采用高效液相色谱法测定黄酮类化合物的含量。
40、进一步地,步骤(2)中所述的uplc-ms/ms分析时,液相条件主要包括:
41、色谱柱:agilent sb-c181.8μm,2.1mm*100mm;
42、流动相:a相为超纯水(加入0.1%的甲酸),b相为乙腈(加入0.1%的甲酸);
43、洗脱梯度:0min b相比例为5%,9min内b相比例线性增加到95%,并维持在95%1min,10.00-11.10min,b相比例降为5%,并以5%平衡至14min;
44、流速:0.35ml/min;
45、柱温:40℃;
46、进样量:4μl。
47、进一步地,步骤(2)中所述的uplc-ms/ms分析时,质谱条件主要包括:
48、lit和三重四极杆(qqq)扫描是在三重四极杆线性离子阱质谱仪,ab4500q trapuplc/ms/ms系统上获得的,该系统配备了esi turbo离子喷雾接口,可由analyst 1.6.3软件控制运行正负两种离子模式;esi源操作参数如下:离子源,涡轮喷雾;源温度550℃;离子喷雾电压5500v/-4500v;离子源气体i,气体ii和帘气分别设置为50、60和25psi,碰撞诱导电离参数设置为高。在qqq和lit模式下分别用10和100μmol/l聚丙二醇溶液进行仪器调谐和质量校准,qqq扫描使用mrm模式,并将碰撞气体设置为中等;通过进一步的dp和ce优化,完成了各个mrm离子对的dp和ce,根据每个时期内洗脱的代谢物,在每个时期监测一组特定的mrm离子对,利用三重四级杆质谱的多反应监测模式分析定量代谢物,根据投影中的变量重要性(vip)≥1和倍数变化(fc)≥2或≤0.5确定差异累积代谢物(dam),基于kegg数据库对dam代谢途径进行了kegg功能注释和富集分析。
49、进一步地,步骤(4)中所述的酚抽提缓冲液为:10mm二硫苏糖醇,1%蛋白酶抑制剂,1%磷酸酶抑制剂,3μm tsa,50mm nam。
50、进一步地,步骤(5)中所述的ip缓冲溶液为100mmnacl,1mm edta,50mm tris-hcl,0.5%np-40,ph 8.0。
51、进一步地,步骤(5)中所述的赖氨酸乙酰组分析时除了对所鉴定的乙酰化修饰蛋白进行相同的功能注释和功能富集分析外,还对修饰位点的基序进行了分析。
52、进一步地,步骤(7)中所述的蛋白质印迹分析具体是通过使用第一抗乙酰化抗体和第二抗体进行乙酰化检测,用bio-rad成像系统分析特异性条带。
53、进一步地,所述的第一抗体为泛抗乙酰赖氨酸小鼠mab,1:1000稀释,cat#ptm-101,ptm bio,杭州;第二抗体为山羊抗小鼠igg(h+l),1:5000稀释,cat#31430,赛默飞世尔科学公司,美国。
54、进一步地,步骤(8)中所述的银杏幼苗样品分为三种实验处理:二甲基亚砜(dmso,ck)、5μm tsa和10μm tsa,其中dmso是作为表面活性剂和溶剂使用。
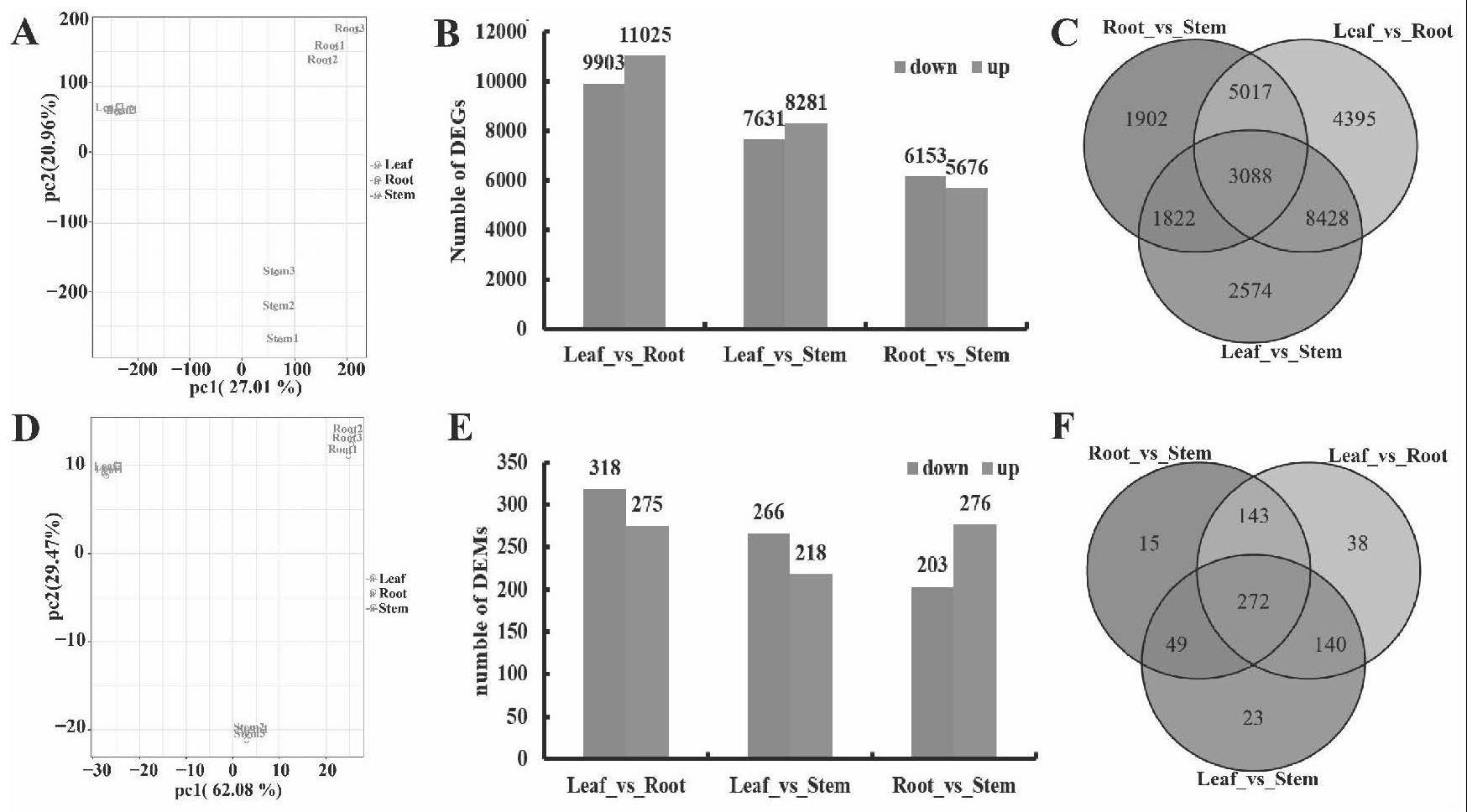
55、黄酮类化合物是银杏最重要的次生代谢产物,具有重要的药用价值。它们是用于评估银杏药用价值的指标之一。银杏叶提取物(gbe)是临床治疗认知障碍最常用的产品,24%的提取物由黄酮类化合物组成,黄酮类化合物是该产品的药用成分。许多研究侧重于利用转录组学等技术阐明银杏黄酮生物合成的分子机制,并长期试图提高银杏中黄酮的含量,促进银杏产业的发展。本技术首次利用转录组学、蛋白质组学、代谢组学和翻译后修饰蛋白质组学来阐明银杏类黄酮合成的分子调控。首先,在转录水平上,从类黄酮的生物合成途径(ko00940、ko00941、ko00942、ko00943、ko00944)中分别鉴定出152、100和111个deg。对银杏组织的乙酰组进行了分析,在4324个蛋白质上鉴定出11788个赖氨酸乙酰化位点。这些修饰蛋白参与了不同的代谢过程和各种生物过程。将蛋白质组与乙酰化修饰的蛋白质组相结合,发现许多参与类黄酮代谢的蛋白质(ko00940、ko00941、ko00944)被乙酰化。最后,以类黄酮的积累为重点,从类黄酮的生物合成途径(ko00941、ko00943、ko00944)中分别鉴定了leaf_vs_root、leaf_vs_stem和root_vs_stem中差异积累的203、173和178种类黄酮。为了确定最关键的修饰蛋白并收集跨类黄酮代谢途径的数据,从类黄酮生物合成(ko0941)和黄酮醇生物合成途径(ko00944)中鉴定了12种乙酰化蛋白,即chi、c3h1、anr、dfr、ccoaomt1、f3h1、f3h2、ccoaomt2、c3h2、hct、f3'5'h和fg2。对c3h1、ccoaomt1和f3'5'h的定点突变蛋白的wb分析验证了乙酰化水平,用kdac抑制剂tsa处理影响了银杏叶中黄酮类化合物的含量,这支持了kac在黄酮类化合物积累中的重要作用。
56、蛋白质是生物或细胞动力学的载体,蛋白质水平的研究可以更直观地反映基因表达水平。在本技术中,使用pearson相关系数来评估每对转录物与蛋白质表达之间的整体关系。转录物与蛋白质表达的正相关率为89.3%(r>0)(图13a),而转录物与蛋白表达的相关系数大于0.9,仅占50%。转录物和蛋白质也被分为六类(图12b)。图13c显示了在不同的调控关系下可能与蛋白质或转录物相关的kegg途径过程。大多数蛋白质参与次级代谢产物的生物合成和代谢途径,包括大量的正相关蛋白质和一些负相关蛋白质。据报道,kac水平可能会影响mrna和蛋白质丰度之间的相关性,而蛋白质kac可能导致了异基因四倍体过程中转录组和蛋白质组变化之间的不一致。相反,在这项研究中,蛋白质水平和转录物之间总体上存在高度相关性,大约11%的转录物与其相应的蛋白质之间仍然存在负相关性。因此,有理由推测蛋白质kac是转录物和蛋白质表达之间差异的原因之一,这也表明除了控制生物次级代谢的基因外,可能还有一种蛋白质kac独立于该蛋白质的转录和翻译水平参与类黄酮生物合成。
57、图13中:a、转录组和蛋白质组之间定量pearson相关系数的累积分布。计算每个蛋白质与相应转录物之间的pearson相关系数,并对pearson相关性系数进行统计。横坐标表示pearson相关系数,纵坐标表示在该pearson相关性系数下的蛋白质或转录物的数量。红色表示正相关,蓝色表示负相关。b、转录组和蛋白质组定量相关系数的基因集富集分析(gsea),kegg注释被用作具有已知功能的基因集,并输入蛋白质和转录物之间的相关系数,以研究参与不同调控关系的主要kegg途径。为nom p val<0.05的通道绘制gsea分析图。c、转录组和蛋白质组表达的聚类热图。
58、蛋白质赖氨酸乙酰化是一种动态可逆的ptm,包括组蛋白kac和非组蛋白kak。组蛋白kac是基因表达表观遗传调控中的关键染色质修饰之一,已被证明在植物代谢、植物对胁迫的反应和耐受中发挥关键作用。h3和h4中的kac位点在不同物种中高度保守,h2a和h2b中的kak位点是物种依赖性的,并表现出物种特异性,这主要是由于h2a尾部的序列多样性。在这项研究中,共鉴定了23个组蛋白,89个kac位点。有趣的是,除了h3和h4组蛋白修饰位点外,还发现h2b组蛋白的修饰位点相对保守。尽管在组蛋白h2a中检测到的kac位点不太保守,但在组蛋白h2a中已经发现了连续的kac位置,如k10–k19和k133–k138,这与其他人的研究结果一致(xia,l.,kong,x.,song,h.,han,q.&zhang,s.advances in proteome-wideanalysis of plant lysine acetylation.plant commun.3,100266(2021).)。组蛋白中kac位点的发现为分析银杏中类黄酮生物合成和不同组织发育等生命活动提供了新的研究焦点。
59、除了组蛋白外,通过我们对乙酰化的深入分析还发现了非组蛋白的kac。如上所述,组蛋白kac可以改变细胞中染色质的结构,从而增强或激活基因转录。非组蛋白的kac修饰也会影响相关蛋白质的特定结构,导致蛋白质的性质和功能发生变化,从而调节与该蛋白质相关的生物代谢过程。包括与糖酵解、植物光合作用和三羧酸循环相关的关键代谢酶,其活性通过蛋白质kac修饰而调节和改变,从而影响它们所参与的生物过程。尽管对植物中kac蛋白的研究进展晚于对哺乳动物和微生物蛋白的研究,但一些kac蛋白已在大多数植物中进行了研究。远端短柄藻幼苗叶片中蛋白质组的赖氨酸乙酰化首次揭示了这些蛋白质ptm在早期营养阶段的中心作用。在小麦中,鉴定出277个kac蛋白和416个kac修饰位点,这些kac蛋白参与了一些生物学过程。kac蛋白质组也在其他植物中进行了研究,如拟南芥和草莓(fragaria ananassa cultivar hongjia)。在本技术中,生成了银杏根、茎和叶的赖氨酸乙酰组数据集,首次鉴定了类黄酮代谢途径中的乙酰化蛋白,并将该信息与类黄酮生物合成途径的结构基因信息和相关的kegg注释信息相结合,发现了12种可能参与类黄酮生物合成的乙酰化蛋白,即chi、c3h1、anr、dfr、ccoaomt1、f3h1、f3h2、ccoaomt2、c3h2、hct、f3'5'h和fg2,并且每种蛋白在不同组织中具有至少一个具有不同修饰水平的kac位点。
60、在本技术中,tsa处理银杏幼苗会影响总黄酮的含量(图12b),ccoaomt、c3h和f3'5'h的mrna和蛋白质水平与各种黄酮类化合物呈正相关(图9),这表明(1)乙酰化影响银杏黄酮类化合物的生物合成。(2)ccaomt、c3h和f3'5'h蛋白在银杏黄酮的生物合成中起着重要作用。银杏类黄酮合成途径的每一步都是通过多基因家族控制的,从而形成一个复杂的网络。ccoaomt是一种s-腺苷甲硫氨酸依赖性o-甲基转移酶,属于o-甲基转移酶类家族,参与木质素和类黄酮的代谢,植物中木质素和花青素代谢之间存在竞争关系。在矮牵牛中,抑制ccoaomt的表达可以导致其他苯丙烷类化合物生物合成的激活,表明phccoaomt有助于挥发性苯丙烯的形成。在本技术中,通过定点突变验证了ccoaomt1、c3h和f3'5'h的乙酰化修饰。ccoaomt1基因在茎中的表达水平最高,其次是在根中,并且ccoaomt1基因和蛋白的表达水平显著正相关。ccoaomt1的k144位点在根中的修饰水平最高,其次是在茎中的,这与ccoaomt1催化的下游产物同源二聚体含量的变化趋势一致。在他人研究中,下调梨果实中ccoaomt1的表达可以阻碍木质素的生物合成并促进花青素的积累,这不仅降低了梨果实中核细胞的含量和大小,而且增加了果实中黄酮类化合物的含量(cao,y.,li,x.&jiang,l.integrative analysis of the core fruit lignification toolbox in pearreveals targets for fruit quality bioengineering.biomolecules 9,504(2019).)。因此,我们推测,根中高水平的kac修饰抑制了该基因在根中的表达,最终增加了根中同源性的含量。
61、f3'5'h催化类黄酮3'和5'位的羟基化形成b-环三羟基产物。大多数研究一致认为,f3'5'h在类黄酮生物合成中起着积极的调节作用,myb117通过上调白杨(populustremula×tremuloides)中的f3'5'h1基因来促进花青素的合成并增强类黄酮b环的羟基化。在本技术中,验证了k367和k392乙酰化位点对f3′5′h蛋白的修饰,发现它们在根中的修饰水平显著高于茎,而在叶中没有。对f3′5′h直接催化的四种产物的分析表明,只有二氢杨梅素含量的变化趋势与kac位点修饰、mrna和蛋白质水平的变化趋势一致。同一物种中不同的f3'5'h蛋白酶对催化底物有偏好。在山茶中,csf3'5'ha可以催化黄烷酮黄烷醇,而csf3'5'hb只能催化黄烷醇或黄烷醇。其中,csf2'5'ha和csf3'5'hb分别偏好柚皮素和二氢山奈酚底物。我们推测gbf3′5′h对二氢山奈酚具有较高的催化活性,并且f3′5'h在根中的高水平修饰改变了mrna或蛋白质在根中积累,从而导致下游产物二氢杨梅素和二氢山奈酚在根中积聚。
62、tsa对银杏叶的根、茎和叶中黄酮类化合物含量的影响,证实了kac在银杏黄酮类化合物积累中的重要作用。为了更好地了解kac在黄酮类化合物生物合成中的作用,本技术绘制了kac在类黄酮生物合成中的调控模型图。从图中可以看出,tsa抑制了银杏中kdacs的活性,介导了蛋白质的乙酰化过程,最终影响了黄酮类化合物的积累。根据本技术结果,推测了kac在类黄酮生物合成中的几种分子机制(图14):银杏中的组蛋白被乙酰化,通过影响类黄酮代谢途径中关键基因的表达水平来参与类黄酮生物合成;类黄酮代谢途径中的关键结构基因蛋白被乙酰化,改变了其自身活性,影响了类黄酮的积累;乙酰化类黄酮结构基因蛋白通过调节类黄酮代谢途径中基因的转录水平参与类黄酮生物合成。然而,还需要进一步的研究来证实上述调控机制。
63、本发明相比现有技术具有以下优点:
64、1、本技术对银杏不同组织的转录组、代谢组、蛋白质组和赖氨酸乙酰组进行了综合分析。在4324个乙酰化蛋白上共鉴定出11788个赖氨酸酰化(kac)位点,包括23个组蛋白和89个kac位点。此外,在组织中鉴定了128种差异积累的类黄酮,并构建了与类黄酮生物合成途径相关的差异表达基因数据集。十二个(chi、c3h1、anr、dfr、ccoaomt1、f3h1、f3h2、ccoaomt2、c3h2、hct、f3'5'h和fg2)乙酰化鉴定了可能参与类黄酮生物合成的蛋白质。我们进一步验证了c3h1、ccoaomt1和f3'5'h在多组学数据集中的差异,并且它们的mrna和蛋白质水平高度相关,并且它们都与一些差异积累的黄酮类化合物呈正相关。其中,ccoaomt1和f3'5'h位点的修饰水平分别与催化产物高碘酸甘油酯和二氢杨梅素的变化趋势一致。去乙酰化酶抑制剂影响了不同组织中总黄酮的含量,并增加了银杏根中黄酮的含量。总之,这些发现首次揭示了乙酰化在类黄酮生物合成中的重要作用。
65、2.本技术通过对银杏根、茎和叶的转录组、代谢组、蛋白质组和赖氨酸乙酰组的联合分析,阐明乙酰化修饰对类黄酮生物合成和代谢的影响机制,试图从多组学角度解释乙酰化在类黄酮积累中的作用。为进一步探索植物黄酮类化合物的代谢调控机制和银杏黄酮类化合物产业的发展提供了依据。
- 还没有人留言评论。精彩留言会获得点赞!