检测腺嘌呤碱基编辑器的编辑效率的方法和核酸组合物与流程
本技术涉及生物,特别是涉及一种检测腺嘌呤碱基编辑器的编辑效率的方法和核酸组合物。
背景技术:
1、crispr/cas9技术是利用rna双链中的引导序列(tracrrna和crrna)与dna靶序列形成碱基对,在靶点处产生dna双链断裂(double strand breaks,dsb),诱发细胞内的同源重组(homology directed repair,hdr)和非同源末端连接(non-homologous endjoining,nhej)修复途径,从而实现对基因组dna的定点敲除、替换、插入等修饰。然而,dsb引发的dna修复很难实现高效稳定的单碱基突变;nhej容易引起随机插入和缺失,造成移码突变,从而影响靶基因的功能;hdr尽管精确性高于nhej,但是其在细胞中的同源重组修复效率低。目前已知的人类致病性突变中,最大的一类是点突变,也称为单核苷酸变异(single-nucleotide variant,snv),约2/3人类疾病的发生与snv有关。
2、碱基编辑技术是基于crispr/cas系统发展起来的一种新型靶基因修饰技术,该技术可以在不切断核酸骨架的情况下实现单核苷酸的定点突变,在基因组和转录组编辑过程中能够直接化学修饰靶核碱基。将crispr/cas系统与单个脱氨酶结合开发的基因编辑工具,可以在dna或rna中精确地进行单碱基替换,而不产生dna双链断裂(dsb)或需要活细胞中的供体dna模板。与crispr/cas9等其他传统人工核酸酶系统相比,碱基编辑器更精确、更安全。因此,碱基编辑器在生物医学领域已得到广泛应用,包括基因功能研究、定向蛋白质进化、遗传谱系追踪、疾病建模和基因治疗。常用的碱基编辑器包括胞嘧啶碱基编辑器(cytosine base editor,cbes)和腺嘌呤碱基编辑器(adenine base editor,abes)。
3、目前,检测abes编辑效率的方法包括一代测序和二代测序。一代测序可直接看到靶序列是否发生碱基替换,但其单次只能测试一个样本,当有大量样本需要检测时,采用一代测序不利于碱基编辑器abes的优化。二代测序可以同时测试多个样本,但其上机时间长,序列分析复杂,对于abes的快速筛选效果不佳。此外,还可以通过直接建立酪氨酸白化鼠根据小鼠皮毛颜色(是否出现白化)来判断abes编辑效率,但小鼠品系建立周期长,操作复杂。
4、因此,传统技术仍有待改进。
技术实现思路
1、基于此,本技术一个或多个实施例提供了一种检测腺嘌呤碱基编辑器的编辑效率的方法和核酸组合物。技术方案包括:
2、根据本技术实施例的一个方面,提供了一种检测腺嘌呤碱基编辑器的编辑效率的方法,包括如下步骤:
3、使用失活的荧光蛋白表达系统、sgrna表达系统以及腺嘌呤碱基编辑器共同转染目标细胞;所述sgrna表达系统靶向所述失活的荧光蛋白表达系统;
4、培养所述转染后的目标细胞,检测表达荧光蛋白的细胞数量和不表达荧光蛋白的细胞数量,计算表达荧光蛋白的细胞占比;以及
5、根据所述表达荧光蛋白的细胞占比,确定所述腺嘌呤碱基编辑器的编辑效率。
6、在其中一个实施例中,所述失活的荧光蛋白表达系统包括pam片段、荧光蛋白编码片段以及终止密码子的编码片段。
7、在其中一个实施例中,所述失活的荧光蛋白表达系统还包括一个或多个色氨酸的编码片段。
8、在其中一个实施例中,所述终止密码子的编码片段与所述pam片段间隔3n个碱基,其中0≤n≤6。
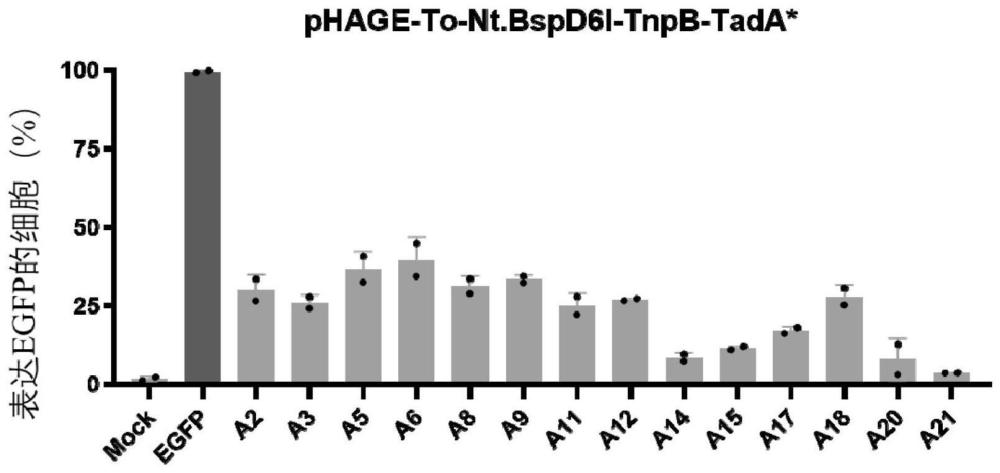
9、在其中一个实施例中,所述腺嘌呤碱基编辑器包括phage-to-tada*-tnpb、phage-to-nt.bspd6i-tnpb-tada*和ng-abe8e中的一种或多种。
10、在其中一个实施例中,所述pam片段的核苷酸序列为ttgat、ngg、ng、tttr、nrn或者nyn。
11、在其中一个实施例中,所述失活的荧光蛋白表达系统包括失活的增强型绿色荧光蛋白表达系统、失活的增强型黄色荧光蛋白表达系统、失活的增强型蓝色荧光蛋白表达系统、失活的增强型青色荧光蛋白表达系统、失活的绿色荧光蛋白表达系统、失活的红色荧光蛋白表达系统、失活的橙色荧光蛋白表达系统、失活的黄色荧光蛋白表达系统、失活的蓝色荧光蛋白表达系统和失活的青色荧光蛋白表达系统中的一种或多种。
12、在其中一个实施例中,构建所述失活的增强型绿色荧光蛋白表达系统的引物对包括:
13、核苷酸序列如seq id no:1所示的正向引物,以及核苷酸序列如seq id no:14~seq id no:27中一种或多种所示的反向引物。
14、在其中一个实施例中,构建所述sgrna表达系统的引物对包括:
15、核苷酸序列如seq id no:28~seq id no:29、seq id no:30~seq id no:31、seqid no:32~seq id no:33、seq id no:34~seq id no:35、seq id no:6~seq id no:37、seq id no:38~seq id no:39、seq id no:40~seq id no:41、seq id no:42~seq idno:43、seq id no:44~seq id no:45、seq id no:46~seq id no:47、seq id no:48~seqid no:49、seq id no:50~seq id no:51、seq id no:52~seq id no:53以及seq id no:54~seq id no:55所示的引物对中的一对或多对。
16、根据本技术实施例的另一个方面,提供了一种检测腺嘌呤碱基编辑器的编辑效率的核酸组合物,包括失活的增强型绿色荧光蛋白表达系统和sgrna表达系统,所述sgrna表达系统靶向所述失活的荧光蛋白表达系统;
17、或者,包括构建所述失活的增强型绿色荧光蛋白表达系统的引物对和构建所述sgrna表达系统的引物对;
18、可选地,构建所述失活的增强型绿色荧光蛋白表达系统的引物对包括:核苷酸序列如seq id no:1所示的正向引物,以及核苷酸序列如seq id no:14~seq id no:27中一种或多种所示的反向引物;
19、可选地,构建所述sgrna表达系统的引物对包括:核苷酸序列如seq id no:28~seq id no:29、seq id no:30~seq id no:31、seq id no:32~seq id no:33、seq id no:34~seq id no:35、seq id no:6~seq id no:37、seq id no:38~seq id no:39、seq idno:40~seq id no:41、seq id no:42~seq id no:43、seq id no:44~seq id no:45、seqid no:46~seq id no:47、seq id no:48~seq id no:49、seq id no:50~seq id no:51、seq id no:52~seq id no:53以及seq id no:54~seq id no:55所示的引物对中的一对或多对。
20、与传统技术相比,本技术具有如下有益效果:
21、本技术提供了一种快速、高效的检测碱基编辑器的编辑效率的方法。碱基编辑器发生编辑时,能够对失活的荧光蛋白表达系统进行编辑使之重新表达,通过检测表达荧光蛋白的细胞比例,能够直观地反映碱基编辑器的编辑效率。此外,本技术的方法能够实现对多个样本同时进行检测,且具有成本低、周期短等优势。
- 还没有人留言评论。精彩留言会获得点赞!