一种检测Fc轻链改造双抗或Fc融合蛋白表达量的方法与流程
本技术涉及蛋白表达量检测,特别是涉及一种检测fc轻链改造双抗或fc融合蛋白表达量的方法。
背景技术:
1、fc轻链改造双抗即保留fc片段的轻链改造双抗,fc融合蛋白即融合有fc片段的融合蛋白。fc轻链改造双抗或fc融合蛋白表达量检测,是抗体或fc融合蛋白细胞株筛选和培养条件优化的重要指标之一。
2、从原核金黄色葡萄球菌细胞壁分离的结合受体protein a(~56kda)能与多数的哺乳动物igg的fc端特异性结合。利用这种特异性结合能够实现含有抗体igg分子fc端的蛋白与杂质的分离。在抗体或fc融合蛋白的开发过程中,采用protein a亲和色谱柱测定细胞培养上清液中目的蛋白浓度,监测细胞培养过程中目的蛋白的表达情况,对高产量的克隆株筛选以及细胞培养条件的优化提供支持。
3、含有抗体igg分子fc端的蛋白在中性条件下与protein a亲和色谱柱发生特异性结合,从而固定在固定相中,而其他杂质不能与protein a结合,随流动相流出。再用酸性洗脱液将结合在色谱柱上的蛋白洗脱下来,在紫外波长280nm下进行检测,采用外标曲线法对浓度进行定量,即可实现fc轻链改造双抗或fc融合蛋白表达量的检测。
4、但是,研究显示,protein a与不同免疫球蛋白同型的fc区以及人vh3家族的fab区具有高度的亲缘关系。进一步研究表明,protein a仅限于与igg亚类igg1、igg2和igg4结合,与igg3的反应性很低,约占总igg的8%。天然的protein a有5个igg结合结构域(即e、d、a、b、c)和未知功能的非fc结合域(即x区域);这样结构的proteina在大量结合目标蛋白的同时,其非fc结合域也会结合部分杂蛋白,导致洗脱下来的目标蛋白表达量检测结果不准确,检测结果与真实表达量相比偏高。
5、此外,对于现有protein a检测蛋白表达量技术,一般轻链会过表达,有些改造的轻链抗体,采用protein a色谱柱会造成检测蛋白时,轻链碎片也会和目的fc抗体一样的结合和洗脱,检测出目标蛋白的含量与真实值相比偏高。
6、因此,如何更准确、真实的检测fc轻链改造双抗或fc融合蛋白的真实表达量,是抗体或fc融合蛋白细胞株筛选和培养条件优化技术领域亟待解决的技术难题。
技术实现思路
1、本技术的目的是提供一种新的检测fc轻链改造双抗或fc融合蛋白表达量的方法。
2、为了实现上述目的,本技术采用了以下技术方案:
3、本技术的一方面公开了一种检测fc轻链改造双抗或fc融合蛋白表达量的方法,其包括采用重组protein g替换proteina对待测样本中的fc轻链改造双抗或fc融合蛋白进行分离和表达量检测。
4、需要说明的是,本技术的关键在于,研究发现protein g可与目标蛋白的fc区域特异性结合,与protein a相比protein g对igg具有更好的结合能力,杂蛋白结合水平更低,检测出的目标蛋白表达量更准确;因此,本技术创造性的提出重组protein g替换proteina对待测样本中的fc轻链改造双抗或fc融合蛋白进行分离和表达量检测,使得检测出的抗体或fc融合蛋白表达量更准确。
5、本技术的一种实现方式中,重组protein g为去除白蛋白结合位点和细胞表面结合位点的重组protein g。
6、需要说明的是,本技术研究发现,天然的proteing还能与大多数物种,包括大鼠和山羊等,的免疫球蛋白结合,并能识别大多数类和亚类,protein g与白蛋白也有很高的亲和性,这可能会导致污染问题;因此,本技术创造性的采用去除白蛋白结合位点和细胞表面结合位点的重组protein g,减少交叉反应和非特异性结合,进一步提高fc轻链改造双抗或fc融合蛋白检测的准确性。
7、本技术的一种实现方式中,采用重组protein g对待测样本中的fc轻链改造双抗或fc融合蛋白进行分离,具体包括,将重组protein g作为亲和配基偶联到琼脂糖凝胶或琼脂糖磁珠上,制成protein g琼脂糖凝胶、protein g琼脂糖磁珠或protein g亲和层析柱,特异性的与待测样本中的fc轻链改造双抗或fc融合蛋白结合,实现待测样本中fc轻链改造双抗或fc融合蛋白的分离。
8、本技术的一种实现方式中,fc轻链改造双抗为human igg1+kappa蛋白。
9、本技术的一种实现方式中,采用重组protein g对待测样本中的fc轻链改造双抗或fc融合蛋白进行分离和表达量检测,具体包括,采用重组protein g对待测样本进行hplc分析,获得待测样本的总峰面积,将待测样本的总峰面积带入标准曲线中,获得待测样本中fc轻链改造双抗或fc融合蛋白的浓度;其中,标准曲线由若干个已知fc轻链改造双抗或fc融合蛋白浓度的样本,以其浓度为x、总峰面积为y轴拟合获得。
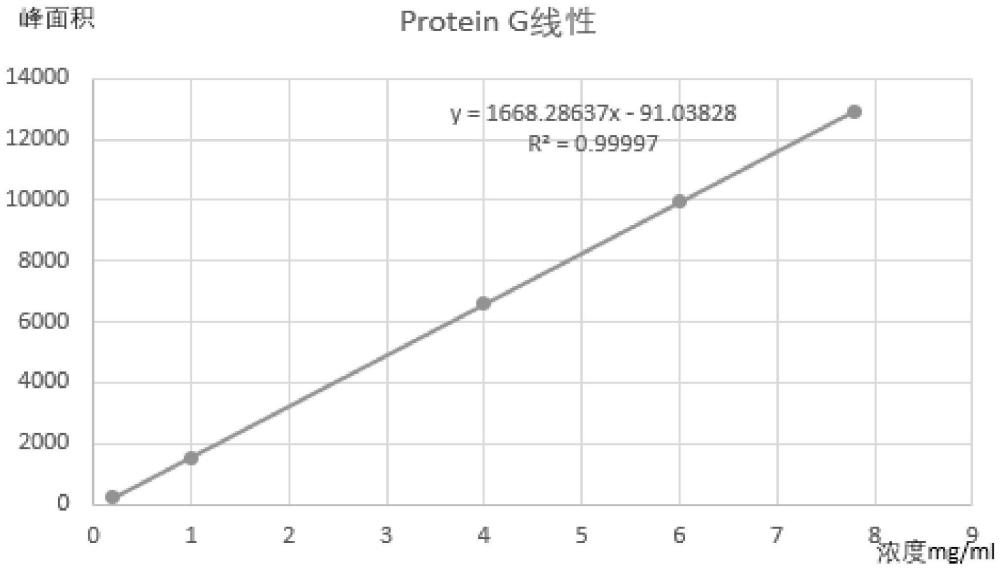
10、需要说明的是,本技术研究发现,fc轻链改造双抗或fc融合蛋白hplc获得的总峰的峰面积与其浓度呈很好的线性关系,本技术的一种实现方式中,蛋白的总峰面积与浓度的线性相关系数r2可以达到0.99995。因此,本技术创造性的提出,将protein g-hplc检测与titer方法组合,用于fc轻链改造双抗或fc融合蛋白的表达量检测。
11、本技术的一种实现方式中,标准曲线的制备方法包括,采用重组protein g对若干个已知fc轻链改造双抗或fc融合蛋白浓度的样本进行hplc分析,获得各已知浓度蛋白样本的总峰面积,以总峰面积为y轴,浓度为x轴拟合曲线,即获得本技术的标准曲线。
12、本技术的一种实现方式中,标准曲线为y=1668.28637x-91.03828,r2=0.99997。
13、需要说明的是,以上具体的标准曲线只是本技术的一种实现方式中具体试验采用的拟合曲线;可以理解,在本技术发明构思下,本领域技术人员完全可以采用其他浓度的已知蛋白样本,从而获得其它的拟合曲线。
14、本技术的另一方面公开了一种检测fc轻链改造双抗或fc融合蛋白表达量的试剂盒,包括以下组分中的至少一种:
15、1)protein g琼脂糖凝胶,由重组protein g作为亲和配基偶联到琼脂糖凝胶上形成;
16、2)protein g琼脂糖磁珠,由重组protein g作为亲和配基偶联到琼脂糖磁珠上形成;
17、3)protein g亲和层析柱,由重组protein g替换proteina亲和层析柱中的proteina形成。
18、需要说明的是,本技术的关键在于,采用重组protein g替换proteina对待测样本中的fc轻链改造双抗或fc融合蛋白进行分离和表达量检测;具体的分离方式可以是protein g琼脂糖凝胶、protein g琼脂糖磁珠或protein g亲和层析柱分离。可以理解,为了配合后续的hplc分析,优选采用protein g亲和层析柱;当然,也不排除其他的固定方式,再用酸性洗脱液将结合的蛋白洗脱下来,在紫外波长280nm下进行检测,即可实现fc轻链改造双抗或fc融合蛋白的表达量检测。同样的,本技术试剂盒中的重组protein g优选为去除白蛋白结合位点和细胞表面结合位点的重组protein g。
19、本技术的一种实现方式中,本技术的试剂盒还包括用于hplc分析的试剂。
20、可以理解,为了使用方便可以将用于hplc分析的试剂整合到本技术的试剂盒中;当然,根据具体使用需求,也可以在试剂盒中只包含本技术的重组protein g、protein g琼脂糖凝胶、protein g琼脂糖磁珠或protein g亲和层析柱,用于hplc分析的试剂另行购买。
21、由于采用以上技术方案,本技术的有益效果在于:
22、本技术检测fc轻链改造双抗或fc融合蛋白表达量的方法,利用重组protein g对fc轻链改造双抗或fc融合蛋白进行表达量检测,与protein a相比,本技术的方法对igg具有更好的结合能力,且杂蛋白结合水平更低,检测出的fc轻链改造双抗或fc融合蛋白的表达量更接近真实表达量,检测结果更准确,为fc轻链改造双抗或fc融合蛋白表达量检测提供了一种简单、快速、准确的新方法。
- 还没有人留言评论。精彩留言会获得点赞!