基于金纳米簇的血浆自身抗体新型检测系统及方法
本发明属于生物医学,尤其涉及一种基于金纳米簇的血浆自身抗体新型检测系统及方法。
背景技术:
1、在过去的几十年里,人们一直在推动采用敏感的方法进行癌症的早期检测。这种需求的出现是因为癌症是最致命的疾病。如果能够早期监测,癌症死亡率可以显著降低。然而,早期癌症的诊断需要检测和定量超低浓度的生物标志物,这些标志物表现在癌变的早期阶段。在临床实践中,可通过检测血清或血浆中的自身抗体水平来判断疾病进展。与其他癌症生物标志物相比,自身抗体具有早期滴度高、循环稳定、易于获取和检测等优点。研究表明,pdl1自身抗体可广泛分布于多种肿瘤中,且在不同类型的肿瘤中,pdl1自身抗体与临床参数之间存在显著相关性。此外,我们前期研究采用酶联免疫吸附测定(elisa)检测了肺癌患者和健康样本中pdl1自身抗体的表达水平,结果表明pdl1自身抗体在肺癌的诊断中具有良好的潜在价值。
2、随着多学科的发展,自身抗体检测方法得到不断改进,检测方法多样化。从1948年haragrave等发现了狼疮细胞开始,越来越多的与自身免疫病相关的自身抗体被研究发现,免疫学检测技术也逐步发展,日渐成熟。之后几十年,自身抗体的检测方法得到飞速发展,许多方法先后被改进并被用于临床诊断。其检测方法可分为定性和定量两类。定性的免疫检测方法:间接免疫荧光技术,免疫扩散、免疫印迹、免疫沉淀法、被动凝集法、对流免疫电泳。半自动化或自动化定量检测的免疫检测方法:放射免疫分析、酶联免疫吸附试验。目前,elisa是一种成熟的基于靶抗原与抗体特异性结合的免疫检测方法,已广泛应用于临床诊断和分析化学。但elisa耗时耗力,灵敏度和特异度有待提高。
3、此外自身抗体检测方法受到很多主观因素的影响,且标准化程度不理想,在临床应用存在一定的局限性。如何实现自身抗体高效、准确、智能化、高通量的定量检测是未来研究自身抗体检测方法的重点。因此,尝试进一步改进类似于elisa方法的检测途径,如使用磁珠(mb)或实施信号放大器等成为研究的重点。mb的应用为增强免疫检测技术的发展提供了一种总体策略,市售的mb种类繁多,具有不同的大小和表面化学功能,用抗原或抗体修饰mb,可以快速、温和、简单地从其他样品成分中分离和浓缩目标分子。与二维表面相比,mb与样品的主动混合促进了更快的免疫反应,具有更高的信号和更低的检测限(lod)。此外,免疫修饰mb的生产相对容易规模化,磁性elisa具有自动化的潜力。在传统的自身抗体检测中,辣根过氧化物酶(hrp)偶联检测抗体作为探针,催化过氧化氢还原和显色底物氧化产生比色信号,但检测信号灵敏度较低。近年来,金纳米团簇(auncs)作为探针被广泛应用于生物检测和体内疾病监测,它们是一种约2nm的纳米材料,具有良好的荧光性能,被广泛用作信号探针。本研究拟通过大量生物信号分子偶联到auncs载体上,以auncs为载体,使其成为一种有吸引力的信号放大方法。然而,单一信号放大方法往往存在灵敏度低、选择性差、线性差等问题,且存在靶标本数量不足、相似生物分子导致信号减弱等问题。因此,一种方法的优点可以与另一种方法的优点合并,同时最大限度地减少两者的缺点。在生物检测方面,大多数研究报道将磁珠与其他纳米材料结合应用于抗原或其他生物分子的检测。
4、通过上述分析,现有技术存在的问题及缺陷为灵敏度和特异度较低,操作步骤繁琐、反应时间较长、标准化程度不理想等问题,因此快速、敏感、低成本的自身抗体标志物检测方法学研究将是未来需要解决的重点。目前纳米材料在生物医学领域的应用得到了广泛的关注,然而针对纳米材料在自身抗体检测中的应用知之甚少。因此本发明基于文献和试验基础,提供了一种基于金纳米簇的血浆自身抗体新型检测系统及方法。
技术实现思路
1、针对现有技术存在的问题,本发明提供了一种基于金纳米簇的血浆自身抗体新型检测系统及方法。本发明的目的在于克服现有肿瘤标志物检测的灵敏度低,耗时耗力,成本高等问题,旨在提高检测的灵敏度、特异度和准确性。为癌症的早期筛查提供一种快速,灵敏和特异的新型检测方法。
2、本发明是这样实现的,一种基于金纳米簇的血浆自身抗体新型检测系统,所述基于金纳米簇的血浆自身抗体新型检测系统由磁珠偶联多肽(mb-peptide)作为捕获探针,合成的具有信号放大效应的金纳米团簇(anti-igg-hrp-auncs)作为检测探针,利用二者的组合实现高灵敏,高特异的自身抗体标志物检测。所述pdl1多肽的序列为seq id no:1:hgeedlkvqhssyrqr。
3、首先,通过ncbi下载pdl1蛋白相应的氨基酸序列(np_054862.1),包含290个氨基酸;根据抗原多肽设计原则,最终确定pdl1多肽序列peptide seq id no:1:hgeedlkvqhssyrqr。
4、进一步,将设计的pdl1多肽表位与磁珠偶联作为捕获探针,并合成具有信号放大作用的hrp包覆的金纳米团簇,并将其与羊抗人igg结合作为检测探针;分别分析表征和性能。
5、本发明的另一目的在于提供一种基于金纳米簇的血浆自身抗体新型检测系统的基于金纳米簇的血浆自身抗体新型检测方法,所述基于金纳米簇的血浆自身抗体新型检测方法包括以下步骤:
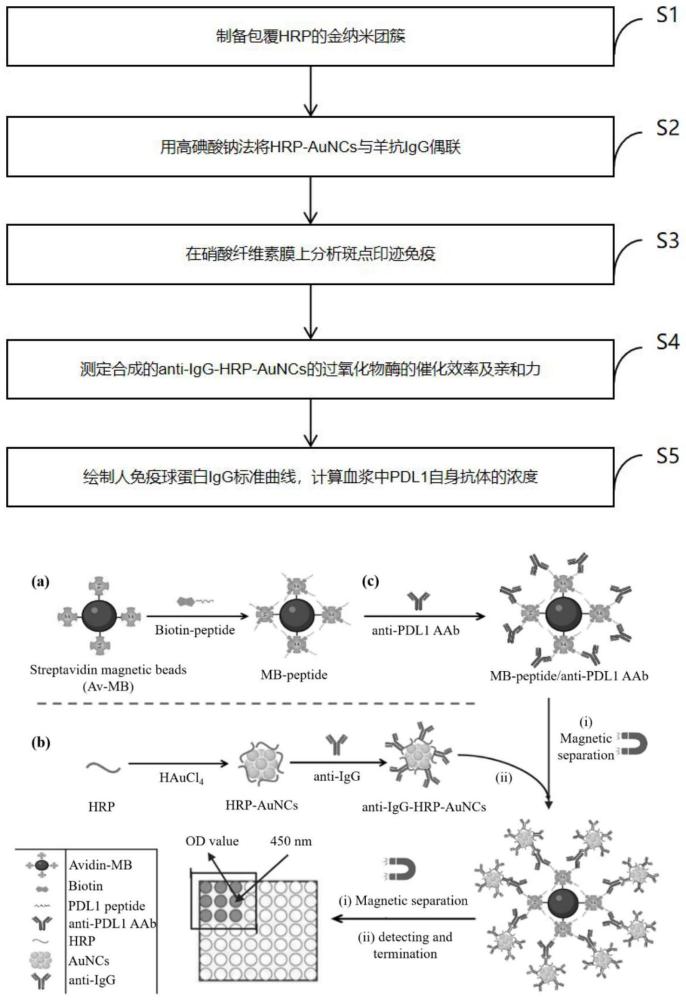
6、s1,制备包覆hrp的金纳米团簇;
7、s2,用高碘酸钠(naio4)法将hrp-auncs与羊抗人igg偶联;
8、s3,在硝酸纤维素膜上分析斑点印迹免疫;
9、s4,测定合成的anti-igg-hrp-auncs的过氧化物酶的催化效率及亲和力;
10、s5,绘制人免疫球蛋白igg标准曲线,计算血浆中pdl1自身抗体的浓度。
11、进一步,所述步骤一具体包括:
12、s11,将haucl4(10mm,1ml)和hrp(100mg/ml,1ml)溶液混合,在37℃下轻轻搅拌10分钟;
13、s12,用1m氢氧化钠调节混合液的ph值至11,在37℃的水浴中轻轻搅拌24小时;
14、s13,反应混合物在4℃透析过夜,与等量的异丙醇混合,在8000rpm的条件下离心30分钟,重复3次;
15、s14,收集沉淀物,用等量的纯蒸馏水悬浮,得到包覆有hrp的金纳米团簇(hrp-auncs)的墨绿色溶液,并用bca法测定其浓度。
16、进一步,所述步骤二具体包括:
17、s21,将45μl 20mg/mlnaio4溶液加入500μl的5mg/mlhrp-auncs中,混合均匀,室温暗置20分钟;
18、s22,加入40μl乙二醇溶液,静置30分钟,在4℃的50mm碳酸盐缓冲液中透析过夜;
19、s23,将氧化后的hrp-auncs与羊抗人igg混合,室温透析2.5h;
20、s24,将交联产物从透析袋中取出,放入耐光容器中,加入80μl的硼氢化钠,在4℃下反应2小时,将还原液置于4℃的pbs缓冲液(10mm,ph7.2)中过夜透析,其间更换34次,即为最终合成的抗igg-hrp-auncs材料。
21、进一步,所述步骤三具体包括:
22、s31,将5μl不同稀释度(0、5、10、20和40μg/ml)的人免疫球蛋白滴在硝酸纤维素膜上;
23、s32,干燥后,用封闭液(5%bsa)摇动孵育60分钟;
24、s33,硝酸纤维素膜用tbst清洗15分钟,再用5ml(1:1000)稀释度的抗igg-hrp-auncs处理30分钟;
25、s34,用tbst清洗膜15分钟,然后加入电化学发光液进行图像采集。
26、进一步,所述步骤四具体包括:
27、s41,将愈创木酚(20mm,50μl)与过氧化氢(8mm,50μl)混合,加入辣根过氧化物酶标记的抗体,在470nm波长处测定酶的催化效率;
28、s42,用biacore x100表面等离子体共振(spr)生物传感器测定anti-igg-hrp-auncs或anti-igg-hrp与人血清免疫球蛋白igg的亲和力;
29、s43,通过1(3二甲基氨基丙基)3-乙基碳二亚胺/n羟基丁二酰亚胺将人血清免疫球蛋白igg(20μg/ml)固定在cm5传感器芯片上;
30、s44,不同稀释浓度(100,50,25,5,1μg/ml)的anti-igg-hrp-auncs和anti-igg-hrp为流动相,用biacore软件的动力学函数计算亲和常数。
31、进一步,所述步骤五绘制人免疫球蛋白igg标准曲线,具体包括:
32、(1)将不同浓度的人免疫球蛋白(1000、500、250、125、62.5、31.25和0ng/ml)包被在96孔板上,然后用2%的bsa在4℃过夜;
33、(2)洗涤3次后,以1:5000稀释的anti-igg-hrp为二抗,37℃反应1h,用pbst洗涤5次;
34、(3)以单组份四甲基联苯胺(tmb)为显色试剂,用10.9%硫酸终止反应;
35、(4)停止反应后,在450nm和620nm波长下用微型平板阅读器(perkinelmer)测定光密度(od)值。
36、进一步,所述步骤五中待测血浆样本中pdl1 aab的检测是在与人免疫球蛋白标准曲线相同的平板上进行的,具体包括:
37、1)将pdl1蛋白包被在96孔板上,经2%的bsa封闭后,除不同浓度的免疫球蛋白标准孔外,其余待测孔均加入1:100稀释度的待测血浆;
38、2)在相同的孵育时间后,加入anti-igg-hrp 37℃孵育1小时后显色;
39、3)用origin软件绘制免疫球蛋白标准曲线,代入相应的血样od值计算血浆浓度。
40、结合上述的技术方案和解决的技术问题,本发明所要保护的技术方案所具备的优点及积极效果为:
41、第一,本发明开发了一种高灵敏度的基于金纳米簇的纳米捕获检测系统,用于检测lc的生物标志物pdl1 aab。该捕获检测系统由链霉亲和素磁珠(av-mb)偶联pdl1多肽(mb-peptide)作为捕获探针和山羊抗人igg偶联辣根过氧化物酶包被金纳米团簇(anti-igg-hrp-auncs)作为检测纳米探针组成。
42、值得注意的是,anti-igg-hrp-auncs纳米探针具有良好的信号放大效果,与商业hrp偶联抗体(anti-igg-hrp)相比,anti-igg-hrp-auncs对四甲基联苯胺(tmb)表现出更高的催化性能,与人igg的结合亲和力提高了10倍(图4)。纳米捕获检测系统的检测时间为50分钟,比传统的elisa检测更快(图5d)。使用纳米捕获检测系统检测79例lc患者和79例健康对照血浆中的抗pdl1aab。在lc早期,纳米捕获检测系统曲线下面积auc(95%ci)从传统elisa的0.746(0.651-0.841)提高到0.884(0.819-0.949)。结果表明,纳米捕获检测系统是一种有效的检测平台,为早期lc的生物标志物检测提供了一种更灵敏的检测系统。
43、本发明提供一种操作简单、成本低、准确性高、无创伤的应用于临床血浆自身抗体的检测方法。本发明发现应用建立的新型检测方法进行血浆自身抗体的检测,可以使检测更加快速,提高检测的灵敏度和特异度。该发明的成功研究也为其它标志物的检测提供可参考的价值。
44、第二,本发明的技术方案转化后的预期收益和商业价值为:本发明转化为试剂盒,将会产生巨大的经济效益。首先,该试剂盒能够提供快速、准确的肺癌诊断结果,使医生能够更早地发现和治疗肺癌,提高治疗成功率和患者生存率。这将减少患者就医次数和住院时间,降低医疗费用,节省医疗资源。其次,肺癌是一种常见的恶性肿瘤,对患者和家庭造成了巨大的经济负担。早期诊断可以帮助患者及时接受治疗,避免疾病进展,减少治疗费用和后续医疗费用的支出。此外,家庭成员的关注和照顾也会减少,有助于提高患者及其家庭的生活质量。第三,针对肺癌的诊断试剂盒的研发和生产将刺激相关产业的发展。例如,该试剂盒的生产需要原料供应商、生产厂家和销售渠道等,将带动相关企业的发展,增加就业机会,提高税收贡献。最后,肺癌的早期诊断和治疗不仅有助于挽救生命,还可以减少因患者过早去世而造成的经济损失。患者能够尽早康复并重返工作岗位,继续为社会做出贡献。这将推动经济增长,促进社会稳定和发展。本发明开发了一种肺癌诊断试剂盒将为医疗行业带来显著的经济效益,减少医疗费用支出、刺激相关产业发展、提高生活质量,并为经济增长和社会进步做出积极贡献。
45、本发明的技术方案填补了国内外业内技术空白:纳米技术检测肿瘤标志物是一项创新的技术,它可以检测肿瘤标志物的表达水平,从而早期发现和诊断恶性肿瘤。该技术的出现填补了国内外的业内空白。首先,传统的肿瘤标志物检测方法存在着很多缺点,如准确性不高、灵敏度低、操作复杂等问题。而纳米技术检测肿瘤标志物可以克服这些缺点,具有更高的准确性和灵敏度,可以有效地提高肿瘤的早期诊断率和治疗效果。其次,纳米技术检测肿瘤标志物是一项前沿技术,目前在国内外都处于较为初级的研究阶段。该技术的研究和应用可以提高我国的科技水平和竞争力,为我国的医疗事业带来更多的发展机会。第三,纳米技术检测肿瘤标志物的应用范围广泛,不仅可以用于早期诊断肿瘤,还可以用于预测肿瘤的发展趋势和治疗效果。这将为临床医生提供更多的信息和参考,帮助他们更好地制定治疗方案和跟踪疾病进展。因此,纳米技术检测肿瘤标志物的出现填补了国内外的业内空白,将为我国的医疗事业带来更多的发展机遇和经济效益。
46、本发明的技术方案解决了人们一直渴望解决、但始终未能获得成功的技术难题:本发明的技术方案在一定程度上解决了人们一直渴望解决的技术难题。传统的肿瘤标志物检测方法存在一些局限性,如准确性不高、灵敏度低等问题。而本发明的技术方案弥补了这些不足之处。
47、首先,利用设计的多肽表位提高检测的特异度,并通过磁珠捕获来缩短了检测系统的时间,此外,通过纳米技术合成具有信号放大效应的auncs纳米探针,提高检测的灵敏度。本发明提高了检测的灵敏度和准确性,使得早期肿瘤的筛查和诊断更加可靠。
48、本发明的技术方案克服了技术偏见:本发明建立的方法可以说在一定程度上克服了一些传统方法存在的技术偏见。传统的肿瘤标志物检测方法会受到一些局限性和偏见的影响,如准确性不高、灵敏度低等。通过纳米技术的应用,可以克服一些传统方法的技术偏见。通过纳米技术制造出具有信号放大效应探针,能够识别和捕获更少量的肿瘤标志物,从而提高了检测的灵敏度和准确性。
49、第三,本发明提供的基于金纳米簇的血浆自身抗体新型检测系统展现了显著的技术进步,特别是在生物医学检测和分析领域。
50、1.高灵敏度和高特异性检测
51、金纳米簇的使用:利用金纳米簇(auncs)的优异性质,实现对目标抗体的高灵敏度检测。金纳米簇的信号放大效果显著提高了检测灵敏度,使得即使在极低浓度的自身抗体存在时也能进行准确检测。
52、特异性多肽设计:通过精确设计的pdl1多肽序列,结合磁珠偶联技术,作为捕获探针,确保了对特定抗体的高特异性捕获。
53、2.精准的抗原多肽设计
54、利用ncbi数据库下载pdl1蛋白的氨基酸序列,并根据抗原多肽设计原则,精准确定了目标多肽序列。这种方法确保了所选多肽能有效地与目标自身抗体结合,从而提高检测的准确性。
55、3.创新的探针组合
56、磁珠偶联多肽作为捕获探针:该技术利用磁珠偶联的方式提高多肽稳定性和功能性,同时简化了抗体捕获过程。
57、hrp包覆的金纳米团簇作为检测探针:这种结构不仅提高了信号的稳定性和强度,而且通过与羊抗人igg的结合,进一步增强了检测的特异性和灵敏度。
58、4.广泛的应用潜力
59、这种检测系统的设计不仅限于pdl1自身抗体的检测,理论上也可以通过更换特定多肽序列,扩展到其他类型的自身抗体或生物标志物的检测,具有广泛的应用潜力。
60、5.潜在的临床意义
61、由于其高灵敏度和高特异性,这种检测系统在早期疾病诊断、病理研究及个性化医疗中具有重要的临床应用价值,尤其是在肿瘤、自身免疫性疾病等领域。
62、本发明提供的基于金纳米簇的新型检测系统通过结合先进的纳米技术和生物化学方法,为高灵敏度、高特异性的生物标志物检测提供了一种有效的新途径。
63、第四,本分析提供的基于金纳米簇的血浆自身抗体新型检测方法代表了在生物医学检测领域的显著技术进步。这种方法的关键特点和优势包括:
64、精确的制备和标定过程:
65、金纳米团簇的制备(s1):通过精确控制反应条件,如温度、ph值和透析过程,来制备包覆有hrp(辣根过氧化物酶)的金纳米团簇,确保了纳米团簇的一致性和功能性。
66、羊抗人igg偶联过程(s2):高碘酸钠法用于有效地将hrp-auncs与羊抗igg偶联,进一步增强了探针的特异性和稳定性。
67、高效的免疫检测技术:
68、斑点印迹免疫分析(s3):在硝酸纤维素膜上进行的斑点印迹免疫分析,允许对样本中的抗体进行直观、快速的定性和半定量分析。
69、过氧化物酶催化效率及亲和力测定(s4):通过专门的实验步骤测定合成的探针的酶活性和亲和力,确保了检测系统的准确性和灵敏度。
70、精密的标准曲线绘制:
71、人免疫球蛋白igg标准曲线(s5):绘制标准曲线对于量化检测至关重要,它为后续的样本分析提供了基准。
72、pdl1自身抗体的定量检测:
73、血浆样本的处理和检测(步骤5):在与标准曲线相同的条件下对血浆样本进行处理和检测,使得检测结果既准确又可比较。
74、本发明提供的方法的优势在于其高灵敏度、高特异性和可重复性,能够有效地检测血浆中的自身抗体,如pdl1自身抗体。此外,它为其他类似的生物标志物检测提供了一种有效的模板,有潜力在临床诊断、生物医学研究及个性化医疗等领域发挥重要作用。
- 还没有人留言评论。精彩留言会获得点赞!