基于纳米酶微电极的组织液化合物的检测系统及制备方法
本技术涉及生物医学分析检测,特别涉及一种基于纳米酶微电极的组织液化合物的检测系统及制备方法。
背景技术:
1、在人体脑组织细胞外液中存在多巴胺、抗坏血酸、尿酸等重要的小分子化合物,但多巴胺、抗坏血酸、尿酸是脑组织液中浓度较低的神经递质,如多巴胺的浓度通常在亚微摩尔范围内,抗坏血酸的浓度和尿酸的浓度通常在毫摩尔范围内。虽然多巴胺、抗坏血酸、尿酸在脑组织液中的浓度较低,但其因对中枢神经活动的调节有着不可替代的作用而极具研究意义。
2、相关技术中,通过研制玻碳电极、块状铜电极、铂电极去检测组织液中的小分子化合物或化合物的浓度,但这些传统的贵金属电极对小分子化合物的灵敏度低,无法精准检测出组织液中化合物的浓度信息;另外,传统的贵金属电极对于脑组织液中多巴胺、抗坏血酸、尿酸等神经递质的电化学检测存在过电位高以及稳定性差的问题。当利用传统的贵金属电极同时对多巴胺、抗坏血酸、尿酸这三种小分子化合物进行检测时,还存在难以区分过电位的问题,经常需要通过对传统的贵金属电极进行修饰改性以提高检测性能。
3、因此,如何研制出对多巴胺、抗坏血酸、尿酸等小分子化合物具备高灵敏度的传感电极是迫切的需求。
技术实现思路
1、本技术旨在至少解决现有技术中存在的技术问题之一。为此,本技术实施例提供了一种基于纳米酶微电极的组织液化合物的检测系统及制备方法,有利于提高传感电极的灵敏性,从而实现低电位下精准检测组织液中小分子化合物的浓度,同时提高了组织液中小分子化合物浓度变化的响应速率。
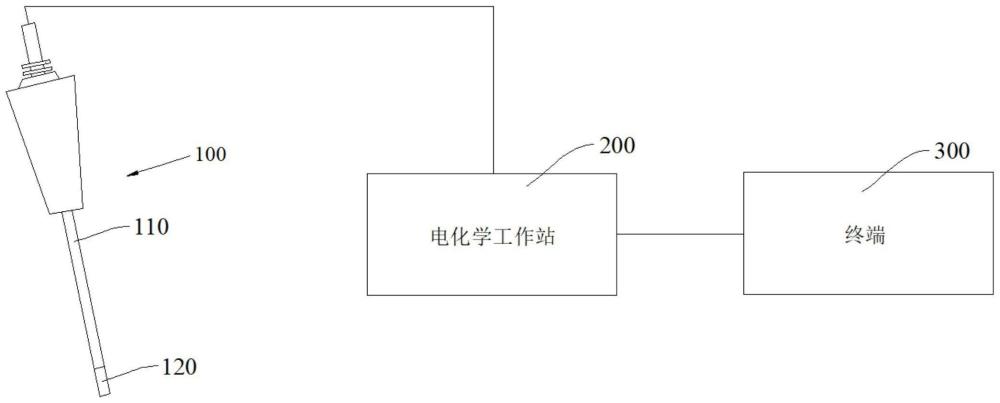
2、第一方面,本技术实施例提供了一种基于纳米酶微电极的组织液化合物的检测系统,包括:
3、纳米酶微电极,通过在金电极上沉积纳米酶制成,所述纳米酶包括金元素和镉元素;
4、电化学工作站,用于和所述纳米酶微电极连接并通过差分脉冲伏安法、方波脉冲伏安法、常规脉冲伏安法和线性扫描伏安法分别扫描出不同浓度的化合物所对应的峰值曲线;
5、终端,用于拟合化合物的浓度和所述化合物的浓度对应的峰值电流,并输出表征所述纳米酶微电极检测不同浓度的化合物的结果图。
6、本技术上述第一方面的技术方案至少具备如下的优点或有益效果之一:纳米酶微电极通过在金电极上沉积纳米酶制成,纳米酶具备高催化特性提高纳米酶微电极对组织液中小分子化合物的电化学检测性能;纳米酶沉积在金电极表面能够增大金电极的表面积,提高了纳米酶微电极的电子转移速率,从而实现在低过电位下对组织液中小分子化合物的电化学检测。化学工作站和纳米酶微电极连接,并通过差分脉冲伏安法、方波脉冲伏安法、常规脉冲伏安法和线性扫描伏安法这四种电化学分析方法扫描不同浓度的化合物所对应的峰值曲线,能够在低电位下精准获取小分子化合物的浓度信息;通过终端拟合化合物的浓度和所述化合物的浓度对应的峰值电流,并输出表征所述纳米酶微电极检测不同浓度的化合物的结果图,根据该结果图得出纳米酶微电极检测小分子化合物的灵敏度的对比,进一步表面表明纳米酶微电极对检测组织液中小分子化合物的灵敏度大大提升。
7、根据本技术的一些实施例,还包括铂电极和氯化银电极,以所述铂电极作为对电极、以所述氯化银电极作为参比电极、以所述纳米酶微电极作为工作电极构建三电极组件。
8、根据本技术的一些实施例,所述纳米酶为au24cd。
9、根据本技术的一些实施例,通过方波脉冲伏安法扫描出不同浓度的化合物所对应的峰值曲线,具体为:
10、在烧杯中滴加入磷酸缓冲盐溶液;
11、将所述三电极组件放置入所述烧杯中,并将所述三电极组件连接所述电化学工作站;
12、选择所述电化学工作站中square wave voltammetry parameters选项,并设置参数;
13、往烧杯逐步滴加待检测化合物溶液以改变所述烧杯中待检测化合物的浓度;
14、所述电化学工作站扫描并显示出不同浓度的化合物所对应的峰值曲线;
15、其中,所述设置参数具体为:设置初试化电压为第一预设电压、设置输出电压为第二预设电压、设置增量电压为第三预设电压,设置振幅为第一预设振幅、设置频率为第一预设频率,并设置扫描时间为第一预设时间。
16、根据本技术的一些实施例,通过线性扫描伏安法扫描出不同浓度的化合物所对应的峰值曲线,具体为:
17、在烧杯中滴加入磷酸缓冲盐溶液;
18、将所述三电极组件放置入所述烧杯中,并将所述三电极组件连接所述电化学工作站;
19、选择所述电化学工作站中linear sweep voltammetry parameters选项,并设置参数;
20、往烧杯逐步滴加待检测化合物溶液以改变所述烧杯中待检测化合物的浓度;
21、所述电化学工作站扫描并显示出不同浓度的化合物所对应的峰值曲线;
22、其中,所述设置参数具体为:设置初始化电压为所述第一预设电压、设置输出电压为所述第二预设电压,设置所述电化学工作站的预设的扫描速率和预设的采样间隔,并设置扫描时间为第二预设时间。
23、第二方面,本技术实施例提供了一种基于纳米酶微电极的组织液化合物的检测系统的制备方法,包括:
24、利用电荷相反的硫醇盐作为配体,在避光条件下制备纳米酶;
25、通过多电位阶跃法将所述纳米酶沉积于金电极上,得到纳米酶微电极;
26、以铂电极作为对电极、以氯化银电极作为参比电极、以所述纳米酶微电极作为工作电极构建三电极组件;
27、将所述三电极组件和电化学工作站连接,所述电化学工作站用于通过差分脉冲伏安法、方波脉冲伏安法、常规脉冲伏安法和线性扫描伏安法分别扫描出所述三电极组件检测到的不同浓度的化合物所对应的峰值曲线,所述电化学工作站还用于与终端连接,以使所述终端拟合不化合物的浓度和所述化合物的浓度对应的峰值电流,并输出表征所述纳米酶微电极检测不同浓度的化合物的结果图。
28、本技术上述第二方面的技术方案至少具备如下的优点或有益效果之一:利用电荷相反的硫醇盐作为配体,在避光条件下制备纳米酶,纳米酶具备高催化特性提高纳米酶微电极对组织液中小分子化合物的电化学检测性能;纳米酶沉积在金电极表面能够增大金电极的表面积,提高了纳米酶微电极的电子转移速率,通过多电位阶跃法将制备得到的纳米酶沉积于金电极上,得到纳米酶微电极,纳米酶微电极相比于传统金属电极的低频阻抗和电子转移速率得到了明显的提升,且具有更高的稳定性,能够在低电位下精准获取小分子化合物的浓度信息。以铂电极作为对电极、以氯化银电极作为参比电极、以纳米酶微电极作为工作电极构建三电极组件,并将三电极组件和电化学工作站连接,电化学工作站用于通过差分脉冲伏安法、方波脉冲伏安法、常规脉冲伏安法和线性扫描伏安法分别扫描出三电极组件检测到的不同浓度的化合物所对应的峰值曲线,电化学工作站还用于与终端连接,以使终端拟合不化合物的浓度和化合物的浓度对应的峰值电流,并输出表征纳米酶微电极检测不同浓度的化合物的结果图,通过结果图得出纳米酶微电极检测小分子化合物的灵敏度的对比,进一步表面表明纳米酶微电极对检测组织液中小分子化合物的灵敏度大大提升。
29、根据本技术的一些实施例,所述利用电荷相反的硫醇盐作为配体,在避光条件下制备纳米酶包括:
30、在纯水中加入haucl4水溶液、cd(no3)2水溶液和甲氧基醋酸正丙酯水溶液,并搅拌均匀至黄绿色;
31、在黄绿色的混合溶液中滴加naoh水溶液,以使所述黄绿色的混合溶液的ph值为第一预设值;
32、在ph值为第一预设值的黄绿色的混合溶液中加入nabh溶液,以使naoh溶液与nabh溶液反应融合,所述黄绿色的混合溶液转变成澄清透明的混合溶液;
33、在所述澄清透明的混合溶液中通入饱和一氧化碳,并使所述澄清透明的混合溶液处于密闭状态第三预设时间;
34、在所述第三预设时间之后,解除密闭状态,并搅拌混合有饱和一氧化碳的澄清透明的混合溶液第四预设时间,所述澄清透明的混合溶液转变成棕色溶液;
35、对所述棕色溶液进行冻干处理,获得纯净的纳米酶。
36、根据本技术的一些实施例,所述通过多电位阶跃法将所述纳米酶沉积于金电极上,得到纳米酶微电极包括:
37、取金电极作为所述三电极组件的工作电极;
38、将所述三电极组件连接电化学工作站,并通过多电位阶跃法对所述金电极进行纳米酶沉积处理;
39、取纳米酶粉末与去离子水充分混合,得到纳米酶溶液,并将所述三电极组件放置于所述纳米酶溶液里;
40、控制所述电化学工作站的输出电压的变化范围为第三预设电压到第四预设电压,在所述第三预设电压到第四预设电压的变化范围内设置预设数量的电位,且设置各个电位之间的阶跃幅度为第五预设电压;
41、控制所述电化学工作站输出的各个电位的持续在第五预设时间,控制所述电化学工作站输出的预设的沉积电流,以使得纳米酶均匀致密的沉积在所述金电极的表面,得到纳米酶微电极。
42、根据本技术的一些实施例,在所述通过多电位阶跃法将所述纳米酶沉积于金电极上,得到纳米酶微电极之前,还包括:
43、使用砂纸对预设直径的金电极的前端进行打磨,以预留出传感区域;
44、将所述金电极的传感区域放置于蒸馏水中进行超声处理。
45、根据本技术的一些实施例,使用聚酰亚胺绝缘对制备完成的纳米酶微电极的非传感区域部分进行绝缘处理;
46、将经绝缘处理的纳米酶微电极放置于室温环境下固化第六预设时间。
47、本技术的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本技术而了解。本技术的目的和其他优点可通过在说明书、权利要求书以及附图中所特别指出的结构来实现和获得。
- 还没有人留言评论。精彩留言会获得点赞!