测定硒形态含量的方法与流程
本技术涉及质量检测,具体涉及测定硒形态含量的方法。
背景技术:
1、有机硒主要为大分子硒和以硒代氨基酸及其衍生物为主要存在形态的小分子硒化物组成。硒代氨基酸是人们日常膳食中获取硒的主要途径。硒的安全阈值很窄,过高或过低的摄入量都会影响人体健康。硒的毒性和生物利用度与其形态密切相关,无机硒的毒性较大,不易被人体吸收,生物有效性低,而有机硒毒性低,生物利用率高。近年市场中不断推出富硒、补硒概念的食品,硒元素的种类和含量仍需明确。
2、在标准化方面,食品安全国家标准《食品中硒的测定》(gb 5009.93-2017)、《出口食品中硒的测定方法》(sn/t 0860-2016)只能测得食品中硒元素的总量,无法对不同化学形态硒进行定性和定量分析。《出口保健品中硒酸和亚硒酸含量测定》(sn/t 4060-2014)、《粮谷中硒代半胱氨酸和硒代蛋氨酸的测定液相色谱-电感耦合等离子体质谱法》(ny/t3556-2020)仅能检测2种硒元素化学形态,无法覆盖其他主要的硒元素化学形态。食品安全国家标准《食品营养强化剂富硒酵母》(gb 1903.21-2016)、《食品营养强化剂富硒食用菌粉》(gb 1903.22-2016)通过测定总硒含量和无机硒含量,再使用差量法计算出有机硒总含量,无法具体指出各类主要有机硒的含量,消费者无法单看有机硒含量区分富硒食品的营养价值,因此开发硒形态检测的方法有重要意义。
3、当前使用高效液相色谱-电感耦合等离子体质谱(hplc-icp-ms)主要有两种做法。其一,即使用阴离子交换柱(主要为hamilton prp x100),以柠檬酸体系或磷酸体系作为流动相,可检测的硒化学形态大多不超过5种;其二,即使用反相柱(如c18、c8或c4柱)结合离子对试剂(如四丁基溴化铵、七氟丁酸等)进行分离检测,可检测的硒化学形态仅为5-7种左右。
技术实现思路
1、针对目前硒化学形态同时检测技术中,硒形态的数量较少,无法覆盖主要的硒分析形态种类的问题,本技术一实施方式提供测定硒形态含量的方法。
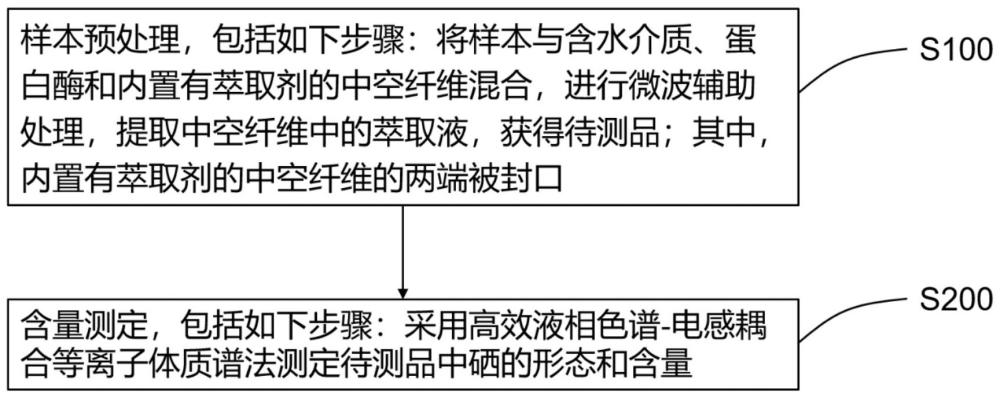
2、在一些实施方式中,提供一种测定硒形态含量的方法,包括样本预处理和含量测定;
3、所述样本预处理包括如下步骤:将样本与含水介质、蛋白酶和内置有萃取剂的中空纤维混合,进行微波辅助处理,提取所述中空纤维中的萃取液,获得待测品;其中,所述内置有萃取剂的中空纤维的两端被封口;
4、所述含量测定包括如下步骤:采用高效液相色谱-电感耦合等离子体质谱法测定所述待测品中硒的形态和含量。
5、在一些实施方式中,所述样本为食品或食用农产品,可选地,所述样本为食用菌、茶叶、食用油和大米中的一种或多种。
6、在一些实施方式中,所述中空纤维满足如下特征中的一项或多项:
7、所述中空纤维选自聚丙烯、聚砜和聚偏氟乙烯中的一种或多种;
8、所述中空纤维的内径为300μm-1000μm;
9、所述中空纤维的壁厚为100μm-200μm;
10、所述中空纤维的长度为1cm-5cm;
11、所述中空纤维的壁孔径为0.1μm-1μm。
12、在一些实施方式中,所述样本预处理步骤满足如下特征中的一项或多项:
13、按投料量计,所述蛋白酶相对于所述样本的质量比为0.02-0.25;
14、按投料量计,所述含水介质相对于所述样本的体积质量比为(10-75)ml/g;
15、按投料量计,所述萃取剂相对于所述样本的体积质量比为(0.0007-0.200)ml/g。
16、在一些实施方式中,所述样本预处理步骤满足如下特征中的一项或多项:
17、按投料量计,所述蛋白酶相对于所述样本的质量比为0.045-0.225;
18、按投料量计,所述含水介质相对于所述样本的体积质量比为(15-75)ml/g;
19、按投料量计,所述萃取剂相对于所述样本的体积质量比为(0.025-0.150)ml/g;
20、所述含水介质为水;
21、所述蛋白酶为蛋白酶k、蛋白酶xiv、胰蛋白酶、胃蛋白酶和链霉蛋白酶中的一种或多种;
22、所述萃取剂为低共熔溶剂中的一种或多种;所述低共熔溶剂包含氢键受体、氢键供体和水;在所述低共熔溶剂中,所述氢键受体为六偏磷酸钠,所述氢键供体包含葡萄糖酸、丙二酸、木糖醇、d-山梨醇、尿素、丙三醇、酒石酸、柠檬酸和氨基葡萄糖中的至少一种;在所述低共熔溶剂中,所述氢键受体、所述氢键供体和水的摩尔比为1:(1-20):(5-100);
23、进行所述微波辅助处理的微波功率为800w-1600w;
24、进行所述微波辅助处理的提取时间为20min-60min;
25、进行所述微波辅助处理的提取温度为20℃-40℃。
26、在一些实施方式中,所述样本预处理步骤满足如下特征中的一项或多项:所述含量测定步骤,所述高效液相色谱-电感耦合等离子体质谱的质谱条件包括如下条件中的一项或多项:
27、射频功率为1400w-1800w;
28、雾化器流速为0.8l/min-1l/min;
29、雾化器的旁路通入高纯氧气辅助矩管燃烧,氧气流量为0.1l/min-0.2l/min;
30、等离子体流速为10l/min-20l/min;
31、辅助气体流速1l/min-1.5l/min;
32、质荷比(m/z)为80,采集时间900ms,带阻参数q为0.44-0.46;
33、内标元素为ge;
34、中心管孔径为1.0mm-1.5mm;
35、定量方法为外标法。
36、在一些实施方式中,所述含量测定步骤,所述高效液相色谱-电感耦合等离子体质谱分析模式为动态反应池模式,反应气体为甲烷,流速为0.5ml/min-1.0ml/min,可选地为0.6ml/min。
37、在一些实施方式中,所述高效液相色谱-电感耦合等离子体质谱的色谱条件包括,流动相包括体积占比为10%-90%的乙腈或10%-90%的甲醇;
38、在一些实施方式中,流动相为包括10%(v/v)-40%(v/v)甲醇、0.5%(v/v)-4%(v/v)甲酸和0.8mmol/l-1.5mmol/l柠檬酸氢二铵的水溶液,或,流动相为包括20%(v/v)乙腈和4%(v/v)甲酸的水溶液。
39、在一些实施方式中,所述高效液相色谱-电感耦合等离子体质谱的色谱条件包括如下条件中的一项或多项:
40、混合模式色谱柱,规格为250mm×4.6mm,5μm;
41、洗脱方式为等度洗脱;
42、流速为0.5ml/min-1.0ml/min,可选地,流速为0.8ml/min;
43、柱温为20℃-30℃,可选地,柱温为25℃;
44、进样量为3μl-20μl,可选地,进样量为10μl。
45、在一些实施方式中,提供的测定硒形态含量的方法还包括制备标准样品的步骤,所述制备标准样品的步骤包括:分别配制硒酸、亚硒酸、硒脲、硒代胱氨酸、l-硒甲基硒代半胱氨酸、l-硒代蛋氨酸、甲基亚硒酸、硒代乙硫氨酸和硒羊毛硫氨酸的至少9种含硒物质的标准品的不同浓度水溶液,每种含硒物质的标准品的不同浓度的水溶液至少包括0.0μg/l、0.5μg/l、100μg/l以及位于0.5μg/l-100μg/l范围内的至少2种浓度;
46、可选地,自100μg/l至0.5μg/l的相邻浓度的稀释倍数为2或2.5。
47、在一些实施方式中,所述的方法包括对选自硒酸、亚硒酸、硒脲、硒代胱氨酸、l-硒甲基硒代半胱氨酸、l-硒代蛋氨酸、甲基亚硒酸、硒代乙硫氨酸和硒羊毛硫氨酸中的一种或多种硒形态进行检测,检出限为0.05μg/kg-0.20μg/kg,定量限为0.15μg/kg-0.60μg/kg。
48、在一些实施方式中,所述的方法检测得到的80se的相对丰度比为49%-50%。
49、目前硒化学形态同时检测技术中,硒形态的数量较少,一般为5-7种,无法覆盖主要的硒分析形态种类。通过将中空纤维技术和微波辅助酶解法结合、以有机进样的hplc-icp-ms法对样本进行检测,能同时定性定量检测包括硒酸、亚硒酸、硒脲、硒代胱氨酸、l-硒甲基硒代半胱氨酸、l-硒代蛋氨酸、甲基亚硒酸、硒代乙硫氨酸和硒羊毛硫氨酸(selenolanthionine)的至少9种硒化学形态。
50、通过将中空纤维技术和微波辅助酶解法结合,可以解决酶解时间较长的问题,同时可降低或避免食品复杂基质和酶解剂对检测结果的影响。在微波辅助酶解的同时,中空纤维内管的萃取剂在微波加热下可实现对目标物的萃取富集;利用中空纤维的壁孔尺寸限制,可以将生物大分子(蛋白质、多肽、多糖等)阻挡在酶解提取溶液中,从而避免对检测的干扰。
51、前述提供的测定硒形态含量的方法还允许有机进样的高效液相色谱-电感耦合等离子体质谱(hplc-icp-ms)法,允许使用乙腈或甲醇(体积分数为10%~90%)作为流动相进行洗脱,可避免矩管熄火的问题,能分析检测水溶性较差的硒化学形态,可拓展传统hplc-icp-ms的应用范围,能同时检测至少9种硒化学形态。
52、通过使用甲烷作为反应气的动态反应池技术,可以测定相对自然丰度比最高的80se核素,可以消除质谱干扰,提高灵敏度,降低检出限。
- 还没有人留言评论。精彩留言会获得点赞!