一种抗菌药物浓度检测试剂盒及其应用的制作方法
本发明属于血药浓度监测。更具体地,涉及一种抗菌药物浓度检测试剂盒及其应用。
背景技术:
1、抗感染治疗是临床医疗中至关重要的一部分,涉及到使用各种药物来治疗由病原体引起的感染。抗菌药物是常用的抗感染药物,其效果与血药浓度及维持时间关系密切。当遇到抗感染治疗效果不佳的危重病人,血药浓度检测能够帮助临床医生优化抗菌药物的给药方案,有助于提高感染性疾病治愈率、减少或避免毒性反应及耐药的发生,实现安全、有效、合理用药。尤其对治疗指数小(如万古霉素)、个体差异大(如美罗培南、替考拉宁)、药物相互作用多(如伏立康唑)的抗菌药物来说,血药浓度检测极为必要。
2、目前,血药浓度检测主要采用色谱分析或免疫分析法。其中,色谱分析法基于样品中待测组分的理化性质不同进行色谱分离,结合紫外检测器、质谱检测器等完成定性、定量检测,包括气相色谱法(gc)、高效液相色谱法(hplc)和液相色谱-质谱联用法(lc-ms)等。色谱分析法具有特异性高、可同时检测同一样本中的不同组分等优点,但色谱分析法的样品前处理较复杂,对检测技术人员要求较高且所需仪器昂贵,难以普及,不利于患者的个体化用药。免疫分析法以特异性抗原-抗体反应为基础,利用竞争性结合的原理进行检测,包括放射免疫法、酶联免疫法、荧光免疫法等。免疫分析法具有灵敏度高、前处理简单、检测时间短等优势。但免疫分析法的药物检测范围窄,能检测药物品种少,一般一个试剂盒只能测定一种药物,方法灵活性不够。实际临床中,常出现抗菌药物联用的情况,免疫分析法无法实现多种联用药物浓度的同时测定,难以满足临床需求。因此,需开发一种操作相对简单且能同时检测多种抗菌药物浓度的试剂盒。
3、免疫pcr是一种结合了免疫学和pcr技术的检测方法,在病原体及蛋白检测领域使用较为广泛。目前,免疫pcr技术尚未完全成熟,利用其检测不同类型的物质时,需针对目标物质设计和调整所需的试剂、磁珠或dna寡核苷酸等方面,以保证其检测的准确性。例如,反应溶液对抗原与抗体的反应会有比较大的影响,针对不同的抗原和抗体,需提供最为合适的反应溶液,以保证其充分反应。而现仍未有基于免疫pcr的能够同时检测万古霉素、美罗培南、替考拉宁和伏立康唑浓度的产品。
技术实现思路
1、本发明针对现有缺乏同时检测万古霉素、美罗培南、替考拉宁和伏立康唑的浓度的产品的不足,提供了一种抗菌药物浓度检测试剂盒,该试剂盒能同时检测万古霉素、美罗培南、替考拉宁和伏立康唑的浓度,具有较高的准确性,能够有效监测万古霉素、美罗培南、替考拉宁和伏立康唑的血药浓度,为临床合理用药提供依据。
2、本发明的第一个目的是提供一种抗菌药物浓度检测试剂盒。
3、本发明的第二个目的是提供所述检测试剂盒在制备用于检测万古霉素、美罗培南、替考拉宁和/或伏立康唑浓度的产品中的应用。
4、本发明上述目的通过以下技术方案实现:
5、本发明基于免疫pcr技术,提供了一种能够同时检测万古霉素、美罗培南、替考拉宁和伏立康唑这四种抗菌药物浓度的试剂盒。同时,本发明通过对所述试剂盒中的样本处理液和免疫磁珠进行优化,进一步提高了其检测所述抗菌药物浓度时的准确性。
6、本发明提供了一种抗菌药物浓度检测试剂盒,其中含有样本处理液、免疫磁珠、抗体与dna寡核苷酸偶联物和qpcr核酸扩增试剂;其所检测的抗菌药物为万古霉素、美罗培南、替考拉宁和伏立康唑。
7、具体地,所述样本处理液包含0.5~5g/l的三羟甲基氨基甲烷,0.2~2g/l的乙二胺四乙酸二钠,0.1~1g/l的尿酸和体积分数为0.2%~2%的聚乙二醇。
8、具体地,所述样本处理液中还含有体积分数为0.1%~1%的proclin 300。所述proclin 300的目的在于保证试剂不会被杂菌污染降解。
9、具体地,所述样本处理液由三羟甲基氨基甲烷、乙二胺四乙酸二钠、尿酸、聚乙二醇、proclin300和水组成;所述三羟甲基氨基甲烷的浓度为0.5~5g/l;所述乙二胺四乙酸二钠尿酸的浓度为0.2~2g/l;所述尿酸的浓度为0.1~1g/l;所述聚乙二醇体积分数为0.2%~2%;所述proclin300的体积分数为0.1%~1%。
10、优选地,所述三羟甲基氨基甲烷的浓度为1~2g/l;所述乙二胺四乙酸二钠尿酸的浓度为0.2~0.8g/l;所述尿酸的浓度为0.1~0.5g/l;所述聚乙二醇体积分数为0.4%~0.8%;所述proclin300的体积分数为0.2%~0.6%。
11、进一步优选地,所述三羟甲基氨基甲烷的浓度为1.5g/l;所述乙二胺四乙酸二钠尿酸的浓度为0.5g/l;所述尿酸的浓度为0.3g/l;所述聚乙二醇体积分数为0.6%;所述proclin300的体积分数为0.4%。
12、具体地,所述样本处理液的ph为7.2±0.2。
13、具体地,所述免疫磁珠包含分别偶联有抗万古霉素、美罗培南、替考拉宁、伏立康唑的第一抗体的磁珠。
14、具体地,所述磁珠为含纳米fe2o3或纳米fe3o4的超顺磁性磁珠。
15、具体地,所述磁珠的结构为三层,从内至外依次为核心层、包裹层和最外层;其中,核心层为纳米fe2o3或纳米fe3o4,包裹层为聚氯乙烯,最外层为羧基。
16、优选地,所述磁珠的核心层为纳米fe3o4。
17、具体地,所述磁珠的直径为1~3μm。
18、优选地,所述磁珠的直径为3μm;其中,包裹层的厚度为30nm。
19、具体地,所述抗体与dna寡核苷酸偶联物包含偶联有抗万古霉素的第二抗体的seqid no.1所示的dna寡核苷酸序列,偶联有抗美罗培南的第二抗体的seq id no.2所示的dna寡核苷酸序列,偶联有抗替考拉宁的第二抗体的seq id no.3所示的dna寡核苷酸序列,偶联有抗伏立康唑的第二抗体的seq id no.4所示的dna寡核苷酸序列。
20、具体地,seq id no.1~4所示dna寡核苷酸序列上修饰有苏糖核酸(tna)。
21、具体地,本发明所述第一抗体与第二抗体是两种不同的抗体,两种抗体能同时与其对应的抗原结合。例如,抗万古霉素的第一抗体与抗万古霉素的第二抗体能同时与万古霉素结合,形成免疫磁珠-万古霉素-偶联物复合物。
22、具体地,所述qpcr核酸扩增试剂包含seq id no.5~12所示扩增引物和seq idno.13~16所示探针。
23、具体地,seq id no.13~16所示探针的5′端分别标记有不同的荧光报告基团,3′端标记有相同或不同的荧光淬灭基团。
24、可选地,所述荧光报告基团选自fam、vic、rox和cy5;所述淬灭基团为mgb。
25、除seq id no.5~12所示扩增引物和seq id no.13~16所示探针外,所述qpcr定量扩增试剂中还包含qpcr定量扩增所需试剂,如dntp、酶等。
26、在本发明具体的实施例中,qpcr定量扩增所用试剂为2×sybr green qpcrmaster mix。
27、具体地,所述检测试剂盒中还含有校准品c1~c4;所述校准品c1包含0.5μg/ml的万古霉素、0.5μg/ml的替考拉宁、0.1μg/ml的伏立康唑和0.1μg/ml的美罗培南;所述校准品c2包含5μg/ml的万古霉素、5μg/ml的替考拉宁、1μg/ml的伏立康唑和1μg/ml的美罗培南;所述校准品c3包含50μg/ml的万古霉素、50μg/ml的替考拉宁、10μg/ml的伏立康唑和10μg/ml的美罗培南;所述校准品c4包含500μg/ml的万古霉素、500μg/ml的替考拉宁、100μg/ml的伏立康唑和100μg/ml的美罗培南。
28、具体地,本发明所述免疫磁珠的制备方法包括以下步骤:
29、a1.将所述超顺磁性磁珠从超顺磁性磁珠悬浮液中分离,用2-吗啉乙磺酸(mes)活化缓冲液洗涤,弃去上清;
30、a2.加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs)溶液重悬磁珠,振荡活化反应30min;
31、a3.分别加含抗万古霉素、美罗培南、替考拉宁、伏立康唑的第一抗体(捕获抗体)的抗体溶液,使所述第一抗体与超顺磁性磁珠偶联;
32、a4.分离与第一抗体偶联的超顺磁性磁珠,用pbs-t缓冲液洗涤,加入tris-hcl缓冲液封闭反应,封闭反应结束后用pbs-t缓冲液洗涤;
33、a5.分离磁珠后用1×pbs缓冲液重悬,得所述免疫磁珠;4℃保存。
34、具体地,a1中所述2-吗啉乙磺酸活化缓冲液的浓度为0.488g/ml,ph为6.0;每毫克超顺磁性磁珠用250μl 2-吗啉乙磺酸活化缓冲液洗涤。
35、具体地,a2中所述1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs)溶液的浓度均为5mg/ml;二者以体积比为1:1的比例混合后使用,现配现用。
36、具体地,a3中所述使第一抗体与超顺磁性磁珠偶联的反应条件为:置于旋转培养仪,4℃偶联过夜。
37、具体地,a4和a5中所述pbs-t缓冲液为10mm pbs,内含体积分数为0.05%的吐温-20。
38、具体地,a4中所述tris-hcl缓冲液为100mm tris-hcl缓冲液,内含体积分数为0.05%的吐温-20。
39、具体地,a4中的封闭反应时间为3h。
40、具体地,a1~a5中分离磁珠时均利用磁力架分离。
41、具体地,本发明所述抗体与dna寡核苷酸偶联物的制备方法包括以下步骤:
42、b1.向苏糖核酸修饰的序列如seq id no.1~4所示的dna寡核苷酸中分别加入100mm二硫苏糖醇(dtt),室温黑暗条件下反应2h后去除多余的dtt;
43、b2.分别将抗万古霉素、美罗培南、替考拉宁、伏立康唑第二抗体-pbs混合液与0.85mg/ml马来酰亚胺-peg-nhs酯交联剂在4℃反应2h,抗体与交联剂的比例为100μg抗体:3μl交联剂,用biocomma脱盐柱纯化以去除多余的交联剂;
44、b3.将b1中纯化后的dna寡核苷酸序列与b2中的纯化抗体在4℃下孵育过夜,抗体与dna寡核苷酸序列的摩尔比为1:10;
45、b4.用ambicon ultra离心式过滤器洗涤5次,去除未反应的dna寡核苷酸序列。具体地,b1中用biocomma脱盐柱纯化去除多余的dtt。
46、具体地,b1中dna寡核苷酸的浓度均为1mm,用量均为50μl。
47、具体地,利用本发明所述检测试剂盒检测万古霉素、美罗培南、替考拉宁和伏立康唑的血药浓度的方法为:
48、s1.将待测血清样品、系列浓度校准品c1~c4分别与所述样品处理液混合;
49、s2.加入所述免疫磁珠,得到免疫磁珠-目标抗菌药物复合物;
50、s3.加入所述抗体与dna寡核苷酸偶联物,得到免疫磁珠-目标抗菌药物-偶联物复合物;
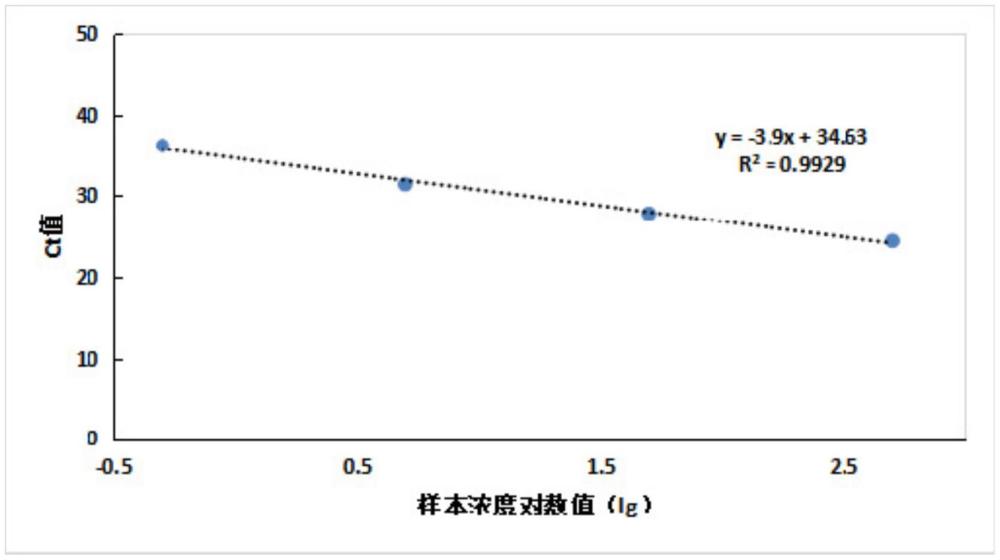
51、s4.分离免疫磁珠-目标抗菌药物-偶联物复合物,对其进行qpcr反应;qpcr反应结束后,以校准品c1~c4的拷贝数对数值(lg)为横坐标x,以其对应的ct值为纵坐标y,绘制标准曲线图,得线性方程;将所测血清样品的ct值代入所得线性方程,计算出所测血清样品中目标抗菌药物的浓度。
52、具体地,所述目标抗菌药物为万古霉素、美罗培南、替考拉宁和伏立康唑。
53、一般地,s1中所述待测血清样品与样本处理液的体积比为1:5~200。
54、具体地,以实际使用的抗菌药物的浓度为准,稀释后,血清中预估的抗菌药物浓度不应低于最低定量限。
55、所述抗菌药物的定量限为:万古霉素0.5μg/ml;替考拉宁0.5μg/ml;伏立康唑0.1μg/ml;美罗培南0.1μg/ml。
56、具体地,s2的操作方法为,将20μl 5mg/ml的偶联了目标抗菌药物第一抗体的免疫磁珠,与100μl按s1中所述方法稀释后的系列浓度校准品c1~c4和待测血清样品分别混匀,置于旋转仪上,室温(25℃)条件下反应3h;对反应后的溶液进行磁分离,用1×pbs缓冲液洗涤3次,得到免疫磁珠-目标抗菌药物复合物。
57、具体地,s3的操作方法为,用样本处理液将目标抗菌药物第二抗体-dna寡核苷酸偶联物按1:100~1:500的比例稀释,然后与s2得到的免疫磁珠-目标抗菌药物复合物混匀,稀释后的偶联物与免疫磁珠-目标抗菌药物复合物的体积比为2:1;置于旋转仪上,室温(25℃)条件下反应2h;对反应后的溶液进行磁分离,用1×pbs缓冲液洗涤3次,得到免疫磁珠-目标抗菌药物-偶联物复合物。
58、具体地,将s3中得到的免疫磁珠-目标抗菌药物-偶联物复合物转移至低吸附离心管中,调节ph至中性(ph 7.0),用于qpcr反应。
59、具体地,所述qpcr反应采用sybr green i染料法,反应体系共20μl,包括扩增引物(10μmol/l)1μl,探针100nm,2×taq pro universal sybr qpcr master mix 10μl,s3中洗脱产物(免疫磁珠-目标抗菌药物-偶联物复合物)2μl,超纯水补足余量。
60、反应程序:预变性:95℃,5s;循环20~40轮:95℃,10s;60℃,30s。
61、qpcr反应结束后,以初始样本的拷贝数(即系列浓度校准品浓度)对数值(lg)为横坐标x,以测得的ct值为纵坐标y绘制标准曲线图。其中,测得的ct值与初始样本的拷贝数(即系列浓度校准品浓度)对数值呈负相关,得线性方程。对于待测临床样本,可通过测得相应的ct值,然后代入方程计算出所测样本中抗菌药物的浓度。
62、利用本发明所述检测试剂盒可同时准确检测万古霉素、美罗培南、替考拉宁和伏立康唑的浓度。因此,本发明请求保护所述检测试剂盒在制备用于检测万古霉素、美罗培南、替考拉宁和/或伏立康唑浓度的产品中的应用。
63、作为其中的一种实施方式,所述浓度为在血液中的浓度。
64、本发明具有以下有益效果:
65、本发明提供了一种抗菌药物浓度检测试剂盒,包括样本处理液、免疫磁珠、抗体与dna寡核苷酸偶联物和qpcr核酸扩增试剂,利用其能同时检测万古霉素、美罗培南、替考拉宁和伏立康唑的浓度,且检测准确度与液相色谱串联质谱定量检测方法相当,检测结果的相对偏倚小于5%。此外,利用所述检测试剂盒检测万古霉素、美罗培南、替考拉宁和伏立康唑时的过程相对简单,可用于替代色谱分析方法,避免因色谱分析方法的样品前处理复杂、所需仪器昂贵等带来的不便,更适合临床检测使用,能够为万古霉素、美罗培南、替考拉宁和伏立康唑的临床合理用药提供参考,有利于个体化用药。
- 还没有人留言评论。精彩留言会获得点赞!