固相萃取-超高效液相色谱-串联质谱法检测蜂蜜中植物源性毒素的方法与流程
本发明涉及固相萃取-超高效液相色谱-串联质谱法检测蜂蜜中植物源性毒素的方法,属于检测。
背景技术:
1、蜂蜜作为蜜蜂采集植物的花蜜或蜜露与自身分泌物混合后,经充分酿造而形成的天然甜味物质,其特殊的风味和营养价值使其具有较高的药食两用特性而具有较大的市场接受度和经济价值[1]。然而蜜蜂在采集花蜜、花粉过程中存在较多的不确定性,可能引入部分有毒物质,长时间的有毒物质富集增加了该类蜂蜜的食品安全风险[2,3]。
2、近年来,国内外多次报道有关检出有毒蜂蜜以及所导致的中毒事件,其涉及的源头植物包括毛茛科、茄科、卫矛科、杜鹃花科、豆科、大戟科、山茶科和罂粟科等,以上类型植物可能含有吡咯里西啶生物碱类、木藜芦烷类、托品烷类、雷公藤类等有毒物质,且具有同系物多、毒性当量大等特点[3–6]。以pas为例,该类化合物目前仅已知种类已接近600种,且具有明显的肺脏、肾脏、神经和胚胎毒性,甚至导致致畸、致突变和致癌[7,8],多个国家对 pas的安全防控制定了严格的标准,而我国暂未对 pas 制定限量规定标准。而木藜芦烷类毒素在欧洲则以被其污染的“mad honey”而出名,食用该类蜂蜜可导致心动过缓、心律失常等不良反应[9,10],efsa contam panel (efsa panel on contaminants in the food chain)等[9]和róisín fattorini等[11]发现部分杜鹃花品种中含有木藜芦烷类毒素而具有较大的食品安全风险。因此,对蜂蜜中以上类型化合物的及时检测和监控,成为确保蜂蜜质量、维护人民健康的主要途径。
3、针对以上毒素种类多、毒性当量大、浓度低的特性,目前主要采用质谱法进行检测。zbynek dzuman等[12]使用多种色谱系统完成了植物源性食品中多种pas和托烷生物碱的分离检测,且部分生物碱需要切换色谱系统进行分离;alejandro garcía-juan等[13] 基于quechers法完成谷物食品中多种pas和托烷生物碱的检测,证实了该类食品中依然含有该类化合物;paola roncada等[14]对多份蜂蜜和花粉中的吡咯里西啶类生物碱的残留进行检测,证明多份样品中不同含量水平的pas残留;专利申请号:202110144362.8,发明名称:一种可同时测定蜂蜜中32种吡咯里西啶生物碱的方法,公开了一种可同时测定蜂蜜中32种吡咯里西啶生物碱的方法,包括如下步骤:称取蜂蜜样品,加入稀硫酸溶液溶解,混合均匀,离心,取上清液。上清液用阳离子交换固相萃取柱净化,氨化甲醇进行洗脱,洗脱液氮吹至干,复溶,过滤膜,用高效液相色谱-质谱联用仪进行32种吡咯里西啶生物碱的检测,外标法定量。该专利方法覆盖的植物源性毒素种类更多,针对蜜蜂采集多种植物花粉所带来多种植物毒素富集现状,该方法在实际应用过程中所测试样品印证了多种类型毒素存在的可能。该方法使用稀硫酸提取,阳离子交换柱进行净化,操作复杂。begoña fernández-pintor等[15]通过固相萃取-液相色谱-串联质谱对蜂蜜中阿托品和东莨菪碱进行检测,并证明多份蜂蜜中含有以上两种植物毒素。但是由于蜂蜜来源的特殊性,可能存在的混合采集多种植物花粉花蜜的情况,导致可能残留多种植物毒素的可能,因此更需建立更为全面的多种植物毒素同时检测方法[16,17,2,3]。
4、目前报道蜂蜜中植物毒素的检测文献主要集中在同系物毒素的检测,针对不同系毒素,在同一条件下实现检测,尚无相关文献报道。
技术实现思路
1、本发明提供了固相萃取-超高效液相色谱-串联质谱法检测蜂蜜中植物源性毒素的方法,立足于蜂蜜中同时监测多种植物毒素的应用需求,通过优化提取净化方法和仪器方法,建立同时测定27种pas、3种木藜芦烷类毒素、3种托品烷类毒素和6种雷公藤类毒素的检测方案。为监测蜂蜜中多种植物毒素残留、提升蜂蜜品质提供技术性支撑。
2、本发明提供了固相萃取-超高效液相色谱-串联质谱法检测蜂蜜中植物源性毒素的方法,包括如下步骤:
3、a、标准物质的配制
4、分别准确吸取不同体积的27种pas混标溶液、闹羊花毒素ii、闹羊花毒素iii、木藜芦毒素i、阿托品、东茛菪碱、山茛菪碱、雷公藤甲素、雷公藤内酯酮、雷公藤吉碱、雷公藤定碱、雷公藤次碱、雷酚内酯的标准溶液至10 ml容量瓶中,用甲醇定容至刻度,摇匀得混合标准中间溶液,其中,除闹羊花毒素ⅲ、雷公藤甲素和雷公藤内酯酮为10μg/ml外,其余组分浓度均为1μg/ml;
5、所述的27种pas混标溶液是指含石松胺、石松胺氮氧化物、倒千里光碱氮氧化物、蓝蓟定氮氧化物、欧天芥菜碱、欧天芥菜碱氮氧化物、春千里光碱氮氧化物、克氏千里光碱、促黑激素、芝麻菜叶千里光碱氮氧化物、野百合碱、野百合碱氮氧化物、促黑激素氮氧化物、倒千里光碱、毛束草碱、千里光菲林碱、千里光菲林碱氮氧化物、天芥菜碱、天芥菜碱氮氧化物、千里光宁碱、千里光宁碱氮氧化物、蓝蓟定、毛果天芥菜碱、毛果天芥菜碱氮氧化物、夹可灵、夹可灵氮氧化物、春千里光碱的甲醇溶液;
6、b、样品前处理:
7、准确称取混匀样品2g,置于离心管中,加入10 ml0.1%-2%的甲酸水溶液,涡旋混匀,超声提取,于15℃下9500 r/min离心5 min,取上清液,得到待净化液;
8、取待净化液过亲水亲脂平衡型固相萃取柱,加入5 ml水进行淋洗,抽干5min;加入10 ml甲醇洗脱,收集洗脱液于氮吹管中,45 ℃氮吹至近干,加入1.0 ml甲酸-5mmol/l含0.1%甲酸的乙酸铵水溶液,体积比为1:1,溶解残渣,涡旋混合1 min,超声2 min,过0.22 μm滤膜,滤液供uplc-ms/ms测定;
9、c、uplc-ms/ms测定的条件为:
10、液相色谱条件为:
11、色谱柱: acquity uplc hss c18 3.0×150 mm,1.7μm ;流动相:a为5 mmol/l含0.1%甲酸乙酸铵溶液,b为甲醇溶液;流速:0.3 ml/min;柱温:40 ℃;进样量:1μl;梯度洗脱程序为:0-2.0 min,95%-85%流动相a;2.0-13.0 min,85%-60% 流动相a;13.0-15.0 min,60%-5%流动相a;15.0-20.0 min,5%-5%流动相a;20.0-21.0 min,5%-95%流动相a;21.0-25.0 min,95%-95%流动相a;质谱条件为:
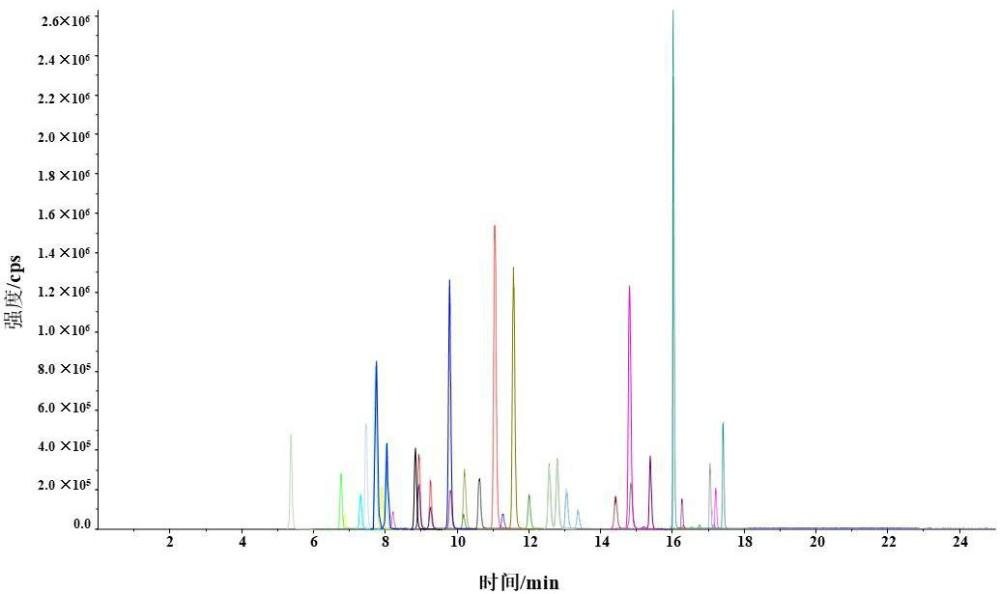
12、离子源类型:esi源,气帘气流速:35 psi;喷雾气流速:55 psi;辅助加热气流速:55 psi;离子源温度:500 ℃;离子化电压:5000 v;扫描模式:多反应监测模式,39种植物源性毒素的质谱参数分别为:
13、石松胺:保留时间为8.01min,母离子为300.3 m/z,定量离子为138.3 m/z,碰撞电压为26ev,定性离子为156.3 m/z,碰撞电压为39ev;
14、石松胺氮氧化物:保留时间为9.25min,母离子为316.1 m/z,定量离子为172.1 m/z,碰撞电压为38ev,定性离子为138.1 m/z,碰撞电压为36ev;
15、倒千里光碱氮氧化物:保留时间为10.19min,母离子为368.2 m/z,定量离子为136.2 m/z,碰撞电压为38ev,定性离子为118.2 m/z,碰撞电压为40ev;
16、蓝蓟定氮氧化物:保留时间为14.83min,母离子为414.2 m/z,定量离子为254.1 m/ z,碰撞电压为41ev,定性离子为352.1 m/z,碰撞电压为33ev;
17、欧天芥菜碱:保留时间为7.44min,母离子为330.1 m/z,定量离子为138.1 m/z,碰撞电压为31ev,定性离子为156.3 m/z,碰撞电压为39ev;
18、欧天芥菜碱氮氧化物:保留时间为8.20min,母离子为346.1 m/z,定量离子为172.1 m/z,碰撞电压为40ev,定性离子为328.0 m/z,碰撞电压为30ev;
19、春千里光碱氮氧化物:保留时间为13.03min,母离子为352.2 m/z,定量离子为118.1 m/z,碰撞电压为39ev,定性离子为120.1 m/z,碰撞电压为38ev;
20、克氏千里光碱:保留时间为15.38min,母离子为366.2 m/z,定量离子为168.2 m/z,碰撞电压为38ev,定性离子为150.3 m/z,碰撞电压为34ev;
21、促黑激素:保留时间为7.72min,母离子为300.1 m/z,定量离子为138.2 m/z,碰撞电压为26ev,定性离子为156.2 m/z,碰撞电压为39ev;
22、芝麻菜叶千里光碱氮氧化物:保留时间为6.85min,母离子为366.1 m/z,定量离子为136.1 m/z,碰撞电压为42ev,定性离子为120.1 m/z,碰撞电压为40ev;
23、野百合碱:保留时间为5.35min,母离子为326.2 m/z,定量离子为120.3 m/z,碰撞电压为44ev,定性离子为237.3 m/z,碰撞电压为32ev;
24、野百合碱氮氧化物:保留时间为6.75min,母离子为342.1 m/z,定量离子为137.4 m/ z,碰撞电压为37ev,定性离子为236.0 m/z,碰撞电压为37ev;
25、促黑激素氮氧化物:保留时间为8.92min,母离子为316.1 m/z,定量离子为111.2 m/ z,碰撞电压为52ev,定性离子为138.1 m/z,碰撞电压为36ev;
26、倒千里光碱:保留时间为9.80min,母离子为352.2 m/z,定量离子为120.3 m/z,碰撞电压为38ev,定性离子为138.3 m/z,碰撞电压为37ev;
27、毛束草碱:保留时间为10.19min,母离子为354.2 m/z,定量离子为222.2 m/z,碰撞电压为38ev,定性离子为120.2 m/z,碰撞电压为44ev;
28、千里光菲林碱:保留时间为10.60min,母离子为334.2 m/z,定量离子为120.2 m/z,碰撞电压为36ev,定性离子为138.2 m/z,碰撞电压为35ev;
29、千里光菲林碱氮氧化物:保留时间为11.25min,母离子为350.2 m/z,定量离子为120.1 m/z,碰撞电压为39ev,定性离子为118.2 m/z,碰撞电压为40ev;
30、天芥菜碱:保留时间为11.03min,母离子为314.2 m/z,定量离子为138.2 m/z,碰撞电压为26ev,定性离子为156.2 m/z,碰撞电压为37ev;
31、天芥菜碱氮氧化物:保留时间为11.99min,母离子为330.2 m/z,定量离子为172.1 m/z,碰撞电压为38ev,定性离子为138.2 m/z,碰撞电压为36ev;
32、千里光宁碱:保留时间为12.77min,母离子为336.2 m/z,定量离子为120.2 m/z,碰撞电压为36ev,定性离子为138.2 m/z,碰撞电压为38ev;
33、千里光宁碱氮氧化物:保留时间为13.36min,母离子为352.2 m/z,定量离子为118.1 m/z,碰撞电压为39ev,定性离子为136.3 m/z,碰撞电压为37ev;
34、蓝蓟定:保留时间为14.79min,母离子为398.2 m/z,定量离子为120.2 m/z,碰撞电压为32ev,定性离子为220.2 m/z,碰撞电压为23ev;
35、毛果天芥菜碱:保留时间为16.02min,母离子为412.2 m/z,定量离子为120.2 m/z,碰撞电压为38ev,定性离子为336.3 m/z,碰撞电压为24ev;
36、毛果天芥菜碱氮氧化物:保留时间为16.26min,母离子为428.2 m/z,定量离子为254.1 m/z,碰撞电压为40ev,定性离子为410.0 m/z,碰撞电压为31ev;
37、夹可灵:保留时间为7.28min,母离子为352.1 m/z,定量离子为120.1 m/z,碰撞电压为38ev,定性离子为155.2 m/z,碰撞电压为38ev;
38、夹可灵氮氧化物:保留时间为7.87min,母离子为368.1 m/z,定量离子为296.1 m/z,碰撞电压为32ev,定性离子为120.1 m/z,碰撞电压为45ev;
39、春千里光碱:保留时间为12.54min,母离子为336.2 m/z,定量离子为120.1 m/z,碰撞电压为36ev,定性离子为138.1 m/z,碰撞电压为38ev;
40、闹羊花毒素ⅱ:保留时间为16.52min,母离子为433.2 m/z,定量离子为415.2 m/z,碰撞电压为37ev,定性离子为373.2 m/z,碰撞电压为37ev;
41、闹羊花毒素ⅲ:保留时间为15.21min,母离子为386.2 m/z,定量离子为315.0 m/z,碰撞电压为17ev,定性离子为297.0 m/z,碰撞电压为20ev;
42、木藜芦毒素ⅰ:保留时间为14.40min,母离子为435.3 m/z,定量离子为375.2 m/z,碰撞电压为30ev,定性离子为357.2 m/z,碰撞电压为33ev;
43、阿托品:保留时间为11.55min,母离子为290.2 m/z,定量离子为124.0 m/z,碰撞电压为32ev,定性离子为93.0 m/z,碰撞电压为40ev;
44、东茛菪碱:保留时间为8.81min,母离子为304.1 m/z,定量离子为138.0 m/z,碰撞电压为30ev,定性离子为156.0 m/z,碰撞电压为23ev;
45、山茛菪碱:保留时间为9.77min,母离子为306.2 m/z,定量离子为140.2 m/z,碰撞电压为33ev,定性离子为122.1 m/z,碰撞电压为37ev;
46、雷公藤甲素:保留时间为16.79min,母离子为361.2 m/z,定量离子为145.0 m/z,碰撞电压为38ev,定性离子为128.0 m/z,碰撞电压为80ev;
47、雷公藤内酯酮:保留时间为16.73min,母离子为359.3 m/z,定量离子为91.0 m/z,碰撞电压为68ev,定性离子为128.0 m/z,碰撞电压为80ev;
48、雷公藤吉碱:保留时间为17.02min,母离子为858.4 m/z,定量离子为206.1 m/z,碰撞电压为50ev,定性离子为686.1 m/z,碰撞电压为47ev;
49、雷公藤定碱:保留时间为17.09min,母离子为884.5 m/z,定量离子为176.0 m/z,碰撞电压为56ev,定性离子为194.0 m/z,碰撞电压为55ev;
50、雷公藤次碱:保留时间为17.19min,母离子为868.1 m/z,定量离子为206.0 m/z,碰撞电压为50ev,定性离子为178.0 m/z,碰撞电压为65ev;
51、雷酚内酯:保留时间为17.40min,母离子为313.2 m/z,定量离子为253.1 m/z,碰撞电压为28ev,定性离子为271.0 m/z,碰撞电压为28ev。
52、其中,b步骤所述的亲水亲脂平衡型固相萃取柱采用6 ml甲醇和6 ml水进行活化。
53、其中,所述的亲水亲脂平衡型固相萃取柱为官能化聚苯乙烯/二乙烯苯萃取柱,萃取柱的装量为 200mg,柱体积为 6ml。
54、其中,b 步骤所述的提取溶剂为0.1%甲酸水溶液。
55、本发明的有益效果是:
56、本发明为监测蜂蜜中可能残留多种植物源性毒素,通过对提取溶液、净化方法和仪器方法进行了优化并完成方法学验证,证明所建立方法具有操作简单、灵敏度高、可准确定量的特性,可满足蜂蜜中以上化合物的残留监测。通过对多批次蜂蜜的检测结果显示,多批次蜂蜜中含有不同含量水平的毒素,预示着可能具有潜在的食品安全风险,可持续跟踪和评估蜂蜜中该类化合物的残留水平。
- 还没有人留言评论。精彩留言会获得点赞!