一种膜蛋白成像技术
本发明属于生物,公开了一种膜蛋白成像技术,具体涉及有效放大膜蛋白信号的成像方法。
背景技术:
1、细胞膜蛋白是细胞膜的重要组成部分,在信号转导、物质转运和能量转换中发挥着不可或缺的作用,也是临床应用中重要的生物标志物和药物靶点。目前,细胞膜蛋白的成像分析方法通常涉及传统的免疫荧光技术及其衍生物。然而,这种检测方法的信号放大率较低,对于低丰度靶蛋白方面的分析方面存在着缺陷。目前的方法主要集中在尝试利用纳米技术修饰荧光二级抗体。然而,这些技术主要依赖于基于“靶标-一抗-二抗”和“靶标-适体”等信号识别与放大过程。蛋白固定在膜上的性质与其在溶液中有较大的差异,这大大限制了信号的放大和输出的效率。
技术实现思路
1、为解决上述问题,我们公开了一种膜蛋白成像技术,利用了dna自组装技术,克服了基于靶蛋白成像原位成像的局限性,提高了信号放大效率和稳定性,实现了靶蛋白的异位分析。
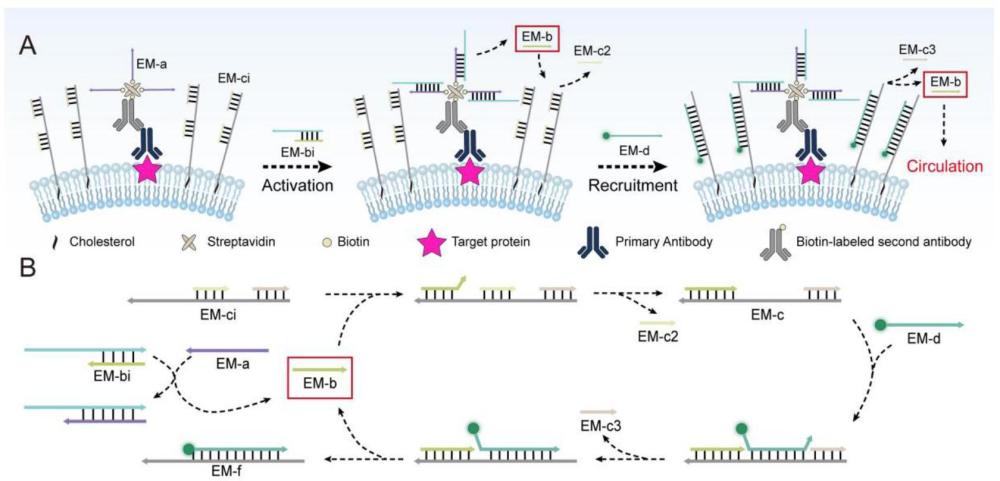
2、为了实现这一目标,我们在传统免疫荧光分析方法的基础上,进一步设计了一种基于分子动态募集的异位放大成像方法。具体而言,使用不同的dna分子作为响应分子来标记细胞膜和靶膜蛋白。随后,标记在靶膜蛋白上的响应分子可以通过链置换反应触发基于熵驱动循环的分子动态募集,导致溶液中的大量探针被募集到细胞膜上。信号从膜界面蛋白扩大到整个细胞膜,实现了基于分子动态募集的膜蛋白的异位放大成像。此外,我们选取上转换纳米颗粒(ucnps)取代传统的荧光部分以进一步增强信号。我们的方法可以有效的增强低丰度靶膜蛋白的成像信号。同时,有助于更深入地了解细胞膜蛋白的生物学意义和动态调控过程。
3、本发明包括以下具体的技术方案:
4、一种膜蛋白成像方法,其特征在于,包括以下步骤:
5、s1、细胞膜蛋白标记:通过靶蛋白-一级抗体-生物素标记的二级抗体-链霉亲和素-生物素-标记的em-a的过程,用em-a标记膜靶蛋白epcam;
6、s2、细胞膜工程:在待成像的细胞中加入被胆固醇修饰的dna复合物em-ci,并在室温下孵育,使em-ci嵌入细胞膜;
7、s3、ucnp-em-d的合成:通过edc/nhs将em-d-nh2与柠檬酸功能化的上转换纳米颗粒ca-ucnp共价偶联;
8、s4、分子动态招募:细胞膜蛋白标记和细胞膜工程完成后,向细胞中加入em-bi和em-d-fam或ucnp-em-d,孵育后dapi对细胞核进行染色,共聚焦激光扫描显微镜成像;
9、所述em-a的核酸序列如seq id no:1所示;
10、所述em-bi包括em-b1与em-b2,其核酸序列如seq id no:2和3所示。
11、所述em-ci包括em-c1、em-c2和em-c3,其核酸序列分别如seq id no:4-6所示;
12、所述em-d的核酸序列如seq id no:7所示。
13、进一步的,上述一种膜蛋白成像方法,所述ca-ucnp由以下步骤合成:
14、1)将ycl3、ybcl3、tmcl3溶液、油酸和1-十八烯混合,反应后加氟化铵和氢氧化钠的甲醇溶液,得到nayf4:yb,tm晶核;
15、2)再与ycl3、油酸、1-十八烯混合物及氟化铵、氢氧化钠反应,得到核壳ucnp;
16、3)经乙醇、水、盐酸亲水处理后,加入柠檬酸钠溶液孵育,得到ca-ucnp。
17、优选的,所述ca-ucnp由以下步骤合成:
18、a、取135.5mg ycl3、83.7mg ybcl3、50μl tmcl3、8ml油酸和15ml 1-十八烯混合,90℃搅拌条件下反应20分钟,随后150℃下反应1小时。加入5ml含有148mg氟化铵和100mg氢氧化钠的无水甲醇,90℃加热1小时以去除甲醇。收集到的产物加入4ml环己烷和4ml乙醇,洗涤3次得到晶核nayf4:yb,tm。
19、b、取135.5mg ycl3、8ml油酸和15ml 1-十八烯混合,90℃搅拌条件下反应20分钟,随后150℃下反应1小时。加入5ml含有148mg氟化铵和100mg氢氧化钠的无水甲醇,和上述含nayf4:yb,tm的环环己烷溶液。90℃加热1小时以去除甲醇和环己烷。得到的混合物在氮气保护下加热至300℃反应1.5小时,自然冷却后,加入20ml乙醇,13000rpm离心5分钟收集产物。收集到的产物加入4ml环己烷和4ml乙醇,得到核壳ucnp;将核壳ucnp分散在4ml乙醇、2ml水和2ml盐酸中进行亲水处理。室温搅拌超声处理2小时后,用50%乙醇洗涤混合物两次,并通过以13000rpm离心20分钟收集ucnp。
20、c、将800mg柠檬酸钠溶解在80ml水中,缓慢加入核壳ucnp中,然后轻轻搅拌并在室温下孵育过夜。通过以13000rpm离心20分钟收集ca-ucnp,并将其分散在4ml水中。
21、进一步的,上述一种膜蛋白成像方法,所述步骤s1中,包括以下步骤:
22、1)当细胞达到适当密度后,取出细胞培养基,用1×pbs洗涤细胞三次;
23、2)加入4%多聚甲醛在室温下固定15分钟,然后用1×pbst洗涤三次;
24、3)加入一抗并孵育1小时,然后用0.05% pbst洗涤三次;
25、4)加入生物素标记的二抗并孵育1小时,然后用0.05%pbst洗涤三次;
26、5)加入链霉亲和素并孵育15分钟,然后用0.05%pbst洗涤三次;
27、6)加入500nm生物素标记的em-a并孵育30分钟,然后用1×pbs洗涤三次,此时,细胞膜上的epcam被em-a标记。
28、进一步的,上述一种膜蛋白成像方法,所述步骤s2中,包括以下步骤:
29、加入500nm被胆固醇修饰的dna复合物em-ci,并在室温下孵育30分钟;在使用1×pbs洗涤以去除游离和不稳定的em-ci之后,将获得的样品用于随后的实验。
30、进一步的,上述一种膜蛋白成像方法,所述步骤s3中,包括以下步骤:
31、1)将20μl的ca-ucnp、2mg的edc和3mg的sulfo nhs混合在1ml 1×pbs中,在600rpm下搅拌30分钟后,再在13000rpm下离心20分钟以收集活化的ca-ucnp;
32、2)活化后,加入1ml 200nm em-d-nh2偶联物,并在室温下以600rpm搅拌过夜;最后,以13000rpm离心20min收集最终产物ucnp-em-d,用1×pbs洗涤三次,然后重新悬浮在含有10mm mgcl2的1×pbs中,并储存在4℃的冰箱中用于后续实验。
33、进一步的,上述一种膜蛋白成像方法,所述步骤s4中,包括以下步骤:
34、1)细胞膜蛋白标记和细胞膜工程完成后,向细胞中加入200μl 1×pbs,由10mmmgcl2、25nm em-bi和100nm em-d-fam或0.1mg/ml ucnp-em-d组成,孵育30分钟,并用1×pbss洗涤三次;
35、2)然后加入dapi对细胞核进行染色,在室温下避光孵育10分钟,用1×pbs洗涤三次,使用lsm 900共聚焦激光扫描显微镜对细胞进行成像。
36、进一步的,上述一种膜蛋白成像方法,所述细胞为mcf7或hepg2。
37、本发明还公开了上述膜蛋白成像方法在生物制药领域中的应用。
38、相比现有技术,本发明具有如下突出的有益效果:
39、本发明公开了一种膜蛋白成像技术,在本发明中,我们基于dna自组装技术模拟了细胞膜表面的招募过程,构建了一种基于分子动态招募的细胞膜蛋白放大成像技术,成功实现了对不同细胞上不同丰度的细胞膜蛋白的放大成像。克服了单纯基于靶蛋白枢轴成像的局限性,使信号在支点处扩散到整个细胞膜,大大提高了信号放大能力。此外这种技术在对低丰度膜蛋白进行成像分析方面也具有优势,本发明对比先前的细胞膜蛋白的成像分析方法,不仅提高了信号放大效率和稳定性,而且在目标检测特异性方面也表现出色。本发明还通过用ucnp取代em-d上的化学荧光信号,证明了不同的信号分子都是可以作为分子动态招募的对象,并且后续还可以开发出可结合其他信号扩增方法,通过进一步根据具体情况调整成像技术以适应检测要求,可以说,本发明的推广为细胞诊断的应用提供一个新的视角。
- 还没有人留言评论。精彩留言会获得点赞!