一种基于DNA链置换的延迟酶促反应超灵敏Brink控制的实现方法
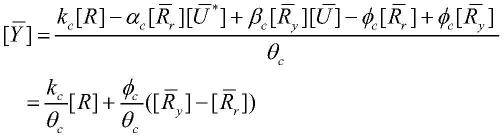
一种基于dna链置换的延迟酶促反应超灵敏brink控制的实现方法
技术领域
1.本发明涉及生物系统基于dna链置换的反馈控制技术领域,具体涉及一种基于dna链置换的延迟酶促反应超灵敏brink控制的实现方法。
背景技术:
2.化学反应网络(crns)通常被用来表示反馈控制系统,以反映生物分子反馈控制电路的性能。同时,dna分子被广泛认为是构建基于crns的分子器件理想工程材料。特别是dna链置换反应,已经成为一种正式编程和分析dna设备的手段。因此,在设计诸如生化控制器等应用时,构建crns来表示系统的动力学成为了一个主要目标。结合dna链置换机制,进而实现数字电路、信号处理计算和仿真等等。现有基于crns的控制器大多采用双轨表示方法,这直接导致控制器实现所需的crns数量大幅度增多,进而增大了dna实现的复杂度。
3.crns提供了复杂生化过程的抽象表示,这为构建控制系统中各个模块的化学反应网络表示和反映生物分子反馈控制电路的性能表现提供了重要前提。samaniego,c.c.,and franco,e.在2021年发表于cell systems,12(3),272-288的文章“ultrasensitive molecular controllers for quasi-integral feedback”,利用模块化设计策略构建了一个分子控制器,即brink控制器,并将其应用于调节靶rna或蛋白质的表达。brink控制器构建所涉及的模块化策略基于使用超灵敏响应和响应的可调谐阈值两个设计原则。此外,fern,j.,scalise,d.,cangialosi,a.,howie,d.,potters,l.,and schulman,r.在2017年发表于acs synthetic biology,6(2),190-193的文章“dna strand-displacement timer circuits”,用抽象的化学反应构建了一个定时器电路,该电路可以在没有外部刺激的情况下协调不同体外化学事件,例如可以用于预先指定特定的物种进行延迟释放。
4.现有基于crns的控制器,经历了pi控制器、pid控制器和非线性qsm控制器等一系列的演变,也已经完成了相应的dna实现。然而这些控制器在结构上存在信号间的减法运算,使得在crns的设计上依赖于双轨表示方法,增加了实现所需的crns数量,进而加大了dna实现的难度。
技术实现要素:
5.本发明的目的在于,提供一种基于dna链置换的超灵敏生物分子brink控制器实现方法,其尽可能用少的化学反应实现超灵敏的输入-输出响应。
6.为实现上述目的,本技术提出一种基于dna链置换的延迟酶促反应超灵敏brink控制的实现方法,包括:
7.用单分子和双分子化学反应来描述酶促反应过程,引入时间延迟因素,得到具有时间延迟的酶促反应过程模型;
8.构建基于crns的brink控制器;
9.获取所述brink控制器输出与稳态条件下系统输出之间的静态映射表达式,进而
得到保证控制器性能的解析条件;
10.利用dna链置换反应实现brink控制器的构建;
11.通过dna链置换机制,并基于延迟物质和补偿机制获取时间延迟表示方式,将所述时间延迟表示方式应用到酶促反应过程模型的dna实现上;同时,结合构建后的brink控制器,实现对重写后酶促反应过程模型的控制。
12.进一步的,用单分子和双分子化学反应来描述酶促反应过程,具体为:
[0013][0014][0015][0016]
其中,s和b分别表示底物和酶,x和p分别表示酶-底物复合物和输出物质。
[0017]
进一步的,构建具有时间延迟的酶促反应过程模型,具体为:
[0018][0019][0020][0021][0022]
其中,参数τ表示产生输出物质p过程中存在的累积时间延迟。
[0023]
进一步的,基于crns的控制器表示为:
[0024][0025][0026][0027][0028][0029][0030][0031]
其中,参数r和y是brink控制器的输入,u表示输出;参数kc、θc和αc表示催化速率,γc和βc表示结合速率,φc表示降解速率;此外,参数r产生物质rr,然后与u
*
反应形成u;参数y产生物质ry,然后与u反应形成u
*
;同时,信号rr和ry结合形成复合物rr·ry
,该复合物不与任何其他物质相互作用,即在brink控制器的两个不同输入参数r和y之间存在一个反向作用的功能机制;brink控制器将信号rr和ry分别作为激活剂和失活剂;
[0032]
结合质量作用动力学mak,对应的odes方程为:
[0033][0034][0035]
[0036][0037]
从微分方程中得到的(d[u
*
]
t
/dt)+(d[u]
t
/dt)=0表明u+u
*
的总质量在时间演化过程中是守恒。
[0038]
进一步的,获取所述brink控制器输出与稳态条件下系统输出之间的静态映射表达式,具体为:
[0039]
假设brink控制器已实现稳态输出,则得到以下结果:
[0040]
kc[r]
t-γc[rr]
t
[ry]
t-φc[rr]
t-αc[rr]
t
[u
*
]
t
=0
[0041]
θc[y]
t-γc[rr]
t
[ry]
t-φc[ry]
t-βc[ry]
t
[u]
t
=0
[0042]-αc[rr]
t
[u
*
]
t
+βc[ry]
t
[u]
t
=0
[0043]
假设brink控制器参考输入r为常数,则得到以下约束条件:
[0044][0045]
其中,信号表示稳态状态下物质
·
的浓度。
[0046]
更进一步的,利用dna链置换反应实现brink控制器的构建,具体为:设i,x,y,z为变量,其中i∈(1,2,...,12),x∈(1,2,...,8),y∈(1,2,3,4),z∈(1,2,...,9);
[0047]
对于反应和两者之间存在相同的dsd实现机制;这两种反应转化为:
[0048][0049][0050]
同时,在反应和之间也存在一个相同的实现机制,转化表示为:
[0051][0052]
对于反应和来说,相应的dna实现表示为
[0053]
[0054][0055][0056]
其中,g
x
,t
x
和ly均表示参与反应的辅助物质,oz和hy表示中间产物,by表示反应产生的不与其他物质相互作用的惰性废物;此外,c
max
表示辅助物质的初始浓度,q
max
表示最大链置换的反应速率,qi表示相应dna实现的反应速率。
[0057]
更进一步的,通过dna链置换机制,并基于延迟物质和补偿机制获取时间延迟表示方式,具体为:
[0058]
利用两个同时发生的抽象化学反应组成的电路来表示时间延迟,其实现是基于延迟物质d的参与,用以下反应来描述:
[0059][0060][0061]
其中,参数k
prod
和k
delay
是速率常数;在第一阶段,物质o以恒定的速率产生;在第二阶段,当物质o与延迟物质d结合时,会迅速转化为废物以物质o消耗物质d的时间作为延迟时间,其延迟效应取决于延迟物质d的初始浓度;
[0062]
更进一步的,将所述时间延迟表示方式应用到酶促反应过程模型的dna实现上,故酶促反应模型重写为:
[0063][0064][0065][0066][0067][0068]
其中,k
delay1
表示延迟反应速率;结合质量作用动力学,得到如下结果:
[0069][0070][0071][0072]
[0073][0074]
更进一步的,结合构建后的brink控制器,实现对重写后酶促反应过程模型的控制,具体为:
[0075]
将反应转化为:
[0076][0077]
降解反应被转化为:
[0078][0079]
此外,将反应转化为:
[0080][0081]
对于可逆反应在设计dna实现时,保持原始的反应形式。
[0082]
更进一步的,利用dsd机制实现基于brink控制器的酶促反应过程模型调节,对提出的关于时间延迟的dna链置换表示进行改进,具体为:通过如下反应机理来补偿酶促反应中物质p的消耗,从而实现输出物质p的预期产量:
[0083][0084][0085]
其中,k
pro1
和k
pro2
均为反应速率常数,f为额外添加的反应物质;结合质量作用动力学,得到相应的常微分方程odes:
[0086][0087][0088]
此外,反应转化为:
[0089][0090]
反应转化为:
[0091][0092]
本发明采用的以上技术方案,与现有技术相比,具有的优点是:brink控制器规避了crns设计时双规表示方法的限制,在结构上不涉及减法运算,减少了实现所需抽象化学反应的数量,大大简化了dna实现的复杂度。此外,以酶促反应为背景,引入时间延迟因素,
进而构建了基于crns的延迟酶促反应模型;考虑到crns与dna反应之间的转化表示,进而提出了一种关于时间延迟在dna链置换反应中的表示方案。最后,利用dna链置换机制实现brink控制器下的酶促反应过程控制。在无延迟和非零延迟条件下,酶促反应过程的输出物质均能在准稳态下接近目标水平。
附图说明
[0093]
图1为酶促反应所涉及的各种化学物质抽象表示图;
[0094]
图2为brink控制器下的生物分子控制系统原理图;
[0095]
图3为基于dna链置换的brink控制下理想化酶促反应过程调控图;
[0096]
图4为图3相关实验的长时间调控结果图;
[0097]
图5为基于dna链置换的brink控制下非零延迟酶促反应的过程调控图;
[0098]
图6为物质d1的初始浓度设为1.1nm时,brink控制下酶促反应的过程调控结果图;
[0099]
图7为物质d1的初始浓度设为1.1nm且物质f的初始浓度设为1.3nm时,brink控制下酶促反应的过程调控结果图。
具体实施方式
[0100]
为了使本技术的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本技术进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本技术,并不用于限定本技术,即所描述的实施例仅是本技术一部分实施例,而不是全部的实施例。
[0101]
因此,以下对在附图中提供的本技术的实施例的详细描述并非旨在限制要求保护的本技术的范围,而是仅仅表示本技术的选定实施例。基于本技术的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本技术保护的范围。
[0102]
实施例1
[0103]
本实施例提供一种基于dna链置换的延迟酶促反应超灵敏brink控制的实现方法,具体包括:
[0104]
s1:用单分子和双分子化学反应来描述酶促反应过程,可以得到如下表示:
[0105][0106][0107][0108]
其中,s和b分别表示底物和酶,x和p分别表示酶-底物复合物和产物,如图1所示。
[0109]
考虑到酶促反应过程容易受到温度和ph值等因素的影响,会导致上述反应中酶活性发生变化,进而影响产物在酶促反应中的生产效率。此外,底物s的积累还需要一定的时间(依据反应可知,s受到输入通量u的影响)。为了更准确地模拟反应过程,在反应模型中引入了延迟因素τ,从而构建了一个具有时间延迟的酶促反应过程模型:
[0110][0111][0112][0113]
[0114]
其中,参数τ表示产生输出物质p过程中存在的累积时间延迟;
[0115]
s2:构建基于crns的brink控制器;
[0116]
具体的,与基于双轨表示的控制器如qsm控制器相比,brink控制器在设计上直接减少了实现超灵敏输入输出响应所需的crns数量,因为它不涉及减法模块的使用,降低了dna实现的复杂性。
[0117]
brink控制器在crns的设计上最大特点是规避了双轨表示方法的限制。如图2所示,参数r和y是brink控制器的输入,而u表示输出。参数kc、θc和αc表示催化速率,γc和βc表示结合速率,φc表示降解速率。此外,r可以产生rr,然后与u
*
反应形成u,而y可以产生ry,然后与u反应形成u
*
。同时,物质rr和ry结合形成复合物rr·ry
,这个复合物不与任何其他物质相互作用,即在brink控制器的两个不同输入r和y之间存在一个反向作用的功能机制。图2中突出显示的模块属于共价修饰循环,brink控制器将信号rr和ry分别作为激活剂和失活剂。相应的crns可以进行如下表示:
[0118][0119][0120][0121][0122][0123][0124][0125]
结合质量作用动力学mak,对应的odes方程为:
[0126][0127][0128][0129][0130]
从微分方程中得到的(d[u
*
]
t
/dt)+(d[u]
t
/dt)=0表明u+u
*
的总质量在时间演化过程中是守恒。
[0131]
s3:获取所述brink控制器输出与稳态条件下系统输出之间的静态映射表达式,进而得到保证控制器性能的解析条件;
[0132]
具体的,假设brink控制器已经实现了稳态输出,则可以得到以下结果:
[0133]
kc[r]
t-γc[rr]
t
[ry]
t-φc[rr]
t-αc[rr]
t
[u
*
]
t
=0
[0134]
θc[y]
t-γc[rr]
t
[ry]
t-φc[ry]
t-βc[ry]
t
[u]
t
=0
[0135]-αc[rr]
t
[u
*
]
t
+βc[ry]
t
[u]
t
=0
[0136]
假设brink控制器的参考输入r为常数,则可以得到以下等式约束条件:
[0137][0138]
其中,信号表示稳态状态下物质
·
的浓度。
[0139]
与同样能够实现超灵敏响应的qsm控制器相比,brink控制器的稳态平衡条件仅与两个变量rr和ry相关,影响最终输出结果的因素相对更少。稳态调节等式约束中所含变量数量的减少有利于保持理想的稳态输出,从而简化控制结构,降低控制器设计的复杂性。
[0140]
s4:利用dna链置换反应实现brink控制器的构建;
[0141]
具体的,设i,x,y,z为变量,其中i∈(1,2,...,12),x∈(1,2,...,8),y∈(1,2,3,4),z∈(1,2,...,9);对于接下来dna实现所涉及的g
x
,t
x
和ly均表示参与反应的辅助物质,oz和hy表示中间产物,by表示反应产生的不与其他物质相互作用的惰性废物;此外,c
max
表示辅助物质的初始浓度,q
max
表示最大链置换的反应速率,qi表示相应dna实现的反应速率;
[0142]
对于反应和两者之间存在相同的dsd实现机制。这两种反应可以转化为:
[0143][0144][0145]
同时,在反应和之间也存在一个相同的实现机制,可以转化表示为:
[0146][0147]
对于反应和来说,相应的dna实现表示为:
[0148][0149]
[0150][0151]
s5:通过dna链置换机制,并基于延迟物质和补偿机制获取时间延迟表示方式,将所述时间延迟表示方式应用到酶促反应过程模型的dna实现上;同时,结合构建后的brink控制器,实现对重写后酶促反应过程模型的控制。
[0152]
具体的,为了使用dna链置换反应来表示时间延迟,设计两个同时发生抽象化学反应组成的电路来表示时间延迟;这一机制的实现是基于延迟物质的参与。可以用以下反应来描述:
[0153][0154][0155]
其中,参数k
prod
和k
delay
是速率常数。在第一阶段,物质o以恒定的速率产生;在第二阶段,当o与延迟物质d结合时,它会迅速转化为废物该机制以物质o消耗物质d的时间作为延迟时间,其延迟效应取决于延迟物质d的初始浓度。
[0156]
将延迟酶促反应模型重写为:
[0157][0158][0159][0160][0161][0162]
其中,k
delay1
表示延迟反应速率。结合质量作用动力学mak,可以得到了如下结果:
[0163][0164][0165][0166][0167][0168]
利用dna链置换反应机制,将反应转化为:
[0169][0170]
降解反应被转化为:
[0171][0172]
此外,将方反应转化为:
[0173][0174]
对于可逆反应在设计dna实现时,可以保持原始的反应形式。
[0175]
需要说明的是,基于crns的brink控制器和酶促过程涉及的所有反应速率、底物值见表1和表2,可行值分别为cmax=1000nm、qmax=107/m/s。对于brink控制器来说,将信号rr,ry和rr·ry
的初值设为零,即r
r0
=r
y0
=[rr·ry
]0=0nm。
[0176]
表1酶促反应过程模型的参数表示
[0177][0178]
此外,酶促反应中物质x和p的初始浓度设为零,即x0=p0=0nm。然后设计了相关实验并对结果进行了分析。
[0179]
表2 brink控制器的参数化表示
[0180][0181]
1)无延迟
[0182]
对于酶促反应过程,为输出物质p的预期浓度选择一个固定的常数,即将参考信号r设置为4.0nm。此时分析了一个理想的酶促反应模型,即d1的初始浓度为零。相应实验结果如图3所示。在图3中,输出信号y,即物质p的实际浓度,逐渐趋于理想的输出浓度,并随着时间的推移保持稳定输出状态。
[0183]
值得注意的是,图3所示的调节结果只能表明在有限的时间内可以达到理想输出状态。实际上,如果模拟运行的时间足够长,整个调节就会崩溃,导致理想的输出状态过渡到另一个状态,如图4所示。整个系统的调节至少可以保证输出物质p的实际浓度y在一定时间内接近于预期浓度。图4中所观察到的现象,主要是由于燃料链的消耗,导致燃料的总浓度随着时间的推移逐渐降低,进而导致dna电路的性能逐渐下降。
[0184]
2)非零延迟
[0185]
接下来,分析了具有非零延迟的酶促反应过程,即物质d1的初始浓度不为零。延迟反应速率k
delay1
被设置为1.0
×
102s-1
。将延迟物质d1的初始浓度设置为三个不同的值,即0.5nm、0.8nm和1.0nm,相应条件下的系统响应如图5所示。根据表3所示的参数,随着物质浓度的增加,系统响应的延迟效应变得更加明显。[d1]0表示物质d1的初始浓度。
[0186]
表3非零延迟模型调节结果的参数化情况
[0187][0188]
然而,上述延迟机制是通过消耗延迟物质来实现的,而这一过程在某种程度上需
要输出物质p的参与和消耗。对于具有时间延迟的基于dna的酶促反应来说,这使得输出物质p实际输出低于预期水平。图5所示的效果可能不明显,但当d1=1.1nm时,整个系统的输出响应如图6所示。
[0189]
为了解决这一问题,设计了如下的反应机理来补偿反应中物质p的消耗,从而实现了输出物质p的预期产量。
[0190][0191][0192]
其中,k
pro1
和k
pro2
均为反应速率常数,f为额外添加的反应物质。结合质量作用动力学mak,可以得到相应的常微分方程odes:
[0193][0194][0195]
此外,反应可以转化为:
[0196][0197]
反应可以转化为:
[0198][0199]
对于上述重新设计后的控制方案,相应调节结果如图7所示。反应速率k
pro1
设置为6.2
×
10-5
s-1
,而反应速率k
pro2
设置为3.0
×
10-5
s-1
。
[0200]
图7中输出物质p实际产量的曲线与图6的结果有显著差异,随着时间推移,另一曲线可以逐渐接近物质p的预期浓度。这种差异是由于补偿机制的构建,加入了化学物质f。因此,基于延迟物质和补偿机制的关于时间延迟dna链置换表示方式是可行的,同时,在brink控制器的作用下,酶促反应过程能够实现预期的输出结果。
[0201]
本发明中brink控制器规避了双轨表示方法的限制,使得所需的crns、dna反应和dna链数量大大减少,降低了dna实现的复杂度。
[0202]
前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1