急性缺血性脑卒中病灶区的自动量化及三维建模方法
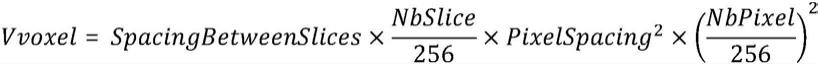
1.本发明涉及临床急性缺血性脑卒中影像处理领域,尤其涉及基于急性缺血性脑卒中病人脑部核磁共振影像不同序列的病灶区自动量化和三维建模方法。
背景技术:
2.急性缺血性脑卒中是一种突发的脑血管疾病,在老年群体中发病率较高(srinivasan, goyal,al azri,&lum,2006)。在全球范围内,大约74%的患者在卒中发作后由于肢体功能丧 失等原因生活无法自理,给社会带来了巨大的经济负担和人力成本负担(miller et al.,2010)。
3.再灌注治疗是目前国际上公认的在急性期内对缺血性脑卒中最有效的治疗方法(jivan, ranchod,&modi,2013)。再灌注治疗可分为静脉溶栓治疗和机械取栓。静脉溶栓治疗通过药物将血管内的血栓“溶解”,机械取栓通过血管内介入治疗,使用导管将闭塞处的血栓取出。再灌注治疗使得血流再通,挽救脑组织的功能,避免病人在卒中发作后的终身残疾。
4.病人病灶区的体积和在不同脑血管供血区域的分布在很大程度上会影响临床医生对于再灌注治疗的决策以及对于病人预后的判断。比如,研究显示如梗死病灶区在mca大脑中动脉供血区分布广泛,机械取栓的预后不佳(manceau et al.,2018);在mca大脑中动脉梗死的病人中不同形态位置的梗死区域模式对病人的溶栓预后有影像(liu et al.,2015);大于70ml的梗死区域对溶栓的预后有较大影响(tisserand et al.,2016);前循环颈内动脉系统的梗死和后循环椎基体动脉系统的梗死对于溶栓预后有不同的影响(keselman et al.,2020)
5.因此,在实际临床应用场景中,临床医生通常希望能三维立体地观察病人的病灶区在各脑血管供血区域的分布形态以及精确地得知病灶区在脑血管供血区域的体积及占比,这对于医生精准地制定再灌注治疗方案及预测预后有指导性的意义。由于威利适环的存在以及同一脑血管所供应的实际区域在不同的个体中存在差异,不同脑血管供血区域没有明确的解剖边界,因此病灶区在脑血管供血区域的精准体积及占比较难量化。过往的医学研究因此将此问题转化为,通过观察病灶区在各脑血管供血的核心解剖区域的分布及占比,间接推算出病灶区在各脑血管供血区域的分布形态以及在脑血管供血区域的体积及占比(barber,demchuk, zhang,&buchan,2000)。
6.临床上一般将核磁共振dwi序列的异常高信号区视为此次卒中发作的病灶区。现阶段,对于病人急性期的影像读取均由人工完成。由于人工三维立体空间想象和三维立体分区计算是一件相当费时费力的工程但与此同时脑卒中的黄金治疗时间窗却十分窄,现阶段影像科出示的卒中影像报告对病灶区在各脑部解剖结构分区的分布形态描述较粗糙,也没有对病灶区进行精准的量化计算。因此临床医生对于病人病灶区在各脑解剖结构的形态和占比体积并不能有直观准确地认知,也造成了一定程度上治疗方案的制定失败以及预后预测的不准确。
7.因此,现阶段急需一种算法,能够精准快速地实现图像去颅骨、图像脑部解剖结构自动分区、病灶区的自动识别、病灶区与不同脑部解剖结构的映射计算以及三维建模。
技术实现要素:
8.为解决现有技术的问题,本发明提供了一种急性缺血性脑卒中病灶区的自动量化及三维建模方法,基于急性缺血性脑卒中病人的临床核磁共振影像序列三维立体展示出病灶区在各脑部解剖结构分区的分布形态以及精确计算出病灶区在各脑部解剖结构的体积及占比,更精准快速地帮助临床医生在病发急性期制定再灌注治疗方案和预测病人预后。
9.本发明采用如下技术方案:
10.一种急性缺血性脑卒中病灶区的自动量化及三维建模方法,处理初期被分为两条分支(branch)同步进行,两条分支的计算结果最后汇总到主干步骤(master100和master200)进行病灶区域映射合并计算和最终三维建模,两条分支如下:
11.branch100:基于核磁共振影像(以下称为mri)adc和dwi序列的脑部病灶区自动划分;
12.branch200:mrit1序列脑部解剖结构自动划分。
13.其中,branch100包括branch101~branch104;branch200包括branch201和branch202。
14.具体的,本发明一种急性缺血性脑卒中病灶区的自动量化及三维建模方法,包括:
15.branch101,基于otsu’smethod算法(otsu,1979)对dwi序列的脑部图像进行去颅骨操作;
16.branch102,对adc序列的脑部图像进行去颅骨操作;
17.branch103,利用脑已经去除颅骨的dwi和adc部图像创建新的磁共振弥散加权影像(dwiadccombineddiffusionsequence,以下简称为cdsequence);该序列可以有效排除t2穿透效应的影响;
18.branch104,利用开发的3dprogression半自动化算法对病灶区域进行划分。以往的深度学习黑盒算法(zhaoetal.,2021)将一个完整的三维病灶区视为多个独立的mri二维切片病灶区,因而损失了较多三维立体空间信息。3dprogression算法将病灶视作一个完整的三维个体,并结合了缺血性血管病灶区由内向外脑血流量(cerebralbloodflow,cbf)依次升高的特点以对病灶区进行分割;
19.branch201,通过dwi和adc序列计算出t1序列,对t1序列的脑部图像进行去颅骨操作;
20.branch202,基于branch201已去除颅骨的影像,运用voxelmorph算法(balakrishnanetal.,2019)对病人的脑部解剖结构进行两种自动分区。第一种分区基于传统的解剖结构,完整的解剖结构列表见附录一,在单一解剖结构中,白质和灰质将会被区分。第二种分区基于aspects(albertastrokeprogrammeearlyctscore)评分系统(barberetal.,2000),病灶区在不同解剖结构中的分布情况间接反应了其在相应血管供血区域的分布情况,完整的解剖结构列表见附录二;
21.master100,将branch104识别的病灶区域映射至branch202的两种脑部解剖结构分区图。我们将按照附录一和附录二中的解剖结构列表分别计算出各个脑部解剖结构的病
灶区体积以及占比;
22.master200,基于master100附录一映射的结果进行三维建模,不同的解剖结构分区将会用不同的颜色标出,病灶区会被立体叠加在相应的脑部解剖结构分区上。
23.优选的,所述branch101,具体包括:
24.branch101
‑
1,利用otsu’s method算法基于dwi序列上的信号值计算出可以区分颅骨和脑部组织的一个信号值阙值(threshold);
25.branch101
‑
2,基于此阙值和原dwi序列生成脑部组织的掩膜(mask brain tissue,以下简称为mbt),具体为原dwi上其信号大于此阙值的区域在mbt上的相应值为1,反之则为0;应用python skimage包label算法将mbt划分成不同的三维连通分量,其中拥有体素数量最多的三维连通分量即为脑组织掩膜,依据此更新mbt;
26.branch101
‑
3,将脑部组织的掩膜mbt映射至原dwi序列,得到去除颅骨的dwi序列dwibt;dwibt=dwi
×
mbt。
27.优选的,所述branch102,具体包括:
28.branch102
‑
1,将branch101得到的脑部组织的掩膜mbt映射至原adc序列,得到去除颅骨的adc序列adcbt;adcbt=adc
×
mbt。
29.优选的,所述branch103,具体包括:
30.branch103
‑
1,对dwibt图像进行特征缩放(feature scaling),使图像上所有的信号值在[0,1]范围之内,特征缩放公式为:
[0031][0032]
branch103
‑
2,对adcbt图像进行特征缩放(feature scaling),使图像上所有的信号值在[0,1]范围之内,特征缩放公式为:
[0033][0034]
branch103
‑
3,计算经过特征缩放过的dwibt和adcbt的信号差值图像,并将信号的范围区间进行平移确保信号值的最小值为非负数:
[0035]
cdsequence=dwibt
‑
adcbt
[0036]
cdsequence=cdsequence
‑
min(cdsequence)
[0037]
cdsequence=cdsequence
×
mbt。
[0038]
优选的,所述branch104,具体包括:
[0039]
branch104
‑
1,在医生提供的病灶区切片上自动识别信号最高点hi
i
;其中,i为三维病灶数量计数变量,初始值为0;
[0040]
branch104
‑
2,获取医生在人机互动界面上调整的延伸度变量pd
i
的数值;
[0041]
branch104
‑
3,创建病灶区掩膜(lesion mask i,以下简称lmaski),hi
i
所在区域在 lmaski上所对应数值为1,其余区域数值为0;
[0042]
branch104
‑
4,应用3d progression算法,算法阐述如下,设置延伸度变量计数变量k, k的初始值为0;当k<pd
i
时,执行如下操作:
[0043]
应用python skimage包的expand_labels算法,将与lmask
i
上初始数值为1的体素(voxel) 距离为1的三维连通分量所对应的体素数值均标记为1,得到掩膜expandlesion;
[0044]
创建新的掩膜newlesion=expandlesion
‑
lmask
i
;newlesion上体素值为1的体素为算法在此次新循环中新标记的三维连通分量体素;
[0045]
将newlesion映射至cdsequence;expandthreshold=max(cdsequence
×
newlesion);expandthreshold为新标记的体素在创建的新的磁共振弥散加权影像cdsequence上的最大信号值;
[0046]
在掩膜newlesion上将cdsequence数值小于expandthreshold的体素重新标记为0;newlesion中数值为1的区域即为此次新循环中将要被标记为新病灶区的体素;
[0047]
更新病灶区掩膜lmask
i
=lmask
i
+newlesion;
[0048]
计数变量k数值加1;
[0049]
branch104
‑
5,医生增大pd
i
数值并对比识别结果和dwi原图像,自动重复branch104
‑
4中的算法以不断更新lmask
i
,识别病灶区不断向外延伸;当识别病灶区完全覆盖信号异常区时,医生停止调整增大pd
i
数值,单个三维病灶区识别结束;
[0050]
branch104
‑
6,当增大pd
i
数值使识别病灶区覆盖原dwi图像上非信号异常区时,医生可缩小pd
i
数值使其仅覆盖信号异常区,并点击“下一独立病灶识别”;计数变量i数值加1;自动更新识别剩余病灶切片上的信号最高点hi
i
;
[0051]
branch104
‑
7,自动重复branch104
‑
2至branch104
‑
6;
[0052]
branch104
‑
8,当识别区域覆盖全部原dwi上信号异常区域时三维病灶区识别结束,最终病灶区掩膜lmask=∑lmask
i
。
[0053]
优选的,所述branch201,具体包括:
[0054]
branch201
‑
1,依据dwi和adc序列可计算出t2序列(b值为0的dwi序列),将branch101得到的脑部组织的掩膜mbt映射至t2序列,得到去除颅骨的t2序列t2bt;t2bt=t2
×
mbt;对t2bt图像进行特征缩放,使图像上所有的信号值在[0,1]范围之内。对t2bt图片信号值进行逆转换得到去除颅骨的t1序列t1bt;t1bt=1
‑
t2bt。
[0055]
优选的,所述branch202,具体包括:
[0056]
branch202
‑
1,从voxelmorph的开源平台github上获取了成人大脑t1图像的模板(braint1template,以下简称template);该template基于7829个成人大脑t1图像的特点由计算机自动合成;
[0057]
branch202
‑
2,运用brainsuite软件对template依据附录一中分区进行划分生成分区掩膜templateseg1;在templateseg1中,附录一中同一分区所对应的体素均被赋值同一正整数;不属于附录一中分区的体素则被赋值为0;
[0058]
branch202
‑
3,运用brainsuite软件对template依据附录二中分区进行划分生成分区掩膜templateseg2;在templateseg2中,附录二中同一分区所对应的体素均被赋值同一正整数;不属于附录二中分区的体素则被赋值为0;
[0059]
branch202
‑
4,对病人的t1bt图像进行预处理使其体素信号值区间和图像三维矩阵的尺寸与template相同:运用数学插值(interpolation)算法使t1bt三维矩阵尺寸为256
×
256
×
256,并裁减至160
×
192
×
224。最后我们对t1bt图像进行特征缩放(featurescaling),使图像上所有的信号值在[0,1]范围之内,特征缩放公式为:
[0060]
[0061]
branch202
‑
5,运用voxelmorph图像配准网络对齐template和t1bt。在配准过程中, templateseg1和templateseg2分别被配准至t1bt形成t1btseg1和t1btseg2。t1btseg1即为依据附录一生成的t1bt分区掩膜,t1btseg2即为依据附录二生成的t1bt分区掩膜。
[0062]
优选的,所述master100,具体包括:
[0063]
master100
‑
1,运用数学插值(interpolation)算法使lmask三维矩阵尺寸为 256
×
256
×
256,并裁减至160
×
192
×
224。
[0064]
master100
‑
2,计算运用数学插值算法后单一体素所代表的体积
[0065][0066]
其中,spacingbetweenslices表示原dwi图像一层slice的中心与临近一层中心的纵向距离;pixelspacing表示原dwi图像单一层图像像素的间距;nbslice表示原dwi图像的切片层数;中的256表示进行插值计算后的新层数;nbpixel表示原dwi图像单层切片的单边像素个数;中的256为进行插值计算后的单层切片的单边像素个数;
[0067]
master100
‑
3,计算病灶总体积vlesion:
[0068]
vlesion=vvoxel
×
nbvoxellesion
[0069]
其中,nbvoxellesion表示进行插值计算后的lmask上数值为1的体素个数;
[0070]
master100
‑
4,将lmask映射至t1btseg1,如下:
[0071]
t1btseg1lesion=lmask
×
t1btseg1
[0072]
master100
‑
5,按照附录一中的解剖结构列表分别计算出各个脑部解剖结构的病灶区体积以及占比;假设解剖结构j,其对应体素在t1btseg1lesion中的值为j,病灶区在解剖结构 j的体积为:
[0073]
vlesionj=vvoxel
×
nbvoxellesionj
[0074]
nbvoxellesionj代表在t1btseg1lesion中体素值为j的体素个数;
[0075]
病灶区在解剖结构j的占比为:
[0076][0077]
其中,nbvoxelj代表在t1btseg1中体素值为j的体素个数;
[0078]
master100
‑
6,将lmask映射至t1btseg2,如下:
[0079]
t1btseg2lesion=lmask
×
t1btseg2
[0080]
master100
‑
7,按照附录二中的解剖结构列表分别计算出各个脑部解剖结构的病灶区体积以及占比;假设解剖结构k,其对应体素在t1btseg2lesion中的值为k,病灶区在解剖结构 k的体积为:
[0081]
vlesionk=vvoxel
×
nbvoxellesionk
[0082]
其中,nbvoxellesionk代表在t1btseg2lesion中体素值为k的体素个数;
[0083]
病灶区在解剖结构k的占比为:
[0084][0085]
其中,nbvoxelk代表在t1btseg2中体素值为k的体素个数。
[0086]
优选的,所述master200,具体包括:
[0087]
master200
‑
1,运用数学插值算法使mbt三维矩阵尺寸为256
×
256
×
256,并裁减至 160
×
192
×
224。以脑部组织的掩膜mbt为基础,利用开源软件vedo的源代码中的legosurface 模块勾勒出病人脑部的轮廓,mbt中拥有同一体素值的体素将在3d建模中用统一颜色展示,得到3d模型brainvolume;
[0088]
master200
‑
2,以master100
‑
4的映射结果t1btseg1lesion为基础,利用开源软件vedo 的源代码中的legosurface模块勾勒出病灶区所累及的解剖区域,t1btsegllesion中拥有同一体素值的体素将在3d建模中用统一颜色展示,得到3d模型segvolume;
[0089]
master200
‑
3,运用vedo的源代码中的shrink模块降低3d模型brainvolume的透明度,并将3d模型segvolume叠加显示在3d模型brainvolume上;
[0090]
master200
‑
4,以branch104
‑
8的病灶区掩膜lmask为基础,利用开源软件vedo的源代码中的legosurface模块勾勒出病灶区域,lmask中拥有同一体素值的体素将在3d建模中用统一颜色展示,得到3d模型lesionvolume;
[0091]
master200
‑
5,运用vedo的源代码中的shrink模块降低3d模型segvolume的透明度,并将3d模型lesionvolume叠加显示在3d模型segvolume上。
[0092]
本发明的有益效果如下:
[0093]
(1)本发明通过与神经内科临床知识紧密结合的特征工程大大提高人工智能模型的可解释性,提高临床医生的接纳度,更好地提高临床医生的工作效率,降低临床医生的工作强度;
[0094]
(2)本发明能基于急性缺血性脑卒中病人的临床核磁共振影像序列三维立体展示出病灶梗死核心区在各脑部解剖结构分区的分布形态以及精确快速计算出梗死区域在各脑部解剖结构的体积及占比。
[0095]
以下结合附图及实施例对本发明作进一步详细说明,但本发明的一种急性缺血性脑卒中病灶区的自动量化及三维建模方法不局限于实施例。
附图说明
[0096]
图1为本发明实施例的急性缺血性脑卒中病灶区的自动量化及三维建模方法的流程图;
[0097]
图2为附录一的解剖结构列表图;
[0098]
图3为附录二的解剖结构列表图;
[0099]
图4为在人机互动界面将病患rj含有病灶的切片放入圆圈的示意图;
[0100]
图5为病患rj病灶区域的信号最高点被算法识别并用圆圈标出;
[0101]
图6为随着医生逐渐增大延伸度变量pd,识别的病患rj的病灶区逐渐由高信号区向低信号区扩散的示意图;
[0102]
图7为病患rj的最终识别病灶区示意图;
[0103]
图8为在人机互动界面将多发梗死病患ws含有病灶的切片部分放入圆圈的示意图;
[0104]
图9为多发梗死病患ws病灶区域的信号最高点被算法识别并用圆圈标出;
[0105]
图10为随着医生逐渐增大延伸度变量pd,识别的病患ws的病灶区逐渐由高信号区
early ct score)评分系统(barber et al.,2000),病灶区在不同解剖结构中的分布情况间接反应了其在相应血管供血区域的分布情况,完整的解剖结构列表见图3 的附录二。
[0122]
(3)branch100以及branch200分支计算结果汇总至主干master,主干步骤可细分为以下步骤:
[0123]
·
master100:将branch104识别的病灶区域映射至branch202的两种脑部解剖结构分区图。我们将按照附录一和附录二中的解剖结构列表分别计算出各个脑部解剖结构的病灶区体积以及占比
[0124]
·
master200:基于master100附录一映射的结果进行三维建模,不同的解剖结构分区将会用不同的颜色标出,病灶区会被立体叠加在相应的脑部解剖结构分区上。
[0125]
一方面,本发明一种急性缺血性脑卒中病灶区的自动量化及三维建模方法通过与神经内科临床知识紧密结合的特征工程大大提高人工智能模型的可解释性,提高临床医生的接纳度,更好地提高临床医生的工作效率,降低临床医生的工作强度。
[0126]
具体的,传统的医疗大数据方法完全基于黑盒模型,导致了临床医生对方法的不信任和不采用。本发明方法与影像学、卒中发病机制、血管解剖学和脑部解剖学都有着紧密关联,具体如下:
[0127]
首先,在步骤branch103中,利用dwi和adc序列创建了新的磁共振弥散加权影像 (dwi adc combined diffusion sequence)以排除t2穿透效应的影响。由于t2的穿透效应, dwi序列上的高亮区并不一定是弥散受限区域(病灶区),而有可能是来源于t2的高信号。为了进一步确定dwi高亮区是否是病灶区,需要验证dwi高亮区所对应的adc序列值是否处在低信号范围。在基于dwi和adc序列创建的磁共振弥散加权影像上,只有同时在dwi 上拥有高信号值和在adc上拥有低信号值的区域才会显示出弥散受限的高信号。
[0128]
其次,在步骤branch104中,运用了自行开发的半自动化3d progression算法对梗死病灶区进行分割。该算法较好地结合了急性缺血性脑卒中的发病机制。急性缺血性脑卒中由脑动脉闭塞引起。脑动脉闭塞引起供血区缺血,超过一定时限后就会发生脑梗死。由于侧支循环的存在,由脑动脉闭塞引起的供血缺血区域仍可获得部分血液的供给,由此导致了不彻底的梗死病灶:梗死病灶区由其中心的核心梗死区(infarct core)和缺血半暗带(penumbra) 组成。半暗带周围还存在着良性灌注不足区域(benign oligemia)。缺血性血管病灶区由内向外,由核心梗死区向良性灌注不足区域,脑血流量(cerebral blood flow,cbf)依次升高 (bandera et al.,2006)。由此可以推断出在dwi adc combined diffusion sequence上,病灶区的信号强度应由内向外依次降低。此外,从数学图论的角度,每一个缺血性梗死病灶区都是沿着责任血管及其分支血管方向延伸的三维连通分量(connected component)。结合以上缺血性梗死病灶区的几何特点和由发病机制推导出的图像信号特点,该算法以dwi adccombined diffusion sequence上的病灶信号最高点作为三维连通分量的中心,向外低信号区逐渐延伸三维连通分量,直至三维连通分量完全覆盖信号异常区域。
[0129]
如下以一位后循环梗死的患者rj的脑部核磁共振影像为例来详细阐述了该算法的工作逻辑:在实际临床应用中,医生只需在本发明提供的人机互动电脑界面上将包含病灶区的切片部分放入图4所示的圆圈内。则本发明的算法会自动识别病灶区在三维立体空间中的信号最高点。患者rj的病灶信号最高点出现在如图5所示第二张切片的圆圈区域。
[0130]
接着,医生可通过在人机互动界面上调整单一数值延伸度变量progression degree(pd) 使病灶三维连通分量由最高信号向外低信号区逐渐延伸。参见图6所示,随着pd数值的增大,识别病灶区逐渐由中心的核心梗死区逐渐向缺血半暗带以及良性灌注不足区域延伸。参见图7所示,当三维连通分量完全覆盖信号异常区域时,医生可停止调整pd变量,病灶识别完成。
[0131]
如病人只有单一三维连通分量立体病灶(常见于由大动脉粥样硬化引起的梗死),医生通过不断增大pd数值即可使识别区域覆盖所有病灶区。如病人有多个独立的三维连通分量立体病灶(常见于心源性梗死),单纯不断增大pd数值会使识别区域覆盖不同立体病灶区之间的正常脑部组织。因此当pd值的增高使识别区域覆盖正常脑组织时,临床医生只需在人机界面上点击“下一独立病灶识别”,系统便会自动识别剩余红色方框内圆圈内的信号最高点,并重复上述识别工作,图8至图14以一位多发梗死病患ws为例,详细阐述了此过程。
[0132]
最后,在branch202中,本发明模拟aspects评分对脑部进行血管供血区量化分区,病灶区在不同解剖结构中的分布情况间接反应了其在相应血管供血区域的分布情况。目前为止较常见的脑部分区量化(brain atlases)一般基于脑部传统解剖结构或是功能分区,比如现在公开的brain atlases数据集2012miccai multi
‑
atlas labeling challenge data或是 hammers adult atlases。版本发明依据脑血管病的特点自行设计了依据aspects评分的脑部血管供血区量化分区。该血管供血区量化分区图能容纳进病人的责任血管相关发病信息,符合脑血管病临床诊断治疗的逻辑。
[0133]
另一方面,本发明一种急性缺血性脑卒中病灶区的自动量化及三维建模方法,能基于急性缺血性脑卒中病人的临床核磁共振影像序列三维立体展示出病灶梗死核心区在各脑部解剖结构分区的分布形态以及精确快速计算出梗死区域在各脑部解剖结构的体积及占比。
[0134]
以下为基于图8中急性缺血性脑卒中病人ws案例所做实验。
[0135]
利用本发明提供的方法,基于病人的原始mri二维图像,生成了可多角度观看的三维病灶立体分区图(如图15所示),3d图中不同脑部解剖区域用不同颜色标出,其中标有颜色的不规则整块状几何体即为算法自动识别并3d呈现出的核心病灶区。本发明方法还计算出了以下量化指标:患者总梗死体积为4.87立方厘米。
[0136]
按照附录一中传统解剖结构分区,一侧小脑灰质梗死体积为2.63立方厘米,占一侧小脑灰质总体积4.79%;一侧小脑白质梗死体积为0.64立方厘米,占一侧小脑灰质总体积3.50%;脑干梗死体积为1.60立方厘米,占小脑干总体积6.10%。
[0137]
按照附录二中依据血管供血区分区,一侧小脑半球梗死体积为3.27立方厘米,占一侧小脑半球总体积4.48%;脑桥梗死体积为1.60立方厘米,占脑桥总体积6.10%。
[0138]
以上方法在计算机(配置为processor 2.6ghz,intel core i5,memory 8go 1600mhzddr3)上的运行速度为150秒。
[0139]
同时,临床医生(三年神经内科临床经验)应用3d slicer软件重新评估了此患者的影像。人工勾画出的病灶区与计算机自动勾画病灶区在不同解剖/血管分区的平均dice score为 0.910。人工勾画病灶区以及计算上述量化指标所花时间为24分钟(1440秒)。
[0140]
为了进一步量化衡量本发明的性能,本发明从医院采集了185名急性缺血性脑卒中病人在进行溶栓治疗前的mri图像。所有病人的敏感个人信息均已由医院方面匿名化处
理,并且该数据采集过程得到了医院伦理委员会的审批。在185名患者中,68%为大脑前循环供血区域梗死,28%为大脑后循环供血区域梗死,4%为分水岭pca
‑
mca梗死。
[0141]
本发明旨在在尽可能短的时间窗内三维立体展示出病灶区在各脑部解剖结构分区的分布形态以及精确快速计算出病灶区域在各脑部解剖结构的体积及占比。因此评价模型的指标应由模型运行时间和病灶区域在各脑部部解剖结构的体积及占比的计算精确度组成。本发明设计了如下评价指标:
[0142]
假设对m(185)位患者的脑部头像分割成n(29,附录一中的12和附录二中的17) 个脑部解剖结构分区(分区描述见branch202步骤描述),p为患者集合,s
i
为i患者解剖结构分区的集合:
[0143]
p={p
i
}i∈[0,m
‑
1]
[0144]
s
i
={s
ij
}j∈[0,n
‑
1]
[0145]
l
ij
值为1如果人工判断患者i的病灶区域出现在解剖结构j中,反之值为0;segm
ij
表示人工运用传统方法标记出的所有患者i解剖结构j中的病灶区的像素的集合;sega
ij
表示运用本发明标记出的所有患者i解剖结构j中的病灶区的像素的集合;tm
i
为临床医生通过3d slicer软件对病人的病灶图像进行三维建模和精准量化分区计算的时间(以秒为单位);ta
i
为运用本发明对病人的病灶图像进行三维建模和精准量化分区计算的时间(以秒为单位);
[0146]
将人工运用传统方法计算的结果均视为金标准,定义:
[0147][0148][0149]
对于每一位患者图像处理的评估,定义:
[0150][0151][0152]
dci表示对于病人i,人工标记梗死区域和运用算法标记的病灶区域在各脑部部解剖结构的平均重叠度。tpenalty
i
为时间惩罚项;performance
i
∈[
‑
1,1]。理想状态下performance
i
达到最大值1,此时dc
i
为1而tpenalty
i
为0,即代表在无限趋近于0秒的时间内,本发明的模型计算出了与金标准相同的病灶分区量化结果。反之,如果performance
i
越趋近于
‑
1,则说明模型的综合评价指标结果不理想。
[0153]
将本发明方法运用到了数据集进行测评,实验结果如表1所示,实验数据格式为 mean
±
sd。
[0154]
表1
[0155][0156]
由实验结果可知,当病灶区位于后循环时算法综合评价指标最理想。由于相比于后循环供血区域,前循环供血区域解剖结构较复杂,因此算法的dc值低于后循环dc值,导致了算法整体的评价指标较后循环评价指标稍差。
[0157]
应当理解的是,对本领域普通技术人员来说,可以根据上述说明加以改进与变换,而所有这些改进与变化都应属于本发明所附权利要求的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1