结直肠癌IHC染色图肿瘤浸润前沿的免疫分级方法、系统和存储介质与流程
结直肠癌ihc染色图肿瘤浸润前沿的免疫分级方法、系统和存储介质
技术领域
1.本发明属于数字图像处理的技术领域,具体涉及一种结直肠癌ihc染色图肿瘤浸润前沿的免疫分级方法、系统和存储介质。
背景技术:
2.结直肠癌是第三大常见恶性肿瘤,伴随着高发病率和高死亡率。在恶性肿瘤癌变时,会导致肿瘤微环境发生变化。肿瘤浸润淋巴细胞是实体瘤免疫微环境的重要组成部分,可以预测实体瘤的预后和治疗效果。cd3、cd8可作为结直肠癌预后评价的标志物。如果能够比较ihc染色图的肿瘤浸润前沿区域和肿瘤中心的cd3、cd8阳性细胞的密度与患者预后评价的关系,只进行重点区域分析就可以达到与分析整张切片同样的效果。选择肿瘤浸润前沿区域和肿瘤中心cd3阳性细胞或cd8阳性细胞中具有较强预后价值的可用变量,可以简化以往评价染色图中所有组织区域cd3、cd8阳性细胞的方式,可以极大的减少病理医生的工作量和患者的支出,提高工作效率。
技术实现要素:
3.本发明的主要目的在于克服现有技术的缺点与不足,提供一种结直肠癌ihc染色图肿瘤浸润前沿的免疫分级方法、系统和存储介质,本发明可以根据结直肠癌患者的ihc染色图,自动计算出肿瘤浸润前沿区域基于t淋巴细胞的免疫分级。
4.为了达到上述目的,本发明采用以下技术方案:
5.第一方面,本发明提供了一种结直肠癌ihc染色图肿瘤浸润前沿的免疫分级方法,包括下述步骤:
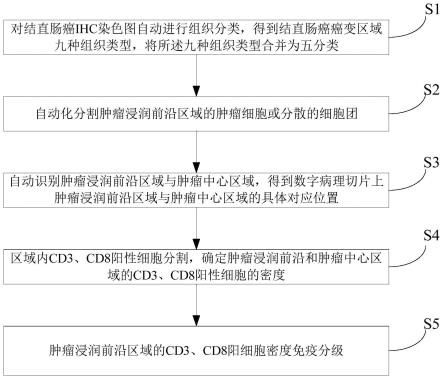
6.s1、对结直肠癌ihc染色图自动进行组织分类,得到结直肠癌癌变区域九种组织类型,将所述九种组织类型合并为五分类;所述九种组织类型包括肿瘤上皮、肿瘤间质、肿瘤坏死、粘液、肌肉、正常腺体、淋巴聚集体、脂肪和背景;所述五分类包括肿瘤区域、正常区域、腺体区域、其他和背景区域;
7.s2、自动化分割肿瘤浸润前沿区域的肿瘤细胞或分散的细胞团,所述肿瘤浸润前沿区域是指肿瘤区域与正常区域重叠的区域;
8.s3、自动识别肿瘤浸润前沿区域与肿瘤中心区域,得到数字病理切片上肿瘤浸润前沿区域与肿瘤中心区域的具体对应位置;
9.s4、区域内cd3、cd8阳性细胞分割,确定肿瘤浸润前沿和肿瘤中心区域的cd3、cd8阳性细胞的密度,为评估指标的预后奠定基础;
10.s5、肿瘤浸润前沿区域的cd3、cd8阳细胞密度免疫分级,根据肿瘤浸润前沿区域cd3、cd8阳细胞的密度确定结直肠癌患者的免疫分级,所述免疫分级为免疫高级和免疫低级。
11.作为优选的技术方案,所述步骤s1具体为:
12.s11、获得标注了肿瘤上皮、肿瘤间质、肿瘤坏死、粘液、肌肉、正常腺体、淋巴聚集体、脂肪和背景的ihc染色图和未标注的ihc染色图;
13.s12、利用已标注的ihc染色图和未标注的ihc染色图来训练分类器,分类器通过对滑动窗口进行分类的方式得到九种组织类型的分割图;
14.s13、为确定肿瘤浸润前沿区域,对九种组织类型的分割图进行合并,得到肿瘤区域、正常区域、腺体区域、其他和背景区域五分类;所述肿瘤区域包括肿瘤坏死、肿瘤间质和肿瘤上皮区域、粘液;所述正常区域包括脂肪和肌肉;所述腺体区域包括正常腺体;所述其他区域包括淋巴聚集体;所述背景区域包括背景。
15.作为优选的技术方案,所述步骤s2具体为:
16.s21、将五分类的ihc染色图由rgb图像转换为灰度图像;
17.s22、采用二维高斯平滑对灰度图像进行滤波,以减少图像噪声和细节;
18.s23、使用otsu方法确定全局阈值,设置一个最小值0和最大值255,该otsu方法自动寻找最优的阈值进行计算;对所述灰度图像进行二值化处理,将二值化处理后的图像分为黑色背景和白色感兴趣区域,根据像素面积大小计算各连通域的面积并按从大到小的顺序进行排列,保留最显著的区域作为感兴趣区域;
19.s24、在保持二值化处理后的黑白图像整体位置和形状不变的情况下,采用膨胀和腐蚀的形态闭合操作对二值化处理后的黑白图像中的小裂缝进行填充,有效去除孤立的小点,毛刺,平滑边界;
20.s25、取肿瘤区域与正常组织区域的重叠的区域为肿瘤浸润前沿。
21.作为优选的技术方案,步骤s3具体为:
22.将肿瘤区域与正常组织区域经扩张和侵蚀的形态学闭合操作,经过膨胀求局部最大值,首先定义一个卷积核b1,且拥有一个单独定义出来的参考点,将卷积核b1与图像a1进行卷积,计算卷积核b1覆盖区域的像素最大值,将这个最大值赋值给参考点指定的像素,;然后进行腐蚀操作,定义一个卷积核b2,且拥有一个单独定义出来的参考点.将卷积核b2与图像a2进行卷积,计算卷积核b2覆盖区域的像素最小值,将这个最小值赋值给参考点指定的像素;最后自动化确定上述两部分重叠的部分。
23.作为优选的技术方案,步骤s4所述区域内cd3、cd8阳性细胞分割前,还包括下述步骤:
24.将已进行形态学闭合操作后的图像,经过颜色反卷积后的dab通道图像i
dab
单独分离,对其使用标准差为σ的二维高斯平滑核对图像进行滤波,得到高斯模糊后的灰度图像i
dab2
,使用掩膜,得到去除背景区域的灰度图像i
dab3
。
25.作为优选的技术方案,所述区域内cd3、cd8阳性细胞分割具体为:
26.s41、使用步进局部阈值分割方法对i
dab3
图像中细胞核进行分割,初始窗口宽度w设为77像素,预设的对比度阈值td设为15,对i
dab3
进行二值化处理,得到二值化掩膜m1,使用m1对i
dab2
掩膜操作得到i
dab4
,对于m1内的所有连通域提取形态学特征:像素面积和紧凑度;对于i
dab4
提取灰度特征:均值与对比度;设置第一次分割条件为:像素面积小于200,或对比度小于0.04,或灰度均值大于200的连通域,接着,将像素面积小于2000,紧凑度大于0.93的连通域保存为n1,对于不符合条件的连通域保存为m2,进行下一步的分割;
27.s42、第二次分割;若m2为空,则跳过该步骤,并将m2所有像素点值设为0,若m2不为
空,使用m2对idab2进行掩膜操作,得到i
dab5
,调整局部窗的大小w为47像素,对比度阈值保持不变,进行局部阈值分割,得到m3;对m3使用带有前景标记的分水岭算法进行分割,极小值参数h设为3,得到m4,重复形态学特征分割步骤,保留紧凑度大于0.95且面积小于1000像素点的连通域保存为n2,对不符合条件的连通域保存为m5;
28.s43、第三次分割,若m5为空,则跳过该步骤,并将n3所有像素点值设为0,若m5不为空,则对m5重复上一步骤的操作,不同之处在于:bernsen分割的局部窗大小w设为17像素,带有前景标记的分水岭算法中极小值h设为1,略过形态学操作,得到n3,最终得到的免疫细胞的二值结果为:n
dab
=n1|n2|n3。
29.作为优选的技术方案,步骤s5中,所述肿瘤浸润前沿cd3、cd8阳细胞密度免疫分级,具体为:
30.s51、计算肿瘤浸润前沿区域cd3、cd8阳性细胞数量,并对结果进行归一化,d’=(d
i-d
min
)/(d
max-d
min
),di为某个结直肠癌患者ihc染色图经过归一化的得分,d
max
和d
min
分别为队列中结直肠癌患者ihc染色图经过归一化后的得分最大值和得分最小值;
31.s52、在评价细胞密度变量的预测性能时,保持变量的连续性,以避免结果受到截止设置的影响,通过患者的生存状态、年龄、性别、生存期os的指标建立cox比例风险模型计算各变量模型预测os的风险比,同时采用pearson相关分析、多因素和单因素logistic回归分析,选取数量特征p《0.05进行数据评估,两组之间的比较采用x2检验,采取二分类和三分类的方法确定最佳截断点;
32.s53、免疫分级;根据步骤s52中确定的二分类最佳截断点,将肿瘤浸润前沿区域内cd3、cd8阳性细胞数,为cd
ct-high和cd
ct-low两组,对队列中的所有患者进行免疫分级,若患者ihc染色图中肿瘤浸润前沿区域内cd3、cd8阳性细胞数低于截断点则为组别cd
ct-low,若患者ihc染色图中肿瘤浸润前沿区域内cd3、cd8阳性细胞数高于截断点则为组别cd
ct-high;根据步骤s52中确定的三分类的两个最佳截断点,将肿瘤浸润前沿区域内cd3、cd8阳性细胞数分为cd
ct-high、cd
ct-intermediate、cd
ct-low三组,若患者ihc染色图中肿瘤浸润前沿区域内cd3、cd8阳性细胞数低于第一个截断点则为组别cd
ct-low,若患者ihc染色图中肿瘤浸润前沿区域内cd3阳性细胞数低于第一个截断点小于第二个截断点则为组别cd
ct-intermediate,若患者ihc染色图中肿瘤浸润前沿区域内cd3、cd8阳性细胞数高于第二个截断点则为组别cd
ct-high。
33.第二方面,本发明还提供了一种结直肠癌ihc染色图肿瘤浸润前沿的免疫分级系统,包括组织分类模块、区域分割模块、区域识别模块、细胞分割模块和免疫分级模块;
34.所述组织分类模块,用于对结直肠癌ihc染色图自动进行组织分类,得到结直肠癌癌变区域九种组织类型,将所述九种组织类型合并为五分类;所述九种组织类型包括肿瘤上皮、肿瘤间质、肿瘤坏死、粘液、肌肉、正常腺体、淋巴聚集体、脂肪和背景;所述五分类包括肿瘤区域、正常区域、腺体区域、其它和背景区域;
35.所述区域分割模块,自动化分割肿瘤浸润前沿区域的肿瘤细胞或分散的细胞团,所述肿瘤浸润前沿区域是指肿瘤区域与正常区域重叠的区域;
36.所述区域识别模块,用于自动识别肿瘤浸润前沿区域与肿瘤中心区域,得到数字病理切片上肿瘤浸润前沿区域与肿瘤中心区域的具体对应位置;
37.所述细胞分割模块,用于区域内cd3、cd8阳性细胞分割,确定肿瘤浸润前沿和肿瘤
中心区域的cd3、cd8阳性细胞的密度,为评估指标的预后奠定基础;
38.所述免疫分级模块,用于肿瘤浸润前沿cd3、cd8阳细胞密度免疫分级,根据肿瘤浸润前沿cd3、cd8阳细胞的密度确定结直肠癌患者的免疫分级,所述免疫分级为免疫高级和免疫低级。
39.第三方面,本发明还提供了一种电子设备,所述电子设备包括:
40.至少一个处理器;以及,
41.与所述至少一个处理器通信连接的存储器;其中,
42.所述存储器存储有可被所述至少一个处理器执行的计算机程序指令,所述计算机程序指令被所述至少一个处理器执行,以使所述至少一个处理器能够执行所述的结直肠癌ihc染色图肿瘤浸润前沿的免疫分级方法。
43.第四方面,本发明还提供了一种计算机可读存储介质,存储有程序,其特征在于,所述程序被处理器执行时,实现所述的结直肠癌ihc染色图肿瘤浸润前沿的免疫分级方法。
44.本发明与现有技术相比,具有如下优点和有益效果:
45.1)本发明可以精准分割出肿瘤浸润前沿区域和肿瘤区域,为后续的人工分析和自动分析提供基础。
46.2)本发明通过横向比较肿瘤浸润前沿区域和肿瘤中心区域cd3、cd8相关变量,确定出肿瘤浸润前沿区域cd3、cd8阳性细胞密度的免疫分级可以作为独立于tnm分期的一个新预后因素。
47.3)本发明提出的肿瘤浸润前沿区域cd3、cd8阳性细胞密度,结合临床数据,对患者的无病生存期做预后分析,与不加入本发明提出的预后因素相比,相对应模型的c-index有显著性提高,与cd3和cd8阳性细胞结合分析的模型结果值相近。肿瘤浸润前沿区域cd3、cd8阳性细胞密度可以预测患者生存,其中密度高的cd
ct-high与更长的生存期紧密相关,密度低的cd
ct-low与较短的生存期紧密相关。
附图说明
48.为了更清楚地说明本技术实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
49.图1为本发明实施例结直肠癌ihc染色图肿瘤浸润前沿的免疫分级方法的流程图;
50.图2为本发明实施例结直肠癌ihc染色图肿瘤浸润前沿的免疫分级系统的方框图。
51.图3为本发明实施例电子设备的结构图。
具体实施方式
52.为了使本技术领域的人员更好地理解本技术方案,下面将结合本技术实施例中的附图,对本技术实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
53.在本技术中提及“实施例”意味着,结合实施例描述的特定特征、结构或特性可以
包含在本技术的至少一个实施例中。在说明书中的各个位置出现该短语并不一定均是指相同的实施例,也不是与其它实施例互斥的独立的或备选的实施例。本领域技术人员显式地和隐式地理解的是,本技术所描述的实施例可以与其它实施例相结合。
54.如图1所示,本实施例一种结直肠癌ihc染色图肿瘤浸润前沿的免疫分级方法,包括下述步骤:
55.s1、ihc染色图自动进行组织分类,得到结直肠癌癌变区域九种组织类型,在此基础上将九种组织类型细分、合并为五大类。
56.进一步的,所述癌变区域的九分类和五分类步骤具体为:
57.s1.1、获得标注了肿瘤上皮、肿瘤间质、肿瘤坏死、粘液、肌肉、正常腺体、淋巴聚集体、脂肪和背景的ihc染色图和未标注的ihc染色图。
58.s1.2、利用上述标注和未标注的图来训练分类器,分类器通过对滑动窗口进行分类的方式得到九种组织类型的分割图。
59.s1.3、为确定肿瘤浸润前沿区域,对九种组织类型的分割图进行合并,得到肿瘤区域、正常区域、腺体区域、其他和背景区域五分类;所述肿瘤区域包括肿瘤坏死、肿瘤间质和肿瘤上皮区域、粘液;所述正常区域包括脂肪和肌肉;所述腺体区域包括正常腺体;所述其他区域包括淋巴聚集体;所述背景区域包括背景。
60.s2、自动化分割肿瘤浸润前沿区域的肿瘤细胞或分散的细胞团,所述肿瘤浸润前沿区域是指肿瘤区域与正常区域重叠的区域。
61.进一步的,肿瘤浸润前沿区域与肿瘤中心自动识别的具体步骤如下:
62.s2.1、将五分类的染色图转换,由rgb图像转换为灰度图像。
63.s2.2、采用标准偏差为10的二维高斯平滑对灰度图像进行滤波,以减少图像噪声和细节。
64.s2.3、使用otsu方法确定全局阈值,对上一步骤所得图像进行二值化,将图像分为黑色背景和白色感兴趣区域。根据像素面积大小计算各连通域的面积并进行排列,保留最显著的区域作为感兴趣区域。
65.更为具体的,设置一个最小值0和最大值255,该otsu方法自动寻找最优的阈值进行计算;对所述灰度图像进行二值化处理,将二值化处理后的图像分为黑色背景和白色感兴趣区域,根据像素面积大小计算各连通域的面积并按从大到小的顺序进行排列,保留最显著的区域作为感兴趣区域。
66.s2.4、在保持二值化处理后的黑白图像整体位置和形状不变的情况下,采用膨胀和腐蚀的形态闭合操作对二值化处理后的黑白图像中的小裂缝进行填充,有效去除孤立的小点,毛刺,平滑边界。
67.s2.5、取肿瘤区域与正常组织区域的重叠的区域为肿瘤浸润前沿。
68.s3、自动识别肿瘤浸润前沿区域与肿瘤中心区域,得到数字病理切片上肿瘤浸润前沿区域与肿瘤中心区域的具体对应位置,具体为:
69.s31、将肿瘤区域与正常组织区域经扩张和侵蚀的形态学闭合操作,经过膨胀求局部最大值,首先定义一个卷积核b,且拥有一个单独定义出来的参考点。将核b与图像a进行卷积,计算核b覆盖区域的像素最大值,将这个最大值赋值给参考点指定的像素。其计算公
式为:
70.s32、然后进行腐蚀操作,定义一个卷积核b,且拥有一个单独定义出来的参考点。将核b与图像a进行卷积,计算核b覆盖区域的像素最小值,将这个最小值赋值给参考点指定的像素。其计算公式为:
71.s33、自动化确定上述两部分重叠的部分,示例性的,本实施例所述肿瘤浸润前沿宽度为500μm。
72.s4、区域内cd3、cd8阳性细胞分割;确定肿瘤浸润前沿和肿瘤中心的cd3、cd8阳性细胞的密度,为评估指标的预后奠定基础。
73.细胞核分割前预处理的具体步骤如下:
74.s4.1、将图像经过颜色反卷积后的dab通道图像i
dab
单独分离,对其使用标准差为σ的二维高斯平滑核对图像进行滤波(σ=3),得到高斯模糊后的灰度图像i
dab2
。使用掩膜,得到去除背景区域的灰度图像i
dab3
。
75.肿瘤浸润前沿和肿瘤中心区域的cd3、cd8阳性细胞分割具体步骤如下:
76.s4.2、使用步进局部阈值分割方法对i
dab3
图像中细胞核进行分割。初始窗口宽度w设为77像素,预设的对比度阈值td设为15,对i
dab3
执行bernsen算法后,得到二值化掩膜m1,使用m1对i
dab2
掩膜操作得到i
dab4
;对于m1内的所有连通域提取形态学特征:像素面积和紧凑度;对于i
dab4
提取灰度特征:均值与对比度;设置条件为:像素面积小于200,或对比度小于0.04,或灰度均值大于200的连通域;接着,将像素面积小于2000,紧凑度大于0.93的连通域保存为n1。对于不符合条件的连通域,保存为m2,进行下一步的分割。
77.s4.3、第二次分割;若m2为空(即所有像素点均为背景),则跳过该步骤,并将m2所有像素点值设为0。若m2不为空,使用m2对idab2进行掩膜操作,得到i
dab5
。调整局部窗的大小w为47像素,对比度阈值保持不变,进行局部阈值分割,得到m3。对m3使用带有前景标记的分水岭算法进行分割,极小值参数h设为3,得到m4。重复形态学特征分割步骤,保留紧凑度大于0.95且面积小于1000像素点的连通域,保存为n2。对不符合条件的连通域,保存为m5。
78.s4.4、第三次分割。若m5为空,则跳过该步骤,并将n3所有像素点值设为0。若m5不为空,则对m5重复上一步骤的操作,不同之处在于:bernsen分割的局部窗大小w设为17像素,带有前景标记的分水岭算法中极小值h设为1,略过形态学操作,得到n3,最终得到的免疫细胞的二值结果为:n
dab
=n1|n2|n3。
79.s5、肿瘤浸润前沿区域cd3阳细胞密度免疫分级;根据肿瘤浸润前沿区域cd3阳细胞的密度确定结直肠癌患者的免疫分级,所述免疫分级为免疫高级和免疫低级。
80.进一步的,肿瘤浸润前沿区域cd3阳细胞密度免疫分级的方法和cd8阳细胞密度免疫分级的方法相同,下面以肿瘤浸润前沿区域cd3阳细胞密度免疫分级为例进行说明,具体方法如下:
81.s5.1、计算肿瘤浸润前沿区域cd3阳性细胞数量,并对结果进行归一化,d’=(d
i-d
min
)/(d
max-d
min
),di为某个结直肠癌患者ihc染色图经过归一化的得分,d
max
和d
min
分别为队列中结直肠癌患者ihc染色图经过归一化后得分最大值和得分最小值。
82.s5.2、在评价细胞密度变量的预测性能时,保持变量的连续性,以避免结果受到截止设置的影响。通过患者的生存状态、年龄、性别、生存期os等指标建立cox比例风险模型计
算各变量模型预测os的风险比,同时采用pearson相关分析、多因素和单因素logistic回归分析,选取数量特征p《0.05进行数据评估。两组之间的比较采用x2检验,采取二分类和三分类的方法确定最佳截断点。
83.s5.3、根据s5.2中确定的二分类最佳截断点,将肿瘤浸润前沿区域内cd3阳性细胞数,分为cd3
ct-high和cd3
ct-low两组,对队列中的所有患者进行免疫分级,若患者ihc染色图中肿瘤浸润前沿区域内cd3阳性细胞数低于截断点则为组别cd3
ct-low,若患者ihc染色图中肿瘤浸润前沿内cd3阳性细胞数高于截断点则为组别cd3
ct-high。根据s5.2中确定的三分类的两个最佳截断点,将肿瘤浸润前沿区域内cd3阳性细胞数分为cd3
ct-high、cd3
ct-intermediate、cd3
ct-low三组。若患者ihc染色图中肿瘤浸润前沿区域内cd3阳性细胞数低于第一个截断点则为组别cd3
ct-low,若患者ihc染色图中肿瘤浸润前沿区域内cd3阳性细胞数低于第一个截断点小于第二个截断点则为组别cd3
ct-intermediate,若患者ihc染色图中肿瘤浸润前沿区域内cd3阳性细胞数高于第二个截断点则为组别cd3
ct-high。
84.可以理解的是,cd8阳细胞密度免疫分级的方法与上述cd3阳细胞密度免疫分级的方法相同,在此不再赘述。
85.将本方案在中山大学第六附属医院的验证集进行重复上述操作,得到结果与训练集结果一致。
86.需要说明的是,对于前述的各方法实施例,为了简便描述,将其都表述为一系列的动作组合,但是本领域技术人员应该知悉,本发明并不受所描述的动作顺序的限制,因为依据本发明,某些步骤可以采用其它顺序或者同时进行。
87.基于与上述实施例中的结直肠癌ihc染色图肿瘤浸润前沿的免疫分级方法相同的思想,本发明还提供了结直肠癌ihc染色图肿瘤浸润前沿的免疫分级系统,该系统可用于执行上述结直肠癌ihc染色图肿瘤浸润前沿的免疫分级方法。为了便于说明,结直肠癌ihc染色图肿瘤浸润前沿的免疫分级系统实施例的结构示意图中,仅仅示出了与本发明实施例相关的部分,本领域技术人员可以理解,图示结构并不构成对装置的限定,可以包括比图示更多或更少的部件,或者组合某些部件,或者不同的部件布置。
88.请参阅图2,在本技术的另一个实施例中,提供了一种结直肠癌ihc染色图肿瘤浸润前沿的免疫分级系统100,该系统包括组织分类模块101、区域分割模块102、区域识别模块103、细胞分割模块104和免疫分级模块105;
89.所述组织分类模块101,用于对结直肠癌ihc染色图自动进行组织分类,得到结直肠癌癌变区域九种组织类型,将所述九种组织类型合并为五分类;所述九种组织类型包括肿瘤上皮、肿瘤间质、肿瘤坏死、粘液、肌肉、正常腺体、淋巴聚集体、脂肪和背景;所述五分类包括肿瘤区域、正常区域、腺体区域、其它和背景区域;
90.所述区域分割模块102,自动化分割肿瘤浸润前沿区域的肿瘤细胞或分散的细胞团,所述肿瘤浸润前沿区域是指肿瘤区域与正常区域重叠的区域;
91.所述区域识别模块103,用于自动识别肿瘤浸润前沿区域与肿瘤中心区域,得到数字病理切片上肿瘤浸润前沿区域与肿瘤中心区域的具体对应位置;
92.所述细胞分割模块104,用于区域内cd3、cd8阳性细胞分割,确定肿瘤浸润前沿和肿瘤中心区域的cd3、cd8阳性细胞的密度,为评估指标的预后奠定基础;
93.所述免疫分级模块105,用于肿瘤浸润前沿cd3、cd8阳细胞密度免疫分级,根据肿
瘤浸润前沿cd3、cd8阳细胞的密度确定结直肠癌患者的免疫分级,所述免疫分级为免疫高级和免疫低级。
94.需要说明的是,本发明的结直肠癌ihc染色图肿瘤浸润前沿的免疫分级系统与本发明的结直肠癌ihc染色图肿瘤浸润前沿的免疫分级方法一一对应,在上述结直肠癌ihc染色图肿瘤浸润前沿的免疫分级方法的实施例阐述的技术特征及其有益效果均适用于结直肠癌ihc染色图肿瘤浸润前沿的免疫分级系统的实施例中,具体内容可参见本发明方法实施例中的叙述,此处不再赘述,特此声明。
95.此外,上述实施例的结直肠癌ihc染色图肿瘤浸润前沿的免疫分级系统的实施方式中,各程序模块的逻辑划分仅是举例说明,实际应用中可以根据需要,例如出于相应硬件的配置要求或者软件的实现的便利考虑,将上述功能分配由不同的程序模块完成,即将所述结直肠癌ihc染色图肿瘤浸润前沿的免疫分级系统的内部结构划分成不同的程序模块,以完成以上描述的全部或者部分功能。
96.请参阅图3,在一个实施例中,提供了一种结直肠癌ihc染色图肿瘤浸润前沿的免疫分级方法的电子设备,所述电子设备200可以包括第一处理器201、第一存储器202和总线,还可以包括存储在所述第一存储器202中并可在所述第一处理器201上运行的计算机程序,如结直肠癌ihc染色图肿瘤浸润前沿的免疫分级分级程序203。
97.其中,所述第一存储器202至少包括一种类型的可读存储介质,所述可读存储介质包括闪存、移动硬盘、多媒体卡、卡型存储器(例如:sd或dx存储器等)、磁性存储器、磁盘、光盘等。所述第一存储器202在一些实施例中可以是电子设备200的内部存储单元,例如该电子设备200的移动硬盘。所述第一存储器202在另一些实施例中也可以是电子设备200的外部存储设备,例如电子设备200上配备的插接式移动硬盘、智能存储卡(smart media card,smc)、安全数字(securedigital,sd)卡、闪存卡(flash card)等。进一步地,所述第一存储器202还可以既包括电子设备200的内部存储单元也包括外部存储设备。所述第一存储器202不仅可以用于存储安装于电子设备200的应用软件及各类数据,例如结直肠癌ihc染色图肿瘤浸润前沿的免疫分级程序203的代码等,还可以用于暂时地存储已经输出或者将要输出的数据。
98.所述第一处理器201在一些实施例中可以由集成电路组成,例如可以由单个封装的集成电路所组成,也可以是由多个相同功能或不同功能封装的集成电路所组成,包括一个或者多个中央处理器(central processing unit,cpu)、微处理器、数字处理芯片、图形处理器及各种控制芯片的组合等。所述第一处理器201是所述电子设备的控制核心(control unit),利用各种接口和线路连接整个电子设备的各个部件,通过运行或执行存储在所述第一存储器202内的程序或者模块,以及调用存储在所述第一存储器202内的数据,以执行电子设备200的各种功能和处理数据。
99.图3仅示出了具有部件的电子设备,本领域技术人员可以理解的是,图3示出的结构并不构成对所述电子设备200的限定,可以包括比图示更少或者更多的部件,或者组合某些部件,或者不同的部件布置。
100.所述电子设备200中的所述第一存储器202存储的结直肠癌ihc染色图肿瘤浸润前沿的免疫分级程序203是多个指令的组合,在所述第一处理器201中运行时,可以实现:
101.s1、对结直肠癌ihc染色图自动进行组织分类,得到结直肠癌癌变区域九种组织类
型,将所述九种组织类型合并为五分类;所述九种组织类型包括肿瘤上皮、肿瘤间质、肿瘤坏死、粘液、肌肉、正常腺体、淋巴聚集体、脂肪和背景;所述五分类包括肿瘤区域、正常区域、腺体区域、其他和背景区域;
102.s2、自动化分割肿瘤浸润前沿区域的肿瘤细胞或分散的细胞团,所述肿瘤浸润前沿区域是指肿瘤区域与正常区域重叠的区域;
103.s3、自动识别肿瘤浸润前沿区域与肿瘤中心区域,得到数字病理切片上肿瘤浸润前沿区域与肿瘤中心区域的具体对应位置;
104.s4、区域内cd3、cd8阳性细胞分割,确定肿瘤浸润前沿和肿瘤中心区域的cd3、cd8阳性细胞的密度,为评估指标的预后奠定基础;
105.s5、肿瘤浸润前沿区域的cd3、cd8阳细胞密度免疫分级,根据肿瘤浸润前沿区域cd3、cd8阳细胞的密度确定结直肠癌患者的免疫分级,所述免疫分级为免疫高级和免疫低级。
106.进一步地,所述电子设备200集成的模块/单元如果以软件功能单元的形式实现并作为独立的产品销售或使用时,可以存储在一个非易失性计算机可读取存储介质中。所述计算机可读介质可以包括:能够携带所述计算机程序代码的任何实体或装置、记录介质、u盘、移动硬盘、磁碟、光盘、计算机存储器、只读存储器(rom,read-only memory)。
107.本领域普通技术人员可以理解实现上述实施例方法中的全部或部分流程,是可以通过计算机程序来指令相关的硬件来完成,所述的程序可存储于一非易失性计算机可读取存储介质中,该程序在执行时,可包括如上述各方法的实施例的流程。其中,本技术所提供的各实施例中所使用的对存储器、存储、数据库或其它介质的任何引用,均可包括非易失性和/或易失性存储器。非易失性存储器可包括只读存储器(rom)、可编程rom(prom)、电可编程rom(eprom)、电可擦除可编程rom(eeprom)或闪存。易失性存储器可包括随机存取存储器(ram)或者外部高速缓冲存储器。作为说明而非局限,ram以多种形式可得,诸如静态ram(sram)、动态ram(dram)、同步dram(sdram)、双数据率sdram(ddrsdram)、增强型sdram(esdram)、同步链路(synchlink)dram(sldram)、存储器总线(rambus)直接ram(rdram)、直接存储器总线动态ram(drdram)、以及存储器总线动态ram(rdram)等。
108.以上实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
109.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1