生物瓣膜的外观检测方法及系统、设计方法、计算机存储介质与流程
本发明涉及医疗,特别涉及一种生物瓣膜的外观检测方法及系统、设计方法、计算机存储介质。
背景技术:
1、心脏瓣膜的病变将损害血液动力学性能,影响人体正常的血液循环。自从1960年采用人工瓣膜置换原生病变瓣膜的手术成功后,已有上千万的患者进行了心脏瓣膜置换手术,寿命得以延长。相较于人工机械瓣膜(简称“机械瓣膜”),人工生物瓣膜(简称“生物瓣膜”)具有较好的血流动力学性能,不需要终身服用抗凝药物以及血栓栓塞的几率低等优点。
2、多年来,研究人员们一直致力于研制性能更为优良的生物瓣膜,但仍存在一些挑战。例如,生物瓣膜的结构退化会影响其使用寿命。研究发现,应力集中是生物瓣膜结构退化的主要原因之一,应力集中导致的反流和耐疲劳性能降低是现阶段亟待解决的问题,同时研究发现,瓣膜闭合高度过低、高低差过大、冗余多、褶皱重、闭合中心旋大、尖角小、瓣叶分离等外观形态特征发生变化是生物瓣膜结构退化的表现之一,因此可以通过分析生物瓣膜外观形态特征差异,找到结构退化的部位,从而评判生物瓣膜反流与疲劳的程度。
3、分析血液与生物瓣膜之间的耦合问题,优化生物瓣膜的构型,详细了解瓣膜的应力分布、外观因素等,对了解瓣膜失效的原因、瓣膜几何参数的优化设计具有十分重要的理论价值和现实意义。但是,目前生物瓣膜植入体内后很难检测其动态外观,而目前的脉动流检测技术虽然能有效模拟体内血流环境,却难以为检测生物瓣膜外观形态特征提供手段,所以无法有效地从设计优化上解决生物瓣膜外观形态特征差异所引起的问题。
技术实现思路
1、本发明的目的在于提供一种生物瓣膜的外观检测方法及系统、设计方法、计算机存储介质,能够得到相应生物瓣膜心动周期内的外观形态特征,进而用于优化生物瓣膜性能设计,提高研发效率,降低研发成本。
2、为实现上述目的,本发明提供一种生物瓣膜的外观检测方法,其包括以下步骤:
3、s1,对生物瓣膜的血流动力学特性进行脉动流实验检测,得到所述生物瓣膜在心动周期内的压力曲线与流量曲线;
4、s2,构建生物瓣膜对应的三维瓣膜模型,并根据所述生物瓣膜的应力与应变关系曲线数据,设置所述三维瓣膜模型的材料参数和几何参数;
5、s3,对所述三维瓣膜模型进行网格划分,得到瓣膜有限元模型;
6、s4,基于流体域与固体域相互耦合,构建流体域的流体控制方程和固体控制方程,并以在流体域流量流入、压力流出为流固耦合边界条件,确定流固耦合界面,进而设置所述瓣膜有限元模型对应的血液模型;
7、s5,根据所述压力曲线向所述流固耦合有限元模型施加相应的压力载荷,根据所述流量曲线设置所述血液模型提供的血流量,对血液与所述瓣膜有限元模型之间的相互作用进行流固耦合动态力学性能分析,以仿真所述脉动流实验检测中的生物瓣膜心动周期内的外观工况;
8、s6,根据所述仿真结果得到所述生物瓣膜心动周期内的外观形态特征。
9、可选地,在步骤s2中,采用solidworks三维软件构建出所述三维瓣膜模型,并使用abaqus软件来设置所述三维瓣膜模型的材料参数和几何参数。
10、可选地,在步骤s3中,把所述三维瓣膜模型以iges格式导入hypermesh程序并进行网格划分,以得到所述流固耦合有限元模型。
11、可选地,在步骤s4中构建的流体控制方程为:
12、且
13、其中,v为血液中任一点的速度向量;ρ为血液密度;p为血液的压力;t为时间;为当前组态的梯度算子。
14、可选地,在步骤s1中设置的所述三维瓣膜模型的材料为非弹性材料,在步骤s4中构建的固体控制方程为:
15、
16、其中,ρs为固体的密度;ρf为血液密度;为固体的加速度;σs为结构的应力张量;为作用于所述三维瓣膜模型的体积力。
17、可选地,在步骤s5中,对血液与所述瓣膜有限元模型之间的相互作用进行流固耦合动态力学性能分析的过程包括以下操作:修改瓣膜有限元模型的材料参数、面型参数和网格参数,并对仿真数据进行拟合和配准计算,以模拟所述脉动流实验设备上的生物瓣膜的外观工况。
18、可选地,修改瓣膜有限元模型的面型参数和网格参数的步骤包括:
19、通过插值函数点对点计算所述瓣膜有限元模型中的动网格,生成只含有边界点的delaunay图网格;
20、通过体积坐标将每个计算网格点定位在所述delaunay图网格中,且所述delaunay图网格随边界的运动而运动,每个所述计算网格点通过相对图单元的位置坐标插值得到。
21、可选地,通过体积坐标将每个计算网格点定位在所述delaunay图网格中的步骤包括:
22、通过单元扫描计算相应的刚度矩阵和载荷向量,以定义每个计算网格点对应的体积公式:t=hx*hy/2,其中,,hx为所述计算网格点对应的单元长度,hy为所述计算网格点对应的单元宽度;
23、计算每个所述计算网格点对应的插值函数的常系数;
24、用解析法计算每个所述计算网格点对应的单元刚度矩阵ke11=(b1*b1+c1*c1)/(4*t),其中,b1、c1分别为所述计算网格点对应的坐标函数;
25、将网格的每个边界点对内点的影响视为一个场,将网格的边界点i对任意网格内点j的影响函数描述为ku=f,并通过距离倒数加权插值的网格变形方法对边界条件处理,使得所述delaunay图网格随边界的运动而运动,其中,f是施加在所述计算网格点上的力,u是所述计算网格点的位移,k为所述计算网格点对应的结构刚度矩阵。
26、可选地,在步骤s5中,采用abaqus软件和xflow软件对血液与所述瓣膜有限元模型之间的相互作用进行流固耦合动态力学性能分析;且在步骤s4中,通过在xflow软件中构建所述血液模型,开启反流设置,且设置仿真时长与所述abaqus软件中的仿真时长相等,来确定所述流固耦合界面;在步骤s5中,所述abaqus软件通过调用二次开发的子程序来执行修改瓣膜有限元模型的面型参数和网格参数以及所述对仿真数据进行拟合和配准计算的操作。
27、可选地,在步骤s6中,通过在所述abaqus软件中对仿真分析后的所述瓣膜有限元模型进行测量,得到所述生物瓣膜的外观形态特征,所述外观形态特征包括闭合高度、高低差和褶皱。
28、基于同一发明构思,本发明还提供一种生物瓣膜的设计方法,其包括:
29、采用如本发明所述的生物瓣膜的外观检测方法,获取已设计的生物瓣膜的外观形态特征数据;
30、根据所述外观形态特征数据,对所述已设计的生物瓣膜的模型参数进行优化,以设计出新的生物瓣膜。
31、基于同一发明构思,本发明还提供一种生物瓣膜的外观检测系统,其包括:
32、脉动流实验设备,用于对生物瓣膜的血流动力学特性进行脉动流实验检测,得到所述生物瓣膜在心动周期内的压力曲线与流量曲线;
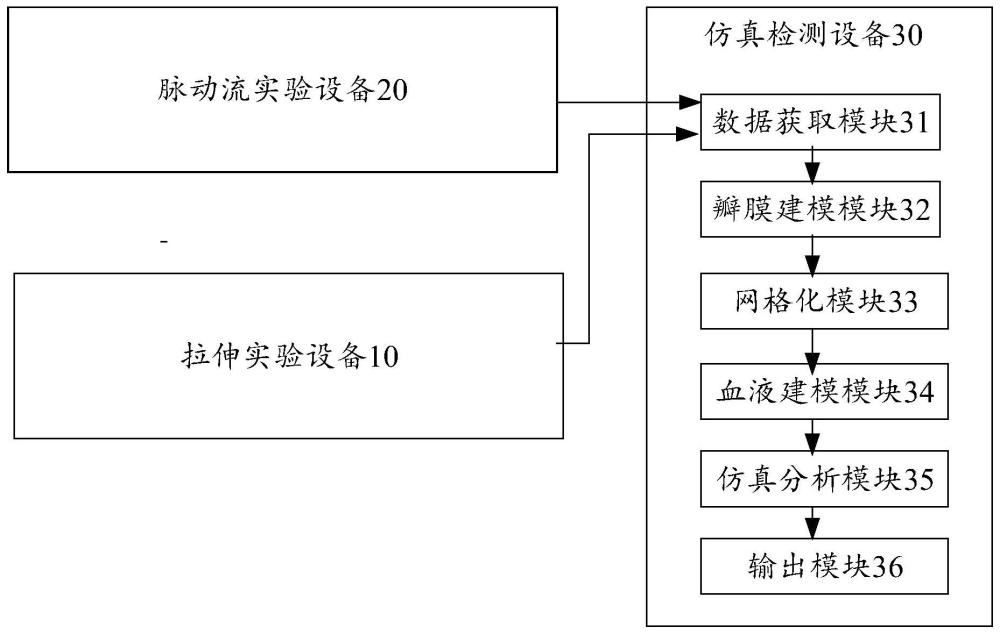
33、以及,仿真检测设备,用于执行以下步骤:
34、构建所述生物瓣膜对应的三维瓣膜模型,并获取所述生物瓣膜的应力与应变关系曲线数据,且根据所述生物瓣膜的应力与应变关系曲线数据,设置所述三维瓣膜模型的材料参数和几何参数;
35、对所述三维瓣膜模型进行网格划分,得到瓣膜有限元模型;
36、基于流体域与固体域相互耦合,构建流体域的流体控制方程和固体控制方程,并以生物瓣膜在流体域流量流入、压力流出为流固耦合边界条件,确定流固耦合界面,进而设置所述瓣膜有限元模型对应的血液模型;
37、根据所述压力曲线向所述流固耦合有限元模型施加相应的压力载荷,根据所述流量曲线设置所述血液模型提供的血流量,对血液与所述瓣膜有限元模型之间的相互作用进行流固耦合动态力学性能分析,以仿真所述脉动流实验设备上的生物瓣膜心动周期内的外观工况;
38、根据所述仿真结果得到生物瓣膜心动周期内的外观形态特征。
39、可选地,所述的生物瓣膜的外观检测系统还包括拉伸实验设备,用于测试所述生物瓣膜的应力与应变关系,以提供所述生物瓣膜的应力与应变关系曲线数据给所述仿真检测设备。
40、可选地,所述仿真检测设备包括:
41、数据获取模块,用于获取所述生物瓣膜的应力与应变关系曲线数据,以及,所述生物瓣膜在心动周期内的压力曲线与流量曲线;
42、瓣膜建模模块,用于构建所述生物瓣膜对应的三维瓣膜模型,并根据所述数据获取模块所获取所述生物瓣膜的应力与应变关系曲线数据,设置所述三维瓣膜模型的材料参数和几何参数;
43、网格化模块,用于对所述第一建模模块构建的所述三维瓣膜模型进行网格划分,得到瓣膜有限元模型;
44、血液建模模块,用于基于流体域与固体域相互耦合,构建流体域的流体控制方程和固体控制方程,并以生物瓣膜在流体域流量流入、压力流出为流固耦合边界条件,确定流固耦合界面,进而设置所述瓣膜有限元模型对应的血液模型;
45、仿真分析模块,用于根据所述压力曲线向所述流固耦合有限元模型施加相应的压力载荷,根据所述流量曲线设置所述血液模型提供的血流量,对血液与所述瓣膜有限元模型之间的相互作用进行流固耦合动态力学性能分析,以仿真所述脉动流实验设备上的生物瓣膜心动周期内的外观工况;
46、输出模块,用于根据所述仿真结果得到和输出生物瓣膜心动周期内的外观形态特征。
47、可选地,所述瓣膜建模模块包括solidworks三维软件,所述网格化模块包括hypermesh软件,所述血液建模模块包括xflow软件,所述仿真分析模块包括abaqus软件和xflow软件,所述输出模块包括abaqus软件。
48、基于同一发明构思,本发明还提供一种计算机存储介质,其上存储有计算机程序,所述计算机程序被一处理器执行时,实现如本发明所述的生物瓣膜的外观检测方法,或者,实现如本发明所述的生物瓣膜的设计方法。
49、本发明的技术方案,针对现有技术缺陷,将有限元仿真分析与脉动流实验结合,一方面可以解决脉动流检测设备无法定性定量检测生物瓣膜的外观形态特征的难题;另一方面,还通过将流固耦合分析的仿真结果与脉动流实验的结果进行对比,从而可以根据对比结果,为生物瓣膜设计提供优化方向,以期减少生物瓣膜因结构退化而导致的瓣膜反流、瓣膜闭合处血栓的问题,延长其使用寿命短,且提高了生物瓣膜的研发效率,降低了研发成本。
- 还没有人留言评论。精彩留言会获得点赞!