钠离子电池阳极的制作方法
本发明涉及用于钠离子电池的电极材料。特别地,本发明涉及适合用作钠离子电池的阳极的电极材料,其中所述电极材料包含钠钛酸盐。
随着近年来对全球变暖的关注日益增加,更多重点已被放在从基于化石燃料的能源收集工厂转向依赖于可再生能源如太阳能和风能的工厂。这些来源的间歇性导致不可避免地需要能量储存。在这个可再生能源的新时代,固定栅电池(stationarygridbattery)形式的能量储存将与实际的太阳能/风电场一样重要,并且其作为集成系统的性能将决定其市场成功。对于后一点,这些栅电池的成本将是最关键的。锂离子电池(lib)(其为目前的技术并且在性能方面远远超过其他传统电池技术)由于锂储量的可用性有限而不适合电网应用。此外,对锂的未来价格的担忧,特别是当在未来需求增加(由于诸如电动车辆的应用的lib需求快速增加)时,将需要不依赖于锂但具有与lib可比的性能的替代电池技术。
在这方面,室温钠离子电池(nib)非常适合,因为其具有与lib相同的工作原理,并且最近的报道表明,其在性能方面可以与lib竞争或者甚至超过lib。转换到nib将是有意义的,因为钠是十分丰富的,并且依赖于钠的电池技术将比依赖于锂的电池技术便宜得多。
nib(类似于lib)需要能够在高电位下嵌入/脱嵌钠离子的阴极材料和能够在低电位下进行相同工作的阳极材料。显然地,阴极的工作电位(被称为“氧化还原电位”(还原/氧化))越高且阳极的氧化还原电位越低,全电池的工作电位将越高。全电池的能量密度(所储存的能量的量/重量,单位通常为wh/kg)等于工作电位(v)乘以其阴极或阳极的容量(所储存的电荷的量/电极材料的重量,mah/g)。对于栅蓄电池,与电动车辆和消费电子产品所需的蓄电池不同,由于对这些电池的重量和尺寸没有限制,故能量密度不是最重要的性能因素。主要因素相反是低成本、超长循环寿命、优异的安全性和至少为80%的高往返能量效率(round-tripenergyefficiency,rtee)。rtee是库仑效率(放电容量与充电容量之比)与电压效率(充电与放电循环之间的电压滞后)的乘积。考虑到这些点,全电池的能量密度可以容易地通过提高全电池的工作电位来提高,这意味着将高电位阴极与低电位阳极组合。此外,可以通过确保在全电池的充电与放电曲线之间存在可忽略的电压滞后(也称为“极化”)来提高rtee。由于全电池的恒电流曲线只是从阴极的恒电流曲线中减去阳极的恒电流曲线,故这意味着阴极和阳极各自的恒电流曲线(通常以“半电池”方法相对于钠金属测量)应当表现出非常小的电压极化。
栅能量储存将成为迎接诸如太阳能和风能的可再生能源时代的重要组成部分,因为其解决了它们的最明显的缺点-它们的间歇性。因此,意在用于电网应用的廉价电池将使得来自这些工厂的电力成本对于消费者来说非常具有成本竞争力。由于成本是一个重要因素,故lib将因锂资源不丰富而自动失去资格。依赖于在全球丰富和因此便宜的钠,nib是最佳候选者。
虽然对于nib已经展示了一些有前景的高电压阴极,但是还未证实非常低电压氧化还原电位和有吸引力的容量的阳极材料的合适组合。用于nib的基于碳的阳极可具有高容量和非常低的氧化还原电位(相对na/na+<0.1v),但是由于钠离子化(sodiated)材料在约100℃至150℃的低温下的热不稳定性,以及在阳极上钠镀(这可由于电压危险地接近0v而导致内部短路)的可能性,它们具有严重的安全问题。
因此,需要发现这样的电极材料:其能够在有吸引力的电压下以合适的容量储存钠,具有低合成成本,能够显示出超长循环寿命,具有高rtee,并且在缺乏钠的相和富含钠的相中为热稳定的。
在本说明书中列出或讨论明显在先公开的文献不应当必然被认为是承认该文献是目前的技术的一部分或公知常识。
本文中引用的任何文献通过引用整体并入本文。
在本发明中,我们已经发现了钠钛酸盐中的新相(na3ti3o7)。这种材料可用作钠离子电池中的阳极,因为作为阳极,其可以在对于用于钠离子电池的任何非碳基阳极材料曾经报道的最低电压下储存钠。我们目前的发现证实了其非常合适的低电压钠储存活性及其有吸引力的容量,这导致具有在钠离子电池中对于非碳基材料曾经报道的最高电压平台的高能量密度全钠离子电池。还提出了电池应用的其他有吸引力的性能,例如极好的高倍率性能、长循环寿命、高效率、使用低成本材料以及大的热稳定性。可以设想这种材料不仅可在基于锂/钠的电池中起关键作用,而且可在其他领域如电致变色窗、水裂解和催化反应中起关键作用。
最具前景的非碳阳极材料是基于嵌入的钠钛酸盐na2ti3o7,其已被证明在相对na/na+0.3v的平均电位下以178mah/g的高容量嵌入两摩尔钠(至标称形式na4ti3o7)。虽然这听起来很有前景,但是这种材料具有很大缺点。其在其充电和放电电位中显示出巨大的极化,分别为>0.4v和<0.2v。这种>0.2v的差异将导致全电池以低rtee操作。
在此,我们提出了用于na2ti3o7的另一种钠储存途径,所述途径涉及将其钠摄取限制为仅1摩尔,形成先前未知的“na3ti3o7”相。这种na2ti3o7<=>na3ti3o7钠储存途径得到对于非碳基阳极材料曾经报道的0.20v的最低氧化还原电压与88.9mah/g的具有吸引力的理论容量。还将证实,在该材料的充电和放电曲线中存在非常小的电压极化。当与高电压阴极组合时,该材料导致显示出高rtee以及相对na/na+4v至相对na/na+3.7v的极高电压平台的高能量密度全电池。这将是迄今为止对于任何非碳基nib显示的最高平台。此外,还将显示出该材料的极好的倍率性能、优异的热稳定性和长循环寿命。
在本发明的一个方面,提供了一种用于钠离子电池的电极材料,该材料包含具有式na3+xti3o7的钠钛酸盐,其中x的值被限定为-0.5≤x≤0.3。
在一个实施方案中,钠钛酸盐具有式na3ti3o7,即na3+xti3o7(其中x≈0),或na3-xti3o7(其中x≈0)。在本申请中,当使用式na3-xti3o7时,也旨在是指其中x≈0的情况,得到式na3ti3o7。
优选地,电极为阳极,并且当在电解质中相对于具有较高电压的阴极材料循环时,材料为na2ti3o7与na3+xti3o7之间的中间相。优选地,当在电解质中相对于具有较高电压的阴极材料循环时,阳极材料为na2ti3o7与na4ti3o7之间的中间相。优选地,该中间相为na3ti3o7。优选地,阴极材料为钠金属。起始电极(阳极)材料na2ti3o7(其可通过任何合适的方法合成)在循环过程中转变为na3+xti3o7(-0.5≤x≤0.3),使得电极在半电池放电期间(在全电池中,该过程将是充电循环)从na2ti3o7转变为na3+xti3o7(-0.5≤x≤0.3),并且在半电池充电过程期间(在全电池中,对应的过程将是放电)从na3+xti3o7(-0.5≤x≤0.3)回到na2ti3o7。
可使用任何合适的电解质,特别是适用于本发明的水性钠离子电池或非水性钠离子电池,或者甚至使用这种na3+xti3o7(-0.5≤x≤0.3)作为阳极的任何其他固态电池的任何电解质。因此,本发明包括任何这样的电解质,其能够允许钠离子从阴极穿梭到阳极,反之亦然。这样的电解质可为基于醚/离子液体/任何其他极性质子惰性溶剂的电解质。在一个实施方案中,电解质是基于碳酸盐/酯的电解质。
在一个实施方案中,电极材料还包含碳基体。
优选地,电极为阳极,并且阳极材料还可包含在形成钠离子电池时可能合适的任何其他添加剂。例如,导电添加剂(例如碳黑、乙炔黑、石墨、碳纳米粉末、石墨烯、碳、氮掺杂的碳)和/或粘合剂可以以任意合适的比例和量存在。
在本发明的另一个方面,提供了一种钠离子电池,其包括(a)阳极;(b)阴极;(c)设置在阳极与阴极之间的隔离件,该隔离件被配置成传导钠离子;和(d)电解质,其中阳极包含材料,该材料包含具有式na3+xti3o7的钠钛酸盐,其中x的值被限定为-0.5≤x≤0.3。
优选地,当在电解质中相对于具有较高电压的阴极材料循环时,所述材料为na2ti3o7与na4ti3o7之间的中间相。电解质可为基于碳酸盐/酯的电解质。优选地,所述阴极材料为钠金属。
在本发明的又一方面,提供了一种生产用于钠离子电池的电极的方法,所述方法包括:(a)提供钠源和钛源;和(b)在碳源和介质的存在下使所述钠源和所述钛源在溶剂热反应中反应以形成钠钛酸盐电极材料,其中电极通过将导电添加剂和粘合剂负载在所述钠钛酸盐电极材料上来形成。
优选地,钠源为氢氧化钠,并且钛源为异丙醇钛。
优选地,导电添加剂为superp碳,并且粘合剂为羧甲基纤维素(cmc)的钠盐。
优选地,电极材料为na2ti3o7。更优选地,电极为阳极,并且当在电解质中相对于具有较高电压的阴极材料循环时,所述材料形成na2ti3o7与na3+xti3o7之间的中间相,其中x的值被限定为-0.5≤x≤0.3。优选地,电极为阳极,并且所述材料形成na2ti3o7与na4ti3o7之间的中间相。更优选地,所述中间相为na3ti3o7。
优选地,电解质为基于碳酸盐/酯的电解质。
优选地,电极材料、superp碳和cmc的重量比为80:10:10或70:20:10。或者,可使用任何其他合适的重量比。
由上述方法形成的电极可用于形成钠离子电池。这样的钠离子电池可应用于固定栅或微栅,或者在其他应用如电动车辆或消费电子产品中是直接相关的。其他相关用途可以是在锂离子电池、电致变色窗、水裂解或催化反应中。
本发明包括具有式na3+xti3o7的任何材料,其中‘x’表示一系列化学计量可以是可能的这一事实(-0.5≤x≤0.3,因此从na2.5ti3o7至na3.3ti3o7)。应当认识到,包括旨在合成这种na3+xti3o7的所有电化学、化学或机械方法。作为一个实例,我们将呈现当在基于碳酸盐/酯的电解质中相对于钠金属循环时由溶剂热反应制备的na2ti3o7向na3ti3o7的电化学转化。除了其在nib中作为阳极的用途之外,还将包括其应用于lib、电致变色窗、水裂解和催化反应。
为了使本发明可被完全理解并且容易付诸实施,现在将仅通过非限制性实例的方式描述本发明的优选实施方案,说明是参考所附的说明性附图进行的。
在附图中:
图1.na2ti3o7向na3ti3o7的电化学转化的图示(a)。相对于已知的na2ti3o7<=>na4ti3o7钠储存机制((b)所示),对于na2ti3o7<=>na3ti3o7钠储存机制获得的不同恒电流曲线的比较。电压极化的差异是明显的。对于所有情况,循环数据以c/5倍率呈现,并且在具有钠金属充当对电极和参比电极的纽扣电池中循环。
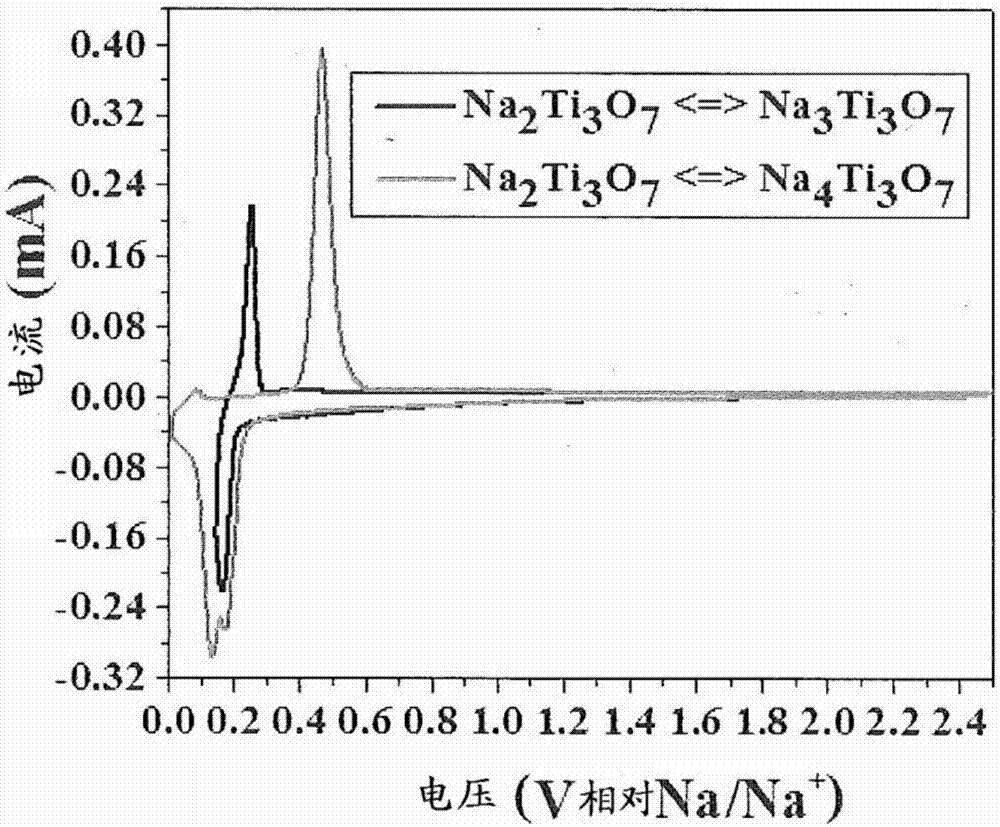
图2.两种不同的钠储存途径的循环伏安图。存在单独的氧化和还原峰清楚地揭示了这两种机制之间的工作电位的差异。
图3.na2ti3o7<=>na3ti3o7钠储存机制的倍率性能,其中na2ti3o7已通过产生碳基体的溶剂热法制备(因此称为na2ti3o7/c)。图3(a)示出了以不同的c倍率获得的容量,同时图3(b)示出了对应的恒电流充电曲线。放电以c/5倍率进行。图3(c)具有对应的循环曲线作为插图的该途径的长期循环。可以看出,显示出在所有倍率下优异的稳定性以及即使在40c和80c的极快充电倍率下较小的极化。
图4.以包含na3v2(po4)2f3/c作为阴极、na2ti3o7/c作为阳极和钠金属作为参比电极的三电极配置制造的全钠离子电池的恒电流循环曲线。示出了阴极、阳极的循环曲线以及所得的全电池的循环曲线。通过限制na2ti3o7中的钠摄取,使得na2ti3o7<=>na3ti3o7钠储存机制起作用,在全电池中获得4.0v至3.7v的极高电压平台。对于阳极,电流计算为c/5。
图5.包含na3v2(po4)2f3/c作为阴极和na2ti3o7/c作为阳极的na2ti3o7<=>na3ti3o7钠储存机制起作用的全钠离子电池的倍率性能。图5(a)示出了全电池在不同的c倍率下的放电容量。请注意,容量仅相对于阳极重量进行计算。图5(b)示出了全电池的对应恒电流放电曲线。在每种情况下,相对于阳极在c/5倍率下恒电流地进行充电。
图6.包含na3v2(po4)2f3/c作为阴极和na2ti3o7/c作为阳极的na2ti3o7<=>na3ti3o7钠储存机制起作用的全钠离子电池的长期恒电流充电-放电循环曲线。图6(a)示出了显示出基于阳极重量的放电容量以及基于阴极和阳极的重量的全电池能量密度的在c/5倍率下的稳定循环。图6(b)示出了全电池的对应库仑效率和rtee。可以看出,在整个循环过程中存在接近85%的稳定rtee。
图7.na3ti3o7的差示扫描量热法(dsc)曲线证实了材料的优异的热稳定性,其中仅在376℃下存在放热峰。这样高的温度应当确保用这种材料的全电池将不会处于热失控的危险中。
图8.合成的na2ti3o7/c的材料表征,其中(a)xrd图谱的rietveld分析、(b)fesem、(c)tga以及(d)hrtem和saed示出了嵌入无定形碳基体中的单晶na2ti3o7片。
图9.(a)具有电压阶跃的放大图作为插图的na2ti3o7/c的三电极恒电流循环,(b)在沿着深度放电的na2ti3o7的不同点处的非原位xrd图谱。(c)具有对应的cv曲线作为插图的
实施例
在此对于阳极na2ti3o7提出了一种新的钠储存途径,所述途径涉及新发现的na3-xti3o7的中间相。以下描述了关于这种
1.方法和材料
na3ti3o7可以方便地由na2ti3o7以电化学方式制备。图1详细说明了这可如何实现。当在合适的电解质中相对于钠金属循环时,可以迫使na2ti3o7接受钠离子。随着这进行,恒电流循环曲线将不断地转移至较低的电位。最后,在相对na/na+约0.19v下,当以c/5倍率(对应于1molna嵌入到na2ti3o7(17.8ma/g)中)循环时,将注意到电压平台开始,其持续直至相对na/na+约0.155v。基于在此时间期间通过的电荷量,可以计算na2ti3o7已经转变为na3ti3o7。已通过x射线衍射(xrd)获得了这种新相的确认。充电后,na3ti3o7转变回na2ti3o7,其中在c/5倍率下在约0.22v处出现充电平台。如果允许放电电流超过规定的截止电位,则na2ti3o7可以转变为不想要的na4ti3o7,并且将在其第一次循环中在0.1v附近显示出另一个平台(参见图2中的cv曲线)。为了获得na2ti3o7<=>na3ti3o7钠储存途径,需要当心何时停止钠嵌入,如图1所示。
由任何方法(其是固态反应、水热/溶剂热反应等)制备的且具有/不具有任何碳作为表面涂层或复合材料基体的na2ti3o7将表现出以上显示的特性。作为一个实例,我们已经采用嵌入碳基体中的溶剂热合成的na2ti3o7(标记为“na2ti3o7/c”)。另外,由na2ti3o7以电化学方式合成的na3ti3o7的材料特性(例如其形态或表面积)将取决于可能由于合成而发生变化的na2ti3o7的材料特性。另一点需要注意的是,可发现规定的下限截止电压是可变的,因为其取决于所应用的放电c倍率、电极厚度、电极中存在的导电添加剂与na2ti3o7的比例、电池制造质量、合成的na2ti3o7的形态以及所使用的电解质。根据这些变量,下限截止电压可以延伸至低至相对na/na+0.0v以证明na2ti3o7<=>na3ti3o7储存途径。
因此,在本发明的一个实施方案中,na2ti3o7/c使用溶剂热法合成。钠源和钛源为氢氧化钠(32mg)和异丙醇钛(296μl),分别以20%摩尔过量的前者的化学计量摩尔比使用。使用葡糖酸内酯(285mg)作为原位碳源,并且无水乙醇(15.3ml)用作介质。反应在180℃下在密封在不锈钢高压釜中的
2.结果
如图8a所示,用对合成材料收集的xrd图谱对结构模型进行rietveld精修表明,在p121/m1空间群中以良好的精修可靠性因子和与先前报道的工作一致的晶格参数获得了纯的na2ti3o7相。场发射扫描电子显微术(fesem)图像(图8b)揭示了亚微米颗粒尺寸,同时热重分析(tga)曲线表明合成材料含有约14.5重量%的原位碳(图8c)。na2ti3o7与原位碳的这种组合此后被称为“na2ti3o7/c”。选区电子衍射(saed)和高分辨率透射电子显微术(hrtem)揭示了被碳包围的单晶na2ti3o7片(图8d)作为无定形基体存在(由扩散saed环显示)。
图9a示出了在c/2.5倍率(基于88.9mah/g的理论容量,对应于每化学式单位1摩尔钠储存)下在2.5v至0.01v(深度放电)的三电极电池中循环的na2ti3o7/c的第一次恒电流循环。在该电压窗口中,na2ti3o7可以容纳两摩尔的钠,得到178mah/g的充电(na提取)容量,这与先前报道一致。请注意,长的第一次循环放电是由于在这样的减小的电压下电解质分解导致在阳极上形成固体电解质中间相(solidelectrolyteinterphase,sei)并且与na2ti3o7的不可逆的钠摄取无关。更仔细地观察放电(na嵌入)曲线揭示了不同的电压阶跃(参见图9a的插图)。事实上,在其他报道中的该材料的第一次放电曲线中也可以清楚地看到这种电压阶跃。这样的电压阶跃与我们先前报道的电压阶跃现象不相关,因为该阶跃由工作电极(we)而不是钠金属对电极(ce)产生,并且we-ce曲线平稳地跟随we曲线。这一观察结果意味着在na2ti3o7与深度放电的na4ti3o7之间一定存在中间相,因为存在两个单独的放电平台。
为了证实这一观察结果,在不同的放电阶段收集非原位xrd图谱(图9b)。随着放电的进行,与母体na2ti3o7相有关的反射的强度降低。同时,新的反射组在2θ=10.93°、16.10°和43.72°处出现,并且以属于母体na2ti3o7相的反射为代价,强度沿着上放电平台增加(参见在图9b中的a、b和c点处收集的图案)。在na2ti3o7向中间相转变的上放电平台的末端,na2ti3o7的反射消失(c点)。因此,很显然沿着上放电平台的na2ti3o7的钠储存通过两相反应机理进行,并且中间相是在上放电平台的末端形成的稳定相。从点c(到由点d和e表示的下放电平台)进一步放电在2θ=12.2°、16.23°、39.56°和41.17°处系统地产生了新的反射组,而属于中间相的反射在消失之前逐渐减小。这些新的反射与对于na4ti3o7所报道的反射一致,意味着沿着下放电平台的钠储存本质上也是两相。因此,在钠嵌入过程中,na2ti3o7表现出两个不同的电压平台,每个平台与不同的两相反应机理有关。
实际上,如果下限截止电压在c/5下被限制为约0.155v(浅放电)而不是0.01v,使得允许材料嵌入钠直至上放电平台的末端(直至电压阶跃),所得的充电曲线的恒电流曲线完全不同(图9c)。浅放电的材料现在显示出0.22v的平的充电平台,与对于深度放电至0.01v的na2ti3o7所观察到的0.44v平台相反。循环伏安法(cv)曲线(图9c的插图)支持明显不同的氧化还原机理操作的观点,对于浅放电,在0.24v处具有清晰的氧化峰,与深度放电的na2ti3o7在0.47v处的峰不同。在充电期间获得的87mah/g的容量表明,在放电期间在na2ti3o7/c复合电极中嵌入几乎1摩尔的钠,名义上形成“na3-xti3o7/c”。请注意,无定形碳基体可能已参与钠储存。然而,由于如果深度放电(意指在其深度放电状态下在na2ti3o7中嵌入两摩尔的钠以形成已建立且很好理解的相na4ti3o7)相同的na2ti3o7/c复合电极在充电期间输送178mah/g,我们确信在浅放电期间形成的中间相的组成是na3-xti3o7,其中x≈0(即,na3ti3o7)。晶体结构和中间相na3-xti3o7中的钠的精确量的确定目前正在通过原位xrd测量进行。
在深度放电后观察到分别对应于na2ti3o7→na3-xti3o7和na3-xti3o7→na4ti3o7两相反应的两个放电平台但是在充电期间仅观察到0.44v充电平台(对应于已建立的na4ti3o7→na2ti3o7两相反应的充电平台)这一事实意味着在深度放电至0.01v期间的不可逆转变,这导致
接近0.2v的充电平台使得
除了上述内容以外,本发明的na2ti3o7<=>na3ti3o7钠储存机制即使在高倍率下也显示出极好的倍率性能与小的极化和在所有倍率下稳定的循环,如图3和上述内容所证明。材料在很多次循环后也是稳定的。当将这种反应机理用于全电池时,如图4所示,当与合适的阴极配对时,可以获得4.0v至3.7v的非常高的全电池平台,并且其在很多次循环后显示出稳定的循环,基于单独的阴极和阳极的重量具有约85wh/kg的高能量密度以及约85%的优异的rtee(参见图6)。如图5所示,在全电池中的倍率性能也是极其令人印象深刻的。最后,这种材料(na3ti3o7)对热非常稳定,仅在376℃(其比钠离子化的碳显示的峰(约100℃至150℃)高得多)附近显示出放热峰(参见图7)。因此,当用于全电池中时,其低成本(基于钠和钛,这些是丰富的元素)、安全性、显示出小极化的极低电压平台、在很多次循环后良好的稳定性和高rtee的组合使得na2ti3o7<=>na3ti3o7成为钠离子电池应用的非常有前景的阳极材料。
由于其涉及嵌入和基于氧化还原反应(如通过钠嵌入所证明)的优异特性,预期这种新发现的化合物na3ti3o7可在需要这些特性中的一种或两种的其他应用(例如电致变色窗、水裂解或催化反应)中显示出非常有利的性能。
经由通过na2ti3o7与na4ti3o7之间的两相反应机理每化学式单位储存两摩尔钠,在na提取后,na2ti3o7具有高容量(178mah/g)和相对na/na+0.4v的低且平稳的电压。这种材料的主要缺点是其大于0.2v的高极化。事实上,已经提出了极化是热力学控制的(不依赖于粒径)并且可能不低于0.225v。此外,完全钠离子化的相na4ti3o7由于自松弛而已被证明是不稳定的,这可能是其差的循环寿命的原因。有利地,本发明得到了用于先前已知的化合物(na2ti3o7)的新的钠储存机制,其不仅导致优异的钠储存特性,而且导致发现新化合物(na3ti3o7)。当用作用于钠离子电池应用的阳极材料时,本发明在非碳基阳极材料的钠储存的最低曾经报道的氧化还原电压活性中起作用,所述材料显示出优异的高倍率性能以及在很多次循环后良好的稳定性。当与高电压阴极如na3v2(po4)2f3配对用于全nib中时,使用非碳基电极曾经制造的最高电压全钠离子电池的结果不仅对于高能量密度nib,而且对于为负载(如果电池的电压太低,其可能不起作用)供电具有明显意义。该阳极支持nib的高速率操作。尽管总是可以通过并联连接相同的电池来提高电压,但是将无疑需要较少的电池并联来为高电压需求如栅蓄电池提供电流。这些事实与该反应机理在全nib中表现出的高rtee及其固有的安全性将使本发明的发现成为意在用于栅蓄电池的商业高电压nib的最合适的选择。
3.结论
已通过钠电池中的na2ti3o7的恒电流循环研究发现和分离了中间相。na2ti3o7的这种新阳极反应导致其通过相
虽然在前述说明书中已经描述了本发明的优选实施方案,但是本领域技术人员将理解,在不脱离本发明的情况下,可以对设计或结构的细节进行许多变化或修改。
- 还没有人留言评论。精彩留言会获得点赞!