用于通过电子捕获解离分析蛋白质的方法和系统与流程
本申请要求2016年6月21日提交的美国临时申请第62/352,836的优先权益,所述美国临时申请的全部内容特此以引用的方式并入。
本文中的教示涉及质谱法,且更具体地说,涉及用于通过电子捕获解离分析蛋白质的方法和系统。
背景技术:
质谱(massspectrometry,ms)是用于测定测试物质的元素组成的分析技术,既具有定量应用又具有定性应用。举例来说,ms可用以识别未知化合物和/或通过观察化合物的分裂来测定其结构。最近,ms已由于ms策略表征并识别肽和蛋白质的速度、特定性和敏感度而在蛋白质组学中扮演越来越重要的作用。
使用基于ms的蛋白质组学来表征蛋白质的一个策略是“自下向上”方法,其中在使肽片段经受ms分析(ms1)或串联ms/ms分析(ms2)之前,使感兴趣的蛋白质经受酶解离(例如,通过胰蛋白酶、lysc等等)和一或多个分离(例如,多维lc)。在“自下而上”ms2工作流中,通常利用碰撞诱导解离(collisioninduceddissociation,cid)以将在第一ms阶段中选定的前驱体肽片段解离成产物离子片段。可接着从产物离子片段的质量推论前驱体肽离子的氨基酸序列。在cid中,电离前驱体离子与惰性惰性气体和/或氮分子之间的高能冲突振动并最终解离(断裂)骨干酰胺键,由此得到b型(n端)产物离子和y型(c端)产物离子。通过识别若干产物离子肽,可所确定原始蛋白质(例如,通过参考蛋白质或基因组数据库中的已知序列)。但是,因为通常仅在最弱的肽酰胺键处发生cid反应,所以沿着肽骨干的不完全分裂会使肽序列的完整重建构变得困难。在蛋白质组学中使用cid的另一关键限制使解离期间的转译后修饰(post-translationalmodification,ptm)的损失。常常仅微弱地键结到肽骨干的ptm(例如,磷酸化或硫酸化功能团)可在分裂期间从肽剥离,由此防止检测并表征ms2质谱中的ptm。
相对于“自下而上”方法,替代性基于ms的蛋白质组学策略利用“自上而下”分析,其中完整蛋白质在质谱仪中经受解离。虽然常规cid通常解离过少的位点以提供表征完整蛋白质的整个氨基酸序列的完整信息,但是由于其对肽骨干的更完全分裂,对于完整蛋白质的“自上向下”定序,电子捕获解离(electroncapturedissociation,ecd)和电子传递解离(electrontransferdissociation,etd)已被标识为cid的可能替代方案。举例来说,ecd利用前驱体离子与使得多电荷前驱体捕获电子的低能量电子之间的离子相互作用,这快速引发n-αc键的更广泛断裂以主要地得到c型(n末端)产物离子和z型(c末端)产物离子(例如,具有不同肽)。另一方面,etd使多电荷前驱体离子与具有相对电荷的试剂离子反应以将电子传递到前驱体离子,由此引起解离。因为在ecd和etd中解离能在整个前驱体肽中通常不分布(或不太分布),所以弱键合的ptm更有可能保持附接搭配肽来在下游ms分析中进行后续检测。在一些方面中,基于高能量电子有效率地解离肽离子的提高的有效性,ecd可比etd优选。
但是,对于“自上而下”ecd方法的一个障碍是产生于发生多个ecd反应的ms2质谱的复杂度。尽管促进多个ecd事件会减少含有特定序列的片段的电荷态的变化,但是此策略还会由于多个解离事件后越来越多地存在内部肽片段而呈现正确地表征整个肽序列的障碍(即,肽片段的所得产物离子中的一些缺乏n端和c端两者)。也就是说,当c型和z型片段的长度变得随产物离子的每次后续解离而变得越来越短时,质谱数据无法有效地展现肽的中间部分的序列信息,并因此使肽序列的完全重建构变得困难。
因此,对于用于蛋白质的基于ecd的分析的改善型方法和系统仍存在需要。
技术实现要素:
根据本发明教示的各个方面,在本文中公开了用于从ecd反应室的相互作用区域选择性地移除产生于ecd事件的产物离子的方法和系统,同时其它前驱体蛋白质离子继续在相互作用区域内经历ecd。因为小振幅辅助ac场会变更与所述前驱体离子反应而损害ecd反应效率的电子的动能,所以本文中所描述的示范性方法和系统可实现在所述ecd反应期间从所述相互作用区域优选地提取产物离子,且不在相互作用区域内产生此辅助ac场(即,非共振提取)。以此方式,本发明教示的各个方面可减少或防止所述产物离子的后续电子捕获事件(例如,次级或三级ecd事件)的发生,以便将前驱体离子限于单个解离事件。因此,所述多个前驱体离子的所述ecd反应可主要产生c型产物离子和z型产物离子(例如,取决于断裂键的位置而展现不同肽长度)。此后,本文中所公开的所述方法和系统可使各种产物离子经受质子传递反应(ptr),所述质子传递反应通过暴露于藉由相反极性的试剂离子来提供非解离电荷减少。因此,在某些方面中,本文中的教示可提供用于利用ecd的高解离效率来产生肽离子的全序列的改善型策略,同时仍然例如相对于将在多个ecd之后产生的质谱产生不太卷积的质谱。
根据本发明教示的各个方面,提供一种分析离子的方法,所述方法包括通过离子处理装置的近端入口端接收由离子源产生的前驱体离子(例如,前驱体蛋白质离子),并将电子引入到所述离子处理装置的相互作用区域中使得所述电子在所述相互作用区域内与前驱体离子相互作用以通过电子捕获解离形成产物离子,其中在形成之后且在前驱体离子继续与所述电子相互作用时从所述相互作用区域优选地移除(例如,质量选择性地移除)所述产物离子。所述方法可进一步包括通过所述离子处理装置的所述近端入口端接收由带电物种源产生的试剂离子,并使所述产物离子与所述试剂离子相互作用以便将所述产物离子浓缩于较低电荷状态。
根据本发明教示的离子处理装置可具有多种配置并可以多种方式操作。在一些方面中,举例来说,所述离子处理装置可包括:第一组电极,所述第一组电极的至少第一片段围绕第一中心轴线在四极定向上布置,其中所述第一组电极的所述第一片段沿着所述第一中心轴线从所述近端入口端轴向地延伸到远端,以便界定沿着所述第一中心轴线延伸的第一路径的第一部分;第二组电极,所述第二组电极的至少第一片段围绕所述第一中心轴线在四极定向上布置以便界定所述第一路径的第二部分,其中所述第二组电极的所述第一片段沿着所述第一中心轴线从近端轴向地延伸到远端出口端,所述第二组电极的所述近端与所述第一组电极的所述远端间隔开,使得横向路径在所述第二组电极的所述近端与所述第一组电极的所述远端之间延伸,所述横向路径沿着大体上正交于所述第一中心轴线且在相交区域处与所述第一路径相交的第二中心轴线从第一轴向端延伸到第二轴向端,其中所述横向路径界定所述相互作用区域。另外,在相关方面中,在所述离子处理装置中接收前驱体离子的所述步骤可包括在所述第一路径的所述第二部分内捕获所述前驱体离子,且将电子引入到所述离子处理装置的所述相互作用区域中的所述步骤可包括朝向所述相交区域沿着所述横向路径发射所述电子。在各种方面中,可在将电子引入于所述相互作用区域中时将辅助ac信号施加到所述第二组电极以便选择性地将所述第一路径的所述第二部分内捕获的前驱体离子驱动到所述相互作用区域中,其中在所述产物离子形成之后即刻在所述第一路径的所述第二部分中捕获所述产物离子或将所述产物离子移除到所述第二部分。另外或替代地,所述方法的某些方面可进一步包括在使所述前驱体离子与所述电子在所述离子处理装置的所述相互作用区域中相互作用时在所述第一路径的所述第一部分中捕获所述试剂离子。
在申请人的本发明教示的一些替代性方面中,所述方法可进一步包括在形成之后即刻通过所述离子处理装置的远端出口端将从所述相互作用区域移除的所述产物离子发射到下游四极棒组中;以及在前驱体离子在所述相互作用区域内与所述电子相互作用时且在使所述产物离子与试剂离子相互作用以使所述产物离子浓缩于较低电荷状态之前在所述下游四极棒组中捕获所述产物离子,其中当所述产物离子捕获于所述下游四极棒组中时,所述试剂离子可被发射穿过所述离子处理装置并进入所述下游四极棒组,以便选择性地减少所述产物离子的电荷来使所述产物离子浓缩于较低电荷状态。
在申请人的本发明教示的一些替代性方面中,所述方法可进一步包括在形成之后即刻通过所述离子处理装置的远端出口端将从所述相互作用区域移除的所述产物离子发射到下游四极棒组中,并在前驱体离子在所述相互作用区域内与所述电子相互作用时和在使所述产物离子与具有试剂离子相互作用以使所述产物离子浓缩于较低电荷状态之前在所述下游四极棒组中捕获所述产物离子。在一些方面中,可接着在所述离子处理装置内终止所述电子捕获解离,且可接着将捕获于所述下游四极棒组内的所述产物离子发射回到所述离子处理装置中来与所述试剂离子相互作用。
在各种方面中,所述电子可在所述相互作用区域中不存在辅助ac激励场的情况下与所述前驱体离子相互作用,且其后,所述产物离子可在存在辅助门ac场的情况下与所述试剂离子相互作用。
根据本发明教示的各个方面,提供一种用于分析离子的系统,所述系统包括样品离子源、带电物种源、电子源和离子处理装置。所述离子处理装置可将由所述离子源通过近端入口端产生的前驱体离子(例如,前驱体肽离子)和来自所述电子源的电子接收到所述离子处理装置的相互作用区域中,使得所述电子在所述相互作用区域内与前驱体离子相互作用以通过电子捕获解离形成产物离子,其中在形成之后且在前驱体离子继续与所述电子相互作用时从所述相互作用区域优选地移除(例如,质量选择性地移除)所述产物离子。由所述带电物种源产生的试剂离子可捕获于所述离子处理装置内来与从所述相互作用区域移除的所述产物离子相互作用,或可被发射穿过所述离子处理装置到下游质量分析器中以与所述产物离子相互作用以便使所述产物离子浓缩于较低电荷状态。
在本发明教示的一些方面中,提供一种用于分析离子的系统,所述系统包括:第一组电极,所述第一组电极的至少第一片段围绕第一中心轴线在四极定向上布置,其中所述第一组电极的所述第一片段沿着所述第一中心轴线从近端入口端轴向地延伸到远端,以便界定沿着所述第一中心轴线延伸的第一路径的第一部分,所述近端入口端用于从离子源接收前驱体离子并从带电物种源接收与所述前驱体离子极性相反的试剂离子;以及第二组电极,所述第二组电极的至少第一片段围绕所述第一中心轴线在四极定向上布置以便界定所述第一路径的第二部分,其中所述第二组电极的所述第一片段沿着所述第一中心轴线从近端轴向地延伸到远端出口端,所述第二组电极的所述近端与所述第一组电极的所述远端间隔开,使得横向路径在所述第二组电极的所述近端与所述第一组电极的所述远端之间延伸,所述横向路径沿着大体上正交于所述第一中心轴线且在相交区域处与所述第一路径相交的第二中心轴线从第一轴向端延伸到第二轴向端。所述系统还可包含电子源,其安置成接近于所述第二路径的所述第一轴向端和所述第二轴向端中的一个来沿着所述第二中心轴线引入多个电子,使得所述电子朝向所述相交区域行进穿过所述横向路径。另外,所述系统可包括一或多个电源,其用于向所述第一组电极和所述第二组电极提供dc电压和rf电压并用以在所述第一路径和所述横向路径中的每一个中产生rf电场、和控制器,其用于控制施加到所述第一组电极和所述第二组中的每一个的所述dc电压和所述rf电压,所述控制器经配置以:i)在所述电子源沿着所述横向路径引入多个电子时在所述横向路径中产生rf四极场,使得所述横向路径中的所述前驱体离子的至少一部分与所述电子相互作用以解离来通过电子捕获解离形成产物离子、ii)至少在所述第一路径的所述第二部分中产生提取电场,使得在形成之后且在前驱体离子与所述电子相互作用时从所述横向路径移除产物离子、并iii)在所述第一路径的所述第一部分和所述第二部分中产生电场,使得沿着所述第一路径发射在所述第一路径的所述入口端处接收到的试剂离子,所述试剂离子用于选择性地减少所述产物离子的电荷以使所述产物离子浓缩于较低电荷状态。在一些方面中,当所述电子源沿着所述横向路径引入多个电子时,不会在所述横向路径内产生辅助ac激励场。
在各种相关方面中,所述系统还可包括:第三组电极,其所述第二中心轴线在四极定向上布置并在所述横向路径的所述第一轴向端与所述相交区域之间延伸;以及第四组电极,其围绕所述第二中心轴线在四极定向上布置并在所述相交区域与所述横向路径的所述第二轴向端之间延伸,其中所述控制器经进一步配置以:i)将dc偏压电压施加到所述第一组电极、所述第二组电极、所述第三组电极和所述第四组电极,使得当使所述前驱体离子的至少一部分与所述电子相互作用之前,在所述第一路径的所述第二部分中捕获在所述近端入口端处接收到的前驱体离子、ii)此后在所述电子源将所述多个电子引入到所述横向路径时将第一辅助ac信号施加到所述第二组电极,使得在所述第一路径的所述第二部分中捕获的所述前驱体离子的至少一部分进入所述相交区域以与所述电子相互作用以形成产物离子,且其中所述第一路径的所述第二部分中的所述电场经配置以捕获从所述横向路径移除的所述产物离子、并iii)此后终止施加到所述第二组电极的所述第一辅助ac信号并变更施加到所述第一组电极、所述第二组电极、所述第三组电极和所述第四组电极的所述dc偏压电压,以共同存储带正电荷离子与带负电荷离子以便选择性地减少所述产物离子的电荷,以通过与所述试剂离子的相互作用来使所述产物离子浓缩于较低电荷状态。另外或替代地,所述控制器可经配置以将所述第一组电极、所述第二组电极、所述第三组电极和所述第四组电极调整成相对于彼此dc电压相同。在各种方面中,rf信号可施加到邻近中心路径和所述横向路径的末端的透镜,以便防止在所述相互存储期间从所述离子处理装置喷射正阳离子和负阴离子两者。
在各种方面中,所述控制器还可在操作上耦合到所述离子源和所述带电物种源来控制由此产生离子的定时,其中所述控制器经配置以控制所述带电物种源以便在所述前驱体离子经历电子捕获解离时产生试剂离子,且其中施加到所述第一组电极、所述第二组电极、所述第三组电极和所述第四组电极的所述dc偏压电压经配置以在所述前驱体离子经历电子捕获解离时在所述第一路径的所述第一部分中捕获试剂离子。在一些相关方面中,所述系统可进一步包括邻近所述第一组电极的所述入口端安置的离子光学元件,所述离子光学元件耦合到所述一或多个电源,且所述控制器经进一步配置以在所述离子光学元件与所述第一组电极之间施加dc偏压并在所述第一组电极与所述第三组电极和所述第四组电极中的电极之间施加dc偏压,以便在所述前驱体离子经历电子捕获解离时在所述第一路径的所述第一部分中捕获试剂离子。
所述电极可具有多种配置。作为实例,在一些方面中,所述第一组电极中的两个电极中的每一个可相对于来自所述第三组电极的一个电极以l形安置,其中所述第一组电极中的另外两个电极中的每一个相对于来自所述第四组电极的一个电极以l形安置,其中所述第二组电极中的两个电极中的每一个相对于来自所述第三组电极的一个电极以l形安置,其中所述第二组电极中的另外两个电极中的每一个相对于来自所述第四组电极的一个电极以l形安置。
在一些替代性方面中,所述第一组电极和所述第二组电极中的所述电极是具有纵向片段和横向片段的l形电极,且其中所述第一组电极和所述第二组电极中的每个电极的所述纵向片段分别界定所述第一组电极和所述第二组电极的所述第一片段,且所述第一组电极和所述第二组电极中的每个电极的所述横向片段界定所述横向路径。在相关方面中,所述系统还可包括在第二组电极远端安置的下游四极棒组,所述四极棒组在其中界定与所述第一路径连通以从其接收产物离子的离子捕获区域。作为实例,在一些相关方面中,所述控制器可经进一步配置以控制施加到所述第二组电极和所述下游四极棒组中的至少一个的dc电压和rf电压中的至少一个,使得在与试剂离子相互作用以使所述产物离子浓缩于较低电荷状态之前在所述下游四极棒组中捕获从所述横向路径移除的产物离子。此外,可提供邻近所述第一组电极的所述入口端安置的第一离子光学元件和邻近所述第二组电极的所述出口端安置的第二离子光学元件,其中所述控制器经进一步配置以控制施加到所述第一离子光学元件和所述第二离子光学元件中的至少一个以及所述下游四极棒组的dc电压和rf电压中的至少一个以便将在所述下游四极棒组中捕获的产物离子发射到所述第一路径,并其后,在将辅助ac信号施加到所述第一组电极和所述第二组电极以便选择性地减少所述产物离子的电荷时同时在所述第一路径和所述横向路径内捕获所述产物离子和所述试剂离子。
申请人教示的这些和其它特征阐述于本文中。
附图说明
所属领域的技术人员将理解,以下描述的图式仅出于说明的目的。所述图式并不打算以任何方式限制申请人教示的范围。
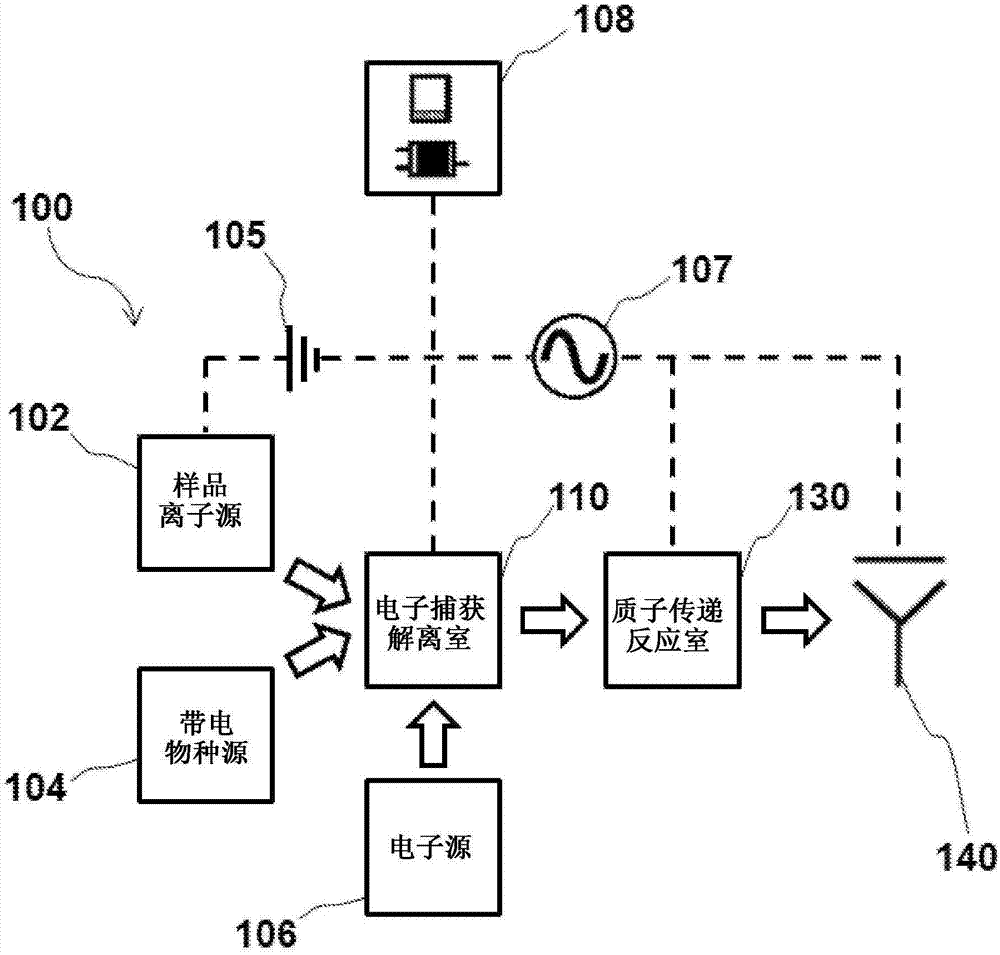
图1以示意图说明根据申请人教示的各种实施例的方面的示范性ecd/ptr质谱仪系统。
图2是展示根据本发明教示的各个方面的图1的系统中处理离子的示范性方法的流程图。
图3a到3d描绘根据本发明教示的各个方面的用于执行图2的示范性方法的示范性系统300的局部视图和示意图。
图4描绘根据本发明教示的各个方面的用于执行图2的示范性方法的另一示范性系统400的局部视图和示意图。
具体实施方式
应了解,为了清楚起见,以下论述将阐明申请人教示的实施例的各个方面,同时每当省略某些具体细节是适宜或恰当的时便省略某些具体细节。举例来说,在替代性实施例中,相同或类似特征的论述可以略微简化。众所周知的想法或概念为简洁起见也可以不进行任何详细论述。技术人员应认识到,申请人教示的一些实施例可能不需要每一实施方案中的某些具体描述的细节,在本文中阐述这些细节仅仅为了提供对实施例的彻底理解。类似地,很明显,可在不脱离本发明的范围的情况下易于根据公共常识对所描述的实施例进行更改或变化。实施例的以下详细描述不应被视为以任何方式限制申请人传授内容的范围。
如本文所使用的术语“约”和“相同”是指可例如通过现实世界中的测量或处理程序;通过这些程序中的无心之失;通过电气元件制造中的差异/错误;通过电损失发生的数字量的变化;以及将由所属领域的技术人员认识为只要不涵盖通过现有技术实践的已知值即可等效的变化。通常,术语“约”意味着比所陈述值或值范围大或小所陈述值的1/10,例如±10%。举例来说,将约+3vdc的电压施加到元件可意味着+2.7vdc与+3.3vdc之间的电压。同样地,当值据称“大体上相同”时,所述值可相差最多5%。不管是否由术语“约”或“大体上”相同修饰,权利要求书中叙述的定量值包含所叙述值的等效物,例如此类值的数字量的会发生的变化,但将由所属领域的技术人员识别为等效物。
在各种方面中,在本文中提供用于分析离子以便实现对样品中存在的完整蛋白质和肽的基于ecd的自上向下分析的方法和系统。而基于ms的蛋白质组学的常规方法可由于具有不同质量的多个产物离子(例如,具有不同肽数目的产物离子)的存在而产生卷积数据,所述产物离子中的每一个可与不同数目个电荷态和/或不完全序列信息(尤其在产物肽离子经受一或多个额外多个解离事件时对于内部肽序列)相关联,本发明教示可适用于利用ecd的高解离效率来产生肽离子的全序列,同时仍然产生不太卷积的质谱。如下文所详细论述,在本文中所公开的方法和系统的各个方面可从ecd反应室的相互作用区域选择性地移除产生于ecd解离事件的产物离子,同时其它前驱体肽离子继续在相互作用区域内经历ecd。作为非限制性实例,方法和系统可实现从相互作用区域质量选择性地提取产物离子,而不在相互作用区域内产生辅助ac激励场,以便避免变更电子的动能和/或路径而损害ecd反应效率。以此方式,本发明教示可由此减少或防止具有产物离子的后续电子捕获事件(例如,次级或三级ecd事件)的发生,以便优选地将前驱体离子限于单个解离事件,由此主要产生可随后经处理以促进蛋白质识别和/或定序的c型和z型产物离子(例如,取决于断裂键的位置而展现不同肽长度)。作为实例,在从ecd产生多个产物离子之后,产物离子可通过以相对带电的试剂离子暴露(例如,同步捕获)经受质子传递反应(protontransferreaction,ptr),以便向较低电荷状态提供非解离电荷减少。
虽然本文中所描述的系统、装置和方法可与比所描绘的质谱仪系统具有更少、更多或不同组件的许多不同质谱仪系统结合使用,但是在图1中示意性地说明用于根据本发明教示使用的示范性质谱仪系统100。如图1中所描绘的示范性实施例中所展示,质谱仪系统100大体上包括用于电离含有或疑似含有一或多个感兴趣分析物(例如,肽、蛋白质)的样品以便从其产生多个前驱体阳离子的样品离子源102、用于产生用于与前驱体阳离子的ecd反应的电子的电子源106、和用于产生试剂阴离子的带电物种源104。此外,质谱仪系统100包含具有相互作用区域的ecd室110和ptr室130,在所述相互作用区域内前驱体阳离子可与电子相互作用以便解离成多个产物离子(例如,肽),在所述ptr室130内产物离子可与试剂阴离子反应以便使产物离子浓缩于较低电荷状态。如下文所详细论述,当前驱体离子继续在反应室内经历ecd时,系统100可在形成之后即刻优选地从ecd室的相互作用区域提取产物离子。尽管ecd室110和ptr室130在图1中描绘为单独的离子-离子反应室,但应了解,在本发明教示的一些方面中,在其中形成产物离子之后,可在ecd室110自身内执行产物离子与试剂阳离子之间的ptr反应,如下文例如参考图3a到3b所论述。
样品离子源102可具有多种配置但大体上经配置以从密封于来自样品源(未展示)的样品内的肽和/或蛋白质产生离子(例如,阳离子)用于根据本发明教示使用的合适样品源可大体上经配置以含有和/或将样品(例如,含有或疑似含有蛋白质或肽的溶液)的样品引入到离子源102,并可例如以流体方式耦合到离子源以便将液体样品传输到离子源102(例如,通过一或多个管道、通道、管路、管、毛细管等等)。作为非限制性实例,样品源可包括待分析的样品的储集器或可通过其注入样品的输入端口。在一些方面中,举例来说,样品源可包括用于使样品持续流动到离子源102中的输液泵(例如,注射泵)。替代地,也作为非限制性实例,待分析的液体样品可呈来自在线液相色谱柱的溶离剂形式,但是在一些方面中,可离线执行一或多个样品制备步骤(例如,多维lc分离、电泳、二硫键还原等等)。
在本发明教示的一些示范性方面中,离子源102可包含与样品源直接或间接流体联通的管道,所述管道在至少部分地延伸到电离腔室中的出口端中终止。当液体样品从出口端排出到电离腔室中(例如,作为多个微液滴)时,密封于微液滴内的肽和/或蛋白质可由离子源102电离(即,充电)。当小滴内的液体(例如,溶剂)蒸发时,蛋白质或肽离子可释放且吸取朝向且穿过孔径以用于发射到ecd室110(例如,通过一或多个质量分析器元件、dms、离子光学元件和/或过滤四极杆)。应了解,所属领域中已知且根据本文中的教示修改的数个不同装置可用作离子源102。作为非限制性实例,离子源102可以是电喷射电离装置、喷洒器辅助电喷射装置、化学电离装置、喷洒器辅助雾化装置、光电离装置、激光电离装置、热喷射电离装置和声波喷涂电离装置。
带电物种源104还可具有多种配置,但大体上经配置以相对于由离子源产生的离子产生具有相对电荷的试剂离子。举例来说,如所属领域的技术人员将了解,当产物离子带正电荷时,可利用离子源,比如上文所论述且经配置以在负离子模式下操作以便产生试剂阳离子的离子源。作为实例,带电物种源104可包含带负电荷的放电针,使得在放电到电离腔室中之后即刻去质子化(例如,[pfo-h]-)试剂(例如,全氟-1-辛醇或pfo)。
如图1中所展示,系统100可另外包含用于如在本文中另外论述而产生电子和/或将电子引入到ecd室110中的电子源106。所属领域的技术人员将了解,适合用于质谱仪系统中来提供用于离子-离子反应的电子且根据本发明教示修改的任何电子源可用于系统100中。作为非限制性实例,电子可由长丝(例如,钨、涂钍钨等)或例如y2o3阴极等另一电子发射极产生。在示范性操作中,可施加1a到3a的电流以热电子源,电子源产生1w到10w的热功率以便产生电子。应了解,电子源106可在一些方面中另外与磁场产生器(例如,永久钕磁铁或电磁体,未展示)相关联,以控制ecd反应室内的电子的路径、用于激活已激活离子ecd(activatedionsecd,ai-ecd)中的离子的光子或光源(例如,激光器)、和冷却机构(例如,散热器、主动冷却)以将所利用磁体(如果存在)的温度维持低于其居里温度,在居里温度下损失永久磁体的磁化。还可利用冷却磁体的其它已知方法。
如所展示,系统100包含能有效地检测从ecd室110和ptr室130发射的离子的质谱仪140(例如,飞行时间质量分析器、离子阱质量分析器、法拉第杯或其它离子电流测量装置)。如所属领域的技术人员将了解,系统100可另外包含安置于ecd室110和ptr室130上游或下游以用于进一步离子处理、操纵和/或质量分析的任何数目个额外质量分析器元件或离子光学元件。作为实例,可通过一或多个额外以差动方式泵吸的真空级(例如,在大致2.3托的压力下维持的第一级、在大致6毫托的压力下维持的第二级、和在大致10-5托的压力下维持的第三级,第三单元含有检测器140和在其间定位有ecd室110的两个或更多个四极质量分析器)输送离子。举例来说,在一个实施例中,ecd室110可表示或替代q-q-q三重四极棒质谱仪内的q2(见例如baba等人,“射频离子阱中的电子捕获解离(electroncapturedissociationinaradiofrequencyiontrap)”,anal.chem.2004,aug.1;76(15):4263-6,pct出版第wo2014191821号,标题为“线内离子反应装置室和操作方法(inlineionreactiondevicecellandmethodofoperation)”,描述exd装置的这些示范性编号中的每一个的教示以全文引用的方式并入)。
如所展示,系统100可另外包含在操作上耦合到系统100的元件中的一或多个以便控制其操作的控制器108。作为实例,控制器108可包含用于处理信息的处理器、用于存储质谱数据的数据存储装置、和待执行的指令。如下文详细地论述且如所属领域中通常已知且根据本发明教示而修改,控制器108可控制样品离子源102的离子、带电物种离子源104的试剂离子和电子源106的电子产生,和/或通过将一或多个rf/dc电压施加到ecd室110和ptr室130的电极来离子控制离子移动到且穿过所述ecd室和所述ptr室中,作为实例。应了解,虽然控制器108描绘为单一组件,但是一或多个控制器(不论本地还是远程)可经配置以致使质谱仪系统100根据本文所描述的方法中的任一个而操作。此外,控制器108还可以操作方式与输出装置和/或输入装置相关联,所述输出装置例如用于显示器(例如,用于向计算机用户显示信息的阴极射线管(crt)或液晶显示器(lcd)),所述输入装置包含用于向处理器传达信息和命令选择的字母数字和其它按键和/或光标控制件。根据本发明教示的某些实施方案,控制器108可例如执行含于数据存储装置中的一或多个指令的一或多个序列,或将所述序列读取到来自计算机可读媒体的存储器中,例如存储装置(例如,磁盘)。一或多个控制器可呈硬件或软件形式,举例来说,控制器108可呈经合适地程式化的计算机形式,其在其中存储有可经执行以致使质谱仪系统100如本文中另外所描述而操作的计算机程序,但是本发明教示的实施方案不限于硬件电路与软件的任何特定组合。举例来说,与控制器108相关联的各种软件模块可执行可编程指令以执行下文参考图2所描述的示范性方法。
如图1中所展示,示范性质谱仪系统100可另外包含一或多个电源(例如,dc电源105和rf电源107),所述电源可受控制器108控制以便将具有rf、ac和/或dc分量的电位施加到各种组件的电极,来以协调方式和/或针对各种不同操作模式对质谱仪系统100的元件进行配置,如在本文中以其它方式所论述。
现参考图2,描绘了根据本发明教示的各个方面的用于操作图1的质谱仪系统100的示范性方法。如步骤201中所展示,方法200可以将含有肽或蛋白质的样品从样品源递送到离子源102开始,由此如步骤201中所展示而电离样品以便产生多个肽和/或蛋白质阳离子。可接着将前驱体阳离子发射到ecd室,如步骤202中所展示。在各种方面中,ecd室上游的一或多个质量分析器可操作为可经操作以选择一系列感兴趣的前驱体阳离子以用于穿过其发射的常规发射rf/dc四极滤质器。作为实例,可为上游四极棒组提供适合于在质量解析模式下操作的rf/dc电压。如所属领域的技术人员将了解,考虑四极棒组的物理特性和电特性,可选择所施加rf电压和dc电压的参数以使得ecd室110接收落于特定隔离窗(例如,通带)内的具有m/z的前驱体阳离子,或可跨越多个m/z隔离窗扫描此通带。此外,质谱仪系统100可包含其上游的一或多个额外元件(例如,仅rf聚焦离子导向器q0、微分迁移率过滤器(differentialmobilityfilter,dms))。对所属领域的技术人员将还显而易见的是,系统中可存在数个离子光学元件。在一些方面中,步骤202可包括在前驱体离子经受ecd之前在ecd室内捕获前驱体阳离子。
继续参考图2,示范性方法200可包括在相互作用区域内执行ecd反应(步骤203),并在一些方面中,在前驱体离子保持在相互作用区域内时从相互作用区域优选地提取产物离子的至少一部分(204)。也就是说,当前驱体离子暴露于在步骤207中由电子源106产生和/或引入到ecd室110中的电子时,可选择性地从相互作用区域提取在相互作用区域中通过前驱体离子与电子的相互作用产生的产物离子(例如,如图3a到3b中),且在一些方面中,完全从ecd室提取产物离子(例如,如图4和5中)以与相互作用区域分离地捕获。一起来自同一前驱体离子的两个产物离子(c片段和z片段)可展现比前驱体离子的m/z更高的m/z,这是因为少了一个正电荷在ecd反应之后与产物离子相关联。因为此方面,从相互作用区域提取具有更高m/z比的那些离子可以是优选的。以此方式,ecd室110的相互作用区域可经配置以在电子发射穿过相互作用区域时类似于高通滤波器而操作,原因在于可从相互作用区域移除具有大于选定值的m/z比(例如,对应于感兴趣的前驱体离子的典型质量和电荷状态)的产物离子,而到那时为止未反应前驱体离子继续在相互作用区域中暴露于电子,由此降低待经受额外电子捕获事件(例如,次级或三级解离事件)的产物离子的可能性。重要的是,因为相互作用区域内的小振幅辅助ac场会变更电子的动能而损害ecd反应效率,所以在四极rf场中优选地执行步骤203和204而不在相互作用区域内产生辅助ac场。
在ecd反应之后,根据本发明教示的各个方面的方法可包含使所提取产物离子浓缩于较低电荷状态的步骤。举例来说,如图2中所展示,方法200可包含步骤205,其中在如图1中所展示的ecd室110或单独ptr室130中以试剂阴离子捕获产物阳离子,使得至少产物离子通过质子传递反应(ptr)经历非解离电荷减少。在步骤208中,可通过图1的带电物种源104产生试剂阴离子并将试剂阴离子发射到ecd室110中以在其中进行ptr反应,或在步骤209中发射到ecd室110中并发射穿过ecd室110以在操作为例如ptr室130的下游离子阱中与产物离子反应。如将在下文详细论述,根据本发明教示的一些方面而选择性地将rf和dc电位施加到ecd室110可使得能够在前驱体离子经历ecd时在ecd室110的与前驱体和产物离子分离的一部分内产生并捕获试剂阴离子,举例来说,在ecd反应之后调整电位使得前驱体阳离子和试剂阴离子可与ecd室110相互作用。替代地,在一些方面中,可在通过ecd产生产物离子之后激活带电物种源104,试剂阴离子被发射到在其中捕获有产物离子的ecd室110或ptr室130中。
在步骤205中使产物离子浓缩于较低电荷状态之后,方法200进一步包含例如通过下游质量分析器、cid室(例如,如ms2中)和/或检测器(例如,tof检测器)进一步处理和/或检测具有相同m/z的产物离子的一或多个步骤206。通过使前驱体离子经受单个ecd反应使得优选地产生c型和z型产物离子(即,通过选择性地提取产物离子)并其后降低产物离子的电荷状态,示范性方法200可产生提供前驱体蛋白质或肽的更全序列的不太卷积的质谱。
现参考图3a到3d,描绘根据本发明教示的各个方面的用于执行图2的示范性方法的示范性系统300和示意图的局部视图。如图3a中最佳展示,系统300大体上包含电子源330、和具有经布置以便界定中心纵向轴线(a)和横向轴线(b)的多个电极的ecd室310。如所展示,系统300可另外包含上游四极棒组q1(其安置于离子源与ecd室310之间)和下游四极棒组q2(其安置于ecd室310与检测器之间)。在各种方面中,ecd室310可容纳于真空腔室内(例如,在亚大气压下),同时添加例如氦气(he)或氮气(n2)等气体以减缓前驱体离子在ecd室内的移动以便延长相互作用区域内的前驱体离子与电子之间的相互作用时间。通常,作为非限制性实例,冷却气体的压力可介于10-2与10-4托之间。此外,例如永久磁体等磁场源可经配置以产生平行于横向通道316的磁场,如例如由箭头(b)示意性地描绘。磁场还可由任何其它磁场产生源产生,并还可包含用以产生平行于且与第二路径的第二中心轴线(b)成直线的场的电磁、钕磁铁等等。磁通量密度可以是能够实施磁场以致使聚焦电子束并可范围例如高达1.5t但优选地约0.1到1.0t的任何密度。具有更高密度的磁体可更远离电极对而定位。0.1t的磁场(如由箭头b指示)对准以平行于且沿着电子引导路径。
如图3a中所展示,示范性ecd室310包括4组电极311到314,所述组电极中的每一个围绕两个轴线中的一个在四极定向上布置。也就是说,每一组电极311到314包括四个并联导电棒或伸长的电极,其被布置成使得其中心形成正方形的角且其相对杆可电连接(例如,对于典型的四极场,静态dc电位和正弦rf电位与彼此相对的邻近电极的相位的重叠)。具体地说,如图3a中所展示,第一组311四个电极311a到311d围绕中心纵向轴线(a)安置以便界定轴向通路的部分315a。第一组311电极沿着其从入口端轴向地延伸,可穿过所述入口端将由上游样品离子源产生(未展示,例如通过q1)的前驱体离子接收到ecd室310内的远端。第二组312四个电极312a到312d(其中仅展示电极312a和312b)也围绕中心纵向轴线(a)安置以便界定轴向通路的第二部分315b。如所展示,第二组312电极与第一组311电极间隔开,使得横向轴线(b)在第一组311电极的远端与第二组312电极的近端之间延伸。如所展示,举例来说,第二组312电极从近端延伸到远端,可通过远端将离子从ecd室310喷射到一或多个质量分析器(例如,q2通过出射透镜iq3)或检测器。此外,第三组313电极313a到313d和第四组314电极314a到314d(在每一组中仅展示四个电极中的两个)围绕横向轴线(b)安置,每一组电极在中心纵向轴线(a)的相对侧上在四极定向上围绕中心纵向轴线安置。通过此布置,第一组311中的每个电极大体上与第三组313或第四组314中的一个电极形成l形,而第二组312中的每个电极大体上与第三组313或第四组314中的电极形成l形。因此,如所展示,第一组311和第二组312至少部分地界定轴向通路,且第三组313和第四组314至少部分地界定在相交区域317处与轴向通路315相交的横向通道316。
所属领域的技术人员应了解,第一、第二、第三和第四组中的电极可具有多种形状和大小,但大体上经配置以在适当的rf信号施加到每组中的电极时在每组电极包围的通路的部分内产生四极场。作为非限制性实例,每个电极可具有介于约3cm的范围内的纵向尺寸(例如,沿着电极311a到311d的中心纵向轴线(a)且沿着电极313a到313d的横向轴线(b)的尺寸)和介于约5mm或更大的范围内的横向尺寸(例如,宽度或半径、垂直于电极311a到311d的中心纵向轴线(a)且垂直于电极313a到313d的横向轴线(b)的尺寸)。如图3a的插图中所展示,在一些方面中,每个电极可按距离(2r)与所述组电极中的其相对电极(例如,跨越每个电极311a到311d的中心纵向轴线(a)的非邻近电极)径向分离,其中r介于约2mm到约10mm的范围内。
继续参考图3a,ecd室310可进一步包含多个透镜320a到320d,所述透镜中的每一个可呈具有可穿过其发射离子或电子的中心孔口的导电板形式。如所展示,透镜320a到320d可邻近于上文所论述的各组电极的入口端或出口端而安置。举例来说,透镜320a可充当离子可穿过其进入ecd室的离子喷射端口,且透镜320b可在解离之后和/或在ptr之后充当离子(例如,如下文所论述的产物离子)可穿过其离开ecd室310的离子喷射端口。如在本文中另外所论述,rf和/或dc电位可施加到各种透镜320a到320d来控制离子在ecd室310内的移动。举例来说,如下文更详细地论述,各种rf和/或dc信号可在离子处理的各阶段期间施加到透镜320a和320b,以便于在电极之间的空间的部分内轴向捕获离子或以便于将离子注入到ecd室310中和将离子喷射出ecd室310。类似地,透镜320c和透镜320d可偏置(例如,通过施加适当的dc电压)以阻止离子在横向路径316内离开。
在本发明教示的各种方面中,q1可操作为操作以选择感兴趣的离子和/或一系列感兴趣的离子常规发射rf/dc四极滤质器。作为实例,四极棒组q1可配备有适合于在质量解析模式下操作的rf/dc电压。如所属领域的技术人员将了解,考虑q1的物理特性和电特性,可选择所施加rf电压和dc电压的参数以使得q1建立具有m/z通带的四极场,选择所述通带以允许特定前驱体阳离子(例如,展现属于特定范围内的m/z)横越基本上不受打扰的四极场,而具有属于通带外部的m/z比的离子可由四极场退化成轨道衰减。应了解,此操作模式仅仅是q1的一个可能操作模式。如所展示,在一些实施例中,一组仅rf粗短棒可设置于相邻对四极棒组之间以便于在四极杆之间传递离子。举例来说,粗短棒可充当brubaker透镜,并可有助于在透镜维持在偏置电势下的情况下防止离子经历因与可已在邻近的透镜附近形成的任何边缘场相互作用所致的轨道衰减。作为非限制性实例,图3a描绘q1与透镜320a之间的粗短棒st以将离子的流动聚焦到轴向通道的第一部分315a中。类似地,由ecd室310发射的离子(例如,产物离子)可传递到可在上游由透镜320b限定的邻近四极棒组q2中。如所属领域的技术人员将了解,q2可以数种方式操作,例如操作为ptr室,操作为用于执行碰撞引发式解离的室(例如,如ms2中),操作为扫描rf/dc四极杆,操作为四极离子阱或操作为线性离子阱。
现特定参考图3b到3d,描绘根据本发明教示的各个方面的用于利用图3a的ecd室310来执行图2的示范性方法的示意图。如上参考图2的步骤202所述,在产生前驱体阳离子之后,可将前驱体阳离子发射穿过q1(例如,在通带模式下操作)并进入ecd室310,其中可通过选择性地将rf和/或dc信号施加到各种电极和ecd室的透镜来在轴向路径的第二部分315b内捕获所述前驱体阳离子。举例来说,如图3b中所展示,在前驱体加载阶段期间,第一、第二、第三和第四组电极中的电极可被施加rf信号(来沿着中心纵向轴线或横向轴线径向聚焦),同时可产生dc梯度以便在轴向路径的第二部分315b中形成电位阱以在其中捕获阳离子。作为实例,如由前驱体加载阶段期间的中心纵向轴线(a)上的dc电场的示意图指示,可在第一dc偏移下维持第一组311电极;可在相对于第一dc偏移对阳离子更有吸引力的第二dc偏移下维持横向路径316的入口(上游)侧上的第三组313电极和第四组314电极中的电极(例如,313a、314a);可在相对于第二dc偏移对阳离子更有吸引力的第三dc偏移下维持横向路径316的出口(下游)侧上的第二组313电极和第三组314电极(例如,313b、314b);可在相对于第三dc偏移对阳离子更有吸引力的第四dc偏移下维持第二组电极;且可在排斥性dc电位下维持透镜320b以阻止阳离子穿过离开所述透镜。以此方式,进入ecd室310的入口端的前驱体阳离子可被发射到轴向路径315的第二部分并可捕获于其中。应了解,鉴于本文中的教示,此配置仅仅是在前驱体加载阶段期间向ecd室310的电极施加rf和dc信号的一个实例。作为实例,可例如通过相对于第一组311的dc偏移按排斥性dc偏移在横向路径316的入口(上游)侧上维持第三组313电极和第四组314电极中的电极(例如,313a、314a)来替代地在轴向路径的第一部分315a内捕获前驱体离子。但是,此配置可能无法使得能够产生试剂阴离子和/或将试剂阴离子发射到ecd室310中,直到完成ecd反应之后为止以便避免试剂阴离子与前驱体/产物阳离子之间的过早ptr反应。
现参考图3c,在轴向路径315的第二部分315b内捕获前驱体阳离子之后,可调整施加到ecd室310的电极的信号以便促进前驱体选择性ecd。具体地说,如示意图中所展示,辅助ac信号可施加到第二组312中的四个电极312a到312d以便共振地激励在其中捕获的前驱体离子。如所属领域的技术人员将鉴于本发明教示而了解,辅助ac信号可包括例如施加到四个电极312a到312d的正弦电位,选择频率以对应于前驱体阳离子的长期频率(即,ω前驱体)。以此方式,前驱体阳离子可获得充足的动能以克服dc场使得前驱体阳离子由于其在ecd室310的运动增加中而进入相交区域317。当施加此辅助ac信号时,可激活电子源310使得电子被发射穿过相交区域317以允许电子与前驱体阳离子在那里相互作用。如果在相交区域内发生ecd事件,那么将接着将由此形成的产物离子提取到轴向路径的第二部分315b中并捕获于所述第二部分内,这是因为辅助ac信号将不相对于前驱体离子共振地激励具有不同m/z的产物离子。因此,前驱体离子可继续优选地经历ecd反应,而先前形成的产物离子避免次级或三级ecd事件。所属领域的技术人员将进一步了解,在图3c中所描绘的示范性ecd反应步骤中,由第二组电极产生的辅助ac场大体上受限于轴向路径315的第二部分315b,使得沿着横向路径316发射的电子将不由此影响而损害ecd反应效率,如本文中另外论述。
此外,如图3c中所展示和上文所提到,ecd室310可使得能够在前驱体离子经历ecd时在ecd室310内捕获试剂阴离子。举例来说,如沿着中心纵向轴线在电场的平均电位的曲线中示意性地所展示,可调整施加到透镜320a的dc信号(即,使其对负试剂离子排斥),使得试剂阴离子沉降并捕获于在轴向通道315的第一部分315a内产生的电位阱内。
现参考图3d,在ecd反应时间段终止(例如,电子源关断、具有ω前驱体的辅助ac信号停止)之后,根本发明教示的各个方面的示范性方法即刻以非解离方式实现试剂阴离子与产物阳离子的相互作用,使得可以降低产物离子的电荷状态。作为实例,可调整施加到ecd室310的电极的信号,使得捕获于轴向通道315的第一部分315a中的试剂阴离子与捕获于第二部分315b中的产物阳离子可在ptr过程中相互作用。具体地说,当径向捕获rf电压保持接通时,第一、第二、第三和第四组电极中的每一个可被调整成相同dc偏移(例如,关断轴向dc捕获电压)。类似地,透镜320a到320d可被施加rf信号以便防止从ecd室310喷射离子。以此方式,产物阳离子和试剂阴离子两者可横越轴向通道315和横向通道316两者,由此允许所述离子混合并彼此相互作用以便实现非解离电荷减少。如上文参考图2所论述,在步骤205中使产物离子浓缩于较低电荷状态之后,可接着从收集器喷射产物离子以用于进一步处理和/或检测。
现参考图4,描绘根据本发明教示的各个方面的另一示范性系统400的部分示意图。如所展示,系统400类似于系统300,但差异在于ecd室410替代地包括一起界定轴向通道和横向通道的两组电极411、412。具体地说,并非电极311a到311d中的每一个与来自第三组和第四组的邻近电极中的一个电隔离并形成大体l形,如图3a的插图中所展示,使得施加到所述电极的信号可在上文所描述的示范性方法期间彼此不同,而是电极411a到411d呈连续l形电极形式。也就是说,举例来说,电极411a的沿着中心纵向轴线延伸的部分与电极411a的沿着横向轴线延伸的部分始终维持在相同电位下。通过此布置且通过恰当地施加rf电压(例如,具有彼此相对的组411a、411b内和其之间的每个邻近电极的相位的正弦rf电位),可在轴向通道和横向通道中的每一个中产生四极场。
如同图3a,系统400同样地包含安置于ecd室410与检测器之间的至少一个下游四极棒组q2a和q2b,但差异在于不存在安置于第二组412电极的出口端与q2a之间的出射透镜。实际上,ecd室410包含透镜透镜420a、420c、420d,所述透镜中的每一个可呈具有中心孔口的导电板形式,可穿过所述中心孔口发射离子或电子。如上,透镜420a可充当离子可穿过其进入ecd室410的离子喷射端口,而透镜420c和透镜420d可偏置(例如,通过施加适当dc电压)以阻止离子在横向路径内离开。如在本文中另外所论述,rf和/或dc电位可施加到第一组411电极和第二组412电极的l形棒、各种透镜420a、420c、420d、q2a和q2b,来控制离子在系统400内的移动。举例来说,如下文更详细地论述,各种rf和/或dc信号可在离子处理的各个阶段期间施加到q2a,以便于在产物离子的ecd引发的产生期间从ecd室410移除具有更高m/z比的产物离子。
现将参考示范性电场图描述根据本发明教示的各种示范性方面的系统400的操作,所述示范性电场图沿着离子行进路径描绘轴向位置处的中心纵向轴线上的示范性电场强度。如上文参考图2的步骤202所论述,在产生前驱体阳离子且发射穿过q1(例如,在通带模式下操作)之后,可通过选择性地将rf信号施加到电极组411、412并将dc阻挡电位施加到透镜420a、420c、420d来在ecd室410中捕获前驱体阳离子(即,透镜420a、420c、420d相对于电极411a到411b和412a到412b对阳离子更具排斥性)。此外,可在在加载阶段期间对前驱体阳离子更具排斥性的dc偏移下维持下游棒组q2a。
如图4中所展示,在ecd步骤的起始时(例如,在启动电子源且ecd室410内捕获的阳离子在横向通道中与电子相互作用之后),可在辅助ac信号同时施加到q2a时将施加到q2a的dc偏移调整为对阳离子更有吸引力。如所属领域的技术人员将了解,鉴于本发明教示,可选择ac信号(例如,通过调整振幅)以便变更q2a中缠身的伪电位阱深,粗略地如下估算:
在ecd反应时间段终止之后(例如,当电子源关断时),可即刻通过移除施加到q2a的ac振幅(例如,将ac振幅设定成0)来将ecd反应区域中剩余的离子传递到q2a。当使施加到q2a的电极的dc信号对试剂离子有吸引力时,可接着再次接通施加到q2a的ac信号。可接着激活带电物种源以产生通过系统400传递以同时捕获于q2a内使得产物离子可与其一起经历ptr的试剂阴离子。在使产物离子浓缩于较低电荷状态(例如,图2的步骤205)的ptr时间段的结束之后,可接着从q2a喷射产物离子以用于进一步处理和/或检测。
应了解,可在不脱离本发明教示的范围的情况下对所公开的实施例进行众多改变。虽然前述图和实例参考特定元件,但是这仅意图作为实例和说明并且不作为限制。所属领域的技术人员应了解,可在不脱离由随附权利要求书涵盖的教示的范围的情况下对所公开实施例进行各种形式和细节改变。
- 还没有人留言评论。精彩留言会获得点赞!