基于金属镀覆的电能储存单元的制作方法
本公开涉及电化学存储单元,具体涉及一种基于金属镀覆的电化学能量存储单元,其可包括电池(例如可再充电电池)、或组合的电池/超级电容器。
背景技术:
电池
如本文所用,电池是指具有由电解质隔开的两个电极(阳极和阴极)的单元。所述单元可以是电化学单元。电极中的材料可以同时有电子活性和化学活性。阳极可以是化学还原剂,而阴极可以是化学氧化剂。因此,阳极和阴极都能够获得和失去离子,通常能够获得和失去相同的离子,该离子被称为电池的“工作离子”。电解质可以是化学活性但是电子被动式的。电解质的化学活性通过获得和失去离子的能力表现出来,所述离子通常是工作离子。电解质通常是电子绝缘体,并且可能不会促进电池内电子的移动。
电池可以通过在具有电子和离子组分的两个电极之间的化学反应来操作,因此该化学反应被称为“电化学反应”。电解质对单元内部的工作离子进行传导,并且作为电子绝缘体,其使得参与反应的电子能够通过外部电路。
当在电池中使用液体或聚合物电解质时,使电子绝缘体与两个电极保持接触的隔膜可以用于保持两个电极不会在单元内彼此电子接触。隔膜可以被液体或聚合物电解质渗透,以允许两个电极之间的离子传导。在一些电池实施方式中,固体电解质可以用作隔膜。固体电解质可以单独使用,或者与接触一个或两个电极的液体或聚合物电解质一起使用。固体电解质也可以用作隔膜,以使得不需要单独的隔膜。
电池通常以工作离子命名。例如,锂离子(li+)是锂离子(li离子)电池的工作离子。钠离子(na+)是钠离子(na离子)电池的工作离子。锂离子电池通常用于电子设备、电动工具和电动车辆。锂离子电池以放电状态组装,从而能够制备不含金属锂的高电压阴极和阳极,同时可以使用易燃的有机液体电解质。通过制造复杂的电极形态已经获得了锂离子电池的持续改善,但是碳阳极具有有限的容量并且在过高的充电速率下可能被金属锂镀覆。此外,如果单元过度充电,则层状氧化物阴极可能会失去氧。管理大量单元堆叠物的多次充电和放电循环可能增加大型多单元电池(例如用于电动车辆的电池)的成本。此外,增加适用于便携式电池以及其它应用的电池的体积容量的能力受到限制。最后,适用于大多数锂离子电池的有机液体电解质是易燃的,存在安全风险,特别是如果电池形成枝晶或者以允许电池中阴极和阳极之间电子接触的某种方式受到损坏,则尤为如此。
超级电容器
超级电容器利用在电极-电解质界面处的电子双层电容,在界面处正电荷和负电荷仅以原子尺寸隔开。此外,如果电解质由于存在电偶极子而具有大的介电常数,则电容可以进一步增加。即使在超级电容器可能包含电能存储的法拉第组件的情况下,超级电容器也仍将电力存储为静电荷而不是化学能。
技术实现要素:
本公开提供了一种包括电池的电化学存储单元。电池包括:具有阳极费米能的碱金属阳极;能够传导碱金属的电子绝缘的无定形干燥固体电解质,该电解质具有通式a3-xhxox,其中0≤x≤1,a是碱金属,x是至少一种卤化物;包括阴极集电器的阴极,其阴极费米能低于阳极费米能。在电化学存储单元操作期间,将碱金属由固体电解质以无枝晶的方式镀覆到碱金属阳极上。而且,在电化学存储单元操作期间,碱金属进一步镀覆到阴极集电器上。
电化学存储单元还可以具有以下一个或多个附加技术特征,除非明确相互排除,否则所述附加技术特征可以彼此组合:a-i)碱金属是锂(li);a-ii)碱金属是钠(na);b)固体电解质还包含玻璃形成添加剂,所述玻璃形成添加剂包括氧化物、氢氧化物和硫化物中的至少一种;c)固体电解质还包含玻璃形成添加剂,所述玻璃形成添加剂包括氧化物、氢氧化物和硫化物中的至少两种;d)固体电解质还包含玻璃形成添加剂,所述玻璃形成添加剂包括ba(oh)2、sr(oh)2、ca(oh)2、mg(oh)2、al(oh)3、或bao、sro、cao、mgo、al、b2o3、al2o3、sio2、s和li2s中的至少一种;e)固体电解质还包含玻璃形成添加剂,所述玻璃形成添加剂包括ba(oh)2、sr(oh)2、ca(oh)2、mg(oh)2、al(oh)3、或bao、sro、cao、mgo、al、b2o3、al2o3、sio2、s和li2s中的至少两种;f)固体电解质还包含小于2摩尔%的玻璃形成添加剂;g)由于固体电解质的原因,电池可以化学方式和静电方式操作性地存储电力;h)在电池范围之外,阴极集电器通常不会被碱金属润湿;i)阴极集电器包含铜(cu)、银(ag)、锌(zn)或金(au)金属,或它们的合金;j)阴极包含碳,所述碳有助于将碱金属镀覆在阴极集电器上;k)阴极包括与固体电解质相邻的阴极集电器表面上的金膜;l)阴极包括与固体电解质相邻的阴极集电器表面上的氧化物膜;m)电池还包括催化氧化还原中心继电器材料,并且,在电化学存储单元的操作期间,碱金属还可借助于催化氧化还原中心继电器材料操作性地镀覆在阴极集电器上;n-i)催化氧化还原中心继电器材料包含硫;n-ii)催化氧化还原中心继电器材料包含二茂铁;n-iii)催化氧化还原中心继电器材料包含硅;n-iv)催化氧化还原中心继电器材料包含硫化物;n-v)催化氧化还原中心继电器材料包含氧化物;o)在开路电压下,碱金属的离子从固体电解质镀覆到阳极上以使电池自充电;p-i)电池是原电池;p-ii)电池是蓄电池;q)电化学存储单元还包括超级电容器;r)电池具有内部电池电阻rb,dis,当连接到具有电阻rl的电子装置时,损耗idis=rl+rb,dis小于通过热量由外部供应的能量,从而产生连续的idis。
本公开还包括使用任一上述电化学存储单元的方法,例如用于自充电、或用于为电子装置供电,特别是通过连续的idis供电。
附图简要说明
可通过参考下述结合附图的说明来获得对本发明某些实施方式和优势的更全面的理解,这些附图与本公开的实施方式有关。
图1是催化氧化还原中心继电器电池的示意图。
图2是具有电解质能量窗口的稳定电池的能量分布的示意图,所述电解质能量窗口具有能隙eg,所述eg=lumo–homo、或等于最低未占分子轨道(lumo)-最高占据分子轨道(homo)。.
图3是li/li-玻璃/cu单元[包含硫(s)继电器]形式的li/s单元的放电电压与容量的曲线图。
图4是相对于锂阳极容量,图3的li/s单元的放电电压相对于容量的曲线图。
图5是在一个放电/充电循环为充电10小时、静止2小时、放电10小时、静止2小时,并且进行多次循环下,图3的li/s单元中的电力存储的存储效率和库仑效率的曲线图。
图6是在二茂铁分子作为氧化还原中心用于将钠镀覆到铜集电器上的na/na-玻璃/cu单元中,电力存储的存储效率和库仑效率的曲线图。
图7是li/s单元的充电/放电电压分布与时间的曲线图,其中,该单元是自充电的。
图8是al/li-玻璃/cu单元的充电/放电电压曲线图,其插图中显示,由于金属锂镀覆到铝阳极上,在开路下连续自充电时,电力存储的库仑效率增加到超过100%。
具体实施方式
本公开涉及基于金属镀覆的电能存储单元。该单元可以包括电池(battery),特别是可再充电电池,以及电池和超级电容的各种组合。更具体地说,本公开描述了全固态可再充电单元(cell),其中在充电期间镀覆在阳极集电器上的金属的阳离子由电解质供应。根据本公开所述的电池可以具有高的能量存储容量以及高的充电速率,并且在多次循环后具有长的操作寿命。根据本公开所述的超级电容器可以具有优化或提高的体积储存能量密度。
根据本公开所述的电池和超级电容器可以包含固体电解质,该固体电解质包含彼此平行取向的电偶极子,并且如果电极或集电器在电化学电势方面具有大的能量差,则包含法拉第电能存储和电容电能存储的串联连接的电池单元可以表现出能量密度得到提高。传统锂离子电池具有碳电极和层状氧化物阴极,并且在充电和放电的速率和程度上受限,与该传统锂离子电池不同的是,本公开提供了体积能量密度大、充放电速率快、循环寿命长的安全的全固态电池或超级电容器单元。
本公开描述了全固态可再充电单元,其中在充电期间镀覆在阳极集电器上的金属的阳离子由电解质供应。
在二次(可再充电)单元中,将阴极集电器上的碱金属镀覆回阳极上而不形成阳极枝晶。如果碱金属润湿固体电解质表面,并且阳极没有钝化的固体电解质中间相(sei)层,使得固体电解质在大于μa(这是阳极的费米能)的能量下具有最低未占分子轨道(lumo),则可以防止阳极枝晶。如本文所公开,这样的固体电解质可以使得单元安全,并且单元中的电能存储效率可以接近100%,并且循环寿命长。
在本文所公开的电池单元中,电能作为化学能存储可以通过将电能作为静电能存储来补充,如在超级电容器中那样。静电能可以通过在电极-电解质界面处形成双电层来提供。此外,如果电解质包含电偶极子,则可以进一步提高所存储的静电能,特别是在电偶极子彼此平行取向的情况下尤为如此。本文公开的存储在单元中的静电能的充电和放电速率可以相对高并且效率高。
在本公开的电化学单元(例如,电池单元)中,金属可以由固体电解质进行镀覆。所镀覆的金属可以是工作离子的金属形式。例如,金属可以是碱金属,例如,锂(li)、钠(na)或钾(k)、或者镁(mg)、或者铝(al)。金属有利地镀覆在阴极集电器上,例如,铜(cu)、银(ag)、锌(zn)或金(au)金属阴极集电器,或它们的合金阴极集电器;可以发生镀覆而不形成枝晶或对能量存储单元性能有害的其它金属结构。
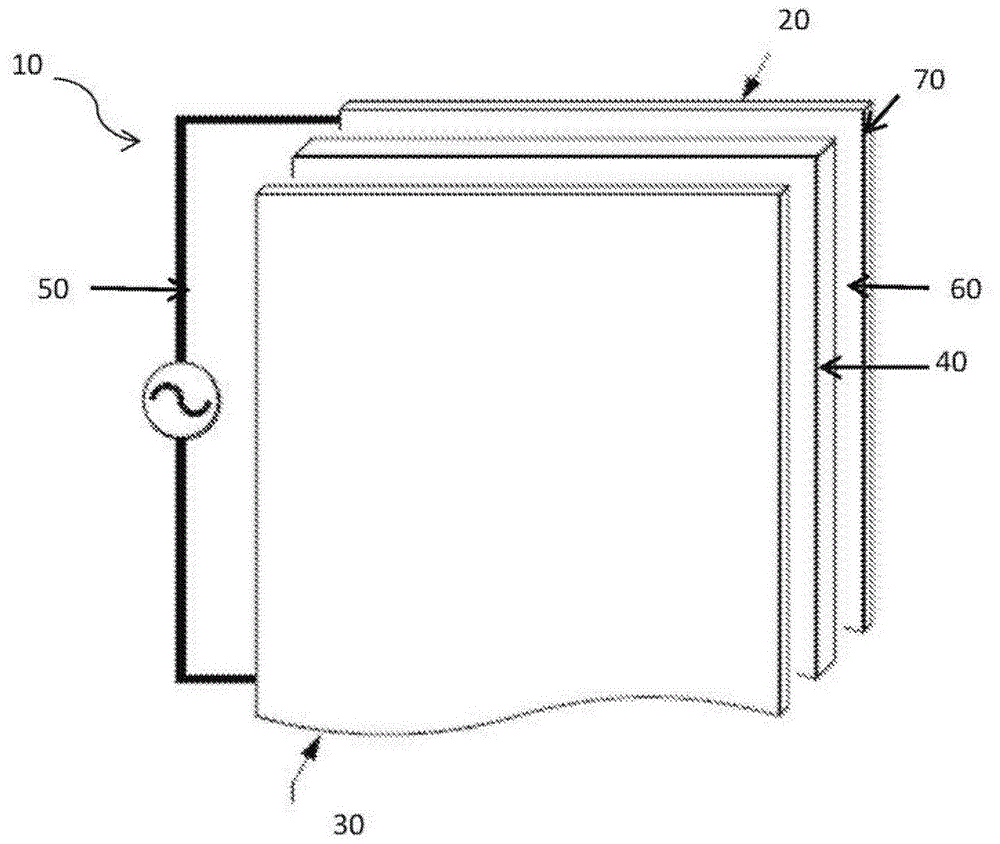
图1是催化氧化还原中心继电器电池10的示意图,该催化氧化还原中心继电器电池10包括阴极20、阳极30和电解质40。电池10可以连接到外部电路50,外部电路50可以包括在放电时使用所存储能量的负载,或者如果电池10是可再充电的,则外部电路50可以包括在充电时提供待存储能量的电源。
阳极30可包括集电器,其可包括工作离子。集电器可以简单地是工作离子的金属。在一些情况下,集电器可以是工作离子的金属与另一种金属的合金。阳极30可以与集电器基本相同。在一些实施方式中,阳极30可以包括除集电器之外的其它材料或与集电器不同的材料。
电解质40可以是固体电解质,其可以单独使用或与液体或聚合物电解质组合使用。因此,电解质40在阴极20处可具有与在阳极30处相同或不同的组成。固体电解质可以具有与有机液体电解质相当的离子电导率和与固体电解质中的电偶极子(其可以彼此平行取向)相关的大介电常数。
特别是,固体电解质可以是玻璃或无定形固体,其可以水溶剂化并且可以传导一价阳离子,例如li+、na+或h+、或它们的混合物。固体电解质可以是电子绝缘体。当固体电解质传导li+、na+或其混合物时,固体电解质可以是干燥的。当固体电解质传导h+时,固体电解质可以不是干燥的。这样的电解质详细见述于pct/us2016/036661,其全部内容通过引用纳入本文。
可以通过加入量小于或等于玻璃/无定形固体的水溶剂化极限的水,使结晶钠离子(na+)或结晶锂离子(li+)电子绝缘体[或包含na+或li+中至少一种的组分前体,其与氧(o)、氢氧化物(oh)或至少一种卤化物结合成水溶剂化玻璃/无定形na+或li+离子传导固体]转化而形成传导li+、na+或其混合物的干燥水溶剂化玻璃/无定形固体。还可以加入玻璃形成氧化物、硫化物或氢氧化物,并且所得材料可以进行加热以使挥发性组分排出。结晶电子绝缘体或其组分前体可包括具有通式a3-xhxox的材料,其中0≤x≤1,a是所述至少一种碱金属,并且x是所述至少一种卤化物。该材料还可以包含玻璃形成添加剂,所述玻璃形成添加剂包括氧化物、氢氧化物和硫化物中的至少一种或至少两种。该玻璃形成添加剂可以包括ba(oh)2、sr(oh)2、ca(oh)2、mg(oh)2、al(oh)3、或bao、sro、cao、mgo、al、b2o3、al2o3、sio2、s和li2s中的至少一种或至少两种。干燥的水溶剂化玻璃/无定形固体可以包含小于2摩尔%的玻璃形成添加剂。玻璃形成添加剂可以调整水溶剂化玻璃/无定形固体的玻璃化转变温度tg。卤化物可以包含氯(cl)、溴(br)或碘(i)、或它们的组合。至少一部分卤化物可以作为卤化氢气体离开水溶剂化玻璃/无定形固体。氢氧化物可以反应形成h2o,该h2o作为气态h2o离开水溶剂化玻璃/无定形固体。
传导h+的水溶剂化电解质可以通过如下形成:加入量少于或等于结晶材料的溶剂化极限的水,将包含与至少一种酸性聚阴离子结合的至少一种碱金属或碱土金属阳离子的结晶材料转化为玻璃/无定形固体,使得水离解为与阳离子配位形成聚阴离子的氢氧根(oh-)阴离子,而水还可以离解成在酸性氧化物和聚阴离子的框架中可移动的质子(h+)。酸性聚阴离子可以包括(so4)2-和/或(po4)3-。
传导h+的水溶剂化玻璃/无定形固体也可以通过加入量小于或等于结晶电子绝缘体的水溶剂化极限的水,将包含至少一种酸性聚阴离子和至少一种阳离子的结晶电子绝缘体转化为传导质子(h+)的水溶剂化玻璃/无定形固体。阳离子可以以稳定的氢氧化物聚阴离子的形式稳定。酸性聚阴离子可包括磷酸根(po4)3-聚阴离子或硫酸根(so4)2-聚阴离子或(sio4)4-聚阴离子或它们的组合。阳离子可包括钡(ba2+)离子、钾(k+)离子、铷(rb+)离子或铯(cs+)离子,或它们的组合。稳定的氢氧化物聚阴离子可包括(ba(oh)x)2-x、(k(oh)x)1-x、(rb(oh)x)1-x或(cs(oh)x)1-x,或它们的组合。
阴极20包含阴极集电器70。阴极20还可以包括与阴极集电器70电子接触的催化氧化还原中心继电器60。催化氧化还原中心继电器60可以是覆盖阴极集电器70的涂层或层。催化氧化还原中心继电器60可以导致工作离子镀覆在阴极集电器70上。催化氧化还原中心继电器60可以包含元素[如硫(s)]、分子[如二茂铁(fe(c5h5)2)]、或可变化合物[例如锂铁磷酸盐(lixfepo4,其中0≤x≤1)]。
阴极20还可以包括在集电器上的表面导电膜(未显示),例如碳。
可以基于电池和材料的电能特性和化学能特性来选择用于阴极20、阳极30和电解质40的合适材料。总之,材料特性的组合使得工作离子能够镀覆到阴极集电器70上、或覆盖阴极集电器70表面的导电膜(如果存在的话)上。可以是某种分子、膜或所添加的颗粒的催化中心继电器60(当存在时)可以进一步促进金属镀覆。
在放电时,电池在电压vdis下输出电流idis,以在完成两个电极之间的化学反应所需的时间δtdis内提供电力pdis(pdis=idisvdis)。以恒定电流idis=dq/dt(q=荷电状态)作为电力pdis输出的化学能的单元密度由下式给出:
v(q)dis=voc-ηdis(i)(3)
其中q(idis)是单元容量。开路电压voc由下式给出:
voc=(μa-μc)/e(4)
其是阳极和阴极处的电化学电势μa和μc之间的差值除以电子电荷e的大小e。单元内部的欧姆损耗ηdis(i)由下式给出:
ηdis(i)=idisrb,dis(5)
其中,rb,dis是放电时单元内单元化学反应的离子组分传递的总内阻。由电解质传递的阳离子是单元的工作离子,并且rb=rct+ri包括工作阳离子(或其前体)在电极/电解质界面上电荷传递的电阻rct、和电解质中的工作阳离子迁移的电阻ri。
原电池单元的化学反应是不可逆的,蓄电池单元的化学反应在施加充电功率pch=ichvch时是可逆的,其中
vch=voc+ηch(i)(6)
并且ηch=ichrb,ch。
二次(可再充电)电池单元中的电能存储效率是pdis/pch。在连续的充电/放电循环次数(n+1)和n时,蓄电池的一个或两个电极处的不可逆化学反应引起单元容量q(i)的损失。库仑效率q(i)n+1/q(i)n决定了在δedis减小到其初始值的80%之前蓄电池单元的循环寿命。
由于电池内部的离子电导率比外部电路中的电子电导率小几个数量级,因此电池单元通常制造为电极-电解质接触部的表面积大的阳极/薄电解质/阴极单元,其中,各电极还接触金属集电器,用于将电子从电极传递到外部电路或从外部电路传递到电极。在充电和放电期间,单元的两个电极改变体积,并且一侧上的电极和集电器之间的牢固界面以及另一侧上的电极和电解质之间的牢固界面的保持与维持化学反应相关。体积约束可以限制电极体积容量q(i),其是为电动道路车辆供电的电池的品质因数,其中,电极由小颗粒组成,工作离子可逆地插入其中或可逆地合金化或经历转化反应。
电池单元的电解质可以是液体、聚合物、玻璃、陶瓷、或它们的复合组合。需要构造机械坚固的柔性电解质,其在数千次充电/放电循环中保持与电极或其他电解质的良好界面。与用聚合物或液体电解质构造相比,用接触固体电极的玻璃或陶瓷固体电解质构造可能更具挑战性。玻璃或陶瓷电解质的复合材料可以用柔性聚合物制成,从而产生坚固且具有柔性的复合材料。在电极是镀覆和剥离的金属或电极是金属集电器的情况下,固-固接触在多次充电/放电循环后可以是稳定的,因为镀覆可涉及强烈的界面结合并且仅发生垂直于界面的尺寸变化。在电极是与工作离子合金化的固体颗粒、是由工作离子转换的固体颗粒或是插入有工作离子的固体颗粒的情况下,体积变化可以是三维的,并且固体颗粒可以优选是液体或聚合物电解质。当继电器或电极是可溶性氧化还原分子时,氧化还原分子可以与所用溶剂中的阴极集电器接触。
传统电池可以使用传导h+离子的含水电解质,并且水的析氢反应和析氧反应之间的能隙为1.23ev,这可以将含水电解质的稳定保存期限限制为放电电压v(q)≤1.5v。
传导li+、na+或k+离子的有机液体电解质可以具有稳定的放电电压v(q)≤3.0v以及长的循环寿命。具有较高v(q)的有机液体电解质电池需要在蓄电池单元的一个或两个电极的表面上形成钝化的固体电解质中间相(sei)层以使电极-电解质反应钝化,其中,μa>lumo和/或μc<homo。电解质的lumo和homo分别是电解质的最低未占分子轨道和最高占据分子轨道。能隙eg=lumo-homo被称为电解质的能量窗口。
图2是具有电解质能量窗口的稳定电池的能量分布的示意图,所述电解质能量窗口具有能隙eg=lumo–homo。阳极的费米能为μa<lumo,阴极的费米能为μc>homo。除非在电极表面提供钝化的sei层,否则费米能μa>lumo将使电解质减少并且费米能μc<homo将使阴极氧化。
如图2所示,μa>lumo的阳极可以使电解质减少,并且μc<homo的阴极可以使电解质氧化。然而,固体电解质(聚合物、玻璃、陶瓷或这些的组合)可具有大的eg,并且lumo所处的能量高于碱金属阳极的μa,而homo所处的能量低于高压阴极的μc,从而提供高电压、安全的电池单元,而在电极-电解质界面处没有任何钝化的sei。
然而,具有碱金属阳极的常规全固态电池具有有限的容量、充电/放电速率和循环寿命,因为难以用陶瓷电解质实现电极-电解质界面。阴极侧上的界面可能特别难以实现,其中,阴极由小颗粒组成以缓解较差的电子电导率和循环期间的大体积变化。陶瓷固体电解质中工作离子的电导率可以非常低,从而使用极薄的电解质。聚合物固体电解质在室温下可能具有过低的工作离子电导率而不能提供与具有用于大规模电池应用的有机液体电解质的单元相当的全固态电池单元。
本公开提供了安全的电池单元,该电池单元包含固体电解质,所述固体电解质与碱金属阳极或可以被碱金属镀覆的金属阳极集电器接触。固体电解质通过碱金属润湿,并且具有lumo>μa。碱金属可以镀覆在费米能μcc<μa的阴极集电器上或镀覆在具有电化学电势μf(并且μcc<μf<μa)的集电器上的表面导电膜上(如碳)上。任选地,当μcc<μox<μf时,可以使用具有氧化还原μox的催化继电器。催化继电器(分子、膜、颗粒)可以与集电器电子接触,并且可以在将工作离子中继到集电器(具有/不具有表面膜)以在放电电压下作为阴极镀覆之前,减少单元处的工作离子。无论在集电器处是否存在表面膜,都可以使用催化继电器。
e是电子电荷的大小。
碱金属阳极可以可逆地镀覆或剥离,而不会与液体、聚合物、陶瓷、或表面被碱金属润湿的玻璃/无定形电解质形成枝晶。玻璃/无定形li+或na+固体电解质(li-玻璃或na-玻璃)可具有与有机液体电解质相当的工作阳离子电导率。玻璃/无定形固体电解质可以通过碱金属阳极润湿,并且可以包含高浓度的电偶极子,该电偶极子可以彼此平行取向以提供大的介电常数。已经对li-玻璃和na-玻璃电解质进行简化从而实践参照图3-8描述的本公开的四个实施方式。
如果工作阳离子在到达集电器之前被还原,则将碱金属镀覆到未被碱金属润湿的金属集电器上可以是无枝晶的方式。如果用于阴极镀覆的催化氧化还原中心继电器具有氧化还原能量μox>μcc,其中,μcc是金属集电器的电化学电势(费米能),则电池放电期间来自阳极的电子或超级电容器放电期间来自集电器的电子可以通过氧化还原继电器中心送到工作阳离子。镀覆电池/超级电容器单元可实现的开路电压由下式给出:
voc=(μa-μox)/e(8)
如果需要氧化还原继电器在集电器上镀覆碱金属,则开路电压由下式给出:
voc=(μa-μcc)/e(9)
如果无需氧化还原中心集电器;则e是电子电荷的大小。因此,为了优化单元开路电压voc,可以选择具有低能量ucc的金属集电器,例如铜(cu)、镍(ni)、锌(zn)、银(ag)、金(au)、或金属化合物(如过渡金属氧化物或硫化物)。
本文公开的金属镀覆的电池/超级电容器单元可以提供安全的高压电池单元,其具有作为化学能的高电能存储容量以及具有长循环寿命的充足的极高速率静电能存储容量和接近100%的存储效率。所公开的金属镀覆电池/超级电容器单元是具有li-玻璃或na-玻璃电解质的全固态镀覆电池/超级电容器单元。本文公开的金属镀覆的电池/超级电容器单元可借助于催化氧化还原中心继电器在金属集电器上提供电池单元而没有枝晶形成,该催化氧化还原中心继电器与集电器电子接触。本文公开的金属镀覆的电池/超级电容器单元可以提供一种新型镀覆电池单元,其将电力作为化学能存储在碱金属阳极中,该碱金属阳极通过将阳极金属镀覆到电化学电势(费米能)低于阳极的阴极集电器上而进行放电,任选地使用催化氧化还原中心,该催化氧化还原中心减少单元的工作阳离子并将工作阳离子中继到阴极集电器用于镀覆以提供原电池单元,并且碱金属可以在充电时返回到阳极以提供蓄电池单元。本文公开的金属镀覆的电池/超级电容器单元可以提供金属镀覆的电池/超级电容器单元,其结合了将电作为化学能储存在金属镀覆的电池中以及将电力作为静电能储存在超级电容器中。本文公开的金属镀覆的电池/超级电容器单元可以提供包括费米能不同的阳极和阴极集电器的单元,其中,所存储的电力主要是静电能,但也通过将电解质的工作阳离子作为金属镀覆到阳极集电器上来存储。对于放电时的负载电阻rl和内部电池电阻rb,dis,如果通过施加至单元的外部热量提供能量idis(rl+rb,dis),则经镀覆的阳极的量可以保持固定以通过负载提供连续放电电流idis。具有并联单元的电池可具有足够小的idis,以在适度温度下提供持续的工作输出idisrl。
本文公开的金属镀覆的电池/超级电容器单元可以是使用固体电解质的镀覆电池/超级电容器单元,该固体电解质具有与有机液体电解质相当的离子电导率和与电偶极子(其可以彼此平行取向)相关的大介电常数,任选地具有接触一个或两个电极的液体或聚合物。本文公开的金属镀覆的电池/超级电容器单元可以在二次镀覆电池/超级电容器单元、高容量一次镀覆电池/超级电容器单元或其中镀覆在阳极集电器上的金属阳离子由电解质提供的金属镀覆电池中储存电能。
在本文公开的金属镀覆的电池/超级电容器单元中,单元的放电电流和充电电流可以通过加热而增加,加热降低了电解质的离子电阻率ri和穿过电极-电解质界面以及任意电解质-电解质界面(如存在)的电荷转移电阻。
在本文公开的金属镀覆的电池/超级电容器单元中,提供在集电器上镀覆碱金属,其中,集电器是镀覆电池单元阴极处的铜,参见图3-6。
图3显示li/li-玻璃/cu单元[包含硫(s)继电器]形式的li/s单元的放电电压与容量的曲线图。在图3中,相对于将所有s还原为li2s的能力来显示容量,从而显示出用作一次单元的单元容量是将阳极锂镀覆到阴极上的能力而不是将s继电器还原为li2s的能力。
图4显示出相对于锂阳极的容量,图3的li/s单元的放电电压与容量的曲线图,其显示出借助于硫继电器将高达90%的阳极的锂镀覆在阴极集电器上。
图5显示出以充电10小时、静止2小时、放电10小时、静止2小时为一次放电/充电循环,在多次循环下,图3的li/s单元中的电力存储的存储效率和库仑效率的曲线图。应注意,图5中的数据收集在1000小时后仍在进行。
图6显示出在二茂铁分子作为氧化还原中心用于将钠镀覆到铜集电器上的na/na-玻璃/cu单元中,电力存储的存储效率和库仑效率的曲线图。
图7示出了li/s单元的充电/放电电压分布与时间的曲线图,其中,该单元是自充电的,在此期间,一些来自电解质的li+镀覆到阳极上。在li/s单元中,在阳极上镀覆li+降低了所存储的静电能的容量,因此降低了各连续循环的电压。从自充电至放电的电压曲线图上的数据点表示快速的初始电压变化(无法获得数据点),然后是可测定的电压变化率。
图8显示出al/li-玻璃/cu单元的充电/放电电压曲线图,其插图中显示,由于金属锂镀覆到铝阳极上,在开路下连续自充电时,电力存储的库仑效率增加到超过100%。
在本文公开的金属镀覆的电池/超级电容器单元中,提供了一次镀覆电池单元,其具有锂阳极、玻璃/无定形电解质、铜集电器和与具有碳的集电器接触的元素硫氧化还原中心继电器,参见图3、5、7和8。
在本文公开的金属镀覆的电池/超级电容器单元中,提供了二次镀覆电池单元,其具有钠阳极、二茂铁氧化还原中心继电器和铜集电器,参见图6,并且公开了具有铝阳极集电器和铜阴极集电器的li-玻璃单元,而无需在制造时将锂加入到铝集电器中,参见图8。
本公开提供了一种借助于与集电器接触的氧化还原材料将碱金属镀覆在金属集电器上而没有枝晶的方法,该金属集电器通常不会被碱金属润湿,其可以在碱金属阳离子镀覆到氧化还原材料上或中继到集电器之前还原碱金属阳离子。
本公开还包括一种金属镀覆电池单元(一次或二次的),其使用碱金属阳极,该阳极可以由电解质以无枝晶的方式镀覆在碱金属上,并且可以借助于氧化还原中间体材料镀覆在费米能的能量低于阳极的费米能的阴极集电器上。在金属镀覆的电池单元的任意公开实施方式中,可以在阴极集电器上进行镀覆而无需借助氧化还原材料中间体的帮助。金属镀覆的电池单元可以使用硫作为氧化还原中间体。金属镀覆的电池单元可以使用二茂铁作为氧化还原中间体。金属镀覆的电池单元可以使用硅作为氧化还原中间体。金属镀覆的电池单元可以使用硫化物作为氧化还原中间体。金属镀覆的电池单元可以使用氧化物作为氧化还原中间体。金属镀覆的电池单元可以使用固体玻璃电解质,并且结合电力的化学存储和静电存储。金属镀覆的电池单元可以使用金属化合物作为阴极集电器。金属镀覆的电池单元可以在集电器上使用碳以帮助电极镀覆在集电器上。金属镀覆的电池单元可以在阴极的集电器表面上使用金膜。金属镀覆的电池单元可以在阴极集电器上使用氧化物膜。金属镀覆的电池单元可以在镀覆电池/超级电容器蓄电池单元中使用。金属镀覆的电池单元可以在镀覆电池或镀覆电池/超级电容器单元中使用。
本公开还包括电化学品,其包含费米能比阴极集电器高的阳极集电器和具有高介电常数的固体li+或na+玻璃/无定形电解质,其在充电时将电力储存为静电能并且通过将一些电解质工作离子镀覆在阳极上储存为化学能。在开路电压下,将工作离子镀覆到阳极上可以通过自充电进行,以增加电池放电的容量。电化学单元可具有铝阳极和铜阴极。在电化学单元中,可以将工作离子的金属添加到阳极集电器。在电化学单元中,阴极集电器可以是铜(cu)、锌(zn)、银(ag)、金(au)、硅、硫化物、或氧化物。在电化学单元中,表面积大的电子导电材料可以是集电器,以增加用于存储静电电荷的电极-电解质接触面积。电化学单元可以在电阻rl小的外部电路中具有负载(如led或电子装置),并且还具有小的内部电池电阻rb,dis,使得idis(rl+rb,dis)损耗小于通过热量由外部供应的能量,从而产生连续的idis。
以上公开的主题应被认为是说明性的而非限制性的,并且所附权利要求旨在覆盖所有落入本公开的真正精神和范围内的这样的修改、改进和其它实施方式。因此,在法律允许的最大程度上,本公开的范围将由所附权利要求及其等同形式的可允许的最宽泛解释来确定,并且不应受前述详细描述的限制或约束。
- 还没有人留言评论。精彩留言会获得点赞!