能原位观察电极材料在充放电过程中状态变化的开放式模拟锂电池的电化学池及测试方法与流程
本发明涉及一种用于原位观察电极材料在充放电过程中状态变化的开放式模拟锂电池的电化学池及电化学测试方法。
背景技术:
随着新能源汽车的快速发展,对高比能量、高比功率和高安全性的电源提出更加迫切的要求。锂离子电池由于其高能量密度,循环寿命长,轻便灵巧等诸多优点成为新能源汽车的首选动力电池。锂电池正极材料的价格占锂离子电池经济的40-50%。目前为止,锂电池的正极材料主要以钴酸锂,三元材料(镍钴锰)为主。根据伦敦金属交易所资料,2017年每吨钴的现货价是51000美元,至2018年目前价格已经冲破每吨83000美元,镍的价格在同一年也上涨不少。因此,锂电池正极材料的发展也是制约锂离子电池发展的关键因素。
相对于无机过渡金属氧化物,有机或聚合物材料具有分子结构可设计,原料丰富,储能密度高等优点,更重要的是它还具备了可逆的电化学氧化还原活性以及良好的可塑性和柔韧性,一直备受人们的关注。然而,有机聚合物电极材料目前在锂离子电池领域仍然无法产业化使用,甚至目前全世界尚无有机电极材料规模化生产的厂家。主要原因有以下几点:第一、有机聚合物电极在充放电过程中存在循环不稳定,容量快速下降,低倍率的问题,这主要是由于聚合物链段在充放电过程可能伴随链段断裂,小分子或低聚物溶于电解液,致使活性物质利用率低。第二、有机聚合物的充放电机理仍然不是特别清楚。
有机聚合物锂电池的充放电机理与传统的锂电池嵌入脱出机理并不相同,目前所公认的机理主要是具有化学活性的有机聚合物发生电化学氧化或电化学还原,伴随着电荷的改变,而与之相对应的阴离子或者阳离子从电解液中转移到电极上与之中和达到电荷平衡。根据正极材料所掺杂的离子电荷的正负性不同,我们把有机锂离子电池反应分为P型掺杂和n型掺杂反应。这种在有机锂电池发生的掺杂机理与有机聚合物在电致变色领域的机理非常近似。然而,传统的锂电池测试都是在手套箱中组装成封闭的锂电池体系后进行电化学测试,在测试过程中主要有以下几个难题:(1)缺乏简便有效的方法来原位观察电极材料在充放电过程中掺杂或脱掺杂状态的变化。目前的原位XRD及原位Raman技术尚未普及,只存在部分高校。(2)观察电极材料在充放电后的状态变化,只能等锂电池充放电结束后,破坏锂电池,取出电极材料拿去表征,这不仅操作繁琐,同时一定程度上带来了安全隐患。
技术实现要素:
本发明要解决的技术问题是提供一种简单有效的能原位观察电极材料在充放电过程中状态变化的开放式的模拟锂电池的电化学池及基于该电化学系统的电化学测试方法,以解决封闭锂电池体系带来的表征困难问题。
为解决上述技术问题,本发明采用如下技术方案:
一方面,本发明提供了一种能原位观察电极材料在充放电过程中状态变化的开放式模拟锂电池的电化学池,所述的电化学池为一个置于无水无氧环境中的二电极体系电化学池,所述的二电极体系电化学池是以金属锂片为负极、薄膜电极为正极、锂电池电解液为电解液,所述的薄膜电极是在导电基体表面涂覆锂电池正极材料形成的均匀规整的薄膜,所述的锂电池正极材料为具有电致变色性能的有机小分子或有机聚合物,所述的薄膜厚度需能使薄膜呈现颜色。
本发明所述的二电极系统电化学池应置于无水无氧环境中,其主要原因是金属锂片及电解液对水、氧值过于敏感。作为优选,所述的无水无氧环境为氩气手套箱,所述的手套箱需控制水值<10ppm、氧气值<10ppm。进一步优选控制手套箱中的水值<0.5ppm、氧气值<0.5ppm。
本发明中,为了模拟组装锂电池的实验,所述的锂电池电解液可选择与组装锂电池相同的电解液,溶质一般是六氟磷酸锂、高氯酸锂、四氟硼酸锂、二草酸硼酸锂、三氟甲磺酰锂等锂电池常规电解质,溶剂可以为碳酸酯类或醚类,浓度与组装电池的电解液浓度相同,电解液优选为导电性较高的电解液。
本发明中,所述的锂片应是光滑有金属光泽的锂片。
本发明中,所述的导电基底为氧化铟锡(ITO)电极、铝箔、铜箔、泡沫镍、碳纸等导电基底,优选氧化铟锡(ITO)电极。所述的具有电致变色性能的有机小分子可以是含D-A结构的三苯胺类、噻吩类或咔唑类有机小分子,有机聚合物可以是相应含D-A结构的有机小分子聚合形成的聚合物。所述的薄膜电极优选通过下列方式之一制备:单体电化学聚合成膜、喷涂或旋涂成膜。
具体而言,所述的单体电化学聚合成膜推荐按照如下步骤实施:(1)选择能进行电化学聚合的单体小分子,该单体小分子电化学聚合时需具有较可逆的氧化还原峰以及较好的成膜性;(2)将单体小分子、支持电解质和电解溶剂加入三电极电解池中配制成电解液,采用循环伏安法或恒电位法进行聚合,在导电基底上电沉积后得到有机聚合物薄膜,用电解溶剂清洗有机聚合物薄膜,干燥得到薄膜电极进行存放。
步骤(1)中,所述单体小分子优选为含D-A结构的三苯胺类、噻吩类或咔唑类有机小分子。
步骤(2)中,所述支持电解质为四丁基高氯酸铵、四丁基六氟磷酸铵或四丁基四氟硼酸铵,优选为四丁基高氯酸铵。所述电解溶剂由单体溶解性决定,优选为乙腈、二氯甲烷或两者混合液,更优选为两者混合液。所述电解液中,单体浓度为0.0005~0.005mol/L,优选为0.001mol/L;支持电解质浓度为0.01-0.2mol/L,优选为0.1mol/L。所述的三电极电解池以导电基底为工作电极,所述导电基底优选为氧化铟锡(ITO)电极;以金或铂为辅助电极,优选为铂丝电极;以甘汞电极或银-氯化银电极为参比电极,优选为银-氯化银电极。所述的聚合的工艺参数以单体小分子的氧化还原电压为参考,循环伏安聚合法以高于单体的氧化还原峰电压0.1-0.3V为工作电压,优选为高于单体的氧化还原峰电压0.2V;扫速为0.05V/s-0.5V/s,优选为0.1V/s。恒电位法以高于单体的氧化还原峰电压0-0.3V为工作电压,优选为高于单体的氧化还原峰电压0.1V,聚合电量以所显示的电流/时间图中,电流随时间趋于稳定为准,聚合后仍需要一个负电位进行脱掺杂。具体的工艺参数需要根据单体小分子的氧化还原电位选择恰当的参数后聚合。
具体而言,所述的喷涂或旋涂成膜是通过喷枪或旋涂仪将已溶于良溶剂的单体小分子或者有机聚合物均匀涂在导电基底上。所述的良溶剂优选为四氢呋喃和/或三氯甲烷,具体的溶剂根据单体小分子或有机聚合物在溶剂中的溶解能力参考选择。
第二方面,本发明提供了一种基于所述开放式模拟锂电池的电化学池的电化学测试方法,所述的电化学测试方法采用以下步骤:
将开放式模拟锂电池的电化学池通过信号线与电化学测试系统连接,所述的信号线至少包括两根导电铜线,其中至少一根连接电化学测试系统的正极与电化学池的正极,至少一根连接电化学测试系统的负极与电化学池的负极,进行模拟锂电池的电化学测试,通过电压的变化观察薄膜电极的薄膜颜色变化,从而实现原位观察薄膜电极材料在充放电过程中状态变化。
在有机锂电池充放电过程中,有机小分子或有机聚合物发生电化学氧化和电化学还原过程,为了电荷补偿,相应的电解质离子进入到电极与其中和达到电荷平衡,从而导致薄膜颜色发生变化。因此,薄膜颜色变化的电压即有机小分子或有机聚合物氧化还原的变化和离子掺杂电压。
作为优选,所述的电化学测试系统为电化学工作站,所述的的电化学测试为循环伏安测试。
作为优选,所述的电化学测试系统为LAND电池测试系统,所述的电化学测试为充放电循环测试。
本发明通过循环伏安测试对以薄膜电极为电极的模拟锂电池电化学池进行测试,发现电聚合制备得到的薄膜模拟锂电池与化学聚合制备的聚合物锂电池器件的循环伏安曲线非常近似;通过电池充放电测试对以聚合物薄膜为电极的模拟锂电池电化学池进行测试,发现电聚合制备得到的薄膜模拟锂电池与化学聚合制备的聚合物锂电池器件的充放电曲线以及电压平台近似,这些都表明模拟锂电池电化学池是可以印证聚合物电极在锂电池器件中充放电的状态变化,从而解决封闭锂电池体系带来的表征困难。
与现有技术相比,本发明的优势在于:
(1)本发明提供的开放型的模拟锂电池电化学系统可有效印证有机小分子或聚合物电极在锂电池器件中充放电的状况变化,故其提供的原位观察有机小分子或聚合物电极在充放电中不同电压的掺杂脱掺杂态变化的环境(有机小分子或聚合物电极的颜色变化),为研究有机小分子或聚合物锂电池的充放电机理提供了一条新的路径。
(2)开放型的锂电池电化学池提供了一种简便有效的开放环境进行后续表征,解决了封闭锂电池体系带来的表征困难问题。
附图说明
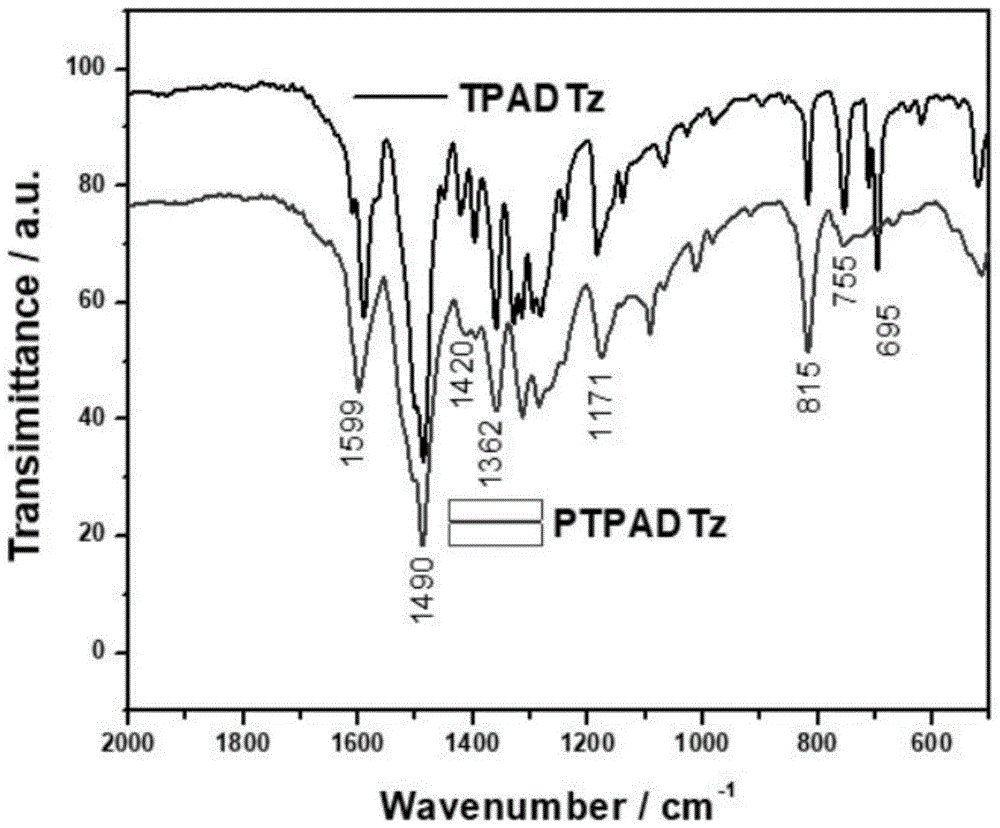
图1为实施例1制备的4,4’,6,6’-四(4-二苯胺基苯基)-2,2’-双三嗪与聚[4,4’,6,6’-四(4-二苯胺基苯基)-2,2’-双三嗪]共轭微孔有机聚合物材料的红外光谱图。
图2为实施例2制备的锂离子电池的循环性能图。
图3为在手套箱中模拟锂电池电化学池的一种实施方式。
图4为聚[4,4’,6,6’-四(二苯胺苯)2,2’-双三嗪]的电化学聚合曲线。
图5为聚[4,4’,6,6’-四(二苯胺苯)2,2’-双三嗪]电化学聚合薄膜的红外光谱。
图6为聚[4,4’,6,6’-四(二苯胺苯)2,2’-双三嗪]电化学聚合薄膜的SEM形貌图。
图7为以聚[4,4’,6,6’-四(二苯胺苯)2,2’-双三嗪]聚合物薄膜正极在模拟锂电池电化学池的循环伏安测试,电解液分别是LiPF6EC/DMC/EMC=1:1:1和LiClO4EC/DMC/EMC=1:1:1。
图8为以聚[4,4’,6,6’-四(二苯胺苯)2,2’-双三嗪]聚合物正极在模拟锂电池电化学池的充放电测试,电解液分别是LiPF6EC/DMC/EMC=1:1:1。(插入:聚合物薄膜在不同充放电压下的颜色变化)。
图9为以聚[4,4’,6,6’-四(二苯胺苯)2,2’-双三嗪]聚合物正极在模拟锂电池电化学池的充放电测试,电解液分别是LiClO4EC/DMC/EMC=1:1:1。(插入:聚合物薄膜在不同充放电压下的颜色变化)。
具体实施方式
以下通过实施例进一步说明本发明的技术方案,但本发明的保护范围不限于此。
实施例1:
Zn粉预处理:在洁净的大烧杯中加入10g锌粉,100ml稀盐酸(质量分数:2%),搅拌1min后过滤,再用100ml相同浓度的稀盐酸反复洗涤,用水、乙醇、丙酮各淋洗三次,然后在60℃下真空干燥2h,研磨后装入密封瓶中待用。
式(III)所示的2,4-(N,N-二苯基苯)-6-氯-1,3,5-三嗪的合成:
在预先洗涤干燥处理的100ml双口烧瓶中加入4-硼酸三苯胺(1.445g),2,4,6-三氯-1,3,5-三嗪(0.369g),Pd(PPh3)2Cl2(46mg),K2CO3(1.38g),氮气保护后加入去离子水2ml、甲苯30ml,升温至70℃反应4h。反应结束后冷却至室温,用二氯甲烷和水萃取洗涤多次,用无水硫酸镁干燥,随后用薄层色谱层析法,展开剂石油醚:二氯甲烷=2:1,得到黄色产物0.96g,产率为80%。1H NMR(500MHz,CDCl3),δ8.40(d,J=8.5Hz,4H),7.34(t,J=7.8Hz,8H),7.19(d,J=7.7Hz,8H),7.16(t,J=7.3Hz,4H),7.10–7.05(m,4H)。
式(II)所示的4,4’,6,6’-四(4-二苯胺基苯基)-2,2’-双三嗪的合成:
在预先洗涤干燥处理的25ml两口烧瓶中加入2,4-(N,N-二苯基苯)-6-氯-1,3,5-三嗪(0.72g)、实施例1预处理后的锌粉(0.38g)、Ni(PPh3)2Cl2(0.026g)和n-Bu4NI(0.44g),在氮气保护下加入重蒸四氢呋喃15ml,升温至70℃,反应36h。反应结束后冷却至室温,用二氯甲烷和水萃取洗涤多次,用无水硫酸镁干燥,随后用薄层色谱层析法(展开剂以石油醚:二氯甲烷=1:1),得到黄色产物0.315g,产率46.5%。1H NMR(500MHz,CDCl3),δ8.62(d,J=8.8Hz,6H),7.33(t,J=7.9Hz,12H),7.21(d,J=7.6Hz,12H),7.17–7.11(m,12H).MS(MADLI-TOF):m/z=1132.47。
式(I)所示的聚[4,4’,6,6’-四(4-二苯胺基苯基)-2,2’-双三嗪]的合成:
将0.2g 4,4’,6,6’-四(4-二苯胺基苯基)-2,2’-双三嗪单体溶于20ml重蒸氯仿中,在氮气氛围下加入摩尔量为单体摩尔量5倍的无水三氯化铁粉末,在30℃下反应进行24h。反应结束后加入大量的甲醇沉淀,然后过滤,用稀盐酸、水和甲醇分别洗涤,过滤,将得到的滤饼在50℃下鼓风干燥12h,再在120℃下真空干燥24h,得到土黄色固体粉末,产量0.172g,产率86%。
通过红外光谱表征4,4’,6,6’-四(4-二苯胺基苯基)-2,2’-双三嗪单体与聚合物(见附图1),从图中可以看出,该化合物单体和聚合物同时具备三苯胺单元的特征峰和三嗪环的特征峰。位于1599cm-1处的吸收峰是苯环上C=C键的伸缩振动峰,1490cm-1处的吸收峰是苯环上的C-C键的伸缩振动峰,1328cm-1上的吸收峰是由于苯环上的C-H键的弯曲震动所引起的,出现在1276cm-1和820cm-1处的吸收峰分别是归属于叔胺C-N键的伸缩振动和1,4-双取代苯环上的C-H键的面外摇摆振动。1362cm-1处出现的吸收峰则可以认为是三嗪环骨架振动特征峰,而1420cm-1处出现的是C=N键的伸缩振动峰。因此可以认定该单体是目标产物。在815cm-1处出现的吸收峰为对位取代苯C-H面外弯曲振动,在755cm-1处出现的吸收峰为苯环单取代C-H面外弯曲振动,从这两处的吸收峰强度变化可知该聚合物已经成功合成。
实施例2:
以实施例1制得的聚[4,4’,6,6’-四(4-二苯胺基苯基)-2,2’-双三嗪]作为正极材料的活性物质,按照如下步骤制备锂离子电池:
我们采用涂膜法进行制备正极片,以预先制备好的聚合物作为活性物质,乙炔黑作为导电剂,PVDF作为粘结剂。按活性物质、导电剂、粘结剂的质量比为50/40/10的比例碾磨均匀混合,滴加适量的N-甲基吡咯烷酮(NMP)溶解,研磨搅拌使之形成正极浆料。然后,将制备好的浆料用涂布器涂在预先处理过的铝箔表面,在真空干燥箱中在60℃下真空干燥24h,得到正极片。
以制得的正极片作正极,金属锂片作负极,1M LiPF6的EC:DMC:EMC=1:1:1(v/v)溶液作为电解质溶液,聚丙烯微孔膜(Celgard 2300)作为隔膜,在充满氩气的手套箱中(H2O<0.5ppm,O2<0.5ppm)组装成CR2032扣式电池。组装顺序如下排列(以下层优先):负极壳-弹簧片-垫片-金属锂片-电解液-隔膜-电解液-正极片-电解液-正极壳,在金属锂片上加入的电解液为4滴,隔膜上加入的电解液为4滴,正极片加入的电解液为2滴。结束后用2032型纽扣电池封口机进行封口,并静置24h。
对制得的电池进行电化学测试,在充放电测试中(图2)聚[4,4’,6,6’-四(4-二苯胺基苯基)-2,2’-双三嗪]在3.8V和2V左右出现两个电压平台,在工作电压1.5-4.2V下,首次比容量达到220mAh/g。
实施例3:
以按照实施例1方法制备的4,4’,6,6’-四(二苯胺苯)2,2’-双三嗪(TPADTz)为单体进行电化学聚合成膜:
将单体TPADTz(1mM),支持电解质TBAP(0.1M),电解溶剂DCM均匀混合配制成电解液,然后加入到三电极电解池中,其中工作电极为ITO导电玻璃电极(0.9cm×4cm),辅助电极为铂电极,参比电极为银-氯化银电极,工作电压为0~1.6V~-1.2V~0V,扫速为0.1V/s,进行10个循环。聚合结束后,用电解溶剂DCM进行清洗,除去残余的电解液,放入鼓风干燥箱烘干待用。
通过红外光谱表征制备的聚[4,4’,6,6’-四(二苯胺苯)2,2’-双三嗪]聚合物薄膜(见附图5),由图可见,在754cm-1和692cm-1的红外峰明显减少,这属于外围三苯胺中取代苯的变形振动峰,因此可以证明聚[4,4’,6,6’-四(二苯胺苯)2,2’-双三嗪]已成功合成。通过扫描电镜观察聚合物表面形貌(见附图6),可以发现聚合物微观粒子形貌规整,分布均匀,说明由电化学聚合制备得到的聚合物PTPADTz薄膜具有较好的成膜性。
实施例4:
参见图3,在充满氩气的手套箱中(水值<0.5ppm,氧气值<0.5ppm)搭建能原位观察电极材料在充放电过程中状态变化的开放式模拟锂电池的电化学池,以金属锂片为负极(可裁剪成条状),以实施例3制备好的PTPADTz聚合物薄膜电极为正极,LiPF6EC/DMC/EMC=1:1:1锂电池电解液为电解液。
所述的电化学池通过信号线与手套箱外的电化学测试系统连接,所述的电化学测试系统为荷兰Ivium型电化学工作站,所述的信号线有8根导电铜线,其中4根连接电化学工作站的正极与电化学池的正极,4根连接电化学工作站的负极与电化学池的负极,进行循环伏安测试。
实施例5:
搭建能原位观察电极材料在充放电过程中状态变化的开放式模拟锂电池的电化学池,其中电化学池中的电解液为LiClO4EC/DMC/EMC=1:1:1锂电池电解液,其他同实施例4。
按照实施例4的电化学测试方法进行循环伏安测试。
实施例6:
按照实施例4的方法搭建能原位观察电极材料在充放电过程中状态变化的开放式模拟锂电池的电化学池。
所述的电化学池通过信号线与手套箱外的电化学测试系统连接,所述的电化学测试系统为LAND电池测试系统,所述的信号线有8根导电铜线,其中4根连接LAND电池测试系统的正极与电化学池的正极,4根连接LAND电池测试系统的负极与电化学池的负极,进行充放电循环测试。
实施例7:
按照实施例5的方法搭建能原位观察电极材料在充放电过程中状态变化的开放式模拟锂电池的电化学池。
按照实施例6的电化学测试方法进行充放电循环测试。
本发明选用聚[4,4’,6,6’-四(二苯胺苯)2,2’-双三嗪]聚合物薄膜是由于其具有丰富的N杂环结构,N孤对电子会与电解液的痕量氢离子反应,从而出现低电压平台,这对锂离子电池充放电性能具有一定的影响。由图7可见,PTPADTz薄膜在LiPF6电解液中出现2.85/1.85V的氧化还原峰,而在LiClO4电解液中并没有出现相似的氧化还原峰。图8说明在LiClO4电解液中,PTPADTz薄膜在开路电压中颜色没有发生改变(黄色),随着充电的进行,颜色从中性态黄色(3.7V)到半氧化态的棕红色(3.85V),再到全氧化态的蓝色(4.0V),在放电过程中,颜色又从蓝色(4.2V)回到原来的黄色(2V)。而图9则说明PTPADTz薄膜在LiPF6电解液中表现出不同的颜色变化。在开路电压中颜色就从黄色变成微红色,在充放电过程中,聚合物薄膜的颜色同样随着电压的变化发生类似的颜色变化,但颜色相对LiClO4电解液中的薄膜颜色更深一些,这主要是因为六氟磷酸锂中会有痕量的副产物HF,这会与三嗪中的N孤对电子进行结合,形成类似于酸掺杂的效应。在放电过程中,聚合物薄膜注入电子,会打断N-H键,从而使HF离开聚合物薄膜,从而在充放电曲线中显示出较低的电压平台。图2说明化学聚合制备的聚合物PTPADTz组装成电池后的充放电曲线,发现模拟电化学池测试的充放电曲线与组装电池的充放电曲线比较近似,这也说明模拟锂电池电化学池可以用来印证聚合物电极在锂电池器件中的充放电过程,从而为锂电池的充放电机理提供一种可简便的途径去深入研究。
以上结果说明,本发明所述的开放型的锂电池电化学池提供了原位观察聚合物电极在充放电中不同电压的掺杂脱掺杂态变化的环境(聚合物电极的颜色变化),这为研究有机或聚合物锂电池的充放电机理提供了一条新的路径。
- 还没有人留言评论。精彩留言会获得点赞!