一种通过固液法制备氧空位富锂锰基层状正极材料的方法与流程
本发明涉及一种通过固液法制备氧空位富锂锰基层状正极材料的方法,属于新能源技术领域。
背景技术:
富锂锰基层状正极材料由于具有优异的容量(>250mahg-1)和能量密度(>1000whkg-1),在近年来受到人们的极大关注,被认为是下一代高比能动力电池的关键所在。但是目前市面上还没有完全成熟的商品化富锂锰基正极材料,主要是因为仍然有一些问题亟待解决,比如电压衰退较为严重,这严重降低了动力电池在使用过程中的功率密度;循环稳定性差,造成了电池在运行中使用寿命及功率输出的不稳定性;较低的倍率性能限制了动力电池进行充电需要花费更久的时间。目前针对于这些主要问题,相关的报道认为主要与首次充放电过程中氧气的产生和不可逆相变导致的晶体层间距减小以及在循环过程中过度金属离子被还原而溶解到了电解液中引起晶体结构破坏有关。基于这些相关的研究,为了改进富锂锰基正极材料的相关性能,许多研究从表面包覆(氧化物,磷酸盐和锂离子导体等),体相过渡金属元素掺杂以及最近比较流行的晶体缺陷工程等方面入手。这些方法在一定程度上可以抑制氧气的析出,稳定晶体结构和增大层间距,因此提高了电池的电化学性能。但是富锂锰基正极材料中重要的氧气析出未能从根本上得到解决,且传统的包覆和掺杂手段方法复杂,耗能较高,经济效益不够明显。从缺陷工程角度出发,在富锂锰基层状正极材料表面产生氧空位能够有效降低材料在充放电过程中的氧气产出,以及氧空位的产生能够增大锂离子扩散层,稳定过度金属层,降低材料与电解液和氧气发生的副反应。有利于增强锂离子的电化学性能。但是相关的研究还比较少,且制备工艺要么复杂要么制备不够均匀。因此,开发更有效和廉价的改性方法显得极为重要。还原性溶液能够与材料表面的氧原子发生反应,使材料表面产生氧空位。材料在液相环境中能够充分的与反应溶液接触,使产生的氧空位均匀的分布在材料表面。从而极大的提高材料制备和性能的均一性。
技术实现要素:
本发明的目的是提出一种通过固液法制备氧空位富锂锰基层状正极材料的方法,即还原性溶液(水合肼或硼氢化钠或亚硫酸盐或低价金属/非金属化合物水溶液)与富锂锰基层
状正极材料通过液相搅拌法合成,并且液相法能够使材料与溶液充分均匀的接触,使制得的材料均匀一致,锂离子电池的电化学综合性能获得显著改善,尤其是热稳定性,长程循环稳定性和高倍率性能,另外对其电压衰减也起到明显的抑制作用。
本发明提出的通过固液法制备氧空位富锂锰基层状正极材料的方法,采用直接搅拌法产生氧空位,该方法包括以下步骤:
(1)碳酸盐前驱体的制备:
将钴的金属盐、镍的金属盐和锰的金属盐溶于水中,钴的金属盐、镍的金属盐和锰的金属盐按照金属离子的摩尔比例为:镍的金属盐:钴的金属盐:锰的金属盐=(0.1~0.7):(0~0.5):(0.1~0.9),使三种金属盐的摩尔数加和小于或等于1,同时使金属离子的总摩尔浓度为1~3mol/l,得到金属离子混合溶液;配制摩尔浓度为1~3mol/l的沉淀剂溶液,磁力搅拌下将该沉淀剂溶液加入到上述金属离子混合溶液中,加入的摩尔比例为:沉淀剂溶液:金属离子混合溶液=1:(0.7~2),产生共沉淀产物,搅拌6~12小时后,对共沉淀产物进行离心分离,分别用去离子水清洗三次及无水乙醇清洗沉淀物2次,将沉淀物置于60-90℃烘箱中干燥6-12小时,得到碳酸盐前驱体,碳酸盐前驱体的分子式为:(mn0.1~0.9ni0.1~0.7co0~0.5)1.25co3·2h2o;
(2)富锂锰基层状正极材料的制备:
将步骤(1)得到的碳酸盐前驱体与lioh·h2o或li2co3按照1:(1~2)的摩尔比相混,充分研磨,使颗粒直径在0.5um-5um,混匀后置于马弗炉中,以1~5℃/min的升温速率,在700~1000℃下煅烧处理6~24小时,自然冷却至室温,得到富锂锰基层状正极材料;
(3)氧空位富锂锰基层状正极材料的制备:
配制摩尔浓度为0.1m-18m的还原性溶液,将上述步骤(2)得到的富锂锰基层状正极材料分散在所配制的还原性溶液中,还原性溶液与富锂锰基正极材料的质量比为:还原性溶液:富锂锰基正极材料=(1~20):100,得到混合物,将该混合物超声分散2~10分钟,然后将分散有正极材料的溶液转移到磁力搅拌器上,在25~75℃下以100~900转/分钟的速度搅拌0.5~8小时,待搅拌完成后离心洗涤,去离子水清洗三次,乙醇清洗两次,将离心洗涤得到的沉淀物在80℃下干燥6~12小时,在真空干燥箱中120℃下干燥5~12小时,得到含有氧空位的富锂锰基层状正极材料。
上述方法中,所述的钴的金属盐为coso4·7h2o、co(no3)2·6h2o、cocl2·6h2o或co(ac)2·4h2o。
上述方法中,所述的步骤(1)中,其中所述的镍的金属盐为niso4·6h2o、ni(no3)2·6h2o、nicl2·6h2o或ni(ac)2·4h2o。
上述方法中,所述的步骤(1)中,锰的金属盐为mnso4·h2o、mn(no3)2·4h2o、mncl2·4h2o或mn(ac)2·4h2o。
上述方法中,所述的步骤(1)中,所述的沉淀剂为naoh、na2co3、nahco3、(nh4)2co3或nh4hco3中任何一种。
上述方法中,所述的步骤(3)中的还原性溶液为水合肼、硼氢化钠、低价金属/非金属化合物或亚硫酸盐溶液。
本发明提出的通过固液法制备氧空位富锂锰基层状正极材料的方法,其优点是:
1、本发明的通过固液法制备氧空位富锂锰基层状正极材料的方法中,不同氧空位浓度的系列材料是通过直接搅拌法制备,即将还原性溶液(水合肼、硼氢化钠、低价金属/非金属化合物或亚硫酸盐等溶液)与富锂锰基层状正极材料直接搅拌,并通过改变溶液与原料比例,成功地在富锂锰基层状正极材料表面产生不同浓度的氧空位。
2、本发明方法制备的含氧空位富锂锰基层状正极材料,与同种无氧空位的材料相比,在电池循环稳定性和倍率等电池性能方面都有了很大的提高,同时抑制了表面氧的析出和电压衰减。
3、本发明制备方法,通过简单的搅拌法制得氧空位富锂锰基正极材料,使用的溶液来源广泛,价格便宜,反应物所需要的原料易得且成本低廉,生产过程无需特殊防护,反应条件容易控制,所得到的产物具有产量大、结果重复性好等优点。本发明方法合成工艺简单,生产效率高,生产成本较低,适宜规模化生产。
附图说明
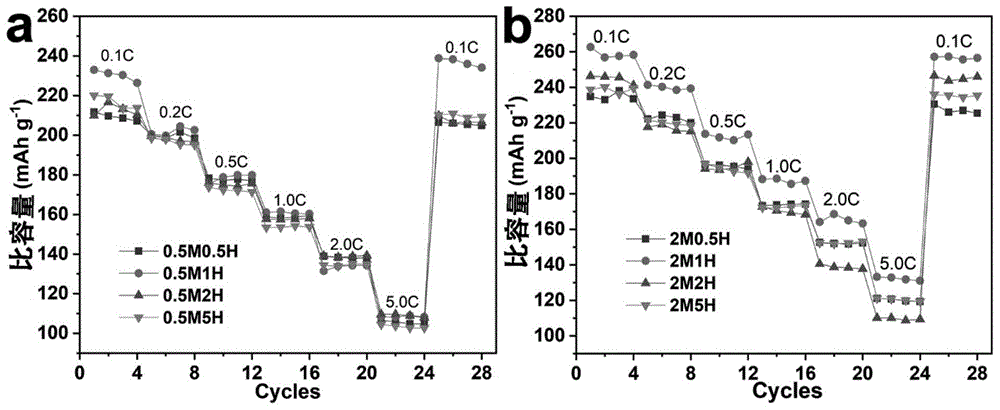
图1为浓度为0.5m和2m的水合肼溶液处理不同时间得到的含氧空位富锂锰基层状正极材料与未处理的富锂锰基层状正极材料在0.1c,0.2c,0.5c,1c,2c和5c(1c=250mag-1)电流密度下的放电比容量循环对比图,其中,图1(a)为0.5m浓度的水合肼溶液处理不同时间所得氧空位样品的不同倍率电化学性能图,图1(b)为2m浓度的水合肼溶液处理不同时间所得氧空位样品的不同倍率电化学性能图。
图2为浓度8m的水合肼溶液处理不同时间得到的含氧空位富锂锰基层状正极材料与未处理的富锂锰基层状正极材料在0.1c,0.2c,0.5c,1c,2c和5c(1c=250mag-1)电流密度下的放电比容量循环对比图。
图3为不同浓度水合肼处理1小时得到的含氧空位富锂锰基层状正极材料与未处理的富锂锰基层状正极材料在0.1c,0.2c,0.5c,1c,2c和5c(1c=250mag-1)电流密度下的放电比容量循环对比图。
图4为2m浓度水合肼处理1小时原始富锂锰基材料得到含氧空位富锂锰基层状正极材料与未处理的富锂锰基层状正极材料在0.2c,1c和5c(1c=250mag-1)电流密度下的放电比容量循环和电压循环对比图,其中,图4(a)为原始材料与氧空位材料在0.2c倍率下的循环比容量和循环电压对比图,图4(b)为原始材料与氧空位材料在1c倍率下的循环比容量和循环电压对比图,图4(c)为原始材料与氧空位材料在5c倍率下的循环比容量和循环电压对比图。
具体实施方式
本发明提出的通过固液法制备氧空位富锂锰基层状正极材料的方法,采用直接搅拌法产生氧空位,该方法包括以下步骤:
(1)碳酸盐前驱体的制备:
将钴的金属盐、镍的金属盐和锰的金属盐溶于水中,钴的金属盐、镍的金属盐和锰的金属盐按照金属离子的摩尔比例为:镍的金属盐:钴的金属盐:锰的金属盐=(0.1~0.7):(0~0.5):(0.1~0.9),使三种金属盐的摩尔数加和小于或等于1,同时使金属离子的总摩尔浓度为1~3mol/l,得到金属离子混合溶液;配制摩尔浓度为1~3mol/l的沉淀剂溶液,磁力搅拌下将该沉淀剂溶液加入到上述金属离子混合溶液中,加入的摩尔比例为:沉淀剂溶液:金属离子混合溶液=1:(0.7~2),产生共沉淀产物,搅拌6~12小时后,对共沉淀产物进行离心分离,分别用去离子水清洗三次及无水乙醇清洗沉淀物2次,将沉淀物置于60-90℃烘箱中干燥6-12小时,得到碳酸盐前驱体,碳酸盐前驱体的分子式为:(mn0.1~0.9ni0.1~0.7co0~0.5)1.25co3·2h2o;
(2)富锂锰基层状正极材料的制备:
将步骤(1)得到的碳酸盐前驱体与lioh·h2o或li2co3按照1:(1~2)的摩尔比相混,充分研磨,使颗粒直径在0.5um-5um,混匀后置于马弗炉中,以1~5℃/min的升温速率,在700~1000℃下煅烧处理6~24小时,自然冷却至室温,得到富锂锰基层状正极材料;
(3)氧空位富锂锰基层状正极材料的制备:
配制摩尔浓度为0.1m-18m的还原性溶液,将上述步骤(2)得到的富锂锰基层状正极材料分散在所配制的还原性溶液中,还原性溶液与富锂锰基正极材料的质量比为:还原性溶液:富锂锰基正极材料=(1~20):100,得到混合物,将该混合物超声分散2~10分钟,然后将分散有正极材料的溶液转移到磁力搅拌器上,在25~75℃下以100~900转/分钟的速度搅拌0.5~8小时,待搅拌完成后离心洗涤,去离子水清洗三次,乙醇清洗两次,将离心洗涤得到的沉淀物在80℃下干燥6~12小时,在真空干燥箱中120℃下干燥5~12小时,得到含有氧空位的富锂锰基层状正极材料。
上述方法中,所述的钴的金属盐为coso4·7h2o、co(no3)2·6h2o、cocl2·6h2o或co(ac)2·4h2o。
上述方法中,所述的步骤(1)中,其中所述的镍的金属盐为niso4·6h2o、ni(no3)2·6h2o、nicl2·6h2o或ni(ac)2·4h2o。
上述方法中,所述的步骤(1)中,锰的金属盐为mnso4·h2o、mn(no3)2·4h2o、mncl2·4h2o或mn(ac)2·4h2o。
上述方法中,所述的步骤(1)中,所述的沉淀剂为naoh、na2co3、nahco3、(nh4)2co3或nh4hco3中任何一种。
上述方法中,所述的步骤(3)中的还原性溶液为水合肼、硼氢化钠、低价金属/非金属化合物或亚硫酸盐溶液。
下面介绍本发明方法的实施例:
实施例一:
(1)将钴的金属盐coso4·7h2o与镍的金属盐niso4·6h2o与锰的金属盐mnso4·h2o按照0.13:0.13:0.54的摩尔比例溶于100ml水中,使金属离子的总摩尔浓度为2mol/l,得到金属离子混合溶液;配置摩尔浓度为2mol/l的na2co3溶液50ml,磁力搅拌下将上述沉淀剂溶液加入到上述金属离子混合溶液中,产生沉淀物,搅拌8小时后,离心分离,分别用去离子水及无水乙醇清洗沉淀物2次,将沉淀物置于80℃烘箱中干燥12小时,得到碳酸盐前驱体,碳酸盐前驱体的分子式为:(ni0.13co0.13mn0.54)1.25co3·2h2o。
(2)将上述步骤(1)得到的碳酸盐前驱体与lioh·h2o或li2co3按照1:1.05的摩尔比充分研磨并混匀置于马弗炉中,以3~5℃/min的升温速率,在900℃下煅烧处理12小时,自然冷却至室温,得到相应的锂离子电池富锂锰基层状正极材料。
(3)配制0.5m水合肼溶液,将上述步骤(2)得到的富锂锰基层状正极材料分散在所配制的水合肼溶液中,溶液与富锂锰基正极材料的质量比为:1:75,得到混合物,超声分散2-10分钟,然后将分散有正极材料的溶液转移到磁力搅拌器上,在室温下以700转/分钟的速度搅拌0.5/1/2/5小时。待搅拌完成后离心洗涤,去离子水清洗三次,乙醇清洗两次。将离心洗涤得到的沉淀物在80℃下干燥6-12小时,然后转移到真空干燥箱中在120℃下干燥12小时。最终得到含有不同浓度氧空位的富锂锰基层状正极材料。
实施例二:
(1)将镍的金属盐nicl2·6h2o与锰的金属盐mncl2·4h2o按照0.2:0.6的摩尔比例溶于100ml水中,使金属离子的总摩尔浓度为2mol/l,得到金属离子混合溶液;配置摩尔浓度为2mol/l的naoh溶液50ml,磁力搅拌下将上述沉淀剂溶液加入到上述金属离子混合溶液中,产生沉淀物,搅拌8小时后,离心分离,分别用去离子水及无水乙醇清洗沉淀物2次,将沉淀物置于80℃烘箱中干燥12小时,得到氢氧化物前驱体,氢氧化物前驱体的分子式为:ni0.2mn0.6(oh)1.6·2h2o。
(2)将上述步骤(1)得到的氢氧化物前驱体与lioh·h2o或li2co3按照1:1.05的摩尔比充分研磨并混匀置于马弗炉中,以3~5℃/min的升温速率,在900℃下煅烧处理12小时,自然冷却至室温,得到相应的锂离子电池富锂锰基层状正极材料。
(3)配制2m硼氢化钠溶液,将上述步骤(2)得到的富锂锰基层状正极材料分散在所配制的水合肼溶液中,溶液与富锂锰基正极材料的质量比为:1:75,得到混合物,超声分散2-10分钟,然后将分散有正极材料的溶液转移到磁力搅拌器上,在室温下以700转/分钟的速度搅拌0.5/1/2/5小时。待搅拌完成后离心洗涤,去离子水清洗三次,乙醇清洗两次。将离心洗涤得到的沉淀物在80℃下干燥6-12小时,然后转移到真空干燥箱中在120℃下干燥12小时。最终得到含有不同浓度氧空位的富锂锰基层状正极材料。
实施例三:
(1)将镍的金属盐ni(no3)2·6h2o与锰的金属盐mn(no3)2·4h2o按照0.2:0.6的摩尔比例溶于100ml水中,使金属离子的总摩尔浓度为2mol/l,得到金属离子混合溶液;配置摩尔浓度为2mol/l的nahco3溶液50ml,磁力搅拌下将上述沉淀剂溶液加入到上述金属离子混合溶液中,产生沉淀物,搅拌8小时后,离心分离,分别用去离子水及无水乙醇清洗沉淀物2次,将沉淀物置于80℃烘箱中干燥12小时,得到碳酸氢盐前驱体,碳酸氢盐前驱体的分子式为:ni0.2mn0.6(hco3)1.6·2h2o。
(2)将上述步骤(1)得到的碳酸氢盐前驱体与lioh·h2o或li2co3按照1:1.05的摩尔比充分研磨并混匀置于马弗炉中,以3~5℃/min的升温速率,在900℃下煅烧处理12小时,自然冷却至室温,得到相应的锂离子电池富锂锰基层状正极材料。
(3)配制1m硫酸亚铁溶液,将上述步骤(2)得到的富锂锰基层状正极材料分散在所配制的水合肼溶液中,溶液与富锂锰基正极材料的质量比为:15:100,得到混合物,超声分散2-10分钟,然后将分散有正极材料的溶液转移到磁力搅拌器上,在室温下以700转/分钟的速度搅拌0.5/1/2/5小时。待搅拌完成后离心洗涤,去离子水清洗三次,乙醇清洗两次。将离心洗涤得到的沉淀物在80℃下干燥6-12小时,然后转移到真空干燥箱中在120℃下干燥12小时。最终得到含有不同浓度氧空位的富锂锰基层状正极材料。
实施例四:
(1)将镍的金属盐ni(ac)2·4h2o与锰的金属盐mn(ac)2·4h2o按照0.2:0.6的摩尔比例溶于100ml水中,使金属离子的总摩尔浓度为2mol/l,得到金属离子混合溶液;配置摩尔浓度为2mol/l的(nh4)2co3溶液50ml,磁力搅拌下将上述沉淀剂溶液加入到上述金属离子混合溶液中,产生沉淀物,搅拌8小时后,离心分离,分别用去离子水及无水乙醇清洗沉淀物2次,将沉淀物置于80℃烘箱中干燥12小时,得到醋酸盐前驱体,醋酸盐前驱体的分子式为:(ni0.2mn0.6)1.25co3·2h2o。
(2)将上述步骤(1)得到的醋酸盐前驱体与lioh·h2o或li2co3按照1:1.05的摩尔比充分研磨并混匀置于马弗炉中,以3~5℃/min的升温速率,在900℃下煅烧处理12小时,自然冷却至室温,得到相应的锂离子电池富锂锰基层状正极材料。
(3)配制2m亚硫酸钠溶液,将上述步骤(2)得到的富锂锰基层状正极材料分散在所配制的水合肼溶液中,溶液与富锂锰基正极材料的质量比为:8:100,得到混合物,超声分散2-10分钟,然后将分散有正极材料的溶液转移到磁力搅拌器上,在室温下以700转/分钟的速度搅拌0.5/1/2/5小时。待搅拌完成后离心洗涤,去离子水清洗三次,乙醇清洗两次。将离心洗涤得到的沉淀物在80℃下干燥6-12小时,然后转移到真空干燥箱中在120℃下干燥12小时。最终得到含有不同浓度氧空位的富锂锰基层状正极材料。
实施例五:
(1)将镍的金属盐niso4·6h2o与锰的金属盐mnso4·h2o按照0.2:0.6的摩尔比例溶于100ml水中,使金属离子的总摩尔浓度为2mol/l,得到金属离子混合溶液;配置摩尔浓度为2mol/l的nh4hco3溶液50ml,磁力搅拌下将上述沉淀剂溶液加入到上述金属离子混合溶液中,产生沉淀物,搅拌8小时后,离心分离,分别用去离子水及无水乙醇清洗沉淀物2次,将沉淀物置于80℃烘箱中干燥12小时,得到碳酸氢盐前驱体,碳酸氢盐前驱体的分子式为:ni0.2mn0.6(hco3)1.6·2h2o。
(2)将上述步骤(1)得到的碳酸氢盐前驱体与lioh·h2o或li2co3按照1:1.05的摩尔比充分研磨并混匀置于马弗炉中,以3~5℃/min的升温速率,在900℃下煅烧处理12小时,自然冷却至室温,得到相应的锂离子电池富锂锰基层状正极材料。
(3)配制8m水合肼溶液,将上述步骤(2)得到的富锂锰基层状正极材料分散在所配制的水合肼溶液中,溶液与富锂锰基正极材料的质量比为:1:100,得到混合物,超声分散2-10分钟,然后将分散有正极材料的溶液转移到磁力搅拌器上,在室温下以700转/分钟的速度搅拌0.5/1/2/5小时。待搅拌完成后离心洗涤,去离子水清洗三次,乙醇清洗两次。将离心洗涤得到的沉淀物在80℃下干燥6-12小时,然后转移到真空干燥箱中在120℃下干燥12小时。最终得到含有不同浓度氧空位的富锂锰基层状正极材料。
说明书附图中的图1为浓度0.5m和2m的水合肼溶液处理不同时间得到的含氧空位富锂锰基层状正极材料与未处理的富锂锰基层状正极材料在0.1c,0.2c,0.5c,1c,2c和5c(1c=250mag-1)电流密度下的放电比容量循环对比图,图1(a)为0.5m浓度的水合肼溶液处理不同时间所得氧空位样品的不同倍率电化学性能图,图1(b)为2m浓度的水合肼溶液处理不同时间所得氧空位样品的不同倍率电化学性能图,样品由实施例一制备。
图2为浓度8m的水合肼溶液处理不同时间得到的含氧空位富锂锰基层状正极材料与未处理的富锂锰基层状正极材料在0.1c,0.2c,0.5c,1c,2c和5c(1c=250mag-1)电流密度下的放电比容量循环对比图,样品由实施例五制备。
图3为不同浓度水合肼处理1小时得到的含氧空位富锂锰基层状正极材料与未处理的富锂锰基层状正极材料在0.1c,0.2c,0.5c,1c,2c和5c(1c=250mag-1)电流密度下的放电比容量循环对比图。
图4为2m浓度水合肼处理1小时原始富锂锰基材料得到含氧空位富锂锰基层状正极材料与未处理的富锂锰基层状正极材料在0.2c,1c和5c(1c=250mag-1)电流密度下的放电比容量循环和电压循环对比图。图4(a)为原始材料与氧空位材料在0.2c倍率下的循环比容量和循环电压对比图,图4(b)为原始材料与氧空位材料在1c倍率下的循环比容量和循环电压对比图,图4(c)为原始材料与氧空位材料在5c倍率下的循环比容量和循环电压对比图。
- 还没有人留言评论。精彩留言会获得点赞!