有机电致发光元件、显示装置和照明装置
本发明涉及在发光层中包含主体化合物、热活化型延迟荧光体和荧光体这三种成分的有机电致发光元件、以及具备该有机电致发光元件的显示装置和照明装置。
背景技术:
以往,使用进行电致发光的发光元件得到的显示装置因能够实现省电化、薄型化而受到各种研究,进而,由有机材料形成的有机电致发光元件(有机el元件)因容易轻量化、大型化而受到积极研究。尤其是,针对具有作为光的三原色之一的蓝色等的发光特性的有机材料的开发和具备空穴、电子等的电荷输送能力的有机材料的开发,无论是高分子化合物还是低分子化合物,至今为止均进行了积极研究。
有机el元件具有如下结构:其包括包含阳极和阴极的一对电极、以及配置在该一对电极之间且包含有机化合物的一个层或多个层。包含有机化合物的层有发光层、输送或注入空穴、电子等电荷的电荷输送/注入层等,开发了适合于这些层的各种有机材料。
作为有机el元件的发光机理,主要有使用来自激发单重态的发光的荧光发光和使用来自激发三重态的发光的磷光发光这两种。一般的荧光发光材料的激子利用效率低,约为25%,即便使用三重态-三重态融合(ttf:triplet-tripletfusion;或者三重态-三重态湮灭、tta:triplet-tripletannihilation),其激子利用效率也为62.5%。另一方面,磷光材料还存在激子利用效率达到100%的情况,但难以实现深色的蓝色发光,并且发光光谱的宽度较宽,因此,存在色纯度低的问题。
因而,九州大学的安达千波矢教授提出了热活化型延迟荧光(tadf:thermallyassistingdelayedfluorescence))机理(参照非专利文献1)。tadf化合物是能够吸收热能而发生自激发三重态向激发单重态的反向系间窜跃,并能够自该激发单重态进行辐射失活而发射荧光(延迟荧光)的化合物。通过利用这样的tadf化合物,三重态激子的能量也能够有效利用于荧光发光,从而使得发光的激子利用效率达到100%。tadf化合物因其结构而提供色纯度低的宽幅的发光光谱,但反向系间窜跃的速度极快。
着眼于该优点,提出了利用tadf化合物作为辅助掺杂物(assistingdopant:ad)的有机发光元件(taf元件:tadfassistingfluorescence元件)(参照专利文献1)。taf元件使用主体化合物、tadf化合物(辅助掺杂物)和荧光体这三种成分,利用tadf化合物中的反向系间窜跃而将激发三重态能量转换成激发单重态能量,并使其向荧光体移动。由此,从结果来说,激发三重态能量被有效利用于荧光体的发光而得到高发光效率,且通过荧光体而实现色纯度高的发光。
现有技术文献
专利文献
专利文献1:日本特许第5669163号公报
非专利文献
非专利文献1:highlyefficientorganiclight-emittingdiodesfromdelayedfluorescence,nature492,234–238
技术实现要素:
发明要解决的问题
如上所述,提出了利用tadf化合物作为辅助掺杂物的有机发光元件(taf元件)。但是,本发明人等研究在以往的taf元件中使用的三种成分的性能、元件的发光效率时发现:发光层中的电荷迁移率、向tadf化合物分子内封闭三重态激子的封闭效果不充分,发光效率尚有进一步改善的余地。
因而,本发明人等为了解决这种现有技术的课题,致力于提供可利用tadf化合物而获得更高发光效率的有机发光元件而进行了研究。
用于解决问题的方案
本发明人等为了解决上述课题而进行了深入研究,结果获得如下见解:通过使用在分子中具有硼原子和氧原子的化合物来作为由主体化合物、热活化型延迟荧光体和荧光体构成的三成分体系的主体化合物,与使用mcbp那样的以往的主体化合物的体系相比,发光效率会显著提高(参照后述实施例)。本发明是基于这种见解而提出的,具体具有以下的构成。
[1]一种有机电致发光元件,其具有发光层,前述发光层中,作为第一成分,包含在分子中具有硼原子和氧原子的主体化合物;作为第二成分,包含激发单重态能级与激发三重态能级之差δest为0.20ev以下的热活化型延迟荧光体;作为第三成分,包含荧光体。
[2]根据[1]所述的有机电致发光元件,其中,前述发光层中,作为前述第一成分,包含下述式(i)、(ii)和(iii)中任意者所示的化合物中的至少1种。
(上述式(i)中,
a环、b环和c环各自独立地为芳环或杂芳环,这些环中的至少1个氢任选被取代,式(i)所示的化合物或结构中的至少1个氢任选被氰基、卤素或氘取代。)
(上述式(ii)中,a环、b环和c环各自独立地为芳环或杂芳环,这些环中的至少1个氢任选被取代,y1为b,x1、x2和x3各自独立地为>o、>n-r、>cr2或>s,x1~x3之中的至少两者为>o,前述n-r的r和>cr2的r为任选被取代的芳基、任选被取代的杂芳基或烷基,而且,前述>n-r的r任选借助连接基团或单键而与前述a环、b环和c环中的至少一者键合;并且,式(ii)所示的化合物或结构中的至少1个氢任选被氰基、卤素或氘取代。)
(上述式(iii)中,a环、b环、c环和d环各自独立地为芳环或杂芳环,这些环中的至少1个氢任选被取代,r1和r2各自独立地为氢、碳原子数1~6的烷基、碳原子数6~12的芳基、碳原子数2~15的杂芳基、二芳基氨基(其中,芳基为碳原子数6~12的芳基)、二杂芳基氨基(其中,杂芳基为碳原子数2~15的杂芳基)或芳基杂芳基氨基(其中,芳基为碳原子数6~12的芳基、杂芳基为碳原子数2~15的杂芳基),并且,式(iii)所示的化合物中的至少1个氢任选被氰基、卤素或氘取代。)
[3]根据[1]和[2]中任一项所述的有机电致发光元件,其中,前述发光层中,作为前述第一成分,包含下述式(1)、(2)和(3)中任意者所示的化合物中的至少一种。
(上述式(1)中,r1、r2、r3、r4、r5、r6、r7、r8、r9、r10和r11各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基,它们任选进一步被选自芳基、杂芳基和烷基中的至少一者取代,式(1)所示的化合物和结构中的至少1个氢任选被氰基、卤素或氘取代。)
(上述式(2)中,r1、r2、r3、r4、r5、r6、r9、r10和r11各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基,它们任选进一步被选自芳基、杂芳基和烷基中的至少一者取代,x1、x2和x3各自独立地为>o、>n-r、>s或>cr2,x1、x2和x3中的至少两者为>o,前述>n-r的r和>cr2的r为芳基、杂芳基或烷基,它们任选进一步被选自芳基、杂芳基和烷基中的至少一者取代,其中,x1、x2和x3不同时为>cr2,并且,式(2)所示的化合物和结构中的至少1个氢任选被氰基、卤素或氘取代。)
(上述式(3)中,r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13和r14各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基、芳氧基、杂芳氧基、芳基硫基、杂芳基硫基或烷基取代甲硅烷基,它们中的至少1个氢任选被芳基、杂芳基或烷基取代,而且,r5~r7和r10~r12之中的相邻基团彼此任选键合并与b环或d环一同形成芳环或杂芳环,所形成的环中的至少1个氢任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基、芳氧基、杂芳氧基、芳基硫基、杂芳基硫基或烷基取代甲硅烷基取代,它们中的至少1个氢任选被芳基、杂芳基或烷基取代,并且,式(3)所示的化合物中的至少1个氢任选被氰基、卤素或氘取代。)
[4]根据[1]~[3]中任一项所述的有机电致发光元件,其中,作为前述第一成分的主体化合物为包含下述式(1-1)、(2-1)、(2-2)或(3-1)所示结构的化合物。
(上述的各式中,氢各自独立地任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基取代,它们任选进一步被选自芳基、杂芳基和烷基中的至少一者取代。)
[5]根据[3]或[4]所述的有机电致发光元件,其中,前述式(1)~(3)中任意者所示的化合物包含选自下述部分结构组a中的至少一种结构。
部分结构组a:
(上述部分结构式中,me表示甲基,波浪线表示键合位置。其中,上述部分结构式中的氢各自独立地任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、烷氧基或芳氧基取代,前述芳基中的氢任选进一步被芳基、杂芳基或烷基取代,前述杂芳基中的氢任选进一步被芳基、杂芳基或烷基取代,前述二芳基氨基中的氢任选进一步被芳基、杂芳基或烷基取代,前述二杂芳基氨基中的氢任选进一步被芳基、杂芳基或烷基取代,前述芳基杂芳基氨基中的氢任选进一步被芳基、杂芳基或烷基取代。)
[6]根据[1]~[5]中任一项所述的有机电致发光元件,其中,前述第一成分、前述第二成分和前述第三成分满足下述式(a)~(c)中的至少任意者。
|ip(1)|≥|ip(2)|…式(a)
[式(a)中,ip(1)表示第一成分的电离电势,ip(2)表示第二成分的电离电势。]
|eg(2)|≥|eg(3)|…式(b)
[式(b)中,eg(2)表示第二成分的电离电势与电子亲和力的能量差,eg(3)表示第三成分的电离电势与电子亲和力的能量差。]
δest(1)≥δest(2)…式(c)
[式(c)中,δest(1)表示第一成分的激发单重态能级与激发三重态能级的能量差,δest(2)表示第二成分的激发单重态能级与激发三重态能级的能量差。]
[7]根据[1]~[6]中任一项所述的有机电致发光元件,其中,前述第三成分的荧光峰的半值全宽fwhm为35nm以下。
[8]根据[1]~[7]中任一项所述的有机电致发光元件,其中,前述第三成分为包含下述式(ed11)、(ed12)、(ed13)、(ed14)、(ed15)、(ed16)、(ed17)、(ed18)、(ed19)、(ed21)、(ed22)、(ed23)、(ed24)、(ed25)、(ed26)、(ed27)、(ed211)、(ed212)、(ed221)、(ed222)、(ed223)、(ed231)、(ed241)、(ed242)、(ed261)或(ed271)所示结构的化合物。
(其中,上述的各式中,
氢各自独立地任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基取代,它们任选进一步被选自芳基、杂芳基和烷基中的至少一者取代。)
[9]根据[1]~[8]中任一项所述的有机电致发光元件,其中,前述第二成分为包含下述式(ad11)、(ad12)、(ad13)、(ad21)或(ad22)所示结构的化合物。
(上述的各式中,r7或r8为碳原子数1~6的烷基,氢各自独立地任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基取代,它们任选进一步被选自芳基、杂芳基和烷基中的至少一者取代。)
[10]根据[1]~[9]中任一项所述的有机电致发光元件,其中,前述第二成分中,作为前述热活化型延迟荧光体,含有下述式(ad31)所示的化合物中的至少一种。
(上述式(ad31)中,m各自独立地为单键、-o-、>n-ar和>car2中的至少一者,前述>n-ar和>car2中的ar为芳基,q为部分结构式(q1)~(q26)中任意者所示的基团。n为1~5的整数,上述式中的氢各自独立地任选被碳原子数6~18的芳基、碳原子数6~18的杂芳基、碳原子数1~6的烷基和碳原子数3~12的环烷基取代,上述各式所示的化合物中的至少1个氢任选被卤素或氘取代。)
[11]根据[1]~[10]中任一项所述的有机电致发光元件,其中,前述第二成分中,作为前述热活化型延迟荧光体,含有至少一种具有下述式(ad3101)~(ad3118)中任意者所示结构的化合物。
[12]根据[1]~[11]中任一项所述的有机电致发光元件,其中,前述第三成分中,作为前述荧光体,包含具有选自下述部分结构组b中的至少一种结构的化合物。
部分结构组b:
(上述部分结构式中,me表示甲基,tbu和t-bu表示叔丁基,波浪线表示键合位置。
其中,上述部分结构式中的氢各自独立地任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、烷氧基或芳氧基取代,前述芳基中的氢任选进一步被芳基、杂芳基或烷基取代,前述杂芳基中的氢任选进一步被芳基、杂芳基或烷基取代,前述二芳基氨基中的氢任选进一步被芳基、杂芳基或烷基取代,前述二杂芳基氨基中的氢任选进一步被芳基、杂芳基或烷基取代,前述芳基杂芳基氨基中的氢任选进一步被芳基、杂芳基或烷基取代。)
[13]一种显示装置,其具备[1]~[12]中任一项所述的有机电致发光元件。
[14]一种照明装置,其具备[1]~[12]中任一项所述的有机电致发光元件。
发明的效果
本发明的有机电致发光元件通过在发光层中包含主体化合物、热活化型延迟荧光体和荧光体这三种成分,并使该主体化合物为分子中具有硼原子和氧原子的化合物,从而能够实现高发光效率。
附图说明
图1是示出本实施方式的有机el元件的示意剖视图。
具体实施方式
以下,针对本发明进行详细说明。以下记载的构成条件的说明有时基于代表性的实施方式、具体例来进行,但本发明不限定于这种实施方式。需要说明的是,本说明书中,使用“~”来表示的数值范围是指包括在“~”前后记载的数值作为下限值和上限值的范围。
(有机电致发光元件)
本发明的有机电致发光元件是发光层包含第一成分~第三成分的有机电致发光元件,作为第一成分,使用在分子中具有硼原子和氧原子的主体化合物,作为第二成分,使用激发单重态能级与激发三重态能级之差δest(2)为0.20ev以下的热活化型延迟荧光体,作为第三成分,使用荧光体。此处,用于求出δest(2)的激发三重态能级和激发单重态能级设为反向系间窜跃前后的激发三重态能级和激发单重态能级。例如,可以是最低激发三重态能级和最低激发单重态能级,也可以是高阶激发三重态能级和最低激发单重态能级,还可以是高阶激发三重态能级和高阶激发单重态能级。此处,高阶激发三重态能级和高阶激发单重态能级分别是指最低激发三重态能级、能量比最低激发单重态能级高的激发三重态能级、激发单重态能级。如后所述,最低激发单重态能级和最低激发三重态能级可以由荧光光谱和磷光光谱的短波长侧的峰顶来求出。高阶激发三重态能级和高阶激发单重态能级可通过九州大学野田、中野谷、安达等人的论文(naturematerials,18,2019,1084–1090)中记载的方法并使用部分结构来推测。或者,可通过京都大学佐藤等人的论文(scientificreports,7:4820,doi:10.1038/s41598-017-05007-7)中记载的计算来求出。
本发明中的“主体化合物”是指:由荧光光谱的峰短波长侧的肩求出的激发单重态能级比作为第二成分的热活化型延迟荧光体和作为第三成分的荧光体高的化合物。
“热活化型延迟荧光体”是指:能够吸收热能而发生自激发三重态向激发单重态的反向系间窜跃,并能够自该激发单重态进行辐射失活而发射延迟荧光的化合物。此处,“热活化型延迟荧光体”还包括在自激发三重态向激发单重态的激发过程中历经高阶三重态的荧光体。历经高阶三重态而发射荧光的发光机理被称为fvht(fluorescenceviahighertriplet)机理,对此,例如durham大学monkman等人的论文(naturecommunications,7:13680,doi:10.1038/ncomms13680)、产业技术综合研究所细贝等人的论文(hosokaietal.,sci.adv.2017;3:e1603282)、京都大学佐藤等人的论文(scientificreports,7:4820,doi:10.1038/s41598-017-05007-7)和同为京都大学佐藤等人的学会发表(日本化学会第98春季年会、发表编号:2i4-15、将dabna用作发光分子的有机el中的高效发光的机理(dabnaを発光分子として用いた有機el中的高効率発光の機構)、京都大学大学院工学研究科)等中有所记载。本发明中,针对包含对象化合物的样品以300k测定荧光寿命时,根据观测到慢的荧光成分而判定该对象化合物为“热活化型延迟荧光体”。此处,“慢的荧光成分”是指荧光寿命为0.1μ秒以上。与此相对,从通过自基底单重态的直接跃迁而产生的激发单重态所发射的荧光的荧光寿命通常为0.1n秒以下。在以下的说明中,将寿命为0.1n秒以下的荧光称为“快的荧光成分”。本发明中使用的“热活化型延迟荧光体”所发射的荧光可以同时包含慢的荧光成分和快的荧光成分。
荧光寿命的测定可使用例如荧光寿命测定装置(hamamatsuphotonics公司制、c11367-01)来进行。
第二成分的δest(2)是指:由通过其荧光光谱的短波长侧的峰顶求出的激发单重态能级e(2,s,pt)减去通过磷光光谱的短波长侧的峰顶求出的激发三重态能级e(2,t,pt)而得的能量差,即通过e(2,s,pt)-e(2,t,pt)算出的值。δest(2)为0.20ev以下,优选为0.15ev以下,更优选为0.10ev以下。
“荧光体”是指能够自激发单重态进行辐射失活而发射荧光的化合物。荧光体可以是以300k测定荧光寿命时仅观测到快的荧光成分的普通荧光体,也可以是观测到快的荧光成分和慢的荧光成分这两者的延迟荧光体。荧光体的由荧光光谱的峰短波长侧的肩求出的激发单重态能级优选比作为第一成分的主体化合物和作为第二成分的热活化型延迟荧光体更低。
本发明中,“荧光体”能够作为发光掺杂物而发挥功能,“热活化型延迟荧光体”能够作为辅助荧光体发光的辅助掺杂物而发挥功能。在以下的说明中,有时将使用热活化型延迟荧光体作为辅助掺杂物的有机电致发光元件称为“taf元件”(tadfassistingfluorescence元件)。在taf元件中,通过热活化型延迟荧光体中的反向系间窜跃,激发三重态能量被转换成激发单重态能量,因此,能够对荧光体高效地供给激发单重态能量,并辅助发光。由此获得高的发光效率。
此外,本发明中,尤其是通过使发光层包含在分子中具有硼原子和氧原子的主体化合物,与使用以往的主体化合物的三成分体系相比,能够实现显著高的发光效率。可认为其基于以下的理由。
即,一般的taf元件中使用的mcbp等主体化合物(第一成分)的空穴输送性高于电子输送性。因此,在以往的taf元件中,向发光层中大量添加作为热活化型延迟荧光体的辅助掺杂物(第二成分)来弥补电子输送性。与此相对,本发明所使用的在分子中具有硼原子和氧原子的主体化合物由于硼原子富有受电子性且氧原子具有高电负度,从而具有电子输送性高的优点。因此可推测:通过使用具有硼原子和氧原子的主体化合物,对辅助掺杂物造成的电荷输送负担会减轻且发光位点受到调节,发光效率和元件寿命得以改善。
本发明中使用的第一成分、第二成分和第三成分优选其能级满足下述式(a)~(c)中的至少任意者,更优选满足全部条件。
|ip(1)|≥|ip(2)|…式(a)
式(a)中,ip(1)表示作为第一成分的主体化合物的电离电势,ip(2)表示作为第二成分的热活化型延迟荧光体的电离电势。
|eg(2)|≥|eg(3)|…式(b)
式(b)中,eg(2)表示作为第二成分的热活化型延迟荧光体的电离电势与电子亲和力的能量差,eg(3)表示作为第三成分的荧光体的电离电势与电子亲和力的能量差。
δest(1)≥δest(2)…式(c)
式(c)中,δest(1)表示作为第一成分的主体化合物的激发单重态能级与激发三重态能级的能量差,δest(2)表示作为第二成分的热活化型延迟荧光体的激发单重态能级与激发三重态能级的能量差。此处,激发单重态能级是由其荧光光谱的短波长侧的峰顶求出的激发单重态能级e(1,s,pt)、e(2,s,pt),激发三重态能级是由其磷光光谱的短波长侧的峰顶求出的激发三重态能级e(1,t,pt)、e(1,t,pt)。关于它们的含义,如后所述。
通过使第一成分和第二成分满足式(a),第一成分所输送的空穴被高效地向第二成分传递。此外,通过使第二成分和第三成分满足式(b),在第二成分中的载流子再结合时,生成大的激发能量,该激发单重态能量以及历经自激发三重态向激发单重态的反向系间窜跃而生成的激发单重态能量被高效地供给至第三成分。进而,通过使第一成分和第二成分满足式(c),在第二成分中发生反向系间窜跃,激发三重态能量被转换成激发单重态能量,该激发单重态能量被供给至荧光体。综上所述,通过使第一成分、第二成分和第三成分满足式(a)~(c),从而向荧光体高效地供给激发单重态能量,能够获得更高的发光效率。
进而,若第一成分的由磷光光谱的短波长侧的峰顶求出的激发三重态能级e(1,t,pt)高于第二成分的由磷光光谱的短波长侧的峰顶求出的激发三重态能级e(2,t,pt),则第一成分中产生的激发三重态能量容易向第二成分移动,且激发三重态能量被封闭在第二成分的分子内,促进第二成分中的反向系间窜跃。其结果,更高效地向第三成分供给激发单重态能量,获得更高的发光效率。具体而言,e(1,t,pt)优选比e(2,t,pt)高0.01ev以上,更优选高0.03ev以上,进一步优选高0.1ev以上。
另一方面,作为第三成分的荧光体优选在其荧光光谱的440~590nm的范围具有半值全宽fwhm为35nm以下的发光峰。在蓝色发光元件的用途中,更优选为450~475nm,进一步优选为455~465nm。在绿色发光元件的用途中,更优选为490~590nm,进一步优选为510~550nm。发光峰的半值全宽fwhm为35nm以下是指发光的色纯度高。因此,通过使用这种荧光体,能够实现颜色良好的有机发光元件。
本说明书中,电离电势(ip)是指基于光电子产额谱(photoelectronyieldspectroscopy)的电离电势(ip),能隙(eg)是指由通过紫外可见吸收光谱求出的光谱的最长波长侧的吸收峰的切线与基线的交点求出的光学带隙,电子亲和力(ea)是指通过从ip减去eg而求出的电子亲和力。
此外,本说明书中,针对作为第一成分的主体化合物,将由其荧光光谱的峰短波长侧的肩求出的激发单重态能级表述为e(1,s,sh),将由荧光光谱的短波长侧的峰顶求出的激发单重态能级表述为e(1,s,pt),将由磷光光谱的峰短波长侧的肩求出的激发单重态能级表述为e(1,t,sh),将由磷光光谱的短波长侧的峰顶求出的激发三重态能级表述为e(1,t,pt)。此外,将通过e(1,s,pt)-e(1,t,pt)而算出的能量差表述为δest(1)。针对第二成分和第三成分的各能级和能量差,将第一成分中的符号的“1”在第二成分的情况下变更为“2”,并在第三成分的情况下变更为“3”来表述。此外,将上述e(1,s,sh)、e(2,s,sh)、e(3,s,sh)统称为e(s,sh),将e(1,s,pt)、e(2,s,pt)、e(3,s,pt)统称为e(s,pt),将e(1,t,sh)、e(2,t,sh)、e(3,t,sh)统称为e(t,sh),将e(1,t,pt)、e(2,t,pt)、e(3,t,pt)统称为e(t,pt),将δest(1)、δest(2)、δest(3)统称为δest。
本发明中,由荧光光谱的峰短波长侧的肩求出的激发单重态能级e(s,sh)、由荧光光谱的短波长侧的峰顶求出的激发单重态能级e(s,pt)、由磷光光谱的峰短波长侧的肩求出的激发三重态能级e(t,sh)、由磷光光谱的短波长侧的峰顶求出的激发三重态能级e(t,pt)、反向系间窜跃速度和发光速度如下操作来计算。
此处,“峰短波长侧的肩”是指发光峰的短波长侧的拐点,“短波长侧的峰顶”是指发光峰的发光最大值之中与最短波长侧的发光最大值对应的峰上的位置。
此外,作为用于测定各能级的测定样品,在对象化合物为主体化合物或辅助掺杂物的情况下,使用在玻璃基板上形成的对象化合物的单独膜(neat膜、厚度:50nm),在对象化合物为发光掺杂物的情况下,使用在玻璃基板上形成的分散有对象化合物的聚甲基丙烯酸甲酯膜(厚度:10μm、对象化合物的浓度:1重量%)。针对分散有对象化合物的聚甲基丙烯酸甲酯膜的膜厚,只要是能够获得对于测定吸收光谱、荧光光谱和磷光光谱而言充分强度的膜厚即可,在强度弱时设定得厚、在强度强时设定得厚即可。激发光使用在吸收光谱中得到的吸收峰的波长,并使用由在荧光光谱或磷光光谱中出现的发光峰之中的如下发光峰得到的数据来求出各能级,所述发光峰分别在蓝色发光的情况下出现在400~500nm的范围,在绿色发光的情况下出现在480~600nm的范围,在红色的情况下出现在580~700nm的范围。此外,吸收峰与发光峰相近而导致发光峰中混合有激发光时,可以使用更短波长侧的吸收峰、吸收肩。
[1]由荧光光谱的峰短波长侧的肩求出的激发单重态能级e(s,sh)
对包含对象化合物的测定样品以77k照射激发光来观测荧光光谱。对于在该荧光光谱中出现的发光峰,画出穿过其短波长侧的拐点(肩)的切线,使用下述式,由该切线与基线的交点的波长(bsh)[nm]计算激发单重态能级e(s,sh)。
e(s,sh)[ev]=1240/bsh
[2]由荧光光谱的短波长侧的峰顶求出的激发单重态能级e(s,pt)
对包含对象化合物的测定样品以77k照射激发光来观测荧光光谱。根据与在该荧光光谱中出现的发光峰的最短波长侧的峰顶对应的波长(发光最大波长、bpt)[nm],使用下述式来计算激发单重态能级e(s,pt)。
e(s,pt)[ev]=1240/bpt
[3]由磷光光谱的峰短波长侧的肩求出的激发三重态能级e(t,sh)
对包含对象化合物的测定样品以77k照射激发光来观测磷光光谱。对于在该磷光光谱中出现的发光峰,画出穿过其短波长侧的拐点(肩)的切线,使用下述式,由该切线与基线的交点的波长(csh)[nm]计算激发三重态能级e(t,sh)。
e(t,sh)[ev]=1240/csh
[4]由磷光光谱的短波长侧的峰顶求出的激发三重态能级e(t,pt)
对包含对象化合物的测定样品以77k照射激发光来观测磷光光谱。根据与在该磷光光谱中出现的发光峰的最短波长侧的峰顶对应的波长(发光最大波长、cpt)[nm],使用下述式来计算激发三重态能级e(t,pt)。
e(t,pt)[ev]=1240/cpt
此处可以认为:在d-a(施主-受主)型tadf材料和mre(multiresonanceeffect、多重共振)型化合物中,由于荧光光谱和磷光光谱的发光宽度因分子的牢固性而异,因此,即便最大发光波长相同,d-a型tadf化合物与mre型化合物分子相比在分子所具有的能量方面也更有宽度。taf元件需要准确地预估各成分之间的能量授受来设计构成,因此,由光谱的短波长侧的肩来预估激发单重态能级和激发三重态能级。一般而言,将穿过光谱的短波长侧的拐点的切线与基线的交点作为由短波长侧的肩求出的能量。
由峰顶求出的激发单重态能级e(s,pt)和激发三重态能级e(t,pt)用于δest的计算和讨论。由光谱的短波长侧的肩求出的激发单重态能级e(s,sh)和激发三重态能级e(t,sh)用于作为第一成分的主体化合物与辅助掺杂物的能量的封闭和授受、辅助掺杂物与发光掺杂物的能量的封闭和授受的讨论。
(5)反向系间窜跃速度
反向系间窜跃速度表示自激发三重态向激发单重态的反向系间窜跃的速度。辅助掺杂物和发光掺杂物的反向系间窜跃速度可通过瞬态荧光光谱测定,并使用nat.commun.2015,6,8476.或organicelectronics2013,14,2721–2726中记载的方法来计算,具体而言,辅助掺杂物的反向系间窜跃速度为105s-1,进一步优选为106s-1。
(6)发光速度
发光速度表示未历经tadf过程而是历经自激发单重态向基态进行荧光发光并跃迁的速度。辅助掺杂物和发光掺杂物的发光速度与反向系间窜跃速度同样地可使用nat.commun.2015,6,8476.或organicelectronics2013,14,2721–2726中记载的方法来计算,具体而言,发光掺杂物的反向系间窜跃速度为107s-1,进一步优选为108s-1。
以下,针对构成本发明的发光元件的各层和各材料进行说明。
1.发光层
发光层包含作为第一成分的主体化合物、作为第二成分的热活化型延迟荧光体和作为第三成分的荧光体。此处,主体化合物是在分子中具有硼原子和氧原子的化合物,热活化型延迟荧光体的激发单重态能级与激发三重态能级之差δest(2)为0.20ev以下。此处,构成第一成分~第三成分的化合物分别可以为1种,也可以为2种以上。
本说明书中,有时将作为第二成分的热活化型延迟荧光体称为“辅助掺杂物”(化合物),将作为第三成分的荧光体称为“发光掺杂物”(化合物)。
发光层可以为单一层,也可以由多层构成。此外,主体化合物、热活化型延迟荧光体和荧光体可以包含在同一层内,也可以在多层中各包含至少1种成分。发光层所包含的主体化合物、热活化型延迟荧光体和荧光体分别可以为一种,也可以是多种的组合。辅助掺杂物和发光掺杂物可以整体包含在作为基质的主体化合物中,也可以部分包含在作为基质的主体化合物中。掺杂有辅助掺杂物和发光掺杂物的发光层可通过如下方法等来形成:利用三元共蒸镀法对主体化合物和辅助掺杂物和发光掺杂物进行成膜的方法;在将主体化合物和辅助掺杂物和发光掺杂物预先混合后,同时进行蒸镀的方法;涂布将主体化合物和辅助掺杂物和发光掺杂物溶解于有机溶剂而制备的涂料的湿式成膜法。
作为主体化合物的第一成分的用量因主体化合物的种类和第二成分的种类而异,根据其组合来决定即可。从提高电子输送性和最佳的载流子平衡的观点出发,优选第一成分多,主体化合物的用量的基准优选为发光层用材料整体的40~99.999重量%,更优选为50~99.99重量%,进一步优选为60~99.9重量%。如果是上述范围,则从例如高效的电荷输送和能量向掺杂物的高效移动的观点出发是优选的。
作为辅助掺杂物(热活化型延迟荧光体)的第二成分的用量因辅助掺杂物的种类而异,根据该辅助掺杂物的特性来决定即可。从在化合物上高效地发生再结合的观点出发,优选第二成分多,辅助掺杂物的用量的基准优选为发光层用材料整体的1~60重量%,更优选为2~50重量%,进一步优选为5~30重量%。如果是上述范围,则从例如能够高效地发生辅助掺杂物上的再结合、使能量向发光掺杂物移动的观点出发是优选的。此处,本发明中,由于主体化合物的电子输送性高而无需用辅助掺杂物来弥补电子输送性。因此,存在能够重视作为辅助掺杂物的功能来选择热活化型延迟荧光体的用量的优点。
作为发光掺杂物(荧光体)的第三成分的用量因发光掺杂物的种类而异,根据该发光掺杂物的特性来决定即可。发光掺杂物的用量的基准优选为发光层用材料整体的0.001~30重量%,更优选为0.01~20重量%,进一步优选为0.1~10重量%。一般而言,平面性高的分子、利用了多重共振效应的分子容易发生聚集,因此,优选用量少。此外,从在第二成分上高效地发生再结合的观点出发,也优选用量少。另一方面,从工艺容易度的观点出发,用量多时能够拓宽工艺余量,故而优选。如果是上述范围,则从例如可控的工艺和防止浓度淬灭现象和第二成分上的高效再结合的观点出发是优选的。
从辅助掺杂物的热活化型延迟荧光机理的效率的观点出发,优选的是:与辅助掺杂物的用量相比,发光掺杂物的用量为低浓度。
1-1.主体化合物
本发明中,作为发光层的第一成分,使用在分子中具有硼原子和氧原子的主体化合物。
在分子中具有硼原子和氧原子的主体化合物优选为具有在硼原子上键合有3个芳香环的结构,且其中的至少一个芳香环与另两个芳香环借助连接基团相连,至少一个连接基团为氧基(-o-)的多环芳香族化合物(以下称为“具有硼原子和氧原子的多环芳香族化合物”)。
具有硼原子和氧原子的多环芳香族化合物具有大的homo-lumo间隙和高的激发三重态能级(et)。推测其原因在于,由于包含杂元素的芳香环的芳香属性低,因而,与共轭体系的扩张相伴的homo-lumo间隙的减少受到抑制,且因杂元素的电子微扰而导致激发三重态(t1)的两个somo(单占分子轨道;singleoccupiedmolecularorbital)、即somo1和somo2定域化。包含硼原子和氧原子的多环芳香族化合物具有高的激发三重态能级,因此,可特别优选地用作向热活化型延迟荧光材料的分子内封闭激发三重态能量的主体。
此外,作为第一成分的主体化合物中,优选考虑以下方面来选择结构。
即,从使相互作用降低而得到高的激发三重态能量的观点出发,第一成分优选采用聚集性变低那样的结构,具体而言,第一成分的分子结构优选为非对称结构,优选在分子内具有大的二面角,或者,优选在分子内具有位阻。此外,从提高电荷输送性和能量迁移率的观点出发,优选与电荷输送相关的轨道是接近的。此外,从元件驱动时的元件特性稳定性的观点出发,优选第一成分的玻璃化转变温度(tg)高,为此,优选导入在分子间发生相互作用那样的结构。
需要说明的是,为了抑制各成分之间的聚集,作为第一成分和第二成分,可以均使用聚集性低的化合物,也可以任一者使用聚集性低的化合物。针对聚集性,可根据低浓度均匀分散状态和单一成分蒸镀膜的光谱的红移程度、或者第一成分与第二成分的共蒸镀膜的光谱和低浓度均匀分散状态的第二成分的光谱的红移程度来预估。
作为在分子中具有硼原子和氧原子的主体化合物,可列举出下述式(i)、(ii)和(iii)中任意者所示的化合物。
1-1-1.式(i)所示的化合物
式(i)中,a环、b环和c环各自独立地为芳环或杂芳环,这些环中的至少1个氢任选被取代。针对任选对a环、b环和c环的氢进行取代的取代基的说明和优选范围、具体例,可以参照式(1)的r1~r11中的取代基的说明和优选范围、具体例。
进而,式(i)所示的化合物或结构中的至少1个氢除了任选被上述取代基取代之外,也任选被氰基、卤素或氘取代。
“芳环”或“杂芳环”为芳基或杂芳基的无价环。提及芳环、杂芳环的碳原子数时,包括稠合前的环的碳原子数。
式(i)所示的化合物优选为下述式(1)所示的化合物。
式(1)中,r1~r11各自独立地表示氢或取代基。r1~r11之中的取代基的数量没有特别限定,r1~r11中的1个或2个以上可以为取代基,也可以均未取代(即为氢原子)。r1~r11中的2个以上为取代基时,这些取代基任选相同或不同。此处,由于位阻不易变大,因此,可以不加限定地向r1、r2、r3、r4、r5、r6、r9、r10和r11中导入各种取代基。另一方面,从调节homo能级和lumo能级的观点出发,为了使homo能级变深,优选r1、r3、r4、r6、r9和r11中的至少一者为吸电子性取代基,反之,为了使homo能级变浅,优选r1、r3、r4、r6、r9和r11中的至少一者为供电子性取代基。此外,为了使lumo能级变深,优选r2、r5和r10中的至少一者为吸电子性取代基,反之,为了使lumo能级变浅,优选r2、r5和r10中的至少一者为供电子性取代基。
此外,优选通过由a环~c环和硼原子和氧原子形成的芳香环所成的面与r1~r11中的取代基所成的面的二面角来控制分子间的相互作用。即,式(1)所示的化合物、后述作为第二成分的例子的式(ad11)、(ad12)、(ad13)、(ad21)或(ad22)所示的化合物的平面性高,因此,通过采用上述二面角变大那样的结构,从而有效地减轻由平面性引起的聚集、主体分子间和主体分子-掺杂物分子间的相互作用。其结果,发光光谱的红移、宽幅化受到抑制,能够实现深蓝色的发光和高的色纯度。分子的二面角可通过半经验性的分子轨道计算mopac那样的分子轨道计算来求出。
式(1)中,r1~r11各自独立地优选为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基。此处,除了这些基团之中的氢之外,是对与a环~c环对应的苯环的氢进行取代的取代基。在以下的说明中,将这些取代基称为“第一取代基”。第一取代基之中,芳基、杂芳基、二芳基氨基、二杂芳基氨基和芳基杂芳基氨基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代。在以下的说明中,将对第一取代基的氢进行取代的取代基称为“第二取代基”。
作为第一取代基的“芳基”可以为单环,也可以为两个以上的芳香族烃环稠合而成的稠环,还可以是两个以上的芳香族烃环相连而成的连接环。两个以上的芳香族烃环相连时,可以连接成直链状,也可以连接成分枝状。关于作为第一取代基的“芳基”,可列举出例如碳原子数6~30的芳基,优选为碳原子数6~24的芳基,更优选为碳原子数6~20的芳基,进一步优选为碳原子数6~16的芳基,特别优选为碳原子数6~12的芳基,最优选为碳原子数6~10的芳基。
作为具体的芳基,可列举出例如作为单环系芳基的苯基;作为二环系芳基的联苯基(2-联苯基、3-联苯基、4-联苯基);作为稠合二环系芳基的萘基(1-萘基、2-萘基);作为三环系芳基的三联苯基(间三联苯-2’-基、间三联苯-4’-基、间三联苯-5’-基、邻三联苯-3’-基、邻三联苯-4’-基、对三联苯-2’-基、间三联苯-2-基、间三联苯-3-基、间三联苯-4-基、邻三联苯-2-基、邻三联苯-3-基、邻三联苯-4-基、对三联苯-2-基、对三联苯-3-基、对三联苯-4-基);作为稠合三环系芳基的苊基(苊烯-1-基、苊烯-3-基、苊烯-4-基、苊烯-5-基)、芴基(芴-1-基、芴-2-基、芴-3-基、芴-4-基、芴-9-基)、非那烯基(非那烯-1-基、非那烯-2-基)、菲基(1-菲基、2-菲基、3-菲基、4-菲基、9-菲基);作为四环系芳基的四联苯基(5’-苯基-间三联苯-2-基、5’-苯基-间三联苯-3-基、5’-苯基-间三联苯-4-基、间四联苯基);作为稠合四环系芳基的苯并菲(苯并菲-1-基、苯并菲-2-基)、芘基(芘-1-基、芘-2-基、芘-4-基)、并四苯基(并四苯-1-基、并四苯-2-基、并四苯-5-基);作为稠合五环系芳基的苝基(苝-1-基、苝-2-基、苝-3-基)、并五苯基(并五苯-1-基、并五苯-2-基、并五苯-5-基、并五苯-6-基)等。
针对作为第一取代基的二芳基氨基中的“芳基”、芳基杂芳基氨基中的“芳基”、芳氧基中的“芳基”、作为第二取代基的“芳基”的说明和优选范围、具体例,可以参照上述作为第一取代基的“芳基”的相关说明和优选范围、具体例。
作为第一取代基的“杂芳基”可以为单环,也可以为1个以上的杂环与1个以上的杂环或1个以上的芳香族烃环稠合而成的稠环,还可以为两个以上的杂环相连而成的连接环。两个以上的杂环相连时,可以连接成直链状,也可以连接成分枝状。关于作为第一取代基的“杂芳基”,可列举出例如碳原子数2~30的杂芳基,优选为碳原子数2~25的杂芳基,更优选为碳原子数2~20的杂芳基,进一步优选为碳原子数2~15的杂芳基,特别优选为碳原子数2~10的杂芳基。杂芳基中的杂原子没有特别限定,可列举出氧、硫和氮等。杂芳基优选包含含有1~5个杂原子的杂环。
作为具体的杂芳基,可列举出例如呋喃基、噻吩基、吡咯基、噁唑基、异噁唑基、噻唑基、异噻唑基、咪唑基、吡唑基、噁二唑基、呋咱基、噻二唑基、三唑基、四唑基、吡啶基、嘧啶基、哒嗪基、吡嗪基、三嗪基、苯并呋喃基、异苯并呋喃基、二苯并呋喃基、苯并[b]噻吩基、二苯并噻吩基、吲哚基、异吲哚基、1h-吲唑基、苯并咪唑基、苯并噁唑基、苯并噻唑基、1h-苯并三唑基、喹啉基、异喹啉基、噌啉基、喹唑啉基、喹喔啉基、酞嗪基、萘啶基、嘌呤基、蝶啶基、咔唑基、吖啶基、吩噁嗪基、吩噻嗪基、吩嗪基、吩噁噻基、噻蒽基、中氮茚基等。
针对作为第一取代基的、二杂芳基氨基中的“杂芳基”、芳基杂芳基氨基中的“杂芳基”、作为第二取代基的“杂芳基”的说明和优选范围、具体例,可以参照上述作为第一取代基的“杂芳基”的相关说明和优选范围、具体例。此外,作为第二取代基的“杂芳基”还包括该杂芳基中的至少1个氢被苯基等芳基、甲基等烷基取代而成的取代杂芳基。针对作为第二取代基的“杂芳基”上取代的芳基的说明和优选范围、具体例,可以参照作为第一取代基的“芳基”的相关说明和优选范围、具体例。针对作为第二取代基的“杂芳基”上取代的烷基的说明和优选范围、具体例,可以参照下述作为第一取代基的“烷基”的相关说明和优选范围、具体例。关于作为第二取代基的取代杂芳基的例子,可列举出至少9位的氢被苯基等芳基、甲基等烷基取代的咔唑基。
作为第一取代基的“烷基”可以为直链烷基和支链烷基中的任意者。关于作为第一取代基的烷基,可列举出例如碳原子数1~24的烷基,优选为碳原子数1~18的烷基,更优选为碳原子数1~12的烷基,进一步优选为碳原子数1~6的烷基,特别优选为碳原子数1~4的烷基,最优选为甲基。需要说明的是,作为第一取代基的烷基为支链烷基时,作为该支链烷基,可列举出例如碳原子数3~24的支链烷基,优选为碳原子数3~18的支链烷基,更优选为碳原子数3~12的支链烷基,进一步优选为碳原子数3~6的支链烷基,特别优选为碳原子数3~4的支链烷基。
作为具体的烷基,可列举出例如甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基、叔戊基、正己基、1-甲基戊基、4-甲基-2-戊基、3,3-二甲基丁基、2-乙基丁基、正庚基、1-甲基己基、正辛基、叔辛基、1-甲基庚基、2-乙基己基、2-丙基戊基、正壬基、2,2-二甲基庚基、2,6-二甲基-4-庚基、3,5,5-三甲基己基、正癸基、正十一烷基、1-甲基癸基、正十二烷基、正十三烷基、1-己基庚基、正十四烷基、正十五烷基、正十六烷基、正十七烷基、正十八烷基、正二十烷基等。
针对作为第二取代基的“烷基”的说明和优选范围、具体例,可以参照作为第一取代基的“烷基”的相关说明和优选范围、具体例。在第一取代基中,作为第二取代基的烷基的取代位置没有特别限定,以第一取代基在a环、b环和c环上的键合位置(1位)作为基准,优选为2位或3位,更优选为2位。
作为第一取代基的“环烷基”可以为包含1个环的环烷基、包含多个环的环烷基、在环内包含非共轭双键的环烷基和在环外包含支链的环烷基中的任一者。关于作为第一取代基的“环烷基”,可列举出例如碳原子数3~12的环烷基,优选为碳原子数5~10的环烷基,更优选为碳原子数6~10的环烷基。
作为具体的环烷基,可列举出例如环丙基、环丁基、环戊基、环己基、环庚基、环辛基、双环[2,2,1]庚基、双环[2.2.2]辛基、十氢萘基、金刚烷基等。
关于作为第二取代基的“环烷基”的说明和优选范围、具体例,可以参照作为第一取代基的“环烷基”的相关说明和优选范围、具体例。
作为第一取代基的“烷氧基”可以为直链状,也可以为支链状。关于作为第一取代基的“烷氧基”,可列举出例如碳原子数1~24的烷氧基,优选为碳原子数1~18的烷氧基,更优选为碳原子数1~12的烷氧基,进一步优选为碳原子数1~6的烷氧基,特别优选为碳原子数1~4的烷氧基。需要说明的是,作为第一取代基的烷氧基为支链状时,作为该支链状的烷氧基,可列举出例如碳原子数3~24的支链烷氧基,优选为碳原子数3~18的支链烷氧基,更优选为碳原子数3~12的支链烷氧基,进一步优选为碳原子数3~6的支链烷氧基,特别优选为碳原子数3~4的支链烷氧基。
作为具体的烷氧基,可列举出甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、异丁氧基、仲丁氧基、叔丁氧基、戊基氧基、己基氧基、庚基氧基、辛基氧基等。
式(1)所示的化合物优选在分子内包含选自下述部分结构组a中的至少一种结构。式(1)所示的化合物所包含的选自部分结构组a中的结构可以为1种,也可以为2种以上。
部分结构组a:
各部分结构中,me表示甲基,波浪线表示键合位置。波浪线所示的键合位置为其连接键所挂的苯环(还包括构成稠环的苯环)的可取代的任意位置。各部分结构中的至少1个氢各自独立地任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、烷氧基或芳氧基取代,其中的芳基、杂芳基、二芳基氨基、二杂芳基氨基和芳基杂芳基氨基中的至少1个氢任选进一步被芳基、杂芳基或烷基取代。针对芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、烷氧基和芳氧基的优选范围、具体例,可以参照式(1)的r1~r11的对应记载。
式(1)中,r1~r11中的至少一者优选为下述式(1-a)~(1-n)中任意者所示的基团,更优选为下述式(1-d)所示的基团。
式(1-a)~(1-n)中,*表示键合位置。式(1-d)、(1-i)~(1-n)中,*所示的键合位置为其连接键所挂的苯环(还包括构成稠环的苯环)的可取代的任意位置。式(1-h)中,*-o-所示的基团键合于其连接键所挂的苯环的可取代的任意位置。
式(1-a)~式(1-h)中的氢任选被作为上述r1~r11中的“第二取代基”的、碳原子数6~30的芳基、碳原子数2~30的杂芳基、碳原子数1~24的烷基或碳原子数3~12的环烷基取代。
此外,式(1-i)、式(1-j)和式(1-k)中的r各自独立地表示氢、或者作为上述r1~r11中的“第二取代基”的、碳原子数6~30的芳基、碳原子数2~30的杂芳基、碳原子数1~24的烷基或碳原子数3~12的环烷基。r所键合的位置为其连接键所挂的苯环(还包括构成稠环的苯环)的可取代的任意位置。
r1~r11采用式(1-a)~(1-n)中任意者所示的基团时,其数量和位置没有特别限定,优选将r1、r2、r3、r4、r5、r6、r9、r10和r11中的至少一者设为式(1-a)~(1-n)中任意者所示的基团。此外,为了使homo能级变深,优选将r1、r3、r4、r6、r9和r11中的至少一者设为式(1-a)~(1-n)中任意者所示的基团,为了使lumo变深,优选将r2、r5和r10中的至少一者设为式(1-a)~(1-n)中任意者所示的基团。
作为式(1-a)~式(1-n)所示基团的更具体方式,可列举出例如以下所示的基团。需要说明的是,式中的*表示键合位置,me表示甲基,tbu表示叔丁基。
式(1)中,r1~r11之中的第一取代基的数量没有特别限定,r1~r11中的1个或2个以上可以为第一取代基,也可以均未取代(即为氢原子)。此处,r1~r11中的取代基的总碳原子数优选为36以下。r1~r11中的2个以上为第一取代基时,这些第一取代基的取代基种类、第二取代基的有无或种类彼此任选相同或不同。此外,a环、b环和c环中的2个以上具有第一取代基时,这些环彼此的第一取代基的取代数量、取代位置和种类、第一取代基中的第二取代基的有无或种类任选相同或不同。此外,向r1~r11中的2个以上导入第一取代基时,从容易合成的观点出发,优选以彼此位阻变小的方式选择取代位置。具体而言,优选的是:向不同的环中导入第一取代基;或者,在向同一环中导入第一取代基的情况下,在彼此成为间位的位置、彼此成为对位的位置导入第一取代基。另一方面,在彼此成为邻位的位置导入第一取代基的情况下,作为第一取代基、第二取代基,优选选择位阻小的基团。作为位阻小的基团,可列举出直链烷基、直链烷氧基、氟、氰基等。
此外,尤其是通过最后导入硼的合成方法来合成式(1)所示的化合物时,从合成容易度的观点出发,优选以相对于a环-b键呈现线对称的方式导入取代基。另一方面,从降低结晶性和聚集性的观点出发,优选以相对于a环-b键呈现非对称的方式导入取代基。
此外,上述式(1)中,r1~r11之中的相邻基团任选彼此相互键合并与a环、b环或c环一同形成芳环或杂芳环。其中,a环的r3与c环的r4、c环的r7与b环的r8、b环的r11与a环的r1等不符合此处提及的“相邻基团”,它们不会键合形成环状结构。即,“相邻基团”是指存在于同一环上的基团,且是彼此相邻的基团。在上述相邻基团彼此相互键合并与a环、b环或c环一同形成的环中,至少一个氢任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基取代。在以下的说明中,将对该所形成的环的氢进行取代的取代基称为“第一取代基”。此外,第一取代基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基取代。在以下的说明中,将对第一取代基的氢进行取代的取代基称为“第二取代基”。针对第一取代基和第二取代基的说明和优选范围、具体例,可分别参照r1~r11中的第一取代基和第二取代基的相关说明和优选范围、具体例。
具体而言,式(1)所示的化合物可以是借助a环、b环和c环中的取代基相互键合而如下述式(1-l1)和式(1-l2)所示那样地环结构发生变化而得的化合物。各式中的a’环、b’环和c’环相当于上述“所形成的环”(r1~r11之中的相邻基团彼此相互键合并与a环、b环或c环一同形成的芳环或杂芳环)。需要说明的是,式(1-l1)和式(1-l2)中的r1~r11、a环、b环和c环的定义与式(1)中的r1~r11、a环、b环和c环的定义相同。
需要说明的是,虽未在式中示出,但式(1)所示的化合物可以是a环、b环和c环全部变成a’环、b’环和c’环的化合物。
上述式(1-l1)、式(1-l2)所示的化合物例如是具有对a环、b环和c环中至少一者中的苯环稠合苯环、吲哚环、吡咯环、苯并呋喃环或苯并噻吩环等而形成的a’环(稠环a’)、b’环(稠环b’)和c’环(稠环c’)中至少一者的化合物。作为稠环a’、稠环b’和稠环c’的具体例,可列举出萘环、咔唑环、吲哚环、二苯并呋喃环或二苯并噻吩环等。
此外,作为a’环、b’环和c’环,也可列举出下述芳环和杂芳环。
即,作为a’环、b’环、c’环可采用的“芳环”,可列举出例如碳原子数9~30的芳环,优选为碳原子数9~24的芳环,更优选为碳原子数9~20的芳环,进一步优选为碳原子数9~16的芳环,特别优选为碳原子数9~12的芳环,最优选为碳原子数9~10环的芳基。需要说明的是,此处的“芳环”的碳原子数的下限值“9”相当于在构成a环(b环或c环)的苯环(碳原子数6)上稠合五元环时的总碳原子数。
作为具体的“芳环”,可列举出例如作为稠合二环系的萘环;作为稠合三环系的苊烯环、芴环、非那烯环、菲环;作为稠合四环系的苯并菲环、芘环、并四苯环;作为稠合五环系的苝环、并五苯环等。
作为a’环、b’环、c’环可采用的“杂芳环”,可列举出例如碳原子数6~30的杂芳环,优选为碳原子数6~25的杂芳环,更优选为碳原子数6~20的杂芳环,进一步优选为碳原子数6~15的杂芳环,特别优选为碳原子数6~10的杂芳环。“杂芳环”中的杂原子没有特别限定,可列举出氧、硫和氮等。构成a’环、b’环、c’环的“芳香族杂环”优选为含有1~5个杂原子的杂环。需要说明的是,此处的“杂芳环”的碳原子数的下限值”6”相当于在构成a环(b环或c环)的苯环(碳原子数6)上稠合有杂原子的数量为3的五元环时的总碳原子数6。
作为具体的“杂芳环”,可列举出例如吲哚环、异吲哚环、1h-吲唑环、苯并咪唑环、苯并噁唑环、苯并噻唑环、1h-苯并三唑环、喹啉环、异喹啉环、噌啉环、喹唑啉环、喹喔啉环、酞嗪环、萘啶环、嘌呤环、蝶啶环、咔唑环、吖啶环、吩噁噻环、吩噁嗪环、吩噻嗪环、吩嗪环、中氮茚环、苯并呋喃环、异苯并呋喃环、二苯并呋喃环、苯并噻吩环、二苯并噻吩环、噻蒽环等。
以下,列举出本发明中用于第一成分的主体化合物的优选例(第一方式~第四方式)。
第一方式的主体化合物是式(1)所示的化合物,该化合物的r1~r11各自独立地为氢、或者芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基或烷氧基(第一取代基)。作为第一取代基的芳基、杂芳基、二芳基氨基、二杂芳基氨基和芳基杂芳基氨基中的至少1个氢任选被芳基、杂芳基、烷基或环烷基(第二取代基)取代。换言之,第一方式的主体化合物是第一取代基为除芳氧基(例如上述式(1-h)所示的基团)之外的取代基的化合物。
第二方式的主体化合物是式(1)所示的化合物,且该化合物的r4~r11中的至少一者是作为第一取代基的杂芳基。作为第一取代基的杂芳基中的至少1个氢任选被作为第二取代基的芳基、杂芳基、烷基或环烷基取代。
作为第二方式的主体化合物的具体例,可列举出例如后述化合物(bo2-0431)、化合物(bo2-0520s)等。
第二方式的主体化合物中,式(1)的r4~r11中的至少一者优选为上述式(1-a)、式(1-b)、式(1-c)、式(1-d)、式(1-l)、式(1-m)和式(1-n)中任意者所示的基团,更优选为式(1-a)和式(1-d)中任意者所示的基团。
第三方式的主体化合物为式(1)所示的化合物,且该化合物的r1~r3中的至少一者是作为第一取代基的芳基或二苯并呋喃基。作为第一取代基的芳基和二苯并呋喃基中的至少1个氢任选被作为第二取代基的芳基、杂芳基、烷基或环烷基取代。
作为第三方式的主体化合物的具体例,可列举出例如后述化合物(bo2-0264/0511s)、化合物(bo2-0231)等。
第三方式的主体化合物中,r1~r3中的至少一者优选为上述式(1-d)、式(1-f)、式(1-i)、式(1-j)和式(1-k)中任意者所示的基团,更优选为上述式(1-d)和式(1-i)中任意者所示的基团。
第四方式的主体化合物为式(1)所示的化合物,且该化合物的r1~r3中的至少一者是作为第一取代基的杂芳基,且r4~r11中的至少一者是作为第一取代基的芳基。作为第一取代基的杂芳基中的至少1个氢任选被作为第二取代基的芳基、杂芳基、烷基或环烷基取代,作为第一取代基的芳基中的至少1个氢任选被作为第二取代基的芳基、杂芳基、烷基或环烷基取代。
作为第四方式的主体化合物的具体例,可列举出例如后述化合物(bo2-0220/0510s)、化合物(bo2-0220/0511s)等。
第四方式的主体化合物中,r1~r3中的至少一者优选为上述式(1-a)、式(1-b)、式(1-c)、式(1-d)、式(1-l)、式(1-m)和式(1-n)中任意者所示的基团,r4~r11中的至少一者优选为上述式(1-f)、式(1-i)、式(1-j)和式(1-k)中任意者所示的基团。
需要说明的是,式(1)所示的化合物中的至少1个氢除了任选被上述列举的取代基取代之外,也任选被氰基、卤素或氘取代。卤素为氟、氯、溴或碘,优选为氟、氯或溴,更优选为氟。
作为主体化合物使用的式(1)所示的化合物优选为例如下述式中任意者所示的化合物。需要说明的是,各式中,任意的氢任选被碳原子数1~4的烷基(例如甲基或叔丁基)取代。其中,本发明中,可用于主体化合物的式(1)所示的化合物不受这些具体例的限定性解释。下述式中,me表示甲基,t-bu表示叔丁基。
式(1)所示的化合物的制造方法
关于式(1)所示的化合物,首先,通过利用键合基团(-o-)使a~c环键合来制造中间体(第一反应),其后,通过利用键合基团(包含b的基团)使a~c环进行键合,由此能够制造最终产物(第二反应)。第一反应中,可以利用例如亲核取代反应、乌尔曼反应之类的常规的醚化反应。此外,第二反应中,可以利用tandembora-friedel-crafts反应(连续芳香族亲电取代反应、以下相同)。第一反应和第二反应的详情可以参照国际公开第2015/102118号公报中记载的说明。
第二反应如下述路线(1)所示那样,是导入键合a环、b环和c环的b(硼)的反应。首先,利用正丁基锂、仲丁基锂或叔丁基锂等对两个o之间的氢原子进行邻位金属化。接着,通过添加三氯化硼、三溴化硼等,进行锂-硼的金属交换后,添加n,n-二异丙基乙胺等布朗斯台德碱,从而使其发生tandembora-friedel-crafts反应,能够获得目标物。第二反应中,为了促进反应,可以添加三氯化铝等路易斯酸。
上述路线中,通过邻位金属化而向期望位置导入了锂,但如下述路线(2)那样地向想要导入锂的位置导入溴原子等,通过卤素-金属交换也能够向期望的位置导入锂。
为了获得被卤素或氘取代的化合物,可以将这些基团预先导入至中间体中,也可以在第二反应后再导入这些基团。
通过适当选择上述合成方法,并适当选择所使用的原料,能够合成在期望位置具有取代基且用式(1)表示的化合物。
1-1-2.式(ii)所示的化合物
此外,作为在分子中具有硼原子和氧原子的主体化合物,也可以使用下述式(ii)所示的化合物。
式(ii)中,a环、b环和c环各自独立地为芳环或杂芳环,这些环中的至少1个氢任选被取代。针对任选对a环、b环和c环的氢进行取代的取代基的说明和优选范围、具体例,可以参照式(1)的r1~r11中的取代基的说明和优选范围、具体例。
y1为b,x1、x2和x3各自独立地为>o、>n-r、>cr2或>s,x1~x3之中的至少两者为>o。n-r的r和>cr2的r为任选被取代的芳基、任选被取代的杂芳基或烷基,而且,>n-r的r任选借助连接基团或单键而与a环、b环和c环中的至少一者键合。
式(ii)所示的化合物或结构中的至少1个氢除了任选被上述取代基取代之外,也任选被氰基、卤素或氘取代。
式(ii)所示的化合物优选为下述式(2)所示的化合物。
式(2)中,r1~r6、r9~r11各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基。这些基团之中,除了氢之外,是对与a环~c环对应的苯环的氢进行取代的取代基,相当于上述“第一取代基”。第一取代基的至少一个氢任选被作为第二取代基的芳基、杂芳基或烷基取代。针对第一取代基和第二取代基的说明和优选范围、具体例,可以参照式(1)的r1~r6、r9~r11中的第一取代基和第二取代基的相关对应记载。
上述式(2)中,r1~r6、r9~r11之中的相邻基团任选彼此相互键合并与a环、b环或c环一同形成芳环或杂芳环。针对相邻基团、相邻基团彼此相互键合并与a环、b环或c环一同形成的芳环或杂芳环、以及任选对这些环的氢进行取代的取代基的说明和优选范围、具体例,可以参照式(1)中的对应记载。
x1~x3各自独立地为>o、>n-r、>s或>cr2,x1~x3中的至少2个为>o。x1~x3之中为>o的基团可以为2个,也可以为3个,优选为3个。即,优选x1~x3均为>o。
>n-r的r和>cr2的r为芳基、杂芳基或烷基,进而,这些基团中的至少一个氢任选被芳基、杂芳基或烷基取代。针对r中的芳基、杂芳基和烷基的优选范围和具体例,可以参照式(1)的r1~r11中的对应记载。在式(2)所示的化合物的分子内存在2个以上的r时,多个r彼此任选相同或不同。
式(2)所示的化合物优选在分子内包含选自上述部分结构组a中的至少一种结构,还优选r1~r11中的至少一者为上述式(1-a)~(1-n)中任意者所示的基团。针对部分结构组a、式(1-a)~(1-n)的说明和优选范围、具体例,可以参照式(1)中的部分结构组a、式(1-a)~(1-n)的相关说明和优选范围、具体例。
需要说明的是,式(2)所示的化合物中的至少1个氢除了任选被上述列举的取代基取代之外,也任选被氰基、卤素或氘取代。卤素为氟、氯、溴或碘,优选为氟、氯或溴,更优选为氟。
以下,示出上述式(2)的具体结构。
1-1-3.式(iii)所示的化合物
此外,作为在分子中具有硼原子和氧原子的主体化合物,也可以使用下述式(iii)所示的化合物。
式(iii)中,a环、b环、c环和d环各自独立地为芳环或杂芳环,这些环中的至少1个氢任选被取代。针对任选对a环、b环、c环和d环的氢进行取代的取代基的说明和优选范围、具体例,可以参照式(1)的r1~r11中的取代基的相关说明和优选范围、具体例。
r1和r2各自独立地为氢、碳原子数1~6的烷基、碳原子数6~12的芳基、碳原子数2~15的杂芳基、二芳基氨基(其中,芳基为碳原子数6~12的芳基)、二杂芳基氨基(其中,杂芳基为碳原子数2~15的杂芳基)或芳基杂芳基氨基(其中,芳基为碳原子数6~12的芳基、杂芳基为碳原子数2~15的杂芳基)。
式(iii)所示的化合物中的至少1个氢除了任选被上述取代基取代之外,也任选被氰基、卤素或氘取代。
式(iii)所示的化合物优选为下述式(3)所示的化合物。
式(3)中,r1~r14各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基、芳氧基、杂芳氧基、芳基硫基、杂芳基硫基或烷基取代甲硅烷基。这些基团之中,除了氢之外,是对与a环~d环对应的苯环的氢进行取代的取代基,相当于上述“第一取代基”。第一取代基中的至少1个氢任选被作为第二取代基的芳基、杂芳基或烷基取代。
式(3)中,r5~r7和r10~r12之中的相邻基团任选彼此相互键合并与b环或d环一同形成芳环或杂芳环。针对相邻基团的说明、相邻基团彼此相互键合并与b环或d环一同形成的芳环或杂芳环的说明和优选范围、具体例,可以参照式(1)中的对应记载。
上述相邻基团彼此相互键合并与b环或d环一同形成的环中的至少1个氢任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基、芳氧基、杂芳氧基、芳基硫基、杂芳基硫基或烷基取代甲硅烷基取代。这些基团是对所形成的环的氢进行取代的取代基,相当于上述“第一取代基”。此外,第一取代基中的至少1个氢任选被作为第二取代基的芳基、杂芳基或烷基取代。
针对作为第一取代基的芳基、以及二芳基氨基、芳基杂芳基氨基、芳氧基和芳基硫基中的芳基的说明和优选范围、具体例,可以参照式(1)的r1~r11中的作为第一取代基的芳基的相关说明和优选范围、具体例,针对作为第二取代基的芳基的说明和优选范围、具体例,可以参照式(1)的r1~r11中的作为第二取代基的芳基的相关说明和优选范围、具体例。针对作为第一取代基的杂芳基、以及二杂芳基氨基、芳基杂芳基氨基、杂芳氧基和杂芳基硫基中的杂芳基的说明和优选范围、具体例,可以参照式(1)的r1~r11中的作为第一取代基的杂芳基的相关说明和优选范围、具体例,针对作为第二取代基的杂芳基的说明和优选范围、具体例,可以参照式(1)的r1~r11中的作为第二取代基的杂芳基的相关说明和优选范围、具体例。针对作为第一取代基的烷基和环烷基、以及烷基取代甲硅烷基中的烷基的说明和优选范围、具体例,可以参照式(1)的r1~r11中的作为第一取代基的烷基和环烷基的相关说明和优选范围、具体例,针对作为第二取代基的烷基的说明和优选范围、具体例,可以参照式(1)的r1~r11中的作为第二取代基的烷基的相关说明和优选范围、具体例。针对作为第一取代基的烷氧基的说明和优选范围、具体例,可以参照式(1)的r1~r11中的作为第一取代基的烷氧基的相关说明和优选范围、具体例。
式(3)所示的化合物优选在分子内包含选自上述部分结构组a中的至少一种结构,还优选r1~r14中的至少一者为上述式(1-a)~(1-n)中任意者所示的基团。针对部分结构组a、式(1-a)~(1-n)的说明和优选范围、具体例,可以参照式(1)中的部分结构组a、式(1-a)~(1-n)的相关说明和优选范围、具体例。
需要说明的是,式(3)所示的化合物中的至少1个氢除了任选被上述列举的取代基取代之外,也任选被氰基、卤素或氘取代。卤素为氟、氯、溴或碘,优选为氟、氯或溴,更优选为氟。
以下,示出式(3)所示的化合物的具体例。下述式中,me表示甲基,tbu表示叔丁基,ph表示苯基。
作为第一成分使用的主体化合物还优选为包含下述式(1-1)、(2-1)、(2-2)或(3-1)所示结构的化合物。
式(1-1)、(2-1)、(2-2)或(3-1)所示结构的至少一个氢各自独立地任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基取代。这些基团之中,除了氢之外,是对各结构中的氢进行取代的取代基,相当于上述“第一取代基”。这些第一取代基的至少一个氢任选被作为第二取代基的芳基、杂芳基或烷基取代。针对第一取代基和第二取代基的说明和优选范围、具体例,可以参照式(1)的r1~r11中的第一取代基和第二取代基的相关对应记载。
1-2.热活化型延迟荧光体(辅助掺杂物)
本发明中,作为发光层的第二成分,使用热活化型延迟荧光体(tadf化合物)。
热活化型延迟荧光体优选为通过利用硼(供电子性)和氮(吸电子性)的多重共振效应而使homo定域至包含6个碳的苯环上的3个碳,并使lumo定域至剩余3个碳,以发生高效的反向系间窜跃的方式设计而得的多重共振效应(mre)型tadf化合物,进而,更优选为导入取代基而使平面性减少的mre型tadf化合物。
作为mre型tadf化合物,可列举出包含下述式(ad11)、(ad12)、(ad13)、(ad21)或(ad22)所示结构的化合物。
式(ad11)、(ad12)和(ad13)中,r7和r8为碳原子数1~6的烷基。r7中的碳原子数1~6的烷基可以为直链状、分枝状和环状中的任意者。
式(ad11)、(ad12)、(ad13)、(ad21)或(ad22)所示结构中的至少1个氢各自独立地任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基取代,它们任选进一步被芳基、杂芳基或烷基取代。针对芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基的优选范围和具体例,可以参照式(1)的r1~r11中的对应记载。
以下,针对作为发光层的第二成分使用的式(ad11)、(ad12)和(ad13),通过适当组合(i)向适当的位置导入调整多重共振效应的元素,(ii)为了使分子变形、使平面性减少而向适当的位置导入取代基这两个方法,从而在化合物中实现短的延迟荧光寿命。尤其是,针对前述的(ii),具体而言,通过向z1或r8导入特定的取代基而使分子变形,单重态和三重态的轨道也随之一同变形。该轨道的变形会导致更大的自旋轨道相互作用。具体而言,可列举出如下结构式的化合物。下述式中,me表示甲基,t-bu表示叔丁基。
以下,针对作为发光层的第二成分使用的式(ad21)和(ad22),通过(i)在适当的位置导入调整多重共振效应的元素,从而在化合物中实现短的延迟荧光寿命。关于前述的(i),本发明的通式(ad21)和(ad22)所示的多环芳香族化合物通过>o和>n-r的适当导入而使分子的多重共振效应受到影响。具体而言,可列举出如下结构式的化合物。下述式中,me表示甲基,t-bu表示叔丁基。
上述各式所示的化合物中的至少1个氢任选被碳原子数1~6的烷基、氰基、卤素或氘取代,式中的r100各自独立地为碳原子数6~10的芳基、咔唑基、二芳基氨基(其中,芳基为碳原子数6~10的芳基)、二杂芳基氨基(其中,杂芳基为碳原子数2~15的杂芳基)、芳基杂芳基氨基(其中,芳基为碳原子数6~12的芳基、杂芳基为碳原子数2~15的杂芳基)、碳原子数1~6的烷基、碳原子数3~10的环烷基或碳原子数6~10的芳氧基,前述芳基任选被碳原子数1~6的烷基取代,前述咔唑基任选被碳原子数6~10的芳基或碳原子数1~6的烷基取代。
可通过r100的结构的位阻性、供电子性和吸电子性来调整发光波长,优选为下式所示的基团,更优选为甲基、叔丁基、苯基、邻甲苯基、对甲苯基、2,4-二甲苯基、2,5-二甲苯基、2,6-二甲苯基、2,4,6-三甲苯基、二苯基氨基、二对甲苯基氨基、双(对(叔丁基)苯基)氨基、咔唑基、3,6-二甲基咔唑基、3,6-二叔丁基咔唑基和苯氧基,进一步优选为甲基、叔丁基、苯基、邻甲苯基、2,6-二甲苯基、2,4,6-三甲苯基、二苯基氨基、二对甲苯基氨基、双(对(叔丁基)苯基)氨基、咔唑基、3,6-二甲基咔唑基和3,6-二叔丁基咔唑基。从合成容易度的观点出发,位阻大的基团对于选择性合成而言是优选的,具体而言,优选为叔丁基、邻甲苯基、对甲苯基、2,4-二甲苯基、2,5-二甲苯基、2,6-二甲苯基、2,4,6-三甲苯基、二对甲苯基氨基、双(对(叔丁基)苯基)氨基、3,6-二甲基咔唑基和3,6-二叔丁基咔唑基。
本发明中使用的热活化型延迟荧光体(tadf化合物)还优选为以使用被称为施主的供电子性取代基和被称为受主的受电子性取代基使分子内的homo(最高占据分子轨道;highestoccupiedmolecularorbital)和lumo(最低未占分子轨道;lowestunoccupiedmolecularorbital)定域化,从而发生有效的反向系间窜跃(reverseintersystemcrossing)的方式设计的施主-受主型tadf化合物(d-a型tadf化合物)。
此处,本说明书中,“供电子性取代基”(施主)是指:在tadf化合物分子中,homo轨道定域的取代基和部分结构,“受电子性取代基”(受主)是指:在tadf化合物分子中,lumo轨道定域的取代基和部分结构。
一般来说,使用了施主、受主的tadf化合物因其结构而自旋轨道耦合(soc:spinorbitcoupling)大,且homo与lumo的交换相互作用小,δe(st)小,因此能够获得非常快的反向系间窜跃速度。另一方面,使用了施主、受主的tadf化合物在激发态下的结构松弛变大(在某个分子中,基态与激发态下的稳定结构不同,因此,若因外部刺激而发生自基态向激发态的转换,则在其后,结构向激发态下的稳定结构发生变化),赋予宽的发光光谱,因此,若用作发光材料则有可能使色纯度降低。
作为本发明的热活化型延迟荧光体(tadf化合物),可以使用例如施主和受主隔着间隔基团键合的d-a型tadf化合物。作为d-a型tadf化合物,可列举出下述式(ad31)所示的化合物。式(ad31)中,用括弧括住的结构对应于施主,q所示的基团相当于受主,将用括弧括住的结构与q相连的亚苯基相当于间隔基团。
式(ad31)中,m各自独立地为单键、-o-、>n-ar和>car2中的至少一者,ar为芳基。针对芳基的优选范围和具体例,可以参照式(1)的r1~r11中的芳基的优选范围和具体例。n的连接键键合于亚苯基的可取代的任意位置。
q为下述式(q1)~(q26)中任意者所示的基团。
n为1~5的整数,优选为2~5的整数,更优选为4~5的整数。
式(ad31)中的氢各自独立地任选被碳原子数6~18的芳基、碳原子数6~18的杂芳基、碳原子数1~6的烷基和碳原子数3~12的环烷基取代。针对芳基、杂芳基、烷基、环烷基的优选范围和具体例,可以参照式(1)的r1~r11中的对应记载。
此外,式(ad31)所示的化合物中的至少1个氢除了任选被上述取代基取代之外,也任选被卤素或氘取代。
式(q1)~(q26)中,波浪线表示键合位置。
此外,作为第二成分中使用的d-a型tadf化合物,也可列举出包含下述式(ad3101)~(ad3118)中任意者所示结构的化合物。
式(ad3101)~(ad3118)所示结构中的至少1个氢各自独立地任选被碳原子数6~18的芳基、碳原子数6~18的杂芳基、碳原子数1~6的烷基和碳原子数3~12的环烷基取代。针对芳基、杂芳基、烷基、环烷基的优选范围和具体例,可以参照式(1)的r1~r11中的对应记载。
进而,作为本发明的热活化型延迟荧光体中使用的施主性和受主性的结构,可以使用例如chemistryofmaterials,2017,29,1946-1963中记载的结构。作为施主性的结构,可列举出咔唑、二甲基咔唑、二叔丁基咔唑、二甲氧基咔唑、四甲基咔唑、苯并氟咔唑、苯并噻吩并咔唑、苯基二氢吲哚并咔唑、苯基联咔唑、联咔唑、三联咔唑、二苯基咔唑基胺、四苯基咔唑基二胺、吩噁嗪、二氢吩嗪、吩噻嗪、二甲基二氢吖啶、二苯基胺、双(叔丁基苯基)胺、(二苯基氨基)苯基)二苯基苯二胺、二甲基四苯基二氢吖啶二胺、四甲基二氢茚并吖啶和二苯基二氢二苯并氮硅杂环己烷等。作为受主性的结构,可列举出磺酰基二苯、二苯甲酮、亚苯基双(苯基甲酮)、苯甲腈、异烟腈、邻苯二甲腈、间苯二甲腈、对苯二甲腈、苯三甲腈、三唑、噁唑、噻二唑、苯并噻唑、苯并双噻唑、苯并噁唑、苯并双噁唑、喹啉、苯并咪唑、二苯并喹喔啉、七氮杂非那烯、噻吨酮二氧化物、二甲基蒽酮、蒽二酮、环庚二吡啶、芴二甲腈、三苯基三嗪、吡嗪二甲腈、嘧啶、苯基嘧啶、甲基嘧啶、吡啶二甲腈、二苯并喹喔啉二甲腈、双(苯基磺酰基)苯、二甲基噻吨二氧化物、噻蒽四氧化物和三(二甲基苯基)硼烷。尤其是,本发明的具有热活化型延迟荧光的化合物优选为具有选自咔唑、吩噁嗪、吖啶、三嗪、嘧啶、吡嗪、噻吨、苯甲腈、邻苯二甲腈、间苯二甲腈、二苯基砜、三唑、噁二唑、噻二唑和二苯甲酮中的至少一者作为部分结构的化合物。
以下,例示出可作为第二成分(热活化型延迟荧光体)使用的化合物。下述式中,me表示甲基,t-bu表示叔丁基,ph表示苯基,波浪线表示键合位置。
进而,作为热活化型延迟荧光体,也可以使用下述式(ad1)、(ad2)和(ad3)中任意者所示的化合物。
式(ad1)~(ad3)中,
m各自独立地为单键、-o-、>n-ar或>car2,从形成的部分结构的homo深以及激发单重态能级和激发三重态能级高的观点出发,优选为单键、-o-或>n-ar。j为将施主性的部分结构与受主性的部分结构分隔开的间隔结构,各自独立地为碳原子数6~18的亚芳基,从自施主性的部分结构和受主性的部分结构发出的共轭大的观点出发,优选为碳原子数6~12的亚芳基。更具体而言,可列举出亚苯基、甲基亚苯基和二甲基亚苯基。q各自独立地为=c(-h)-或=n-,从形成的部分结构的lumo浅以及激发单重态能级和激发三重态能级高的观点出发,优选为=n-。ar各自独立地为氢、碳原子数6~24的芳基、碳原子数2~24的杂芳基、碳原子数1~12的烷基和碳原子数3~18的环烷基,从形成的部分结构的homo深以及激发单重态能级和激发三重态能级高的观点出发,优选为氢、碳原子数6~12的芳基、碳原子数2~14的杂芳基、碳原子数1~4的烷基和碳原子数6~10的环烷基,更优选为氢、苯基、甲苯基、二甲苯基、三甲苯基、联苯基、吡啶基、联吡啶基、三嗪基、咔唑基、二甲基咔唑基、二叔丁基咔唑基、苯并咪唑和苯基苯并咪唑,进一步优选为氢、苯基和咔唑基。m为1或2。n为2~(6-m)的整数,从位阻的观点出发,优选为4~(6-m)的整数。进而,上述各式所示化合物中的至少1个氢任选被卤素或氘取代。
作为本发明的发光层的第二成分使用的化合物更具体而言,优选为4czbn、4czbn-ph、5czbn、3cz2dphczbn、4czipn、2pxzーtaz、cz-trz3、bdpcc-tpta、ma-ta、pa-ta、fa-ta、pxz-trz、dmac-trz、bczt、dcztrz、ddcztrz、spiroac-trz、ac-hpm、ac-ppm、ac-mpm、tcztrz、tmcztrz和dczmcztrz。
此外,作为本发明的发光层的第二成分使用的化合物优选为热活化型延迟荧光体,且该化合物的发光光谱与发光掺杂物的吸收峰至少部分重叠。
关于作为本发明的发光层的第二成分使用的化合物,从自三重态向单重态的快的反向系间窜跃速度的观点出发,与mre型tadf化合物相比,更优选为d-a型tadf化合物。
1-3.荧光体(发光掺杂物)
本发明中,使用荧光体作为发光层的第三成分。
作为本发明的第三成分,没有特别限定,可以使用已知的化合物,可根据期望的发光色而从各种材料中进行选择。具体而言,可列举出例如菲、蒽、芘、并四苯、并五苯、苝、萘并芘、二苯并芘、红荧烯和
分发色光地进行例示时,作为蓝~蓝绿色掺杂材料,可列举出萘、蒽、菲、芘、苯并菲、苝、芴、茚、
此外,作为绿~黄色掺杂材料,可列举出香豆素衍生物、邻苯二甲酰亚胺衍生物、萘二甲酰亚胺衍生物、苝酮衍生物、吡咯并吡咯衍生物、环戊二烯衍生物、吖啶酮衍生物、喹吖啶酮衍生物和红荧烯等并四苯衍生物等,进而,作为适合例,还可列举出向作为上述蓝~蓝绿色掺杂材料而例示的化合物中导入芳基、杂芳基、芳基乙烯基、氨基、氰基等能够长波长化的取代基而得的化合物。
进而,作为橙~红色掺杂材料,可列举出双(二异丙基苯基)苝四羧酸酰亚胺等萘二甲酰亚胺衍生物;苝酮衍生物、以乙酰丙酮或苯甲酰丙酮和菲绕啉等作为配体的eu络合物等稀土络合物;4-(二氰基亚甲基)-2-甲基-6-(对二甲基氨基苯乙烯基)-4h-吡喃或其类似物、镁酞菁、铝氯酞菁等金属酞菁衍生物;罗丹明化合物、脱氮黄素衍生物、香豆素衍生物、喹吖啶酮衍生物、吩噁嗪衍生物、噁嗪衍生物、喹唑啉衍生物、吡咯并吡啶衍生物、方酸内鎓盐衍生物、紫蒽酮衍生物、吩嗪衍生物、吩噁嗪酮衍生物和噻二唑并芘衍生物等,进而,作为适合例,还可列举出向上述作为蓝~蓝绿色和绿~黄色掺杂材料而例示的化合物中导入芳基、杂芳基、芳基乙烯基、氨基、氰基等能够长波长化的取代基而得的化合物。
另外,作为第三成分,可以从化学工业2004年6月号第13页和其中列举的参考文献等所记载的化合物等中适当选择并使用。
具有茋结构的胺用例如下述式表示。
该式中,ar1为源自碳原子数6~30的芳基的m价基团,ar2和ar3各自独立地为碳原子数6~30的芳基,ar1~ar3中至少一者具有茋结构,ar1~ar3任选被取代,且m为1~4的整数。
具有茋结构的胺更优选为下述式所示的二氨基茋。
该式中,ar2和ar3各自独立地为碳原子数6~30的芳基,ar2和ar3任选被取代。
碳原子数6~30的芳基的具体例可列举出苯、萘、苊烯、芴、非那烯、菲、蒽、荧蒽、苯并菲、芘、
具有茋结构的胺的具体例可列举出n,n,n’,n’-四(4-联苯基)-4,4’-二氨基茋、n,n,n’,n’-四(1-萘基)-4,4’-二氨基茋、n,n,n’,n’-四(2-萘基)-4,4’-二氨基茋、n,n’-二(2-萘基)-n,n’-二苯基-4,4’-二氨基茋、n,n’-二(9-菲基)-n,n’-二苯基-4,4’-二氨基茋、4,4’-双[4”-双(二苯基氨基)苯乙烯基]-联苯、1,4-双[4’-双(二苯基氨基)苯乙烯基]-苯、2,7-双[4’-双(二苯基氨基)苯乙烯基]-9,9-二甲基芴、4,4’-双(9-乙基-3-咔唑乙烯基)联苯、4,4’-双(9-苯基-3-咔唑乙烯基)联苯等。
此外,也可以使用日本特开2003-347056号公报和日本特开2001-307884号公报等中记载的具有茋结构的胺。
作为苝衍生物,可列举出例如3,10-双(2,6-二甲基苯基)苝、3,10-双(2,4,6-三甲基苯基)苝、3,10-二苯基苝、3,4-二苯基苝、2,5,8,11-四-叔丁基苝、3,4,9,10-四苯基苝、3-(1’-芘基)-8,11-二(叔丁基)苝、3-(9’-蒽基)-8,11-二(叔丁基)苝、3,3’-双(8,11-二(叔丁基)苝基)等。
此外,也可以使用日本特开平11-97178号公报、日本特开2000-133457号公报、日本特开2000-26324号公报、日本特开2001-267079号公报、日本特开2001-267078号公报、日本特开2001-267076号公报、日本特开2000-34234号公报、日本特开2001-267075号公报和日本特开2001-217077号公报等中记载的苝衍生物。
此外,关于作为本发明的第三成分使用的化合物,可列举出包含硼原子的化合物,可列举出例如硼烷衍生物、二氧杂硼杂萘并蒽(dobna)衍生物及其多聚体、二氮杂硼杂萘并蒽(dabna)衍生物及其多聚体、氧杂氮杂硼杂萘并蒽(oabna)衍生物及其多聚体、氧杂硼杂萘并蒽(obna)衍生物及其多聚体、氮杂硼杂萘并蒽(abna)衍生物及其多聚体、三氧杂硼杂二苯并芘衍生物及其多聚体、二氧杂氮杂硼杂苯并芘衍生物及其多聚体、氧杂二氮杂硼杂苯并芘衍生物及其多聚体等。
作为硼烷衍生物,可列举出例如1,8-二苯基-10-(双(三甲苯基硼基))蒽、9-苯基-10-(双(三甲苯基硼基))蒽、4-(9’-蒽基)双(三甲苯基硼基)萘、4-(10’-苯基-9’-蒽基)双(三甲苯基硼基)萘、9-(双(三甲苯基硼基))蒽、9-(4’-联苯基)-10-(双(三甲苯基硼基))蒽、9-(4’-(n-咔唑基)苯基)-10-(双(三甲苯基硼基))蒽等。
此外,也可以使用国际公开第2000/40586号单行本等中记载的硼烷衍生物。
芳香族胺衍生物用例如下述式表示。
该式中,ar4为源自碳原子数6~30的芳基的n价基团,ar5和ar6各自独立地为碳原子数6~30的芳基,ar4~ar6任选被取代,并且,n为1~4的整数。
尤其是,更优选ar4为源自蒽、
碳原子数6~30的芳基的具体例可列举出苯、萘、苊烯、芴非那烯、菲、蒽、荧蒽、苯并菲、芘、
作为芳香族胺衍生物,作为
此外,作为芘系,可列举出例如n,n,n’,n’-四苯基芘-1,6-二胺、n,n,n’,n’-四(对甲苯基)芘-1,6-二胺、n,n,n’,n’-四(间甲苯基)芘-1,6-二胺、n,n,n’,n’-四(4-异丙基苯基)芘-1,6-二胺、n,n,n’,n’-四(3,4-二甲基苯基)芘-1,6-二胺、n,n’-二苯基-n,n’-二(对甲苯基)芘-1,6-二胺、n,n’-二苯基-n,n’-双(4-乙基苯基)芘-1,6-二胺、n,n’-二苯基-n,n’-双(4-乙基苯基)芘-1,6-二胺、n,n’-二苯基-n,n’-双(4-异丙基苯基)芘-1,6-二胺、n,n’-二苯基-n,n’-双(4-叔丁基苯基)芘-1,6-二胺、n,n’-双(4-异丙基苯基)-n,n’-二(对甲苯基)芘-1,6-二胺、n,n,n’,n’-四(3,4-二甲基苯基)-3,8-二苯基芘-1,6-二胺、n,n,n,n-四苯基芘-1,8-二胺、n,n’-双(联苯基-4-基)-n,n’-二苯基芘-1,8-二胺、n1,n6-二苯基-n1,n6-双-(4-三甲基硅烷基苯基)-1h,8h-芘-1,6-二胺等。
例如,作为具体例,可列举出式(pyr1)、(pyr2)、(pyr3)和(pyr4)等。
此外,作为蒽系,可列举出例如n,n,n,n-四苯基蒽-9,10-二胺、n,n,n’,n’-四(对甲苯基)蒽-9,10-二胺、n,n,n’,n’-四(间甲苯基)蒽-9,10-二胺、n,n,n’,n’-四(4-异丙基苯基)蒽-9,10-二胺、n,n’-二苯基-n,n’-二(对甲苯基)蒽-9,10-二胺、n,n’-二苯基-n,n’-二(间甲苯基)蒽-9,10-二胺、n,n’-二苯基-n,n’-双(4-乙基苯基)蒽-9,10-二胺、n,n’-二苯基-n,n’-双(4-乙基苯基)蒽-9,10-二胺、n,n’-二苯基-n,n’-双(4-异丙基苯基)蒽-9,10-二胺、n,n’-二苯基-n,n’-双(4-叔丁基苯基)蒽-9,10-二胺、n,n’-双(4-异丙基苯基)-n,n’-二(对甲苯基)蒽-9,10-二胺、2,6-二叔丁基-n,n,n’,n’-四(对甲苯基)蒽-9,10-二胺、2,6-二叔丁基-n,n’-二苯基-n,n’-双(4-异丙基苯基)蒽-9,10-二胺、2,6-二叔丁基-n,n’-双(4-异丙基苯基)-n,n’-二(对甲苯基)蒽-9,10-二胺、2,6-二环己基-n,n’-双(4-异丙基苯基)-n,n’-二(对甲苯基)蒽-9,10-二胺、2,6-二环己基-n,n’-双(4-异丙基苯基)-n,n’-双(4-叔丁基苯基)蒽-9,10-二胺、9,10-双(4-二苯基氨基-苯基)蒽、9,10-双(4-二(1-萘基氨基)苯基)蒽、9,10-双(4-二(2-萘基氨基)苯基)蒽、10-二对甲苯基氨基-9-(4-二对甲苯基氨基-1-萘基)蒽、10-二苯基氨基-9-(4-二苯基氨基-1-萘基)蒽、10-二苯基氨基-9-(6-二苯基氨基-2-萘基)蒽等。
此外,还可列举出[4-(4-二苯基氨基-苯基)萘-1-基]-二苯基胺、[6-(4-二苯基氨基-苯基)萘-2-基]-二苯基胺、4,4’-双[4-二苯基氨基萘-1-基]联苯、4,4’-双[6-二苯基氨基萘-2-基]联苯、4,4”-双[4-二苯基氨基萘-1-基]-对三联苯、4,4”-双[6-二苯基氨基萘-2-基]-对三联苯、茚并咔唑衍生物等。
此外,也可以使用日本特开2006-156888号公报等中记载的芳香族胺衍生物。
作为茚并咔唑衍生物,为下述通式(idc1)所示的化合物。具体而言,可列举出下述具有部分结构(idc11)、(idc12)和(idc13)的化合物。下述通式(idc1)中的z各自独立地为cra或n,π1和π2各自独立地为取代或未取代的成环碳原子数6~50的芳香族烃或者取代或未取代的成环碳原子数5~50的芳香族杂环,ra、rb和rc为氢和任意的取代基,n和m各自独立地为1~4的整数,相邻的两个ra、rb和rc任选相互键合而形成取代或未取代的环结构。更具体而言,可列举出通式(idc121)、(idc131)、(idc132)、(idc133)和(idc134)等。
茚井咔唑化合物的部分结构
茚并咔唑化合物的具体化合物
作为香豆素衍生物,可列举出香豆素-6、香豆素-334等。
此外,也可以使用日本特开2004-43646号公报、日本特开2001-76876号公报和日本特开平6-298758号公报等中记载的香豆素衍生物。
作为吡喃衍生物,可列举出下述dcm、dcjtb等。
此外,也可以使用日本特开2005-126399号公报、日本特开2005-097283号公报、日本特开2002-234892号公报、日本特开2001-220577号公报、日本特开2001-081090号公报和日本特开2001-052869号公报等中记载的吡喃衍生物。
此外,本发明中使用的荧光体优选为具有硼原子的化合物。关于作为荧光体使用的具有硼原子的化合物,可列举出二氧杂硼杂萘并蒽(dobna)衍生物及其多聚体、二氮杂硼杂萘并蒽(dabna)衍生物及其多聚体、氧杂氮杂硼杂萘并蒽(oabna)衍生物及其多聚体、氧杂硼杂萘并蒽(obna)衍生物及其多聚体、氮杂硼杂萘并蒽(abna)衍生物及其多聚体等。
本发明的有机电致发光元件中,作为前述第三成分,还优选包含下述通式(ed1)、(ed1’)和(ed2)所示化合物中的至少1个。
(上述通式(ed1)中,
r1、r2、r3、r4、r5、r6、r9、r10和r11各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基,它们任选进一步被芳基、杂芳基或烷基取代,此外,r1~r3、r4~r6和r9~r11之中的相邻基团任选彼此键合并与a环、b环或c环一同形成芳环或杂芳环,所形成的环任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基取代,它们任选进一步被芳基、杂芳基或烷基取代,
x各自独立地为>o或>n-r,前述>n-r的r为芳基、杂芳基、环烷基或烷基,它们任选被芳基、杂芳基、环烷基或烷基取代,
其中,x为氨基时,r2不是氨基,并且
通式(ed1)所示的化合物和结构中的至少1个氢任选被氰基、卤素或氘取代。)
(上述通式(ed1’)中,
r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13和r14各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基,它们任选进一步被芳基、杂芳基或烷基取代,此外,r1~r3、r4~r7、r8~r10和r11~r14之中的相邻基团任选彼此键合并与a环、b环、c环或d环一同形成芳环或杂芳环,所形成的环任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基取代,它们任选进一步被芳基、杂芳基或烷基取代,
x为>o或>n-r,前述>n-r的r为芳基、杂芳基或烷基,它们任选被芳基、杂芳基或烷基取代,
l为单键、>cr2、>o、>s和>n-r,前述>cr2和>n-r中的r各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、烷氧基或芳氧基,它们任选进一步被芳基、杂芳基或烷基取代,并且
通式(ed1’)所示的化合物和结构中的至少1个氢任选被氰基、卤素或氘取代。)
(上述通式(ed2)中,
r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13和r14各自独立地为氢、芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基、芳氧基、杂芳氧基、芳基硫基、杂芳基硫基或烷基取代甲硅烷基,它们中的至少1个氢任选被芳基、杂芳基或烷基取代,此外,r5~r7和r10~r12之中的相邻基团任选彼此键合并与b环或d环一同形成芳环或杂芳环,所形成的环中的至少1个氢任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基、芳氧基、杂芳氧基、芳基硫基、杂芳基硫基或烷基取代甲硅烷基取代,它们中的至少1个氢任选被芳基、杂芳基或烷基取代,
x1、x2、x3和x4各自独立地为>o、>n-r或>cr2,前述>n-r的r和>cr2的r为碳原子数6~12的芳基、碳原子数2~15的杂芳基、碳原子数3~12的环烷基或碳原子数1~6的烷基,此外,前述>n-r的r和>cr2的r任选借助-o-、-s-、-c(-r)2-或单键而与前述a环、b环、c环和d环中的至少一者键合,前述-c(-r)2-的r为氢或碳原子数1~6的烷基,
其中,x1、x2、x3、和x4之中是>o的基团为2个以下,并且
通式(ed2)所示的化合物中的至少1个氢任选被氰基、卤素或氘取代。)
更具体而言,可列举出包含下述式(ed11)~(ed19)、(ed21)~(ed27)、(ed211)、(ed212)、(ed221)~(ed223)、(ed231)、(ed241)、(ed242)、(ed261)和(ed271)所示结构的化合物。
式(ed11)~(ed19)、(ed21)~(ed27)、(ed211)、(ed212)、(ed221)~(ed223)、(ed231)、(ed241)、(ed242)、(ed261)和(ed271)所示结构中的至少1个氢各自独立地任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基取代,它们任选进一步被芳基、杂芳基或烷基取代。针对芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、环烷基、烷氧基或芳氧基的优选范围和具体例,可以参照式(1)的r1~r11中的对应记载。需要说明的是,式(ed11)和(ed12)中,与苯环的b键合的碳的邻位上键合的氢未被烷基取代,优选为未取代。
此外,成为第三成分的荧光体优选为具有选自下述部分结构组b中的至少一种结构的化合物,更优选为具有式(ed11)~(ed19)、(ed21)~(ed27)、(ed211)、(ed212)、(ed221)~(ed223)、(ed231)、(ed241)、(ed242)、(ed261)或(ed271)所示的结构,且具有在其结构中的苯环(还包括构成稠环的苯环)上键合有选自部分结构组b中的至少一种结构的结构的化合物。
部分结构组b:
各部分结构中,me表示甲基,tbu和t-bu表示叔丁基,波浪线表示键合位置。
各部分结构中的至少1个氢各自独立地任选被芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、烷氧基或芳氧基取代,这些之中,芳基、杂芳基、二芳基氨基、二杂芳基氨基和芳基杂芳基氨基中的氢任选进一步被芳基、杂芳基或烷基取代。针对芳基、杂芳基、二芳基氨基、二杂芳基氨基、芳基杂芳基氨基、烷基、烷氧基或芳氧基的优选范围和具体例,可以参照式(1)的r1~r11中的对应记载。
作为本发明的第三成分使用的化合物具体为下式所示的化合物。
(其它有机层)
本发明的有机电致发光元件中,除了具有发光层之外,还可以具有1个以上的有机层。作为有机层,可列举出例如电子输送层、空穴输送层、电子注入层和空穴注入层等,进而,也可以具有其它的有机层。
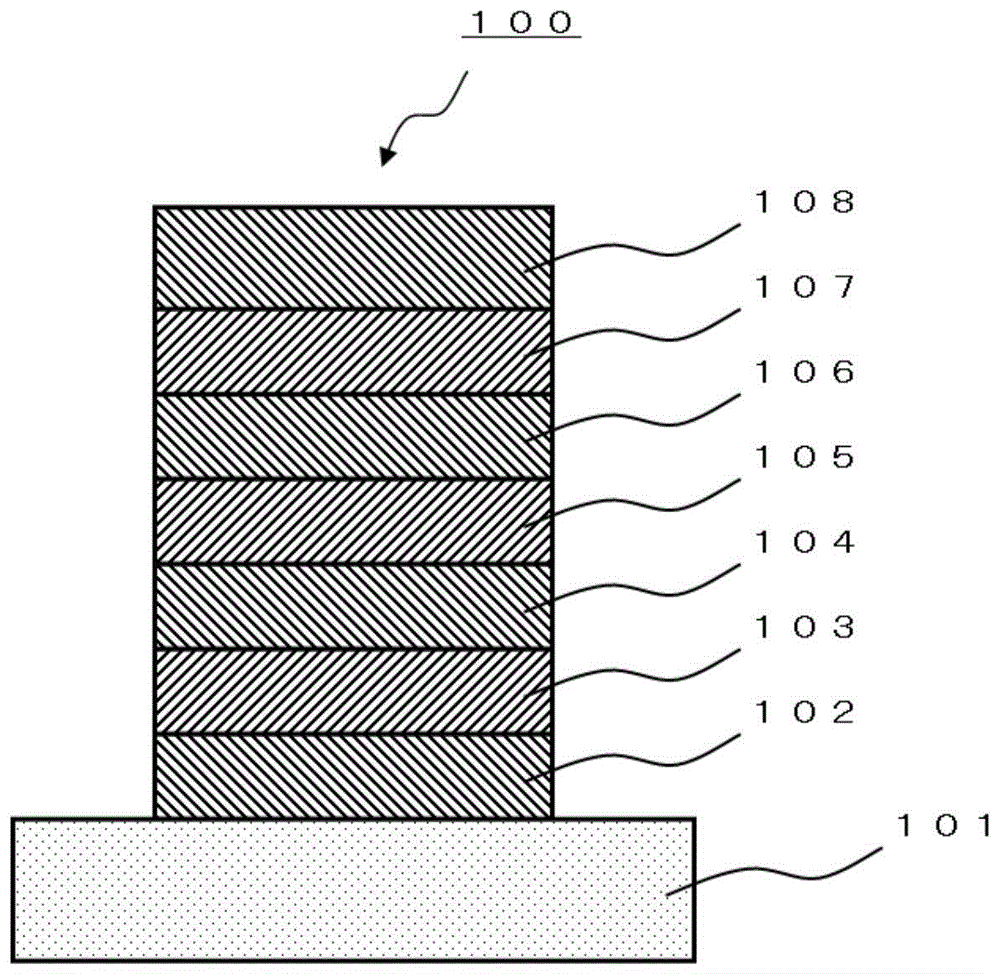
图1中示出具备这些有机层的有机电致发光元件的层构成的一例。图1中,101表示基板、102表示阳极、103表示空穴注入层、104表示空穴输送层、105表示发光层、106表示电子输送层、107表示电子注入层、108表示阴极。
以下,针对在有机电致发光元件中除了发光层之外设置的有机层、阴极和阳极、基板进行说明。
2.有机电致发光元件中的电子注入层、电子输送层
电子注入层107发挥将从阴极108移动过来的电子高效地注入至发光层105内或电子输送层106内的作用。电子输送层106发挥将从阴极108注入的电子或从阴极108借助电子注入层107注入的电子高效地输送至发光层105的作用。电子输送层106和电子注入层107分别通过将一种或两种以上的电子输送/注入材料层叠、混合来形成。
电子注入/输送层是指负责从阴极注入电子、进而输送电子的层,理想的是电子注入效率高,且高效地输送所注入的电子。为此,优选电子亲和力大且电子迁移率大、进而稳定性优异、在制造时和使用时不易产生成为阱的杂质的物质。然而,考虑到空穴与电子的输送平衡时,在主要发挥能够高效地阻止来自阳极的空穴流向阴极侧而未再结合的作用的情况下,即便电子输送能力不那么高,也与电子输送能力高的材料同等地具有使发光效率提高的效果。因此,本实施方式中的电子注入/输送层也包括能够高效地阻止空穴移动的层的功能。
作为形成电子输送层106或电子注入层107的材料(电子输送材料),可以从在光导电材料中作为电子传导化合物一直以来惯用的化合物、在有机el元件的电子注入层和电子输送层中使用的公知化合物中任意地选择并使用。
作为在电子输送层或电子注入层中使用的材料,优选含有从如下物质中选择的至少一种:包含由选自碳、氢、氧、硫、硅和磷中的一种以上原子构成的芳香族环或杂芳香族环的化合物、吡咯衍生物及其稠环衍生物、以及具有受电子性氮的金属络合物。具体而言,可列举出萘、蒽等稠环系芳香族环衍生物;4,4’-双(二苯基乙烯基)联苯所代表的苯乙烯基系芳香族环衍生物;苝酮衍生物、香豆素衍生物、萘二甲酰亚胺衍生物、蒽醌、联苯醌等醌衍生物;氧化磷衍生物、咔唑衍生物和吲哚衍生物等。作为具有受电子性氮的金属络合物,可列举出例如羟基苯基噁唑络合物等羟基唑络合物;偶氮次甲基络合物、环庚三烯酚酮金属络合物、黄酮醇金属络合物和苯并喹啉金属络合物等。这些材料可以单独使用,也可以与不同的材料混合使用。
此外,作为其它电子传导化合物的具体例,可列举出吡啶衍生物、萘衍生物、蒽衍生物、菲绕啉衍生物、苝酮衍生物、香豆素衍生物、萘二甲酰亚胺衍生物、蒽醌衍生物、联苯醌衍生物、二苯基醌衍生物、苝衍生物、噁二唑衍生物(1,3-双[(4-叔丁基苯基)1,3,4-噁二唑基]亚苯基等)、噻吩衍生物、三唑衍生物(n-萘基-2,5-二苯基-1,3,4-三唑等)、噻二唑衍生物、8-羟基喹啉衍生物的金属络合物、羟基喹啉系金属络合物、喹喔啉衍生物、喹喔啉衍生物的聚合物、苯并唑类化合物、镓络合物、吡唑衍生物、全氟化亚苯基衍生物、三嗪衍生物、吡嗪衍生物、苯并喹啉衍生物(2,2’-双(苯并[h]喹啉-2-基)-9,9’-螺二芴等)、咪唑并吡啶衍生物、硼烷衍生物、苯并咪唑衍生物(三(n-苯基苯并咪唑-2-基)苯等)、苯并噁唑衍生物、苯并噻唑衍生物、喹啉衍生物、三联吡啶等寡吡啶衍生物、联吡啶衍生物、三联吡啶衍生物(1,3-双(4’-(2,2’:6’2”-三联吡啶基))苯等)、萘啶衍生物(双(1-萘基)-4-(1,8-萘啶-2-基)苯基氧化膦等)、醛连氮衍生物、咔唑衍生物、吲哚衍生物、氧化磷衍生物、双苯乙烯基衍生物等。
此外,也可以使用具有受电子性氮的金属络合物,可列举出例如羟基喹啉系金属络合物、羟基苯基噁唑络合物等羟基唑络合物;偶氮次甲基络合物、环庚三烯酚酮金属络合物、黄酮醇金属络合物和苯并喹啉金属络合物等。
上述材料可以单独使用,也可以与不同的材料混合使用。
上述材料之中,优选为硼烷衍生物、吡啶衍生物、荧蒽衍生物、bo系衍生物、蒽衍生物、苯并芴衍生物、氧化膦衍生物、嘧啶衍生物、咔唑衍生物、三嗪衍生物、苯并咪唑衍生物、菲绕啉衍生物和羟基喹啉系金属络合物。
2-1.吡啶衍生物
吡啶衍生物为例如下述式(etm-2)所示的化合物,优选为式(etm-2-1)或式(etm-2-2)所示的化合物。
φ-(吡啶系取代基)n(etm-2)
φ为n价的芳环(优选为n价的苯环、萘环、蒽环、芴环、苯并芴环、非那烯环、菲环或苯并菲环),n为1~4的整数。
上述式(etm-2-1)中,r11~r18各自独立地为氢、烷基(优选为碳原子数1~24的烷基)、环烷基(优选为碳原子数3~12的环烷基)或芳基(优选为碳原子数6~30的芳基)。
上述式(etm-2-2)中,r11和r12各自独立地为氢、烷基(优选为碳原子数1~24的烷基)、环烷基(优选为碳原子数3~12的环烷基)或芳基(优选为碳原子数6~30的芳基),r11与r12任选键合而形成环。
各式中,“吡啶系取代基”为下述式(py-1)~式(py-15)中任一者,吡啶系取代基各自独立地任选被碳原子数1~4的烷基取代。此外,吡啶系取代基任选借助亚苯基、亚萘基而键合于各式中的φ、蒽环或芴环。
吡啶系取代基为上述式(py-1)~式(py-15)中的任一者,这些之中,优选为下述式(py-21)~式(py-44)中的任一者。
各吡啶衍生物中的至少1个氢任选被氘取代,此外,上述式(etm-2-1)和式(etm-2-2)中的两个“吡啶系取代基”之中的一者任选被芳基置换。
作为r11~r18中的“烷基”,可以为直链和支链中的任一者,可列举出例如碳原子数1~24的直链烷基或碳原子数3~24的支链烷基。优选的“烷基”为碳原子数1~18的烷基(碳原子数3~18的支链烷基)。更优选的“烷基”为碳原子数1~12的烷基(碳原子数3~12的支链烷基)。进一步优选的“烷基”为碳原子数1~6的烷基(碳原子数3~6的支链烷基)。特别优选的“烷基”为碳原子数1~4的烷基(碳原子数3~4的支链烷基)。
作为具体的“烷基”,可列举出甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基、叔戊基、正己基、1-甲基戊基、4-甲基-2-戊基、3,3-二甲基丁基、2-乙基丁基、正庚基、1-甲基己基、正辛基、叔辛基、1-甲基庚基、2-乙基己基、2-丙基戊基、正壬基、2,2-二甲基庚基、2,6-二甲基-4-庚基、3,5,5-三甲基己基、正癸基、正十一烷基、1-甲基癸基、正十二烷基、正十三烷基、1-己基庚基、正十四烷基、正十五烷基、正十六烷基、正十七烷基、正十八烷基、正二十烷基等。
作为在吡啶系取代基上进行取代的碳原子数1~4的烷基,可以引用上述烷基的说明。
作为r11~r18中的“环烷基”,可列举出例如碳原子数3~12的环烷基。优选的“环烷基”为碳原子数3~10的环烷基。更优选的“环烷基”为碳原子数3~8的环烷基。进一步优选的“环烷基”为碳原子数3~6的环烷基。
作为具体的“环烷基”,可列举出环丙基、环丁基、环戊基、环己基、甲基环戊基、环庚基、甲基环己基、环辛基或二甲基环己基等。
作为r11~r18中的“芳基”,优选的芳基为碳原子数6~30的芳基,更优选的芳基为碳原子数6~18的芳基,进一步优选为碳原子数6~14的芳基,特别优选为碳原子数6~12的芳基。
作为具体的“碳原子数6~30的芳基”,可列举出作为单环系芳基的苯基;作为稠合二环系芳基的(1-,2-)萘基;作为稠合三环系芳基的苊烯-(1-,3-,4-,5-)基、芴-(1-,2-,3-,4-,9-)基、非那烯-(1-,2-)基、(1-,2-,3-,4-,9-)菲基;作为稠合四环系芳基的苯并菲-(1-,2-)基、芘-(1-,2-,4-)基、并四苯-(1-,2-,5-)基;作为稠合五环系芳基的苝-(1-,2-,3-)基、并五苯-(1-,2-,5-,6-)基等。
优选的“碳原子数6~30的芳基”可列举出苯基、萘基、菲基、
上述式(etm-2-2)中的r11与r12任选键合而形成环,其结果,任选在芴骨架的五元环上螺键合有环丁烷、环戊烷、环戊烯、环戊二烯、环己烷、芴或茚等。
作为该吡啶衍生物的具体例,可列举出例如以下的化合物。
该吡啶衍生物可使用公知的原料和公知的合成方法来制造。
2-2.氧化膦衍生物
氧化膦衍生物为例如下述式(etm-7-1)所示的化合物。详情还记载于国际公开第2013/079217号公报中。
r5为取代或未取代的、碳原子数1~20的烷基、碳原子数6~20的芳基或碳原子数5~20的杂芳基,
r6为cn、取代或未取代的、碳原子数1~20的烷基、碳原子数1~20的杂烷基、碳原子数6~20的芳基、碳原子数5~20的杂芳基、碳原子数1~20的烷氧基或碳原子数6~20的芳氧基,
r7和r8各自独立地为取代或未取代的、碳原子数6~20的芳基或碳原子数5~20的杂芳基,
r9为氧或硫,
j为0或1,k为0或1,r为0~4的整数,q为1~3的整数。
氧化膦衍生物可以为例如下述式(etm-7-2)所示的化合物。
r1~r3可以相同也可以不同,选自氢、烷基、环烷基、芳烷基、烯基、环烯基、炔基、烷氧基、烷基硫基、芳基醚基、芳基硫醚基、芳基、杂环基、卤素、氰基、醛基、羰基、羧基、氨基、硝基、甲硅烷基、以及在相邻取代基之间形成的稠环。
ar1可以相同也可以不同,为亚芳基或亚杂芳基,ar2可以相同也可以不同,为芳基或杂芳基。其中,ar1和ar2中的至少一者具有取代基或者在相邻取代基之间形成有稠环。n为0~3的整数,n为0时不存在不饱和结构部分,n为3时不存在r1。
这些取代基之中,烷基表示例如甲基、乙基、丙基、丁基等饱和脂肪族烃基,它们可以未取代也可以被取代。被取代时的取代基没有特别限定,可列举出例如烷基、芳基、杂环基等,这一点在以下的记载中也是通用的。此外,烷基的碳原子数没有特别限定,从获取容易性、成本的观点出发,通常为1~20的范围。
此外,环烷基表示例如环丙基、环己基、降冰片基、金刚烷基等饱和脂环式烃基,它们可以未取代也可以被取代。烷基部分的碳原子数没有特别限定,通常为3~20的范围。
此外,芳烷基表示例如苄基、苯基乙基等借由脂肪族烃的芳香族烃基,脂肪族烃和芳香族烃均可以未取代也可以被取代。脂肪族部分的碳原子数没有特别限定,通常为1~20的范围。
此外,烯基表示例如乙烯基、烯丙基、丁二烯基等包含双键的不饱和脂肪族烃基,它们可以未取代也可以被取代。烯基的碳原子数没有特别限定,通常为2~20的范围。
此外,环烯基表示例如环戊烯基、环戊二烯基、环己烯基等包含双键的不饱和脂环式烃基,它们可以未取代也可以被取代。
此外,炔基表示例如乙炔基等包含三键的不饱和脂肪族烃基,它们可以未取代也可以被取代。炔基的碳原子数没有特别限定,通常为2~20的范围。
此外,烷氧基表示例如甲氧基等借由醚键的脂肪族烃基,脂肪族烃基可以未取代也可以被取代。烷氧基的碳原子数没有特别限定,通常为1~20的范围。
此外,烷基硫基是烷氧基的醚键的氧原子被硫原子取代的基团。
此外,芳基醚基表示例如苯氧基等借由醚键的芳香族烃基,芳香族烃基可以未取代也可以被取代。芳基醚基的碳原子数没有特别限定,通常为6~40的范围。
此外,芳基硫醚基是芳基醚基的醚键的氧原子被硫原子取代而成的基团。
此外,芳基表示例如苯基、萘基、联苯基、菲基、三联苯基、芘基等芳香族烃基。芳基可以未取代也可以被取代。芳基的碳原子数没有特别限定,通常为6~40的范围。
此外,杂环基表示例如呋喃基、噻吩基、噁唑基、吡啶基、喹啉基、咔唑基等具有除碳之外的原子的环状结构基团,它们可以未取代也可以被取代。杂环基的碳原子数没有特别限定,通常为2~30的范围。
卤素表示氟、氯、溴、碘。
也可以包含在醛基、羰基、氨基上用脂肪族烃、脂环式烃、芳香族烃、杂环等进行取代而成的基团。
此外,脂肪族烃、脂环式烃、芳香族烃、杂环可以未取代也可以被取代。
甲硅烷基表示例如三甲基甲硅烷基等硅化合物基团,它们可以未取代也可以被取代。甲硅烷基的碳原子数没有特别限定,通常为3~20的范围。此外,硅原子数通常为1~6。
在相邻取代基之间形成的稠环是指例如在ar1与r2、ar1与r3、ar2与r2、ar2与r3、r2与r3、ar1与ar2等之间形成的共轭或非共轭的稠环。此处,n为1时,任选两个r1彼此形成共轭或非共轭的稠环。这些稠环可以在环内结构中包含氮、氧、硫原子,也可以进一步与其它环稠合。
作为该氧化膦衍生物的具体例,可列举出例如以下的化合物。
该氧化膦衍生物可使用公知的原料和公知的合成方法来制造。
2-3.嘧啶衍生物
嘧啶衍生物为例如下述式(etm-8)所示的化合物,优选为下述式(etm-8-1)所示的化合物。详情还记载于国际公开第2011/021689号公报中。
ar各自独立地为任选被取代的芳基或任选被取代的杂芳基。n为1~4的整数,优选为1~3的整数,更优选为2或3。
作为“任选被取代的芳基”的“芳基”,可列举出例如碳原子数6~30的芳基,优选为碳原子数6~24的芳基、更优选为碳原子数6~20的芳基、进一步优选为碳原子数6~12的芳基。
作为具体的“芳基”,可列举出作为单环系芳基的苯基;作为二环系芳基的(2-,3-,4-)联苯基;作为稠合二环系芳基的(1-,2-)萘基;作为三环系芳基的三联苯基(间三联苯-2’-基、间三联苯-4’-基、间三联苯-5’-基、邻三联苯-3’-基、邻三联苯-4’-基、对三联苯-2’-基、间三联苯-2-基、间三联苯-3-基、间三联苯-4-基、邻三联苯-2-基、邻三联苯-3-基、邻三联苯-4-基、对三联苯-2-基、对三联苯-3-基、对三联苯-4-基);作为稠合三环系芳基的苊烯-(1-,3-,4-,5-)基、芴-(1-,2-,3-,4-,9-)基、非那烯-(1-,2-)基、(1-,2-,3-,4-,9-)菲基;作为四环系芳基的四联苯基(5’-苯基-间三联苯-2-基、5’-苯基-间三联苯-3-基、5’-苯基-间三联苯-4-基、间四联苯基);作为稠合四环系芳基的苯并菲-(1-,2-)基、芘-(1-,2-,4-)基、并四苯-(1-,2-,5-)基;作为稠合五环系芳基的苝-(1-,2-,3-)基、并五苯-(1-,2-,5-,6-)基等。
作为“任选被取代的杂芳基”的“杂芳基”,可列举出例如碳原子数2~30的杂芳基,优选为碳原子数2~25的杂芳基,更优选为碳原子数2~20的杂芳基,进一步优选为碳原子数2~15的杂芳基,特别优选为碳原子数2~10的杂芳基。此外,作为杂芳基,可列举出例如除碳之外还含有1~5个选自氧、硫和氮中的杂原子作为成环原子的杂环等。
作为具体的杂芳基,可列举出例如呋喃基、噻吩基、吡咯基、噁唑基、异噁唑基、噻唑基、异噻唑基、咪唑基、吡唑基、噁二唑基、呋咱基、噻二唑基、三唑基、四唑基、吡啶基、嘧啶基、哒嗪基、吡嗪基、三嗪基、苯并呋喃基、异苯并呋喃基、苯并[b]噻吩基、吲哚基、异吲哚基、1h-吲唑基、苯并咪唑基、苯并噁唑基、苯并噻唑基、1h-苯并三唑基、喹啉基、异喹啉基、噌啉基、喹唑啉基、喹喔啉基、酞嗪基、萘啶基、嘌呤基、蝶啶基、咔唑基、吖啶基、吩噁嗪基、吩噻嗪基、吩嗪基、吩噁噻基、噻蒽基、中氮茚基等。
此外,上述芳基和杂芳基任选被取代,分别任选被例如上述芳基、杂芳基取代。
作为该嘧啶衍生物的具体例,可列举出例如以下的化合物。
该嘧啶衍生物可使用公知的原料和公知的合成方法来制造。
2-4.三嗪衍生物
三嗪衍生物为例如下述式(etm-10)所示的化合物,优选为下述式(etm-10-1)所示的化合物。详情记载在美国公开公报2011/0156013号公报中。
ar各自独立地为任选被取代的芳基或任选被取代的杂芳基。n为1~4的整数,优选为1~3的整数,更优选为2或3。
作为“任选被取代的芳基”的“芳基”,可列举出例如碳原子数6~30的芳基,优选为碳原子数6~24的芳基、更优选为碳原子数6~20的芳基、进一步优选为碳原子数6~12的芳基。
作为具体的“芳基”,可列举出作为单环系芳基的苯基;作为二环系芳基的(2-,3-,4-)联苯基;作为稠合二环系芳基的(1-,2-)萘基;作为三环系芳基的三联苯基(间三联苯-2’-基、间三联苯-4’-基、间三联苯-5’-基、邻三联苯-3’-基、邻三联苯-4’-基、对三联苯-2’-基、间三联苯-2-基、间三联苯-3-基、间三联苯-4-基、邻三联苯-2-基、邻三联苯-3-基、邻三联苯-4-基、对三联苯-2-基、对三联苯-3-基、对三联苯-4-基);作为稠合三环系芳基的苊烯-(1-,3-,4-,5-)基、芴-(1-,2-,3-,4-,9-)基、非那烯-(1-,2-)基、(1-,2-,3-,4-,9-)菲基;作为四环系芳基的四联苯基(5’-苯基-间三联苯-2-基、5’-苯基-间三联苯-3-基、5’-苯基-间三联苯-4-基、间四联苯基);作为稠合四环系芳基的苯并菲-(1-,2-)基、芘-(1-,2-,4-)基、并四苯-(1-,2-,5-)基;作为稠合五环系芳基的苝-(1-,2-,3-)基、并五苯-(1-,2-,5-,6-)基等。
作为“任选被取代的杂芳基”的“杂芳基”,可列举出例如碳原子数2~30的杂芳基,优选为碳原子数2~25的杂芳基,更优选为碳原子数2~20的杂芳基,进一步优选为碳原子数2~15的杂芳基,特别优选为碳原子数2~10的杂芳基。此外,作为杂芳基,可列举出例如除碳之外还含有1~5个选自氧、硫和氮中的杂原子作为成环原子的杂环等。
作为具体的杂芳基,可列举出例如呋喃基、噻吩基、吡咯基、噁唑基、异噁唑基、噻唑基、异噻唑基、咪唑基、吡唑基、噁二唑基、呋咱基、噻二唑基、三唑基、四唑基、吡啶基、嘧啶基、哒嗪基、吡嗪基、三嗪基、苯并呋喃基、异苯并呋喃基、苯并[b]噻吩基、吲哚基、异吲哚基、1h-吲唑基、苯并咪唑基、苯并噁唑基、苯并噻唑基、1h-苯并三唑基、喹啉基、异喹啉基、噌啉基、喹唑啉基、喹喔啉基、酞嗪基、萘啶基、嘌呤基、蝶啶基、咔唑基、吖啶基、吩噁嗪基、吩噻嗪基、吩嗪基、吩噁噻基、噻蒽基、中氮茚基等。
此外,上述芳基和杂芳基任选被取代,分别任选被例如上述芳基杂芳基取代。
作为该三嗪衍生物的具体例,可列举出例如以下的化合物。
该三嗪衍生物可使用公知的原料和公知的合成方法来制造。
2-5.苯并咪唑衍生物
苯并咪唑衍生物为例如下述式(etm-11)所示的化合物。
φ-(苯并咪唑系取代基)n(etm-11)
φ为n价的芳环(优选为n价的苯环、萘环、蒽环、芴环、苯并芴环、非那烯环、菲环或苯并菲环),n为1~4的整数,“苯并咪唑系取代基”是上述式(etm-2)、式(etm-2-1)和式(etm-2-2)中的“吡啶系取代基”中的吡啶基置换成苯并咪唑基而得的取代基,苯并咪唑衍生物中的至少1个氢任选被氘取代。
上述苯并咪唑基中的r11为氢、碳原子数1~24的烷基、碳原子数3~12的环烷基或碳原子数6~30的芳基,可以引用上述式(etm-2-1)和式(etm-2-2)中的r11的说明。
φ优选进一步为蒽环或芴环,此时的结构可以引用上述式(etm-2-1)或式(etm-2-2)中的说明,各式中的r11~r18可以引用上述式(etm-2-1)或式(etm-2-2)中的说明。此外,上述式(etm-2-1)或式(etm-2-2)中,用键合有两个吡啶系取代基的形态进行了说明,但将它们置换成苯并咪唑系取代基时,可以将两个吡啶系取代基用苯并咪唑系取代基进行置换(即n=2),也可以将任一个吡啶系取代基用苯并咪唑系取代基进行置换,并将另一个吡啶系取代基用r11~r18进行置换(即n=1)。进而,例如,还可以将上述式(etm-2-1)中的r11~r18中的至少一者用苯并咪唑系取代基进行置换,并将“吡啶系取代基”用r11~r18进行置换。
作为该苯并咪唑衍生物的具体例,可列举出例如1-苯基-2-(4-(10-苯基蒽-9-基)苯基)-1h-苯并[d]咪唑、2-(4-(10-(萘-2-基)蒽-9-基)苯基)-1-苯基-1h-苯并[d]咪唑、2-(3-(10-(萘-2-基)蒽-9-基)苯基)-1-苯基-1h-苯并[d]咪唑、5-(10-(萘-2-基)蒽-9-基)-1,2-二苯基-1h-苯并[d]咪唑、1-(4-(10-(萘-2-基)蒽-9-基)苯基)-2-苯基-1h-苯并[d]咪唑、2-(4-(9,10-二(萘-2-基)蒽-2-基)苯基)-1-苯基-1h-苯并[d]咪唑、1-(4-(9,10-二(萘-2-基)蒽-2-基)苯基)-2-苯基-1h-苯并[d]咪唑、5-(9,10-二(萘-2-基)蒽-2-基)-1,2-二苯基-1h-苯并[d]咪唑等。
该苯并咪唑衍生物可使用公知的原料和公知的合成方法来制造。
2-6.菲绕啉衍生物
菲绕啉衍生物为例如下述式(etm-12)或式(etm-12-1)所示的化合物。详情记载在国际公开2006/021982号公报中。
φ为n价的芳环(优选为n价的苯环、萘环、蒽环、芴环、苯并芴环、非那烯环、菲环或苯并菲环),n为1~4的整数。
各式的r11~r18各自独立地为氢、烷基(优选为碳原子数1~24的烷基)、环烷基(优选为碳原子数3~12的环烷基)或芳基(优选为碳原子数6~30的芳基)。此外,上述式(etm-12-1)中,r11~r18中任意者与作为芳环的φ键合。
各菲绕啉衍生物中的至少1个氢任选被氘取代。
作为r11~r18中的烷基、环烷基和芳基,可以引用上述式(etm-2)中的r11~r18的说明。此外,φ除了上述例子之外,还可列举出例如以下的结构式。需要说明的是,下述结构式中的r各自独立地为氢、甲基、乙基、异丙基、环己基、苯基、1-萘基、2-萘基、联苯基或三联苯基。
作为该菲绕啉衍生物的具体例,可列举出例如4,7-二苯基-1,10-菲绕啉、2,9-二甲基-4,7-二苯基-1,10-菲绕啉、9,10-二(1,10-菲绕啉-2-基)蒽、2,6-二(1,10-菲绕啉-5-基)吡啶、1,3,5-三(1,10-菲绕啉-5-基)苯、9,9’-二氟双(1,10-菲绕啉-5-基)、浴铜灵、1,3-双(2-苯基-1,10-菲绕啉-9-基)苯等。
该菲绕啉衍生物可使用公知的原料和公知的合成方法来制造。
2-7.羟基喹啉系金属络合物
羟基喹啉系金属络合物为例如下述通式(etm-13)所示的化合物。
式中,r1~r6为氢或取代基,m为li、al、ga、be或zn,n为1~3的整数。
作为羟基喹啉系金属络合物的具体例,可列举出8-羟基喹啉锂、三(8-羟基喹啉)铝、三(4-甲基-8-羟基喹啉)铝、三(5-甲基-8-羟基喹啉)铝、三(3,4-二甲基-8-羟基喹啉)铝、三(4,5-二甲基-8-羟基喹啉)铝、三(4,6-二甲基-8-羟基喹啉)铝、双(2-甲基-8-羟基喹啉)(苯酚)铝、双(2-甲基-8-羟基喹啉)(2-甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(3-甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(4-甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(2-苯基苯酚)铝、双(2-甲基-8-羟基喹啉)(3-苯基苯酚)铝、双(2-甲基-8-羟基喹啉)(4-苯基苯酚)铝、双(2-甲基-8-羟基喹啉)(2,3-二甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(2,6-二甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(3,4-二甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(3,5-二甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(3,5-二叔丁基苯酚)铝、双(2-甲基-8-羟基喹啉)(2,6-二苯基苯酚)铝、双(2-甲基-8-羟基喹啉)(2,4,6-三苯基苯酚)铝、双(2-甲基-8-羟基喹啉)(2,4,6-三甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(2,4,5,6-四甲基苯酚)铝、双(2-甲基-8-羟基喹啉)(1-萘酚)铝、双(2-甲基-8-羟基喹啉)(2-萘酚)铝、双(2,4-二甲基-8-羟基喹啉)(2-苯基苯酚)铝、双(2,4-二甲基-8-羟基喹啉)(3-苯基苯酚)铝、双(2,4-二甲基-8-羟基喹啉)(4-苯基苯酚)铝、双(2,4-二甲基-8-羟基喹啉)(3,5-二甲基苯酚)铝、双(2,4-二甲基-8-羟基喹啉)(3,5-二叔丁基苯酚)铝、双(2-甲基-8-羟基喹啉)铝-μ-氧代-双(2-甲基-8-羟基喹啉)铝、双(2,4-二甲基-8-羟基喹啉)铝-μ-氧代-双(2,4-二甲基-8-羟基喹啉)铝、双(2-甲基-4-乙基-8-羟基喹啉)铝-μ-氧代-双(2-甲基-4-乙基-8-羟基喹啉)铝、双(2-甲基-4-甲氧基-8-羟基喹啉)铝-μ-氧代-双(2-甲基-4-甲氧基-8-羟基喹啉)铝、双(2-甲基-5-氰基-8-羟基喹啉)铝-μ-氧代-双(2-甲基-5-氰基-8-羟基喹啉)铝、双(2-甲基-5-三氟甲基-8-羟基喹啉)铝-μ-氧代-双(2-甲基-5-三氟甲基-8-羟基喹啉)铝、双(10-羟基苯并[h]喹啉)铍等。
该羟基喹啉系金属络合物可使用公知的原料和公知的合成方法来制造。
3.有机电致发光元件中的阴极
阴极108发挥借助电子注入层107和电子输送层106而向发光层105中注入电子的作用。
作为形成阴极108的材料,只要是能够将电子高效地注入至有机层中的物质,就没有特别限定,可以使用与形成阳极102的材料相同的物质。其中,优选为锡、铟、钙、铝、银、铜、镍、铬、金、铂、铁、锌、锂、钠、钾、铯和镁等金属或者它们的合金(镁-银合金、镁-铟合金、氟化锂/铝等铝-锂合金等)等。为了提高电子注入效率而使元件特性提高,锂、钠、钾、铯、钙、镁或包含这些低功函数金属的合金是有效的。然而,这些低功函数金属通常在大气中不稳定的情况较多。为了改善这一点,已知例如向有机层中掺杂微量的锂、铯、镁并使用稳定性高的电极的方法。作为其它的掺杂物,也可以使用氟化锂、氟化铯、氧化锂和氧化铯那样的无机盐。但不限定于它们。
进而,为了保护电极,作为优选例可列举出将铂、金、银、铜、铁、锡、铝和铟等金属或使用了这些金属的合金、以及二氧化硅、二氧化钛和氮化硅等无机物、聚乙烯醇、氯乙烯、烃系高分子化合物等进行层叠。这些电极为电阻加热、电子束蒸镀、溅射、离子镀和涂布等,只要能够实现导通,就没有特别限定。
4.有机电致发光元件中的空穴注入层、空穴输送层
空穴注入层103发挥将从阳极102移动过来的空穴高效地注入至发光层105内或空穴输送层104内的作用。空穴输送层104发挥将从阳极102注入的空穴或从阳极102借助空穴注入层103注入的空穴高效地输送至发光层105的作用。空穴注入层103和空穴输送层104分别通过将一种或两种以上的空穴注入/输送材料层叠、混合来形成,或者,由空穴注入/输送材料与高分子粘结剂的混合物来形成。此外,可以向空穴注入/输送材料中添加氯化铁(iii)那样的无机盐来形成层。
作为空穴注入/输送性物质,在施加有电场的电极间高效地注入/输送来自正极的空穴是必要的,理想的是空穴注入效率高,并高效地输送所注入的空穴。为此,优选电离电势小且空穴迁移率大、进而稳定性优异、在制造时和使用时不易产生成为阱的杂质的物质。
作为形成空穴注入层103和空穴输送层104的材料,可以从在光导电材料中作为空穴的电荷输送材料一直以来惯用的化合物、在p型半导体、有机电致发光元件的空穴注入层和空穴输送层中使用的公知物中选择任意物来使用。它们的具体例为咔唑衍生物(n-苯基咔唑、聚乙烯基咔唑等)、双(n-芳基咔唑)或双(n-烷基咔唑)等双咔唑衍生物;三芳基胺衍生物(在主链或侧链具有芳香族叔氨基的聚合物、1,1-双(4-二对甲苯基氨基苯基)环己烷、n,n’-二苯基-n,n’-二(3-甲基苯基)-4,4’-二氨基联苯、n,n’-二苯基-n,n’-二萘基-4,4’-二氨基联苯、n,n’-二苯基-n,n’-二(3-甲基苯基)-4,4’-二苯基-1,1’-二胺、n,n’-二萘基-n,n’-二苯基-4,4’-二苯基-1,1’-二胺、n4,n4’-二苯基-n4,n4’-双(9-苯基-9h-咔唑-3-基)-[1,1’-联苯]-4,4’-二胺、n4,n4,n4’,n4’-四[1,1’-联苯]-4-基)-[1,1’-联苯]-4,4’-二胺、4,4’,4”-三(3-甲基苯基(苯基)氨基)三苯基胺等三苯基胺衍生物;星型胺衍生物等)、茋衍生物、酞菁衍生物(无金属、铜酞菁等)、二氢吡唑衍生物、腙系化合物、苯并呋喃衍生物、噻吩衍生物、噁二唑衍生物、喹喔啉衍生物(例如1,4,5,8,9,12-六氮杂苯并菲-2,3,6,7,10,11-六甲腈等)、卟啉衍生物等杂环化合物;聚硅烷等。在聚合物系中,优选在侧链具有前述单体的聚碳酸酯、苯乙烯衍生物、聚乙烯基咔唑和聚硅烷等,只要是能够形成对于发光元件的制作而言必要的薄膜,能够从阳极注入空穴,进而能够输送空穴的化合物,就没有特别限定。
此外,还已知有机半导体的导电性受到其掺杂的强烈影响。这种有机半导体基质物质由供电子性良好的化合物或受电子性良好的化合物构成。为了掺杂供电子物质,已知四氰基醌二甲烷(tcnq)或2,3,5,6-四氟四氰基-1,4-苯醌二甲烷(f4tcnq)等强受电子体(例如参见文献“m.pfeiffer,a.beyer,t.fritz,k.leo,appl.phys.lett.,73(22),3202-3204(1998)”和文献“j.blochwitz,m.pheiffer,t.fritz,k.leo,appl.phys.lett.,73(6),729-731(1998)”)。它们通过供电子型基础物质(空穴输送物质)中的电子迁移过程而生成所谓的空穴。根据空穴的数量和迁移率,基础物质的传导性非常明显地变化。作为具有空穴输送特性的基质物质,已知例如联苯胺衍生物(tpd等)或星型胺衍生物(tdata等)或特定的金属酞菁(尤其是锌酞菁znpc等)(日本特开2005-167175号公报)。
5.有机电致发光元件中的阳极
阳极102发挥出向发光层105中注入空穴的作用。需要说明的是,在阳极102与发光层105之间设置有空穴注入层103和/或空穴输送层104时,借助它们向发光层105中注入空穴。
作为形成阳极102的材料,可列举出无机化合物和有机化合物。作为无机化合物,可列举出例如金属(铝、金、银、镍、钯、铬等)、金属氧化物(铟的氧化物、锡的氧化物、铟-锡氧化物(ito)、铟-锌氧化物(izo)等)、卤化金属(碘化铜等)、硫化铜、炭黑、ito玻璃、奈塞玻璃等。作为有机化合物,可列举出例如聚(3-甲基噻吩)等聚噻吩、聚吡咯、聚苯胺等导电性聚合物等。此外,可以从作为有机电致发光元件的阳极使用的物质中适当选择来使用。
关于透明电极的电阻,只要能够供给对于发光元件的发光而言充分的电流即可,因此没有限定,从发光元件的耗电量的观点出发,优选为低电阻。例如,如果是300ω/□以下的ito基板则作为元件电极发挥功能,但现在也能够供给10ω/□左右的基板,因此,特别期望使用例如100~5ω/□、优选50~5ω/□的低电阻制品。ito的厚度可根据电阻值来任意选择,通常在50~300nm之间使用的情况较多。
6.有机电致发光元件中的基板
基板101成为有机电致发光元件100的支承体,通常可使用石英、玻璃、金属、塑料等。基板101根据目的而形成为板状、薄膜状或片状,可使用例如玻璃板、金属板、金属箔、塑料薄膜、塑料片等。其中,优选为玻璃板、以及聚酯、聚甲基丙烯酸酯、聚碳酸酯、聚砜等的透明合成树脂制板。如果是玻璃基板,则可使用钠钙玻璃、无碱玻璃等,此外,厚度只要是对于保持机械强度而言充分的厚度即可,只要是例如0.2mm以上即可。作为厚度的上限值,例如为2mm以下、优选为1mm以下。关于玻璃的材质,从玻璃中溶出的离子少时较好,因此优选为无碱玻璃,施加有sio2等隔离涂层的钠钙玻璃也已有市售,因此可以使用该玻璃。此外,为了提高阻气性,可以在基板101的至少单面设置有致密的氧化硅膜等阻气膜,尤其是将阻气性低的合成树脂制的板、薄膜或片用作基板101时,优选设置阻气膜。
7.有机电致发光元件
构成有机电致发光元件的各层可通过利用蒸镀法、电阻加热蒸镀、电子束蒸镀、溅射、分子层叠法、印刷法、旋涂法或流延法、涂布法等方法将应构成各层的材料制成薄膜来形成。如此操作而形成的各层的膜厚没有特别限定,可根据材料的性质来适当设定,通常为2nm~5000nm的范围。膜厚通常可通过石英振荡式膜厚测定装置等进行测定。使用蒸镀法进行薄膜化时,其蒸镀条件因材料的种类、膜的目标晶体结构和缔合结构等而异。蒸镀条件通常优选在蒸镀用坩埚加热温度+50~+400℃、真空度10-6~10-3pa、蒸镀速度0.01~50nm/秒、基板温度-150~+300℃、膜厚2nm~5μm的范围内适当设定。
接着,作为制作有机电致发光元件的方法的一例,针对包括阳极/空穴注入层/空穴输送层/包含主体化合物、热活化型延迟荧光体和具有硼原子的化合物的发光层/电子输送层/电子注入层/阴极的有机电致发光元件的制作法进行说明。
7-1.蒸镀法
在适当的基板上,通过蒸镀法等形成阳极材料的薄膜而制作阳极后,在该阳极上形成空穴注入层和空穴输送层的薄膜。在其上共蒸镀主体化合物、热活化型延迟荧光体和具有硼原子的化合物而形成薄膜,制成发光层,在该发光层上形成电子输送层、电子注入层,进而通过蒸镀法等形成包含阴极用物质的薄膜而制成阴极,由此得到目标的有机电致发光元件。需要说明的是,在上述有机电致发光元件的制作中,也可以颠倒制作顺序,按照阴极、电子注入层、电子输送层、发光层、空穴输送层、空穴注入层、阳极的顺度来制作。
7-2.湿式成膜法
在发光层形成用组合物的情况下,通过使用湿式成膜法来成膜。
一般来说,湿式成膜法通过历经在基板上涂布发光层形成用组合物的涂布工序和从所涂布的发光层形成用组合物中去除溶剂的干燥工序来形成涂膜。根据涂布工序的差异,将使用旋涂机的方法称为旋涂法,将使用狭缝涂布机的方法称为狭缝涂布法,将使用版的方法称为凹版、胶版、反向胶版、柔性印刷法,将使用喷墨打印机的方法称为喷墨法,将以雾状进行喷洒的方法称为喷雾法。干燥工序有风干、加热、减压干燥等方法。干燥工序可以仅进行1次,也可以使用不同的方法、条件进行多次。此外,例如在减压下烧成那样地,也可以并用不同的方法。
湿式成膜法是指使用溶液的成膜法,例如,一部分印刷法(喷墨法)、旋涂法或流延法、涂布法等。湿式成膜法与真空蒸镀法不同,其不需要使用昂贵的真空蒸镀装置,能够在大气压下成膜。并且,湿式成膜法能够大面积化、连续生产,有助于降低制造成本。
另一方面,与真空蒸镀法相比时,湿式成膜法难以层叠化。使用湿式成膜法来制作层叠膜时,需要防止下层因上层的组合物而溶解,使用溶解性受控的组合物、下层的交联和正交溶剂(orthogonalsolvent、互不相溶的溶剂)等。然而,即使使用这些技术,有时也难以在全部膜的涂布中使用湿式成膜法。
因而,通常采用如下方法:仅几个层使用湿式成膜法,剩余通过真空蒸镀法来制作有机el元件。
例如,以下示出部分应用湿式成膜法来制作有机el元件的步骤。
(步骤1)阳极的基于真空蒸镀法的成膜
(步骤2)空穴注入层的基于湿式成膜法的成膜
(步骤3)空穴输送层的基于湿式成膜法的成膜
(步骤4)包含主体化合物、热活化型延迟荧光体和具有硼原子的化合物的发光层形成用组合物的基于湿式成膜法的成膜
(步骤5)电子输送层的基于真空蒸镀法的成膜
(步骤6)电子注入层的基于真空蒸镀法的成膜
(步骤7)阴极的基于真空蒸镀法的成膜
通过历经该步骤,从而得到由阳极/空穴注入层/空穴输送层/包含主体材料和掺杂材料的发光层/电子输送层/电子注入层/阴极构成的有机el元件。
8.有机电致发光元件的应用例
此外,本发明也可以应用于具备有机电致发光元件的显示装置或具备有机电致发光元件的照明装置等。
具备有机电致发光元件的显示装置或照明装置可通过将本实施方式的有机电致发光元件与公知的驱动装置连接等公知的方法来制造,可以适当使用直流驱动、脉冲驱动、交流驱动等公知的驱动方法来驱动。
作为显示装置,可列举出例如彩色平板显示器等面板显示器、柔性彩色有机电致发光(el)显示器等柔性显示器等(例如参见日本特开平10-335066号公报、日本特开2003-321546号公报、日本特开2004-281086号公报等)。此外,作为显示器的显示方式,可列举出例如矩阵方式和/或区段方式等。需要说明的是,矩阵显示和区段显示可以在相同面板中共存。
在矩阵中,用于显示的像素二维地配置成格子状、马赛克状等,通过像素的集合来显示文字、图像。像素的形状、尺寸根据用途来确定。例如,在个人电脑、监测器、电视机的图像和文字显示中,通常使用单边为300μm以下的四边形的像素,此外,在显示面板那样的大型显示器的情况下,使用单边为mm数量级的像素。在单色显示的情况下,只要排列相同颜色的像素即可,在彩色显示的情况下,将红、绿、蓝的像素排列并进行显示。该情况下,典型而言,有三角类型和条纹类型。并且,作为该矩阵的驱动方法,可以是线依次驱动方法、有源矩阵中的任一者。线依次驱动具有结构简单的优点,但考虑到工作特性时,有源矩阵有时更优异,因此,其也需要根据用途来区分使用。
在区段方式(类型)中,以显示预先确定的信息的方式形成图案,并使已确定的区域发光。可列举出例如数字时钟、温度计中的时刻、温度显示;音响设备、电磁炉等的工作状态显示和汽车的面板显示等。
作为照明装置,可列举出例如室内照明等照明装置、液晶显示装置的背光等(例如参见日本特开2003-257621号公报、日本特开2003-277741号公报、日本特开2004-119211号公报等)。背光主要出于使不会自发光的显示装置的观看性提高的目的而使用,其用于液晶显示装置、钟表、音响装置、汽车面板、显示板和标识等。尤其是,作为液晶显示装置、尤其是薄型化成为课题的个人电脑用途的背光,若考虑到以往方式因由荧光灯、导光板构成而难以薄型化,则使用了本实施方式的发光元件的背光具有薄型且轻量的特征。
实施例
以下,通过实施例来具体说明本发明,但本发明完全不限定于这些实施例。以下,示出实施例中使用的化合物的合成例。
<基础物性的评价方法>
样品的准备
在对评价对象化合物的吸收特性和发光特性(荧光和磷光)进行评价时,存在将评价对象化合物溶解于溶剂并在溶剂中进行评价的情况和在薄膜状态下进行评价的情况。进而,在薄膜状态下进行评价时,根据评价对象化合物在有机el元件中的使用方式,存在仅将评价对象化合物薄膜化来评价的情况和将评价对象化合物分散在适当的基质材料中并薄膜化来评价的情况。此处,将仅蒸镀评价对象化合物而得到的薄膜称为“单独膜”,将涂布包含评价对象化合物和基质材料的涂布液并干燥而得到的薄膜称为“涂膜”。
作为基质材料,可以使用市售的pmma(聚甲基丙烯酸甲酯)等。本实施例中,使pmma和评价对象化合物在甲苯中溶解后,通过旋涂法在石英制的透明支承基板(10mm×10mm)上形成薄膜而制作样品。
此外,基质材料为主体化合物时的薄膜样品如下操作来制作。
将石英制的透明支承基板(10mm×10mm×1.0mm)固定于市售的蒸镀装置(长州产业公司制)的基板支架,安装装有主体化合物的钼制蒸镀用舟、装有掺杂材料的钼制蒸镀用舟后,将真空槽减压至5×10-4pa。接着,将装有主体化合物的蒸镀用舟和装有掺杂材料的蒸镀用舟同时加热,将主体化合物和掺杂材料以形成适当膜厚的方式进行共蒸镀,形成主体化合物与掺杂材料的混合薄膜(样品)。此处,根据主体化合物与掺杂材料的设定重量比来控制蒸镀速度。
吸收特性和发光特性的评价
样品的吸收光谱的测定使用紫外可见近红外分光光度计((株)岛津制作所、uv-2600)来进行。此外,样品的荧光光谱或磷光光谱的测定使用分光荧光光度计(日立hitech公司制、f-7000)来进行。
对于荧光光谱的测定,在室温下利用适当的激发波长进行激发,测定光致发光。对于磷光光谱的测定,使用附带的冷却单元,在将前述样品浸渍于液氮的状态(温度为77k)下进行测定。为了观测磷光光谱,使用光学斩波器来调整从激发光照射起至测定开始为止的延迟时间。样品利用适当的激发波长进行激发,并测定光致发光。
此外,使用绝对pl量子收率测定装置(hamamatsuphotonics公司制、c9920-02g)来测定荧光量子收率(plqy)。
荧光寿命(延迟荧光)的评价
使用荧光寿命测定装置(hamamatsuphotonics公司制、c11367-01),以300k测定荧光寿命。具体而言,在利用适当的激发波长测得的最大发光波长处观测荧光寿命快的发光成分和荧光寿命慢的发光成分。在发出荧光的一般有机el材料的室温中的荧光寿命测定中,几乎不会因热所导致的三重态成分的失活而观测到源自磷光的三重态成分所参与的慢的发光成分。在评价对象化合物中观测到慢的发光成分时,表示激发寿命长的三重态能量因热活化而向单重态能量移动,并以延迟荧光的形式被观测到。
能隙(eg)的计算
由通过前述方法得到的吸收光谱的长波长末端a(nm),通过eg=1240/a来计算。
电离电势(ip)的测定
将蒸镀有ito(铟锡氧化物)的透明支承基板(28mm×26mm×0.7mm)固定于市售的蒸镀装置(长州产业公司制)的基板支架,安装装有对象化合物的钼制蒸镀用舟后,将真空槽减压至5×10-4pa。接着,将蒸镀用舟加热而使对象化合物蒸发,形成对象化合物的单独膜(neat膜)。
将所得单独膜作为样品,使用光电子分光计(住友重机械工业公司pys-201)来测定对象化合物的电离电势。
电子亲和力(ea)的计算
根据通过前述方法而测得的电离电势和通过前述方法而计算的能隙之差,估算电子亲和力。
激发单重态能级e(s,sh)、激发三重态能级e(t,sh)的测定
针对在玻璃基板上形成的对象化合物的单独膜,在77k下,以吸收光谱的荧光峰不重叠的程度、以长波长侧的峰作为激发光来观测荧光光谱,根据该荧光光谱的峰短波长侧的肩求出激发单重态能级e(s,sh)。
此外,针对在玻璃基板上形成的对象化合物的单独膜,在77k下,以吸收光谱的荧光峰不重叠的程度、以长波长侧的峰作为nm激发光来观测磷光光谱,根据该磷光光谱的峰短波长侧的肩求出激发三重态能级e(t,sh)。
[1]化合物的基础物性的评价
(实验例1)作为第一成分(主体化合物)的化合物(bo2-0511s)的基础物性的评价
针对化合物(bo2-0511s)的单独膜评价基础物性的结果,电离电势为6.30ev、电子亲和力为3.26ev且能隙为3.04ev。此外,激发单重态能级e(1,s,sh)为2.94ev、激发三重态能级e(1,t,sh)为2.74ev。
(比较实验例1)作为第一成分(主体化合物)的比较化合物(mcbp)的基础物性的评价
针对比较化合物(mcbp)的单独膜评价基础物性的结果,电离电势为6.07ev、电子亲和力为2.55ev且能隙为3.52ev。此外,激发单重态能级e(1,s,sh)为4.19ev、激发三重态能级e(1,t,sh)为2.78ev。
(实验例2)作为第二成分(辅助掺杂物)的化合物(cz-trz3)的基础物性的评价
针对化合物(cz-trz3)的单独膜评价基础物性的结果,电离电势为5.93ev、电子亲和力为2.99ev且能隙为2.94ev。此外,激发单重态能级e(2,s,sh)为2.92ev、激发三重态能级e(2,t,sh)为2.69ev。进而,峰顶的激发单重态能级e(2,s,pt)为2.76ev、峰顶的激发三重态能级e(2,t,sh)为2.58ev,δest为0.18ev。
(实验例3)作为第三成分(发光掺杂物)的化合物(ed1)的基础物性的评价
针对化合物(ed1)和作为基质材料的pmma的涂膜,在室温下测定基于340nm激发光的荧光光谱。此处,涂膜中的化合物(ed1)的浓度设为1重量%。所测得的荧光光谱的最大发光波长为465nm、半值宽度为19nm。
[2]有机el元件的制作和评价
本实施例中,按照adv.mater.2016,28,2777–2781)中记载的结构来制作有机el元件。将所制作的有机el元件的层构成示于表1。
[表1]
(有机el元件的构成a)
表1中,“npd”为n,n’-二苯-n,n’-二萘基-4,4’-二氨基联苯,“tcta”为4,4’,4”-三(n-咔唑基)三苯基胺,“mcp”为1,3-双(n-咔唑基)苯,“mcbp”为3,3’-双(n-咔唑基)-1,1’-联苯,“bpy-tp2”为2,7-二([2,2’-联吡啶]-5-基)苯并菲、“2czbn”为3,4-二咔唑基苯甲腈。
<实施例1>
以化合物(bo2-0511s)作为主体化合物,以化合物(cz-trz3)作为辅助掺杂物,将化合物(ed1)用作发光掺杂物的元件1的制作和评价
在形成有厚度50nm的包含ito(铟锡氧化物)的阳极的玻璃基板(26mm×28mm×0.7mm)上,通过真空蒸镀法,以5×10-4pa的真空度层叠各薄膜。
首先,在ito上以膜厚达到40nm的方式蒸镀npd,在其上,以膜厚达到15nm的方式蒸镀tcta,形成包含两层的空穴注入输送层。接着,以膜厚达到15nm的方式蒸镀mcp,形成电子阻挡层。接着,从不同的蒸镀源共蒸镀作为主体的化合物(bo2-0511s)、作为辅助掺杂物的cz-trz3和作为发光掺杂物的化合物(ed1),形成膜厚20nm的发光层。此时,主体、辅助掺杂物和发光掺杂物的重量比设为90:9:1。接着,以膜厚达到10nm的方式蒸镀2czbn,形成电子输送层,在其上,以膜厚达到20nm的方式蒸镀tspo1,形成电子输送层(第二电子输送层)。接着,以膜厚达到1nm的方式蒸镀lif,在其上,以膜厚达到100nm的方式蒸镀铝,形成阴极,得到有机el元件(元件1)。
针对所制作的元件1,测定1000cd/m2发光时的发光光谱、色度和外量子效率。其结果,在发光光谱中观测到发光最大波长为470nm、半值宽度为18nm的发光峰,观察到深蓝色(deepblue)的发光。此外,1000cd/m2发光时的外量子效率为20.7%,能够得到高的量子效率。
<比较例1>
以mcbp作为主体化合物,以化合物(cz-trz3)作为辅助掺杂物,将化合物(ed1)用作发光掺杂物的比较元件1的制作和评价
使用化合物(mcbp)代替化合物(bo2-0511s)而用于主体,除此之外,利用与实施例1相同的步骤和构成,得到el元件(比较元件1)。
针对所制作的比较元件1,测定1000cd/m2发光时的发光光谱、色度和外量子效率。其结果,在发光光谱中观测到发光最大波长为471nm、半值宽度为18nm的发光峰,观察到深蓝色(deepblue)的发光。但是,1000cd/m2发光时的外量子效率为14.8%,与实施例1相比量子效率低。
附图标记说明
100有机电致发光元件
101基板
102阳极
103空穴注入层
104空穴输送层
105发光层
106电子输送层
107电子注入层
108阴极
- 还没有人留言评论。精彩留言会获得点赞!