超级电容器及其制备方法、植入方法和可植入电子医疗设备
1.本发明涉及植入式电源领域,特别是涉及一种超级电容器及其制备方法、植入方法和可植入电子医疗设备。
背景技术:
2.生物电子学的一个主要目标是通过具有穿戴和植入功能的设备实现实时的体内健康监测和医疗干预,随着半导体、低功耗集成电路(ic)和封装技术的快速发展,可穿戴和可植入式电子设备的尺寸和重量也显著减小,其中就包括一些无线植入式医疗设备的小型化、微机电系统(mems)、有源射频识别(rfid)、智能电子皮肤、可折叠显示器和人机交互系统等。在人类健康监测和个人健康管理中,随着这些器件的小型甚至微型化,极大地促进了可穿戴和可植入的柔性电子产品朝着微型化、便携化、智能化及集成化的趋势发展,有望实现健康的实时监测与精准诊疗。
3.在过去的几年中,随着材料开发、电子技术和机械设计的最新发展,植入式医疗设备的快速技术进步已经实现,例如起搏器和神经刺激器。但是,长期面临的挑战之一是缺乏合适的植入式电源,该电源需要足够的能力为植入式医疗设备供电。据报道,可植入电源解决方案包括电池、无线电力传输模块和能量收集器。例如,常规电池已经与植入式医疗设备集成在一起为它们供电;基于与线圈感应耦合的无线电力传输设备以不受束缚的方式从外部将电能传输到体内;摩擦电能发电机已被证明可以有效地将器官的机械运动收集为电能。
4.然而,这些可植入电源在体内更深部位的植入应用中,还存在以下问题:(1)它们的机械刚度较大,与组织器官表面的适配程度低,会对实验对象产生严重的不适感;(2)传统的超级电容器的制备方法较为复杂与繁琐,器件的形态多数不是全固态,以至于限制了其在体内植入的应用;(3)传统的超级电容器在植入应用中,多采用手术缝合的方式将超级电容器固定在组织器官表面,加大了手术操作的难度,并且对实验对象造成了严重的伤害,不利于实验对象的后期生理机能的康复。
技术实现要素:
5.基于此,有必要提供一种制备方法简单、与组织的机械刚度较为适配且能够通过无创粘附的方式植入体内的超级电容器及其制备方法。
6.此外,还有必要提供一种可植入电子医疗设备和超级电容器的植入方法。
7.一种超级电容器的制备方法,包括如下步骤:
8.将聚苯胺、氧化石墨烯及溶剂混合,制备混合液;
9.对所述混合液进行加热干燥,使所述氧化石墨烯与所述聚苯胺自组装,制备凝胶电极;
10.将所述凝胶电极封装在海藻酸钠与丙烯酰胺的双网络水凝胶中,然后布上电解质,制备超级电容器。
11.在其中一个实施例中,在所述混合液中,所述聚苯胺与所述氧化石墨烯的质量比为2:1~3:1;及/或,
12.所述混合液中还加入了还原剂,所述还原剂与所述氧化石墨烯的质量比为5:3~8:3;及/或,
13.所述混合液中还加入了max相陶瓷材料,所述max相陶瓷材料与所述氧化石墨烯的质量比为(0.1~1):1。
14.在其中一个实施例中,所述电解质为氯化钾,将所述凝胶电极封装在海藻酸钠与丙烯酰胺的双网络水凝胶中,然后布上电解质的步骤中,将所述双网络水凝胶与所述凝胶电极构成的整体浸泡在氯化钾溶液中,以布上所述电解质。
15.在其中一个实施例中,所述加热干燥的步骤中,加热温度为90℃~100℃,加热时间为1.5h~2h。
16.在其中一个实施例中,将所述凝胶电极封装在海藻酸钠与丙烯酰胺的双网络水凝胶中的步骤包括:将所述凝胶电极置于海藻酸钠与丙烯酰胺的双网络水凝胶的预聚液中,然后固化,使所述凝胶电极封装在所述双网络水凝胶中。
17.在其中一个实施例中,所述固化的步骤中,向所述预聚液中加入钙离子,然后在60℃~70℃下进行加热,同时进行紫外照射。
18.一种超级电容器,由上述的超级电容器的制备方法制备得到。
19.一种可植入电子医疗设备,包括上述的超级电容器。
20.一种超级电容器的植入方法,包括如下步骤:
21.将生物粘附膜的一侧贴合在超级电容器上,所述超级电容器为上述的超级电容器;
22.将所述生物粘附膜的另一侧粘附在待测组织上,以将所述超级电容器植入体内。
23.在其中一个实施例中,所述生物粘附膜为pva
‑
paa
‑
nhs薄膜,所述生物粘附膜的制备步骤包括:
24.提供丙烯酸水溶液,所述丙烯酸水溶液中还含有引发剂和交联剂;
25.将聚乙烯醇薄膜浸泡在所述丙烯酸水溶液中,然后加热干燥,制备pva
‑
paa薄膜;
26.将所述pva
‑
paa薄膜浸泡在n
‑
羟基琥珀酰亚胺水溶液中,然后加热干燥,制备所述生物粘附膜。
27.在其中一个实施例中,在制备所述生物粘附膜的过程中,所用到的聚乙烯醇薄膜、丙烯酸和n
‑
羟基琥珀酰亚胺的质量比为1:30:0.25~1:25:0.25。
28.上述超级电容器的制备方法,先将聚苯胺与氧化石墨烯和溶剂混合,然后加热干燥,在加热过程中,氧化石墨烯与聚苯胺之间通过π
‑
π键自组装形成凝胶电极,较传统的将苯胺在氧化石墨烯中原位聚合制备电极的方法,更简单且不存在聚苯胺聚合过程中堵塞氧化石墨烯而使电化学性能受到影响的问题。将凝胶电极封装在海藻酸盐/丙烯酰胺的双网络水凝胶中,实验证明,该双网络水凝胶的柔性好,作为封装材料使得所制备的超级电容器的整体刚性与组织器官相适配,不影响实验对象的正常生理机能。另外,该双网络水凝胶含有酰胺键、羧基等官能团,能够通过氢键作用与生物粘附膜粘合,从而利用生物粘附膜将超级电容器无创粘附在组织器官上,避免了传统的缝合手术,且不会对实验对象的身体机能造成影响。因此,上述超级电容器的制备方法简单,且所制备的超级电容器与组织器官的机
械刚度适配,能够通过无创粘附的方式植入体内,在医疗电子设备领域中具有广泛应用。
附图说明
29.图1为凝胶电极制备过程中的一种工艺流程图;
30.图2为将凝胶电极封装在海藻酸钠与丙烯酰胺的双网络水凝胶中的一种工艺流程图;
31.图3为实施例1所制备的超级电容器的实物图;
32.图4为大鼠心肌细胞在三组样品不同浓度的浸提液中的荧光染色图;
33.图5为大鼠心肌细胞在三组样品不同浓度的浸提液中的细胞存活率图;
34.图6为实施例1的超级电容器植入大鼠体内两周前后的实物图;
35.图7为三组实验中小鼠血液中ca
2+
、k
+
、cl
‑
的检测结果图;
36.图8为三组实验中小鼠血液中心肌酶的检测结果图;
37.图9为三组实验中小鼠体内心、肝、脾、肺、肾的he切片染色结果图;
38.图10为三组实验中小鼠心脏部位masson切片染色图以及其对应的imagej分离结果图;
39.图11为三组实验中小鼠的免疫荧光和免疫组织化学染色结果图。
具体实施方式
40.为了便于理解本发明,下面将结合具体实施方式对本发明进行更全面的描述。具体实施方式中给出了本发明的较佳的实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
41.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体地实施例的目的,不是旨在于限制本发明。
42.一实施方式的超级电容器的制备方法,包括如下步骤:
43.步骤s110:将聚苯胺、氧化石墨烯和溶剂混合,制备混合液。
44.具体地,将聚苯胺、氧化石墨烯和溶剂混合的步骤中,分别将聚苯胺与氧化石墨烯溶解,得到聚苯胺溶液和氧化石墨烯溶液,然后再将聚苯胺溶液与氧化石墨烯溶液混合。
45.在其中一个实施例中,聚苯胺溶液中的溶剂为n
‑
甲基吡咯烷酮(nmp)。可以理解,聚苯胺溶液中的溶剂不限于为nmp,还可以为其他能够溶解聚苯胺的有机溶剂。
46.具体地,在步骤s110之前,还包括配制聚苯胺溶液的步骤。具体地,将聚苯胺与溶剂混合,然后加热搅拌,制备聚苯胺溶液。在其中一个实施例中,加热的温度为50℃,加热的时间为4h。通过加热能够促进聚苯胺的溶解。可以理解,上述仅给出了一种加热参数,但并不限于此,能够得到均匀的聚苯胺溶液即可。
47.具体地,在混合液中,聚苯胺与氧化石墨烯的质量比为2:1~3:1。例如,聚苯胺与氧化石墨烯的质量比为2:1、2.5:1或3:1。利用氧化石墨烯六元碳环在空间上的π
‑
π错位面对面堆积(f
‑
型堆积)原理,将氧化石墨烯与聚苯胺均匀混合,通过形成π
‑
π键自组装形成凝胶电极。
48.进一步地,混合液中还加入了还原剂。在其中一个实施例中,还原剂为抗坏血酸钠。还原剂能够在加热条件下将氧化石墨烯还原,提高所制备的凝胶电极的电化学性能。可以理解,还原剂不限于为抗坏血酸钠,还可以为本领域常用的其他还原剂。采用抗坏血酸钠为还原剂便于在后续步骤中除去多余未反应的还原剂,减少还原剂在超级电容器中的残留。
49.具体地,还原剂与氧化石墨烯的质量比为5:3~8:3。例如,还原剂与氧化石墨烯的质量比为5:3、6:3、7:3或8:3。
50.进一步地,混合液中还加入了max相陶瓷材料,max相陶瓷材料与氧化石墨烯的质量比为(0.1~1):1。例如,max相陶瓷材料与氧化石墨烯的质量比为0.1:1、0.2:1、0.5:1、0.8:1或1:1。在制备过程中,max相陶瓷材料可以防止氧化石墨烯片层的自身堆积,并且增加片层之间的导电性,进而提高所制备的超级电容器的电化学性能。
51.在其中一个实施例中,max相陶瓷材料为ti3alc2。
52.步骤s120:将混合液进行加热干燥,使氧化石墨烯与聚苯胺自组装,制备凝胶电极。
53.具体地,加热干燥的步骤中,加热温度为90℃~100℃,加热时间为1.5h~2h。通过加热一方面除去混合液中的溶剂,另一方面,氧化石墨烯在还原剂和加热的作用下被还原,并与聚苯胺通过π
‑
π键自组装形成凝胶电极。
54.进一步地,在步骤s120之后,在步骤s130之前,还包括对凝胶电极进行清洗及切割的步骤。具体地,将凝胶电极浸泡在水中进行清洗,以除去未反应完全的还原剂等杂质。将凝胶电极切割为合适的尺寸。
55.采用上述方法制备的凝胶电极的厚度较薄,能够切割为合适的尺寸,且方法简单。
56.具体地,请参阅图1,凝胶电极制备过程中的一种工艺流程图。先将氧化石墨烯(go)和max相陶瓷材料在水溶液中混合,聚苯胺(pani)在nmp中混合,然后将go/max水溶液与pani的nmp溶液混合,得到max/go@pani的水和nmp的混合溶液,在90℃~100℃加热还原,使go和pani通过π
‑
π自组装形成凝胶电极,最后切割成电极形状,得到凝胶电极。
57.步骤s130:将凝胶电极置于海藻酸钠与丙烯酰胺的双网络水凝胶的预聚液中,然后固化,制备封装体。
58.海藻酸钠、丙烯酰胺制备的双网络水凝胶具有良好的柔韧性,可以在平面上以任意角度弯折且不影响其电化学性能。通过封装电极制备的整体器件的机械刚度与组织或器官表面适配程度高。植入到小鼠心脏表面时,不会影响小鼠心脏的收缩与舒张,对心脏的正常生理活动不会产生影响。
59.另外,海藻酸盐/丙烯酰胺双网络水凝胶还含有酰胺键、羧基等官能团,能够通过氢键作用与生物粘附膜粘合,从而利用生物粘附膜将超级电容器粘附在组织器官上,避免了传统的缝合手术,且不会对实验对象的身体机能造成影响。
60.具体地,在步骤s130之前,还包括制备海藻酸钠与丙烯酰胺的双网络水凝胶的预聚液的步骤。具体地,将丙烯酰胺与海藻酸钠在水中混合,然后加入引发剂和交联剂,制备预聚液。在其中一个实施例中,引发剂为aps(过硫酸铵),交联剂为mbaa(n,n亚甲基双丙烯酰胺)。制备预聚液的步骤可以为本领域常用的步骤,在此不再赘述。
61.固化的步骤中,向预聚液中加入钙离子,然后在60℃~70℃下进行加热,同时进行
紫外照射。
62.具体地,请参阅图2,步骤s130的一种工艺流程图。先将丙烯酰胺(aam)与海藻酸钠在水中混合,然后加入引发剂(aps)和交联剂(mbaa)和钙离子,得到预聚液,再将凝胶电极置于预聚液中,在紫外照射和加热的条件下进行固化。
63.步骤s140:将封装体布上电解质,制备超级电容器。
64.具体地,将封装体浸泡在电解质溶液中,以在封装体上布上电解质。电解质溶液为氯化钾溶液。在其中一个实施例中,电解质溶液的浓度为1mol/l。海藻酸盐/丙烯酰胺水凝胶具有孔隙和亲水性,电解质能够填充在其孔隙中,从而得到超级电容器。
65.上述超级电容器的制备方法至少具有以下优点:
66.(1)上述超级电容器的制备方法利用六元碳环在空间上的π
‑
π错位面对面堆积(f
‑
型堆积)原理,将氧化石墨烯与聚苯胺均匀混合,自组装形成凝胶电极,再通过海藻酸钠与丙烯酰胺的离子与共价交联形成双网络水凝胶封装电极,以制备成全固态微型平面柔性超级电容器。制备的器件尺寸为3mm*2mm,厚度仅为0.3mm左右,器件的体积小、柔性好,利于体内的植入应用。
67.(2)海藻酸钠与丙烯酰胺制备的双网络水凝胶具有良好的柔韧性,可以在平面上以任意角度弯折且不影响其电化学性能。通过封装电极制备的整体器件的机械刚度与组织或器官表面适配程度高。植入到小鼠心脏表面时,不会影响小鼠心脏的收缩与舒张,对心脏的正常生理活动不会产生影响。
68.(3)海藻酸盐/丙烯酰胺双网络水凝胶还含有酰胺键、羧基等官能团,能够通过氢键作用与生物粘附膜粘合,从而利用生物粘附膜将超级电容器粘附在组织器官上,避免了传统的缝合手术,且不会对实验对象的身体机能造成影响。
69.(4)采用上述材料为原料所制备的超级电容器的生物相容性好,对细胞的毒性小。
70.本发明还提供一实施方式的超级电容器,由上述实施方式的超级电容器的制备方法制备得到。
71.本发明还提供一实施方式的可植入电子医疗设备,包括上述实施方式的超级电容器。
72.本发明还提供一实施方式的超级电容器的植入方法。
73.超级电容器如何实现在组织器官表面的长久稳定的附着是研究人员亟待解决的问题。在植入应用中,大多采用手术缝合的方式将器件固定在组织或器官表面,一方面加大了手术操作的难度,另一方面对实验对象造成了更加严重的伤害,不利于实验对象的后期身体机能的康复。因此,本发明还提供了一种通过生物粘附膜将超级电容器植入组织器官且长久稳定附着的方法。
74.具体地,一实施方式的超级电容器的植入方法,包括如下步骤:
75.步骤s210:将生物粘附膜的一侧贴合在超级电容器上。
76.其中,超级电容器为上述实施方式的超级电容器,在此不再赘述。
77.具体地,生物粘附膜为pva
‑
paa
‑
nhs薄膜,生物粘附膜的制备步骤包括:
78.提供丙烯酸水溶液,丙烯酸水溶液中还含有引发剂和交联剂;
79.将聚乙烯醇薄膜浸泡在丙烯酸水溶液中,然后加热干燥,制备pva
‑
paa薄膜;
80.将pva
‑
paa薄膜浸泡在n
‑
羟基琥珀酰亚胺水溶液中,然后加热干燥,制备生物粘附
膜。
81.进一步地,在生物粘附膜中,聚乙烯醇、丙烯酸和n
‑
羟基琥珀酰亚胺的质量比为1:30:0.25~1:25:0.25。
82.具体地,聚乙烯醇薄膜的制备过程包括:将聚乙烯醇溶于水中,制备pva水溶液。然后进行冷冻一段时间,再在室温下解冻,制备pva水凝胶。将pva水凝胶在37℃下真空干燥,最后放置在100℃下进行退火,得到pva薄膜。
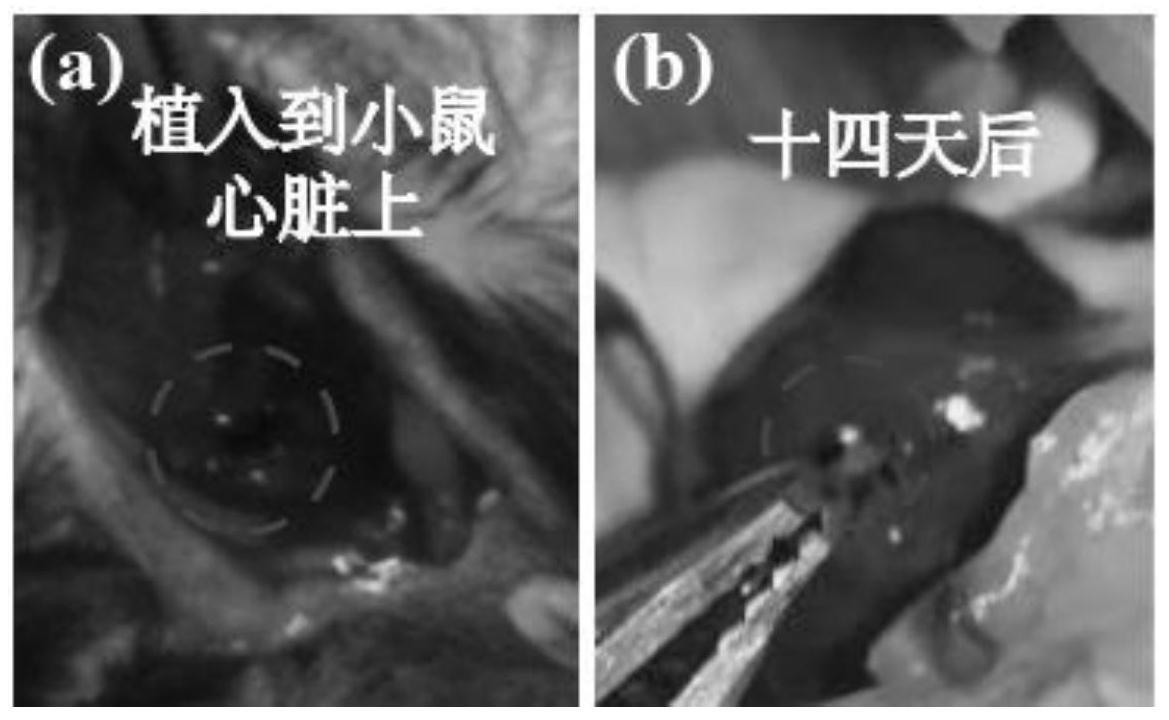
83.在一个具体的示例中,冷冻的温度为
‑
20℃,冷冻的时间为12h。冷冻的目的是为了pva水溶液中能够形成部分氢键,以便之后更好得成膜。
84.解冻的时间为0.5h。真空干燥的时间为1h,退火的时间为1h。
85.上述制备的pva薄膜不具备较好的黏附性能,需要装载paa
‑
nhs酯网络。
86.在其中一个实施例中,将聚乙烯醇薄膜浸泡在丙烯酸水溶液中,然后加热干燥的步骤具体包括:将聚乙烯醇薄膜浸泡在丙烯酸水溶液中5min,然后在70℃下真空干燥30min,得到pva
‑
paa薄膜。
87.在一个具体的示例中,丙烯酸溶液中,丙烯酸的质量百分浓度为30%,引发剂的质量百分浓度为0.15%,交联剂的质量百分浓度为0.03%。在其中一个实施例中,引发剂为2,2
‑
偶氮二(2
‑
甲基丙基咪)二盐酸盐,交联剂为n,n'
‑
双(丙烯酰)胱胺。可以理解,上述仅列出了一种可行的示例,但并不限于此。
88.在其中一个实施例中,将pva
‑
paa薄膜浸泡在n
‑
羟基琥珀酰亚胺水溶液中,然后加热干燥的步骤具体包括:将pva
‑
paa薄膜浸泡在n
‑
羟基琥珀酰亚胺水溶液中5min,然后在70℃下真空干燥30min,得到pva
‑
paa
‑
nhs薄膜。具体地,通过浸泡使nhs有充足的时间与pva
‑
paa薄膜中的paa进行反应,以生成pva
‑
nhs酯基。
89.在实际操作中,由于nhs和edc两种试剂通常在
‑
20℃下保存,无法长时间地保存在室温下,因此,nhs
‑
edc溶液需现配现用,以保证下一步实验能够顺利进行。
90.进一步地,在使用之前,生物粘附薄膜和干燥剂密封并在
‑
20℃下保存。
91.步骤s220:将生物粘附膜的另一侧粘附在待测组织上。
92.pva
‑
paa
‑
nhs薄膜通过氢键作用与超级电容器中的海藻酸钠丙烯酰胺水凝胶作用,薄膜中的pva吸除组织器官表面的界面水,并且以羧酸基团形成氢键和静电相互作用形成暂时的物理交联,最后,nhs酯基与组织器官表面上的伯胺基rnh2形成稳定的共价交联,以此来实现超级电容器长期稳定的粘附在组织器官表面而不容易脱落的目的。通过生物粘附膜将超级电容器粘附在组织器官上,避免进行缝合手术,对实验对象的损伤小。
93.以下为具体实施例部分:
94.实施例1
95.本实施例的超级电容器的制备过程具体如下:
96.(1)凝胶电极的制备步骤:
97.取900mg聚苯胺(pani)于50ml烧杯中,再加入30ml n
‑
甲基吡咯烷酮(nmp)试剂,放置于50℃磁力搅拌加热板加热4小时,以制备30mg/ml pani/nmp溶液备用。
98.取9g氧化石墨烯凝胶溶液(go)于50ml离心管中,放置于恒温超声波清洗机中30分钟,分散均匀后,再向离心管中加入6ml pani/nmp溶液、180mg抗坏血酸钠振荡摇匀,得到go/pani混合溶液。取3g分散均匀的go/pani混合溶液于直径60mm的玻璃培养皿中,向其中
加入3mg的max相陶瓷材料(ti3alc2)。将玻璃培养皿放入90℃的电热恒温干燥箱中还原2小时,得到pani:go:max质量比为2:1:0.1的凝胶电极。最后,将凝胶电极放入超纯水中浸泡24小时,清除没有反应完全的还原剂等杂质,通过激光切割机将凝胶电极切割成7mm
×
2mm尺寸。
99.(2)双网络水凝胶预聚液的制备:
100.取8gaam(丙烯酰胺)单体与1galg
‑
na(海藻酸钠)溶于36g超纯水中,搅拌均匀,静置12小时得到混合溶液。向混合溶液中添加0.08gaps(过硫酸铵)和0.016g mbaa(n,n亚甲基双丙烯酰胺)混合均匀,放置在真空干燥箱中抽真空5分钟,消除加入aps和mbaa搅拌时带入混合溶液中的气泡,得到双网络水凝胶预聚液。此时的双网络水凝胶预聚液具有一定的流动性,用胶头滴管吸取一定体积(2ml)的预聚液,滴在自制的规则凹槽内,使长方体凹槽内充满预聚液。
101.(3)超级电容器的制备:
102.将利用激光切割机切割的长方体凝胶电极摆放在充满预聚液凹槽的两侧,并在凹槽表面涂抹一定体积(1ml)的饱和硫酸钙溶液,用边缘光滑平整的亚克力板轻轻地刮掉溢出凹槽的多余预聚液,以实现整个超级电容器形状的规则。将整个模具放置在电热恒温水槽中60℃加热,并且同时进行紫外光照射15分钟,得到长方体形状的全固态柔性超级电容器,即为本实施的超级电容器。
103.请参阅图3,本实施例的超级电容器的实物图。
104.实施例2
105.本实施例的超级电容器的制备过程与实施例1的超级电容器的制备过程相似,区别在于:在凝胶电极的制备步骤中,go:max质量比为1:0。
106.实施例3
107.本实施例的超级电容器的制备过程与实施例1的超级电容器的制备过程相似,区别在于:在凝胶电极的制备步骤中,go:max质量比为1:1。
108.实施例4
109.本实施例的超级电容器的制备过程与实施例1的超级电容器的制备过程相似,区别在于:在凝胶电极的制备步骤中,pani:go的质量比为2.5:1。
110.实施例5
111.本实施例的超级电容器的制备过程与实施例1的超级电容器的制备过程相似,区别在于:在凝胶电极的制备步骤中,pani:go的质量比为3:1。
112.实施例6
113.本实施例的超级电容器的植入过程具体如下:
114.(1)生物粘附薄膜的制备:
115.取20g聚乙烯醇固体粉末(pva,mw 89000
‑
98000)溶于80g的超纯水中,并搅拌12h以制备质量百分溶度为20%且溶解均匀的pva水溶液。取5g pva的水溶液于直径20mm的玻璃培养皿中,放入
‑
20℃冰箱中冷冻12h。将冷冻完成的pva水溶液放置于室温下解冻30min,以形成pva水凝胶。将pva水凝胶放置于37℃的真空干燥箱吸热1h,最后将吸热完成的pva水凝胶放置在100℃的电热干燥箱中退火1h,退火完成后便得到干燥的pva薄膜。
116.取30g丙烯酸(aa)溶于70g超纯水中,再向该溶液中添加0.03g的n,n'
‑
双(丙烯酰)
胱胺和0.15g的2,2
‑
偶氮二(2
‑
甲基丙基咪)二盐酸盐,得到丙烯酸水溶液(丙烯酸水溶液中,各物质的质量百分浓度分别为:丙烯酸30%,n,n'
‑
双(丙烯酰)胱胺0.03%,2,2
‑
偶氮二(2
‑
甲基丙基咪)二盐酸盐0.15%)。将pva薄膜浸泡在丙烯酸水溶液中5min,将浸泡后的pva薄膜放置于70℃的真空干燥箱中加热30min,保持密封状态,以便在pva薄膜上形成聚丙烯酸(paa)网络,真空干燥后得到pva
‑
paa薄膜。
117.从
‑
20℃冰箱中取出并且分别称量0.5g edc固体粉末和0.25g nhs固体粉末,迅速将这两种称量完毕的药品溶于99.25g超纯水中,立即搅拌均匀以制备nhs
‑
edc水溶液(nhs
‑
edc水溶液中,各物质的质量百分浓度为:edc 0.5%,nhs 0.25%)。这在室温下,将干燥的pva
‑
paa薄膜浸泡在nhs
‑
edc水溶液中5min,使nhs能够有充足的时间与pva
‑
paa薄膜中的paa进行反应,以生成paa
‑
nhs酯基。5min后在70℃下进行真空干燥30min,得到干燥的pva
‑
paa
‑
nhs薄膜,即生物粘附薄膜,将干燥的薄膜和干燥剂一并密封在塑料袋中,并保存在
‑
20℃冰箱中备用。
118.(2)生物粘附薄膜与超级电容器的粘附:
119.从
‑
20℃冰箱中取出生物粘附薄膜,将生物粘附薄膜贴合在实施例1中固化完成的双网络水凝胶上,轻轻按压1min,5min后生物粘附薄膜与水凝胶界面形成氢键,完成粘附。
120.(3)生物粘附薄膜与湿润心脏的粘附:
121.将上述生物粘附薄膜的另一侧贴合在湿润的猪心表面,5min后生物粘附薄膜与组织表面形成稳定的共价键,完成粘附,从而将超级电容器固定在猪心表面。
122.以下为实验部分:
123.(1)大鼠心肌细胞的培养:
124.将含有1.5g/lnahco3的dmem培养基(gibco)、澳洲优质胎牛血清(gibco)以及青霉素
‑
链霉素溶液(gibco),分别按照90%、10%、1%的体积比例混合均匀,以配成完全培养基。将大鼠心肌细胞放在完全培养基中,在37℃下,放入含有5%的co2气相细胞培养箱中培养,使细胞贴壁生长。
125.大鼠心肌细胞的荧光染色实验:
126.实验使用calcein
‑
am/pi double stainkit对大鼠心肌细胞进行荧光染色。具体地,向稀释至1倍的assaybuffer反应缓冲液(10ml)中添加10μl的钙黄绿素(calcein
‑
am)和30μl的碘化丙啶(pi double stain kit)染液,混合混匀,得到染色工作液。
127.在浸提液的制备实验中,可制定2个实验组和1个空白组,2个实验组分别编号为:
①
超级电容器与生物粘附薄膜、
②
超级电容器。2个实验组中所用到的超级电容器为实施例1所制备的超级电容器。
128.依据iso 10993
‑
12标准,结合材料特性,
①
、
②
组的浸提液按照样品质量与完全培养基体积0.1g/ml的比例制备而成。
129.按照
①
、
②
组的设计,将样品分别浸泡在其对应组别的完全培养基中密封,放在37℃的环境下混匀24h,得到
①
、
②
组的浸提液。
130.将得到的
①
、
②
组的浸提液,分别稀释到1%、5%、10%、25%、50%,每个浓度制备8个样品。
131.不同组别不同浓度浸提液培养大鼠心肌细胞24h后,吸出96孔板孔洞中的浸提液,向每个孔中加入100μl现配制的染色工作液,滴加完成后,迅速放入细胞培养箱中孵育
15min。孵育完成后,避光取出,置于荧光显微镜(nikon)光学平台上,调节暗场下激发光的波长分别为490nm与535nm,观察细胞的染色情况,并记录实验结果。
132.大鼠心肌细胞在三组样品不同浓度的浸提液中的荧光染色图如图4所示。图4中,电容器和界面对应实验
①
组:超级电容器与生物粘附薄膜;电容器对应实验
②
组:超级电容器;界面对应空白组。从图4中可以看出,随着浸提液浓度升高时,大鼠心肌细胞依旧保持长条形状,且贴壁生长,细胞的生长状态及细胞增殖基本不受影响,说明两组材料的细胞毒性较低,材料的生物相容性良好。
133.(2)大鼠心肌细胞的吸光度值测定:
134.不同组别不同浓度浸提液培养大鼠心肌细胞24h后,吸出96孔板孔洞中的浸提液,向每个孔中加入10μl增强型cck
‑
8溶液,并放置于培养箱中孵育4h。孵育完成后,放置于酶标仪(spark,tecan)中,测定其在450nm处的吸光度,测得的结果进行数据计算。
135.根据所测得的吸光度值,计算大鼠心肌细胞在三组样品不同浓度的浸提液中的细胞存活率,具体方法为
[0136][0137]
得到如图5所示。从图5中可以看出,在浸提液浓度为10%以内时,两组材料培养的大鼠心肌细胞的存活率均在80%以上,进一步说明本专利中所选材料的细胞毒性低,生物相容性良好,适合用于小鼠的体内植入应用。
[0138]
请参阅图6,图6为实施例1的超级电容器植入体内两周前后的实物图,从图6中可以看出,在植入14天后,超级电容器依旧粘附在心脏表面而不脱落,实验组小鼠全部存活且成长状态良好,说明实施例1超级电容器在植入小鼠心脏表面可行。
[0139]
(3)小鼠采血及组织免疫学处理:
[0140]
小鼠采血:在消毒过的动物实验平台上,进行小鼠眼球摘除采血实验。取小鼠于实验台上,左手固定小鼠头部,使小鼠眼部充血且眼球凸出。将小鼠眼部对准事先准备的离心管的管口,使用镊子摘除小鼠眼球,收集小鼠血液。将装有血液的离心管放置于室温下静置3h,分离血清,送至武汉塞维尔生物科技有限公司深圳服务中心进行小鼠血液生化检测。
[0141]
具体地,采用三组小鼠进行实验,其中,空白组的小鼠三只,作为对照组,不进行任何植入实验;实验组的小鼠五只,对其进行开胸,将实施例1所制备的超级电容器植入小鼠心脏上;开胸组的小鼠三只,三只小鼠只进行开胸实验不植入超级电容器。
[0142]
三组实验中小鼠血液中ca
2+
、k
+
、cl
‑
的检测结果如图7所示。小鼠血液中血钙、血钾、血氯的正常参考范围分别为:1.87
‑
2.34m mol/l、4.85
‑
5.85m mol/l、105
‑
110m mol/l。从图7中可以看出,实验组、开胸组和空白组中小鼠血液中的检测结果基本都在正常参考范围内,说明三组小鼠体内的基本生化数据正常,初步诊断小鼠的健康状态良好,无严重生理疾病出现。
[0143]
三组实验中小鼠血液中心肌酶的检测结果如图8所示。小鼠血液中ck、cr、ast、ldh
‑
l的正常参考范围分别为:1309.27
‑
2625.05u/l、10.91
‑
85.09μmol/l、36.31
‑
235.48u/l、659.32
‑
829.88u/l。从图8中可以看出,实验组、开胸组和空白组中小鼠血液中心肌酶的检测结果基本都在正常参考范围内,说明植入小鼠体内的超级电容器对小鼠的心脏正常生理状态并未产生明显影响。
[0144]
组织学处理:将组织样品送至武汉塞维尔生物科技有限公司深圳服务中心进行组织学处理,分别对实验组、开胸组、空白组小鼠的心、肝、脾、肺、肾五大器官进行苏木精和伊红染色(he染色),以及三组小鼠的心脏表面的结缔组织进行马松三色染色(masson染色)。由技术中心盲法病理学家进行组织学评估,每组的代表性图像显示在相应的图中。
[0145]
三组实验中小鼠体内心、肝、脾、肺、肾的he切片染色结果如图9所示,从图9中可以看出,空白组、开胸组和实验组中,小鼠的心、肝、脾、肺、肾均为出现观察到明显的病变和器质性损伤,心、肝、脾、肺、肾均呈现健康的形态,说明本课题所选用的植入材料生物相容性良好。
[0146]
三组实验中小鼠心脏部位masson切片染色图以及其对应的imagej分离结果图如图10所示,从图10中可以看出,小鼠心脏部位纤维化程度占比较低,进一步说明本专利选用的材料生物相容性良好。
[0147]
免疫组织化学染色处理:将组织样品送至武汉塞维尔生物科技有限公司深圳服务中心进行免疫组织化学染色处理,分别对实验组、开胸组、空白组小鼠的心脏表面进行免疫荧光和免疫组织化学染色,分析目标蛋白cd86、cd206的表达。三组实验中小鼠的免疫荧光和免疫组织化学染色结果如图11所示,从图中可以看出,三组小鼠的红色荧光和绿色荧光强度大致相同,说明在植入14天后,心脏粘附部位炎症反应减缓,没有产生明显的排斥反应。
[0148]
从上述实验结果中可以看出:
[0149]
(1)采用海藻酸钠与丙烯酰胺双网络水凝胶的封装器件,使器件的整体刚性与组织器官相适配,并且能够适应小鼠心脏的收缩与舒张,不影响小鼠心脏的正常生理功能。
[0150]
(2)通过小鼠开胸手术,利用制备的生物粘附薄膜将超级电容器长久稳定粘附在小鼠心脏表面,避免了传统的缝合手术,这样不会对小鼠心脏造成创伤,并且不会影响心脏的正常生理活动。
[0151]
(3)在细胞毒性方面,通过不同实验组在不同浓度的浸提液下培养大鼠心肌细胞,得出了不同材料的不同浓度浸提液对细胞生长状态、增殖、活力以及细胞毒性的相关结果,对该材料细胞毒性的研究情况提供了一定的参考价值,并且验证了所选用材料的细胞毒性较低。
[0152]
(4)在体内植入方面,通过小鼠的血液生化结果、体内主要器官(心肝脾肺肾)h&e切片结果以及心脏粘附部位masson切片结果,系统地分析了所植入的超级电容器对小鼠正常生理机能的影响、各大组织器官的损害情况以及心脏粘附部位的病变情况,进一步验证了所选材料的生物相容性良好。
[0153]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0154]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1