一种用于分离和/或提取放射性金属阳离子的方法与流程
本申请涉及一种用于分离和/或提取放射性金属阳离子的方法,属于环境保护领域中的含放射性金属阳离子水处理技术。
背景技术:
能源与环境一直是当今社会两大热点问题。由于化石能源自身的不可再生性以及利用过程中不可避免的环境污染问题,人类将目光瞄准核能、太阳能、风能等新型能源。其中核能被视作一种高效而清洁的能源,而受到许多国家的青睐。2007年11月2日,中国发布了《核电中长期发展规划(2005-2020年)》,标志着我国核电发展政策由“适度发展”调整为“积极发展”。但是人们对于核能的接受程度与对核废物的处理能力密切相关。放射性核废物尤以其溶液处理最为棘手。核废液处理不当可能会给环境带来放射性污染,这些污染持续的周期长、难治理,并且后果严重,会对人类的生存与发展产生巨大威胁,因而对核废液的处理成为核能工业进一步发展需要优先考虑的关键因素之一。在稀释后的核废液中,放射性133ba2+离子的半衰期约为10.7年,其作为γ射线的放射源是最危险的有害成分之一。另外,高温、强酸性的核废液与容器反应生成的放射性63ni2+、60co2+离子作为β和γ射线的放射源对环境也造成了威胁。世界卫生组织(who)规定饮用水中ba2+、ni2+离子的最高浓度分别为0.7ppm、0.07ppm。值得注意的是,ba2+离子具有与放射性226ra2+离子相似的离子直径和离子交换特征,故ba2+离子常可作为毒性更大的放射性226ra2+离子(半衰期为1600±7年)的替代物。因此,有效去除这些放射性金属阳离子对人类健康、环境保护和能源循环利用至关重要。
从废水中去除和回收金属离子的方式主要有:沉淀法、液液萃取法、吸附法、离子交换法等。其中离子交换法因其操作便捷、低成本、高效等优势而受到关注。当前,应用于去除ba2+(放射性226ra2+离子的替代物)的离子交换剂主要包括沸石、黏土、钛酸盐纳米材料、铌酸盐材料等,但是现有材料存在吸附量低、选择性差等缺点。另一方面,去除ni2+、co2+的离子交换/吸附材料主要包括沸石、黏土、活性炭等,其主要存在选择性差、残余量未达到who的饮用水标准等问题。因此亟需发展一种可以在废液中低成本、高效去除和回收ra2+、ba2+、ni2+、co2+等放射性金属阳离子的方法。
技术实现要素:
根据本申请的一个方面,提供了一种用于分离和/或提取放射性金属阳离子的方法,利用廉价的[sn3s7]n2n-二维骨架材料高效去除和回收放射性金属阳离子,作为离子交换剂处理水中放射性金属阳离子,再通过简单廉价、环境友好的方法将其洗脱下来,并且利用该材料进行了离子交换层析柱实验。该方法在去除放射性金属阳离子时,表现出捕获放射性离子速度快、高吸附量、高选择性、优异的耐β和γ射线辐照性、高去除率、低残余量的优点,残余量达到世界卫生组织(who)饮用水水质标准,并且可通过简单廉价、环境友好的方法将[sn3s7]n2n-二维骨架材料中的放射性金属阳离子洗脱下来,对于高效去除和回收水环境中的放射性金属阳离子具有重要意义。
所述放射性金属阳离子的去除和回收方法所利用的[sn3s7]n2n-二维骨架材料的结构由锡和硫组成,组分简单均一、具有优异的耐辐照性,且对放射性金属阳离子具有强的亲和力和高选择性。
所述的用于分离和/或提取放射性金属阳离子的方法,其特征在于,将离子交换剂置于含有放射性金属阳离子的液体中,于20~80℃下接触不少于5min,所述离子交换剂捕获分离所述放射性金属阳离子;
所述放射性金属阳离子包括ra2+、ba2+、ni2+、co2+;
所述离子交换剂含有具有二维电负性[sn3s7]n2n-骨架的晶体材料;
所述晶体材料具有如下所示的分子式:
r1xr22-xsn3s7·y[h2o]
其中,r1、r2独立地选自有机铵离子中的至少一种;x=0~2,y≥0。
可选地,所述晶体材料属于单斜晶系,空间群为c2/c,单胞参数为a=22.5~22.6,b=13.0~13.1,
可选地,所述r1、r2独立地选自二甲基铵离子、乙基铵离子、三甲基铵离子中的至少一种。
可选地,所述具有二维电负性[sn3s7]n2n-骨架的晶体材料为[me2nh2]4/3[me3nh]2/3sn3s7·1.25h2o。所述的具有二维电负性[sn3s7]n2n-骨架的晶体材料,具有锡和硫形成电负性的二维层状骨架结构,易于交换的有机胺阳离子r1、r2位于二维层状骨架的层间的特征。在二维层状微孔结构中所有的sn原子都为五配位,与硫原子配位形成扭曲的三角双锥配位构型,构成的次级建筑单元为[sn3s7];[sn3s7]分别与周围三个[sn3s7]通过共边的方式相互连接,形成平行于ab面二维蜂窝状扩展阴离子骨架结构[sn3s7]n2n-,层间距为
其中,二甲铵离子表示为[me2nh2]+,其结构式为:
其中,三甲铵离子表示为[me3nh]+,结构式为:
以上[sn3s7]n2n-骨架的化合物仅为本申请所述[sn3s7]n2n-二维骨架材料的典型代表,本申请所述[sn3s7]n2n-二维骨架材料不局限于此。所述放射性金属阳离子的去除和回收方法所利用的[sn3s7]n2n-二维骨架材料其制备方式参见中国发明专利,公开号为cn104399538。
可选地,所述接触的温度为20~30℃。
可选地,所述接触的温度为25℃。
可选地,所述接触的时间为5~10min。
可选地,所述离子交换剂对放射性金属阳离子具有快速的动力学去除能力,在5min内达到对放射性金属阳离子的吸附平衡。
可选地,所述离子交换剂对放射性金属阳离子具有高的吸附量,以对放射性ba2+(放射性226ra2+离子的替代物)、ni2+、co2+离子为例,其吸附量分别可达到289.04mg/g、83.64mg/g、51.98mg/g。
可选地,所述离子吸附剂对放射性金属阳离子具有高的选择性,以对放射性ba2+离子为例,在模拟地下水环境中该放射性金属阳离子的去除和回收方法对ba2+依然保持高的去除率和达到who饮用水标准的残余量。
可选地,所述放射性金属阳离子包括226ra2+、133ba2+、63ni2+、60co2+。
可选地,将含有放射性金属阳离子的液体通过含有所述离子交换剂的离子交换柱,所述离子交换剂捕获分离所述放射性金属阳离子。
可选地,所述具有二维电负性[sn3s7]n2n-骨架的晶体材料在200kgy强度的β和200kgy强度的γ射线辐照后,对放射性金属阳离子的捕获率在99%以上。
可选地,所述离子交换柱采用[sn3s7]n2n-二维骨架材料填充,对放射性金属阳离子具有优异的去除能力,以对ba2+、ni2+、co2+离子的混合水溶液进行处理为例,当处理的混合溶液达到1100倍床体积时,ba2+、ni2+、co2+离子的去除率依然>99%,残余浓度依然达到who对饮用水的标准。
可选地,所述离子交换剂捕获分离所述放射性金属阳离子后,再用无机盐水溶液洗脱。
可选地,所述无机盐水溶液为kcl水溶液。
可选地,所述离子交换柱采用[sn3s7]n2n-二维骨架材料填充,交换放射性金属阳离子后,可通过简单廉价、环境友好的方法将[sn3s7]n2n-二维骨架材料中的放射性金属阳离子洗脱下来,以交换ba2+离子后的[sn3s7]n2n-二维骨架材料为例,其所含ba2+离子可利用kcl等无机盐水溶液完全洗脱回收。
可选地,所述离子交换剂捕获分离所述放射性金属阳离子包括离子交换和/或吸附作用。本申请中离子交换剂的二维层状骨架结构之间为有机胺阳离子r1、r2,与放射性金属阳离子进行离子交换;离子交换剂为二维层状微孔结构,能够有效的捕获放射性金属阳离子。离子交换作用和吸附作用对捕获分离放射性133ba2+离子(放射性226ra2+离子的替代物)的吸附量和吸附限有很大影响,取决于离子交换剂与放射性金属阳离子的物理化学作用。
本申请能产生的有益效果包括:
1)本申请所提供的用于分离和/或提取放射性金属阳离子的方法,该方法在去除放射性金属阳离子时,表现出捕获放射性离子速度快、高吸附量、高选择性、优异的耐β和γ射线辐照性、高去除率、低残余量的优点,残余量达到世界卫生组织(who)饮用水水质标准,并且可通过简单廉价、环境友好的方法将[sn3s7]n2n-二维骨架材料中的放射性金属阳离子洗脱下来,对于高效去除和回收水环境中的放射性金属阳离子具有重要意义;
2)本申请所提供的用于分离和/或提取放射性金属阳离子的方法,对放射性金属阳离子具有快速的动力学去除能力,在5min内达到对放射性金属阳离子的吸附平衡;
3)本申请所提供的用于分离和/或提取放射性金属阳离子的方法,对放射性金属阳离子具有高的吸附量,以对放射性ba2+、ni2+、co2+离子为例,其吸附量分别可达到289.04mg/g、83.64mg/g、51.98mg/g;
4)本申请所提供的用于分离和/或提取放射性金属阳离子的方法,对放射性金属阳离子具有高的选择性,以对放射性ba2+离子为例,在模拟地下水环境中该放射性金属阳离子的去除和回收方法对ba2+依然保持高的去除率和达到who饮用水标准的残余量;
5)本申请所提供的用于分离和/或提取放射性金属阳离子的方法,利用[sn3s7]n2n-二维骨架材料填充的离子交换柱对放射性金属阳离子具有优异的去除能力,以对ba2+、ni2+、co2+离子的混合水溶液进行处理为例,当处理的混合溶液达到1100倍床体积时,ba2+、ni2+、co2+离子的去除率依然>99%,残余浓度依然达到who对饮用水的标准;
6)本申请所提供的用于分离和/或提取放射性金属阳离子的方法,[sn3s7]n2n-二维骨架材料交换放射性金属阳离子后,可通过简单廉价、环境友好的方法将[sn3s7]n2n-二维骨架材料中的放射性金属阳离子洗脱下来,以交换ba2+离子后的[sn3s7]n2n-二维骨架材料为例,其所含ba2+离子可利用kcl等无机盐水溶液完全洗脱回收。
附图说明
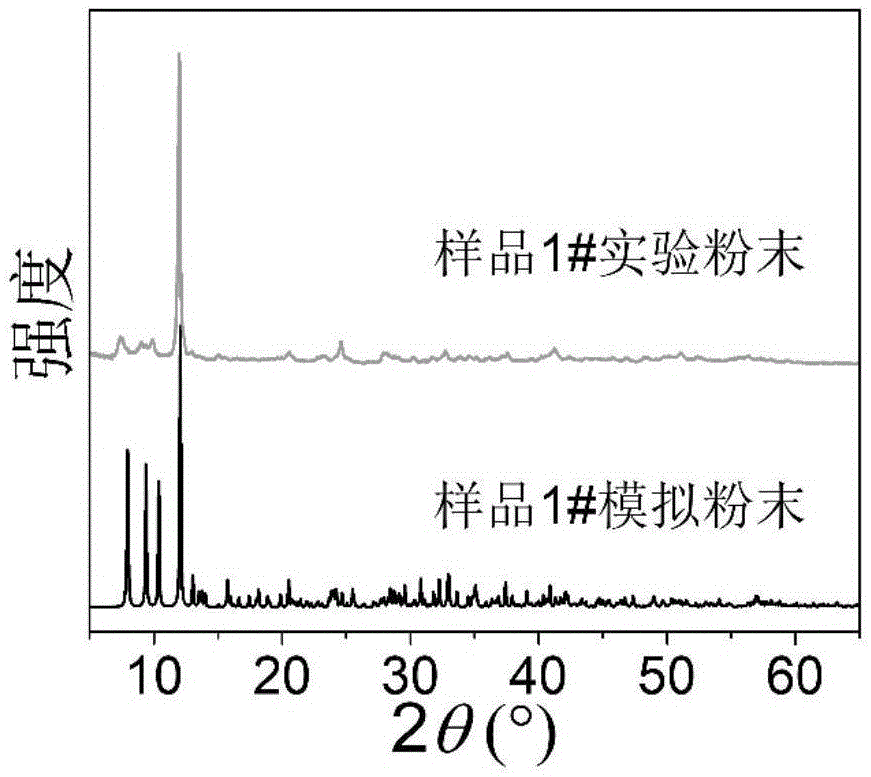
图1为实施例1中样品1#实验与样品1#单晶结构模拟的x射线粉末衍射对比图。
图2为实施例1中样品1#去除和回收放射性金属阳离子的交换动力学测试数据,其中(a)、(b)、(c)分别为样品1#去除ba2+、ni2+、co2+离子的动力学实验结果。
图3为实施例1中样品1#去除和回收放射性金属阳离子的吸附模型测试数据,其中(a)为样品1#去除ba2+离子的吸附模型实验结果;(b)为样品1#去除ni2+、co2+离子的吸附模型实验结果。
图4为实例1中样品1#去除和回收放射性金属阳离子前后的x-射线光电子能谱分析图,其中(a)为样品1#去除ba2+、ni2+、co2+前后n原子的x-射线光电子能谱图;(b)为样品1#去除ba2+、ni2+、co2+前后及bas样品中s原子的x-射线光电子能谱图。
图5为施例1中样品1#去除和回收放射性金属阳离子的分配系数及去除能力测试,其中(a)为辐照前后去除ba2+、ni2+、co2+离子的分配系数;(b)为去除能力实验结果。
图6为应用实施例1中样品1#模拟离子交换层析柱对混合ba2+、ni2+、co2+离子溶液的去除率图。
图7为施例1中样品1#去除和回收放射性金属阳离子的离子交换后洗脱实验中洗脱前后的ba的能谱图,其中(a)为样品1#-ba的能谱图;(b)为样品1#-ba-洗脱的能谱图。
具体实施方式
下面结合实施例详述本申请,但本申请并不局限于这些实施例。
如无特别说明,本申请的实施例中的原料均通过商业途径购买。
本申请的实施例中分析方法如下:
原子吸收光谱和电感耦合等离子体发射光谱分别在thermo7400和xseriseii装置上进行。
能量色散x光谱(eds)测试在jeoljsm-6700f扫描电子显微镜和hitachife-semsu8010机器上进行。
x射线粉末衍射物相分析(xrd)在30kv,15ma的在rigaku公司的miniflexii型x射线衍射仪上进行,cu靶,kα辐射源
x-射线光电子能谱分析(xps)在escalab250xixps能谱仪上记录。
β射线辐照实验是由电子加速器提供能量为1.2mev的电子束照射,γ射线辐照实验是由60co源(2.22×1015bq)提供能量照射。
实施例1
[sn3s7]n2n-二维骨架材料的制备参考公开号为cn104399538的中国专利申请中实施例1,选用的[sn3s7]n2n-二维骨架材料为化合物[me2nh2]4/3[me3nh]2/3sn3s7·1.25h2o,其仅为本申请所述[sn3s7]n2n-二维骨架材料的典型代表,本申请所述[sn3s7]n2n-二维骨架材料不局限于此。[me2nh2]4/3[me3nh]2/3sn3s7·1.25h2o(样品1#)的合成方法具体为:
将锡源、硫源、二甲胺水溶液和水按一定的摩尔比混合均匀,室温下充分搅拌后封入内衬为聚四氟乙烯的不锈钢反应釜中,一定温度恒温反应一段时间后自然降温至室温,将所得样品过滤并以蒸馏水、乙醇充分洗涤、干燥后,即可得到[me2nh2]4/3[me3nh]2/3sn3s7·1.25h2o(样品1#)。原料的种类及配比、反应温度和时间、产率详见表1。
表1
产率=(所得样品1#的质量)÷(锡源中锡元素的摩尔数÷3×产物理论分子量)×100%。
采用x射线粉末衍射对样品1#晶体结构进行分析,结果如图1所示,由图可以看出,样品1#与样品1#的单晶结构模拟粉末比对较好,证明合成所得样品1#为纯相。
实施例2利用[sn3s7]n2n-二维骨架材料去除和回收放射性金属阳离子方法的交换动力学测试
样品1#对ba2+、ni2+、co2+离子的交换动力学实验具体步骤为:研磨后的粉末样品1#分别对一定初始浓度的ba2+、ni2+、co2+离子的水溶液在25℃,v(溶液体积):m(交换剂质量)=1000ml/g条件下,间隔一定的时间分别取上清液测定其中离子浓度。结果如图2所示,由图可以看出,样品1#对ba2+、ni2+、co2+离子的交换在5min以内就能达到平衡,且残余量达到who对饮用水的标准。
实施例3利用[sn3s7]n2n-二维骨架材料去除和回收放射性金属阳离子方法的吸附模型测试
样品1#对ba2+、ni2+、co2+离子的吸附模型实验具体步骤为:研磨后的粉末样品1#对不同初始浓度的ba2+、ni2+、co2+离子水溶液在25℃,v(溶液体积):m(交换剂质量)=1000ml/g条件下交换24h,取上层清液和初始溶液测定其中离子浓度。结果如图3所示,由图可以看出,样品1#对ba2+、ni2+、co2+离子的吸附量可分别达到289.04mg/g、83.64mg/g、51.98mg/g。
样品1#对ba2+离子的吸附量达到了理论值的148%。利用x-射线光电子能谱对交换ba2+、ni2+、co2+离子前后的样品1#进行分析,如图4(a)所示,交换ba2+、ni2+离子后样品1#的n原子的特征峰消失,而交换co2+离子后样品1#的n原子的特征峰明显减弱,表明样品1#中的有机铵离子可以被ba2+、ni2+离子完全交换,被co2+离子仅部分交换;如图4(b)所示,交换ba2+离子后的样品1#出现明显的bas的特征峰,表明样品1#框架上的s2-对ba2+离子存在较强的亲和力,样品1#对ba2+离子的吸附量超出理论值的部分是由于强表面吸附作用的存在。
样品1#能够有效去除放射性ba2+,以及强酸性的放射性核废液与容器反应生成的放射性ni2+、co2+,达到了对ba2+辐射污染的全面去除;ba2+离子具有与ra2+离子相似的离子直径和离子交换特征,故ba2+离子常可作为毒性更大的放射性ra2+离子(半衰期为1600±7年)的替代物,因此可以证明其对ra2+的有效去除作用。
实施例4利用[sn3s7]n2n-二维骨架材料去除和回收放射性金属阳离子方法的选择性去除能力测试
具体实验步骤为研磨后的粉末样品1#对模拟地下水溶液在25℃,v(溶液体积):m(交换剂质量)=1000ml/g条件下交换24h,取上层清液和初始溶液测定其中离子浓度,测试结果详见表2:
表2
结果表明,在模拟地下水环境中(高浓度k+、na+、ca2+、mg2+竞争离子存在),样品1#对ba2+离子的去除率依然达到85.93%,且ba2+离子的残余浓度低至0.386ppm,达到who对饮用水中ba2+离子浓度的标准(0.7ppm)。
实施例5高强度辐照前后,利用[sn3s7]n2n-二维骨架材料去除和回收放射性金属阳离子方法的分配系数及去除能力测试
具体实验步骤为:研磨后的粉末样品1#及其在200kgyβ或200kgyγ射线辐照后对ba2+、ni2+、co2+离子的混合水溶液在25℃,v(溶液体积):m(交换剂质量)=1000ml/g条件下交换24h,取上层清液和初始溶液测定其中离子浓度。结果如图5所示,由图可以看出,样品1#在200kgyβ或200kgyγ辐照后对ba2+、ni2+、co2+离子依然保持高的分配系数(kd)和去除率,说明本申请所提供的离子交换剂具有优异的辐照稳定性,在高强度的β和γ射线辐照后对放射性ba2+、ni2+、co2+离子仍然具有较强的去除能力和高的选择性。
实施例6模拟离子交换柱应用
在一内径为13.4毫米的闪式层析柱中用约3.1克样品1#制备填料高度为2厘米的离子交换柱。用该离子交换柱处理一定体积的ba2+、ni2+、co2+混合溶液,间隔不同滤液体积收集柱出口处的溶液,取样检测其中的ba2+、ni2+、co2+离子浓度。
图6为在模拟离子交换柱实验中,填充3.1克样品1#,共处理1100倍床体积的ba2+、ni2+、co2+混合溶液,ba2+、ni2+、co2+离子的去除率可保持在99%左右,值得注意的是,当处理的混合溶液超过3l时,ba2+、ni2+、co2+离子的去除率依然可分别达到99.74%、99.30%、99.65%,ba2+、ni2+、co2+离子的残余浓度依然可分别低至2.33ppb、6.24ppb、3.25ppb,达到who对饮用水的标准。
实施例7利用[sn3s7]n2n-二维骨架材料去除和回收放射性金属阳离子方法的离子交换后洗脱实验
取实施例1中所得的样品1#20mg,置于20ml含有3000ppmba2+离子的水溶液中,25℃条件下磁力搅拌24h,得到ba2+离子交换后的产物,记为样品1#-ba。将样品1#-ba置于0.5mkcl溶液中25℃条件下磁力搅拌12h,得到ba2+离子洗脱后的产物,记为样品1#-ba-洗脱。将样品1#-ba和样品1#-ba-洗脱进行eds测试,如图7显示经过kcl洗脱,样品1#-ba中的钡元素已被完全洗脱掉。
以上所述,仅是本申请的几个实施例,并非对本申请做任何形式的限制,虽然本申请以较佳实施例揭示如上,然而并非用以限制本申请,任何熟悉本专业的技术人员,在不脱离本申请技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。
- 还没有人留言评论。精彩留言会获得点赞!