制造含GNRH的凝胶的方法与流程
本申请根据35 U.S.C. § 119 (e)要求2014年4月18日提交的美国临时申请序列号61/981,370和2014年7月18日提交的美国临时申请序列号62/026,153的优先权,所述两者的公开内容通过引用并入本文。
发明领域
本发明涉及用于在动物中同步授精时间的组合物。更特别地,本发明涉及用于制造和稳定此类组合物的方法。
发明背景
促性腺激素释放激素(GnRH)是10个氨基酸的肽,并且也被称为促黄体素释放激素(LHRH)。促性腺激素释放激素在下丘脑中产生,并且负责促滤泡激素和促黄体素从脑垂体中释放。促性腺激素释放激素从下丘脑中的神经元释放,并且在促滤泡激素和促黄体素释放的复杂调节中起作用。促滤泡激素和促黄体素组合来调节性腺的功能,以在睾丸中产生睾酮以及在卵巢中产生黄体酮和雌激素,并且调节配子的产生和成熟。例如,促滤泡激素刺激卵巢中未成熟卵泡的生长和补充,并且促黄体素触发排卵。
促性腺激素释放激素已被分离和鉴定为十肽。可利用促性腺激素释放激素的合成形式,并且对促性腺激素释放激素的十肽结构进行的修饰已产生多种促性腺激素释放激素类似物,所述类似物刺激(例如,促性腺激素释放激素激动剂)或抑制(例如,促性腺激素释放激素拮抗剂)促性腺激素,诸如促黄体素和促滤泡激素的释放。
对商品猪生产而言,重要的是最大化繁殖效率,以使猪生产更有利润。已严重依赖个体雌性猪的每日发情检测(heat detection),其中基于对小母猪(gilts)或老母猪(sows)进行每日检查,相关劳动成本用于雌性猪中发情的手动检测,以获得例如人工授精的最佳结果。使用诸如每日检查的劳动密集型方法的发情检测增加了人工授精成功的可能性。因此,对用于发情检测的每日检查付出时间、体力劳动和材料成本是有必要的,因为在不使用需要每日制度以用于监控发情检测的方法的情况下,难以预测发情和排卵的时间(即,为了确定最佳授精时间)。因此,需要优化动物授精成功的组合物,以减少或消除对于发情检测的需求、降低劳动成本并增加猪生产的获利性。
申请人已发现凝胶形式的促性腺激素释放激素组合物可经由施用激素用于控制排卵时间,并且可消除基于动情期检测的育种并允许猪接收仅一或两次授精,从而实现最优生育力和最优成本支出。需要改善的制造方法以制备较大、均匀的商业批料大小(batch size)的用于在动物中同步授精时间的该含GnRH的组合物。申请人已发现导致该组合物均匀性增加的制备此类含GnRH的凝胶组合物的方法。
技术实现要素:
申请人已发现用于制造含有促性腺激素释放激素(GnRH)或GnRH激动剂的凝胶组合物的有效方法,所述凝胶组合物表示为含有促性腺激素释放激素的凝胶、含GnRH的凝胶、含GnRH的药物产品或含GnRH的凝胶组合物。更具体地,申请人已发现用于生产均匀的、较大批料大小的含GnRH的凝胶组合物的改善的制造方法。该改善的方法促进制备均匀的、较大批料大小的含GnRH的凝胶。
在含GnRH的凝胶的制备中,通常将促性腺激素释放激素以及诸如防腐剂、稳定剂、张度剂(tonicity agent)和缓冲剂的其它任选组分在水中混合,以提供水性混合物。伴随持续搅拌,向该混合物中添加诸如甲基纤维素的胶凝剂,并且在高剪切混合条件下(例如,在450-570 RPM下)搅拌所得混合物,以提供在本申请中表示为“初级复合混合物批料(primary compounding mixture batch)”的混合物,包括下文步骤a)中提供的那种。可随后在包装之前将该批料转移至保持容器(holding vessel)。通过从保持容器中各个部位取样来确保批料的均匀性,例如在顶部中心、在顶部边缘(在0°、90°、180°和270°处)、在中部中心、在中部边缘(在0°、90°、180°和270°处)和在底部,参见图1。已发现当在商业规模上,例如在500 kg促性腺激素释放激素的规模上进行程序时,上述高剪切混合步骤可能不足以确保保持容器中产品的均匀性。
在本发明的一个实施方案中,描述了用于从药物产品的初级复合混合物批料制造含有促性腺激素释放激素的凝胶的方法,该方法包括用低剪切混合,例如使用反向运动混合器、使用反向运动混合(CMM),来进一步混合(上述)初级复合混合物批料以获得最终复合相的步骤。
在本发明的另一个实施方案中,描述了用于制造含有促性腺激素释放激素的凝胶的方法,该方法包括使用CMM来进一步混合的以上步骤和使用CMM伴随冷却至15℃或以下的另一步骤。
对于包括使用CMM步骤的以上实施方案而言,另一实施方案包括保持混合物在2-8℃下至少约24小时的步骤。
在一个实施方案中,描述了用于制造含有促性腺激素释放激素的凝胶的方法。该方法包括以下步骤:a)提供药物产品的初级复合混合物批料,该初级复合混合物批料包含在水性混合物中的促性腺激素释放激素,还包含:任选地,防腐剂;任选地,稳定剂;任选地,张度剂;任选地,缓冲剂;和胶凝剂;b)使用反向运动混合(CMM)进一步混合所述混合物;c)任选地,调节所述混合物的pH;d)使用反向运动混合(CMM)伴随冷却至15℃或以下进一步混合所述混合物;e)任选地,过滤所述混合物,和;f)保持所述混合物在2-8℃下至少24小时。
在上述实施方案中,以下特征或其任何组合均适用。在上述实施方案中:1)所述促性腺激素释放激素可具有下式
或其溶剂化物、水合物,或药学上可接受的盐,其中R1和R2在各种情况下独立地为氢,或独立地选自烷基、杂烷基、环烷基、杂环烷基、卤代烷基、芳基、杂芳基、芳基烷基和杂芳基烷基,其各自任选被取代,或者R1和R2和所连接的碳形成碳环或杂环;R5为氢或烷基;并且X为氢,或X选自烷基、环烷基、杂烷基、任选取代的亚烷基-甲酰胺和HNC(O)NR3R4,其中R3和R4在各种情况下独立地选自氢、烷基、杂烷基和卤代烷基;2)所述促性腺激素释放激素可选自具有上式的化合物,其中:a) R1为1H-吲哚-3-基-甲基,R2为氢,X为CH2(CO)NH2;R5为氢;并且R1所连接的碳的构型为R;b) R1为氢,R2为氢,X为CH2(CO)NH2;并且R5为氢;c) R1为1H-1-苄基-咪唑-4-基-甲基、R2为氢、X为乙基;并且R5为氢;d) R1为2-甲基丙基,R2为氢,X为乙基;并且R5为氢;e) R1为2-萘基甲基,R2为氢,X为CH2(CO)NH2;并且R5为氢;f) R1为叔丁氧基甲基,R2为氢,X为乙基;R5为氢;并且R1所连接的碳的构型为R;g) R1为苄基,R2为氢,X为CH2(CO)NH2;R5为氢;并且R1所连接的碳的构型为R;h) R1为叔丁氧基甲基,R2为氢,X为HN(CO)NH2;并且R5为氢;i) R1为1H-吲哚-3-基-甲基,R2为氢,X为乙基;并且R5为氢;j) R1为甲基,R2为氢,X为氢;R5为氢;并且R1所连接的碳的构型为R;k) R1为1H-吲哚-3-基-甲基,R2为氢,X为乙基;R5为甲基;并且R1所连接的碳的构型为R;l) R1为甲基,R2为氢,X为CH2(CO)NH2;R5为氢;并且R1所连接的碳的构型为R;m) R1为4-氨基丁基,R2为氢,X为HN(CO)NH2;R5为氢;并且R1所连接的碳的构型为R;n) R1为甲基,R2为甲基,X为HN(CO)NH2;并且R5为氢;以及o) R1为乙基,R2为氢,X为氢;R5为氢;并且R1所连接的碳的构型为R;3)所述促性腺激素释放激素可为曲普瑞林;4)所述激素可为乙酸盐形式;5)所述混合物可包含防腐剂,其中该防腐剂选自对羟基苯甲酸甲酯和对羟基苯甲酸丙酯;6)所述混合物可包含稳定剂,其中该稳定剂为L-甲硫氨酸;7)所述混合物可包含张度剂,其中该张度剂为氯化钠;8)所述混合物可包含缓冲剂,其中该缓冲剂为柠檬酸钠-柠檬酸;9)所述胶凝剂可为选自纤维素、葡聚糖和藻酸盐的多糖;10)所述胶凝剂可为纤维素;11)所述纤维素可为甲基纤维素;12)所述混合物可包含约0.5重量%至约4.0重量%的甲基纤维素;13)所述混合物可包含约1.2重量%的甲基纤维素;14)所述混合物可包含曲普瑞林、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、L-甲硫氨酸、氯化钠、柠檬酸钠、柠檬酸和甲基纤维素;15)所述混合物可包含约0.01%重量每体积的量的曲普瑞林(作为乙酸盐),约0.09%重量每体积的量的对羟基苯甲酸甲酯,约0.01%重量每体积的量的对羟基苯甲酸丙酯,约0.91%重量每体积的量的氯化钠,约0.1%重量每体积的量的L-甲硫氨酸,约0.186%重量每体积的量的柠檬酸钠,约0.07%重量每体积的量的柠檬酸,和约1.2%重量每体积的量的甲基纤维素;16)所述混合物可具有约5至约6的pH;17)可将步骤b)中的混合物混合约90分钟至约100分钟的时间;18)可通过添加柠檬酸水溶液将pH调节至约5.3至约5.7;19)进一步混合步骤d)可伴随冷却至15℃或以下进行约70分钟至约80分钟的时间;20)所述促性腺激素释放激素可为约50 μg/mL至约200 μg/mL的浓度;21)所述方法可提供100 μg曲普瑞林每mL的浓度的曲普瑞林凝胶(作为乙酸曲普瑞林)。
附图说明
图1.保持容器中的散装均匀性(bulk uniformity)取样位置。
图2.保持容器中的备选示例性取样位置。
图3.工艺验证(process validation)批料在第0、7、21和30天的曲普瑞林测定结果。
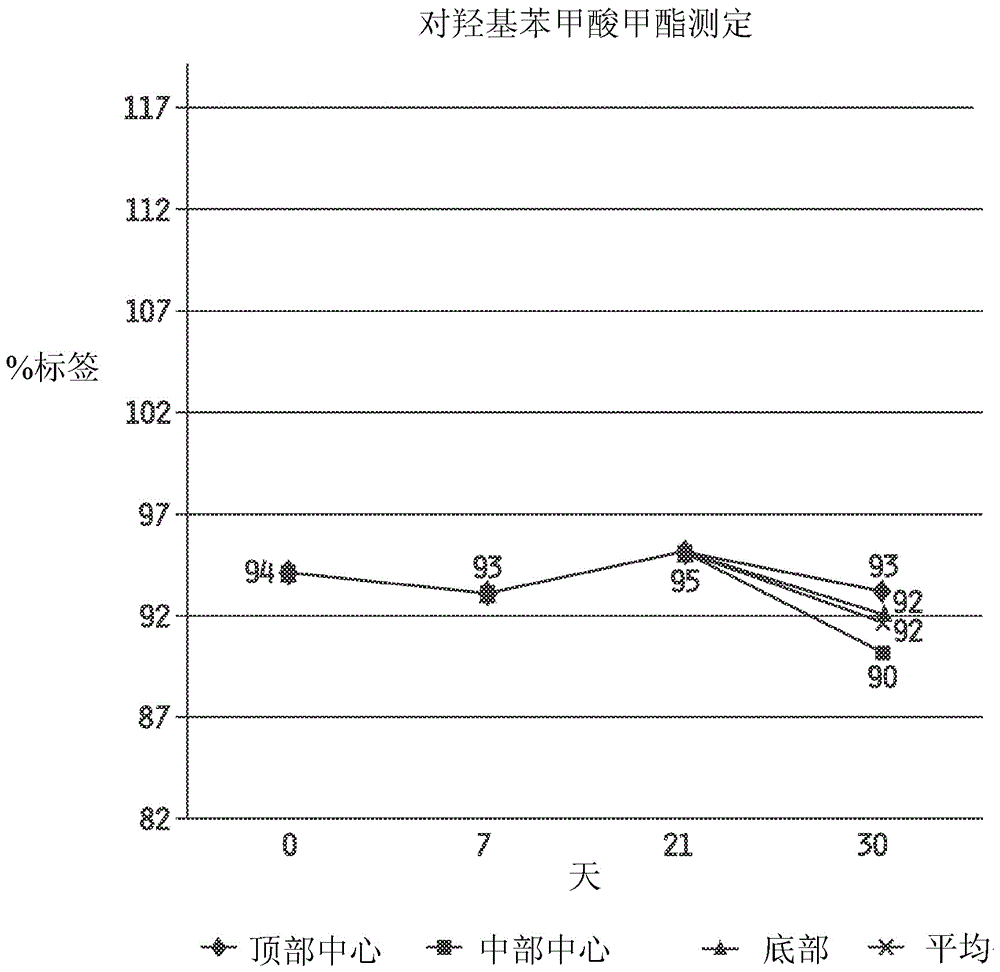
图4.工艺验证批料在第0、7、21和30天的对羟基苯甲酸甲酯测定结果。
图5.工艺验证批料在第0、7、21和30天的对羟基苯甲酸丙酯测定结果。
图6.工艺验证批料在第0、7、14、21和30天的曲普瑞林测定结果。
图7.工艺验证批料在第0、7、14、21和30天的对羟基苯甲酸甲酯测定结果。
图8.工艺验证批料在第0、7、14、21和30天的对羟基苯甲酸丙酯测定结果。
图9A和图9B.建议的(A)和改善的(改进的)(B)商业方法的比较。在阻挡或不发射UV-A、UV-B和UV-C波长的室内进行制造。
发明详述
还在以下条款中提供以下各种实施方案。
1.一种用于从药物产品的初级复合混合物批料制造含有促性腺激素释放激素的凝胶的方法,所述方法包括使用反向运动混合(CMM)进一步混合所述初级复合混合物批料的步骤。
2. 条款1所述的方法,其中所述促性腺激素释放激素具有下式
或其溶剂化物、水合物,或药学上可接受的盐,其中
R1和R2在各种情况下独立地为氢,或独立地选自烷基、杂烷基、环烷基、杂环烷基、卤代烷基、芳基、杂芳基、芳基烷基和杂芳基烷基,其各自任选被取代,或者R1和R2和所连接的碳形成碳环或杂环;
R5为氢或烷基;以及
X为氢,或X选自烷基、环烷基、杂烷基、任选取代的亚烷基-甲酰胺和HNC(O)NR3R4,其中R3和R4在各种情况下独立地选自氢、烷基、杂烷基和卤代烷基。
3.根据条款2所述的方法,其中所述促性腺激素释放激素选自具有条款2所述式的化合物,其中
a) R1为1H-吲哚-3-基-甲基,R2为氢,X为CH2(CO)NH2;R5为氢;并且R1所连接的碳的构型为R;
b) R1为氢,R2为氢,X为CH2(CO)NH2;并且R5为氢;
c) R1为1H-1-苄基-咪唑-4-基-甲基,R2为氢,X为乙基;并且R5为氢;
d) R1为2-甲基丙基,R2为氢,X为乙基;并且R5为氢;
e) R1为2-萘基甲基,R2为氢,X为CH2(CO)NH2;并且R5为氢;
f) R1为叔丁氧基甲基,R2为氢,X为乙基;R5为氢;并且R1所连接的碳的构型为R;
g) R1为苄基,R2为氢,X为CH2(CO)NH2;R5为氢;并且R1所连接的碳的构型为R;
h) R1为叔丁氧基甲基,R2为氢,X为HN(CO)NH2;并且R5为氢;
i) R1为1H-吲哚-3-基-甲基,R2为氢,X为乙基;并且R5为氢;
j) R1为甲基,R2为氢,X为氢;R5为氢;并且R1所连接的碳的构型为R;
k) R1为1H-吲哚-3-基-甲基,R2为氢,X为乙基;R5为甲基;并且R1所连接的碳的构型为R;
l) R1为甲基,R2为氢,X为CH2(CO)NH2;R5为氢;并且R1所连接的碳的构型为R;
m) R1为4-氨基丁基,R2为氢,X为HN(CO)NH2;R5为氢;并且R1所连接的碳的构型为R;
n) R1为甲基,R2为甲基,X为HN(CO)NH2;并且R5为氢;以及
o) R1为乙基,R2为氢,X为氢;R5为氢;并且R1所连接的碳的构型为R。
4. 根据条款1所述的方法,其中所述促性腺激素释放激素为曲普瑞林。
5.根据条款1-4中任一项所述的方法,其中所述激素为乙酸盐形式。
6. 条款1-5中任一项所述的方法,其中所述混合物包含防腐剂,其中所述防腐剂选自对羟基苯甲酸甲酯和对羟基苯甲酸丙酯。
7. 条款1-6中任一项所述的方法,其中所述混合物包含稳定剂,其中所述稳定剂为L-甲硫氨酸。
8. 条款1-7中任一项所述的方法,其中所述混合物包含张度剂,其中所述张度剂为氯化钠。
9. 条款1-8中任一项所述的方法,其中所述混合物包含缓冲剂,其中所述缓冲剂为柠檬酸钠-柠檬酸。
10. 条款1-9中任一项所述的方法,其中胶凝剂为选自纤维素、葡聚糖和藻酸盐的多糖。
11. 条款10所述的方法,其中所述胶凝剂为纤维素,并且所述纤维素为甲基纤维素。
12. 条款11所述的方法,其中所述混合物包含约0.5重量%至约4.0重量%的甲基纤维素。
12.1. 条款11所述的方法,其中所述混合物包含约1重量%至约1.4重量%的甲基纤维素。
13. 条款12所述的方法,其中所述混合物包含约1.2重量%的甲基纤维素。
14. 条款1-5中任一项所述的方法,其中所述混合物包含曲普瑞林、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、L-甲硫氨酸、氯化钠、柠檬酸钠、柠檬酸和甲基纤维素。
15. 条款14所述的方法,其中所述混合物包含约0.01%重量每体积的量的曲普瑞林(作为乙酸盐),约0.09%重量每体积的量的对羟基苯甲酸甲酯,约0.01%重量每体积的量的对羟基苯甲酸丙酯,约0.91%重量每体积的量的氯化钠,约0.1%重量每体积的量的L-甲硫氨酸,约0.186%重量每体积的量的柠檬酸钠,约0.07%重量每体积的量的柠檬酸,和约1.2%重量每体积的量的甲基纤维素。
16. 条款1-15中任一项所述的方法,其中所述混合物具有约5至约6的pH。
17. 条款1-16中任一项所述的方法,其中所述促性腺激素释放激素为约50 μg/mL至约200 μg/mL的浓度。
18. 条款1-17中任一项所述的方法,其中所述方法提供100 μg曲普瑞林每mL的浓度的曲普瑞林凝胶(作为乙酸曲普瑞林)。
19. 根据条款1-18中任一项所述的方法,其中所述甲基纤维素以提供约250 cP至约400 cP的粘度的量存在。
20. 条款1-19中任一项所述的方法,包括使用CMM将所述混合物混合约90分钟至约100分钟的时间。
21. 条款1-20中任一项所述的方法,其中所述使用CMM将所述混合物混合在约15 RPM下进行。
22. 条款1-21中任一项所述的方法,其中所述使用CMM将所述混合物混合在无源真空(passive vacuum)下进行。
23. 条款1-22中任一项所述的方法,包括使用CMM伴随冷却至15℃或以下混合所述混合物的另外的步骤。
23a. 条款23所述的方法,其中所述伴随冷却的混合进行至少约70分钟的时间。
24.条款23所述的方法,其中所述伴随冷却的混合进行约70分钟至约80分钟的时间。
25. 条款23、23a或24所述的方法,其中所述使用CMM伴随冷却的混合在约15 RPM下进行。
26.条款23-25中任一项所述的方法,其中所述使用CMM伴随冷却的混合在无源真空下进行。
27. 条款1-26中任一项所述的方法,包括保持所述混合物在2-8℃下至少约24小时的另外的步骤。
101.一种用于制造含有促性腺激素释放激素的凝胶的方法,所述方法包括以下步骤:
a)提供药物产品的初级复合混合物批料,所述初级复合混合物批料包含在水性混合物中的促性腺激素释放激素,还包含:
任选地,防腐剂;
任选地,稳定剂;
任选地,张度剂;
任选地,缓冲剂;和
胶凝剂;
b)使用反向运动混合(CMM)进一步混合所述混合物;
c)任选地,调节所述混合物的pH;
d)使用反向运动混合(CMM)伴随冷却至15℃或以下进一步混合所述混合物;
e) 任选地,过滤所述混合物,和;
f)保持所述混合物在2-8℃下至少24小时。
102. 条款101所述的方法,其中所述促性腺激素释放激素具有下式
或其溶剂化物、水合物,或药学上可接受的盐,其中
R1和R2在各种情况下独立地为氢,或独立地选自烷基、杂烷基、环烷基、杂环烷基、卤代烷基、芳基、杂芳基、芳基烷基和杂芳基烷基,其各自任选被取代,或者R1和R2和所连接的碳形成碳环或杂环;
R5为氢或烷基;以及
X为氢,或X选自烷基、环烷基、杂烷基、任选取代的亚烷基-甲酰胺和HNC(O)NR3R4,其中R3和R4在各种情况下独立地选自氢、烷基、杂烷基和卤代烷基。
103. 根据条款102所述的方法,其中所述促性腺激素释放激素选自具有条款102所述式的化合物,其中
a) R1为1H-吲哚-3-基-甲基,R2为氢,X为CH2(CO)NH2;R5为氢;并且R1所连接的碳的构型为R;
b) R1为氢,R2为氢,X为CH2(CO)NH2;并且R5为氢;
c) R1为1H-1-苄基-咪唑-4-基-甲基,R2为氢,X为乙基;并且R5为氢;
d) R1为2-甲基丙基,R2为氢,X为乙基;并且R5为氢;
e) R1为2-萘基甲基,R2为氢,X为CH2(CO)NH2;并且R5为氢;
f) R1为叔丁氧基甲基,R2为氢,X为乙基;R5为氢;并且R1所连接的碳的构型为R;
g) R1为苄基,R2为氢,X为CH2(CO)NH2;R5为氢;并且R1所连接的碳的构型为R;
h) R1为叔丁氧基甲基,R2为氢,X为HN(CO)NH2;并且R5为氢;
i) R1为1H-吲哚-3-基-甲基,R2为氢,X为乙基;并且R5为氢;
j) R1为甲基,R2为氢,X为氢;R5为氢;并且R1所连接的碳的构型为R;
k) R1为1H-吲哚-3-基-甲基,R2为氢,X为乙基;R5为甲基;并且R1所连接的碳的构型为R;
l) R1为甲基,R2为氢,X为CH2(CO)NH2;R5为氢;并且R1所连接的碳的构型为R;
m) R1为4-氨基丁基,R2为氢,X为HN(CO)NH2;R5为氢;并且R1所连接的碳的构型为R;
n) R1为甲基,R2为甲基,X为HN(CO)NH2;并且R5为氢;以及
o) R1为乙基,R2为氢,X为氢;R5为氢;并且R1所连接的碳的构型为R。
104. 根据条款101所述的方法,其中所述促性腺激素释放激素为曲普瑞林。
105. 根据条款101-104中任一项所述的方法,其中所述激素为乙酸盐形式。
106. 条款101-105中任一项所述的方法,其中所述混合物包含防腐剂,其中所述防腐剂选自对羟基苯甲酸甲酯和对羟基苯甲酸丙酯。
107. 条款101-106中任一项所述的方法,其中所述混合物包含稳定剂,其中所述稳定剂为L-甲硫氨酸。
108. 条款101-107中任一项所述的方法,其中所述混合物包含张度剂,其中所述张度剂为氯化钠。
109. 条款101-108中任一项所述的方法,其中所述混合物包含缓冲剂,其中所述缓冲剂为柠檬酸钠-柠檬酸。
110. 条款101-109中任一项所述的方法,其中所述胶凝剂为选自纤维素、葡聚糖和藻酸盐的多糖。
111. 条款110所述的方法,其中所述胶凝剂为纤维素,并且所述纤维素为甲基纤维素。
112. 条款111所述的方法,其中所述混合物包含约0.5重量%至约4.0重量%的甲基纤维素。
112.1. 条款111所述的方法,其中所述混合物包含约1重量%至约1.4重量%的甲基纤维素。
113. 条款112所述的方法,其中所述混合物包含约1.2重量%的甲基纤维素。
114. 条款101-105中任一项所述的方法,其中所述混合物包含曲普瑞林、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、L-甲硫氨酸、氯化钠、柠檬酸钠、柠檬酸和甲基纤维素。
115. 条款114所述的方法,其中所述混合物包含约0.01%重量每体积的量的曲普瑞林(作为乙酸盐),约0.09%重量每体积的量的对羟基苯甲酸甲酯,约0.01%重量每体积的量的对羟基苯甲酸丙酯,约0.91%重量每体积的量的氯化钠,约0.1%重量每体积的量的L-甲硫氨酸,约0.186%重量每体积的量的柠檬酸钠,约0.07%重量每体积的量的柠檬酸,和约1.2%重量每体积的量的甲基纤维素。
116. 条款101-115中任一项所述的方法,其中所述混合物具有约5至约6的pH。
117. 条款101-116中任一项所述的方法,包括将步骤b)中的混合物混合约90分钟至约100分钟的时间。
118. 条款101-117中任一项所述的方法,包括其中通过添加柠檬酸水溶液将pH调节至5.3至5.7的步骤c)。
119. 条款101-118中任一项所述的方法,其中所述伴随冷却至15℃或以下进一步混合步骤d)进行约70分钟至约80分钟的时间。
120. 条款101-119中任一项所述的方法,其中所述促性腺激素释放激素为约50 μg/mL至约200 μg/mL的浓度。
121. 条款101-119中任一项所述的方法,其中所述方法提供100 μg曲普瑞林每mL的浓度的曲普瑞林凝胶(作为乙酸曲普瑞林)。
122. 条款101-121中任一项所述的方法,其中所述甲基纤维素以提供约250 cP至约400 cP的粘度的量存在。
123. 条款101-122中任一项所述的方法,其中所述混合物的混合在无源真空下进行。
124. 条款101-123中任一项所述的方法,其中使用低剪切混合,例如使用反向运动混合器,例如在15 RPM下进行所述混合物的混合。
125. 条款1-124中任一项所述的方法,其中使用60目筛过滤所述混合物。
126. 条款1-125中任一项所述的方法,其中使用泵,例如使用低剪切、旋转叶传送泵(rotating lobe transfer pump)将所述药物产品的所述初级复合混合物批料转移至容器以获得最终复合相。
127. 条款1-126中任一项所述的方法,其中使用泵,例如使用低剪切、旋转叶传送泵将所述药物产品的所述最终复合相批料转移至容器以获得最终保持相。
说明性实施方案的详述
在一个实施方案中,描述了用于制造含GnRH的凝胶的方法。该方法包括以下步骤:a)提供药物产品的初级复合混合物批料,该初级复合混合物批料包含在水性混合物中的促性腺激素释放激素,还包含:任选地,防腐剂;任选地,稳定剂;任选地,张度剂;任选地,缓冲剂;和胶凝剂;b)进一步混合所述混合物;c)任选地,调节所述混合物的pH;d)伴随冷却至15℃或以下进一步混合所述混合物;e)任选地,过滤所述混合物,和;f)保持所述混合物在2-8℃下至少24小时。
下文描述的所有说明性实施方案、改进和备选形式均可适用于该详述部分的先前段落中描述的实施方案,并适用于发明内容中描述的实施方案。
在本文描述的任何实施方案中,所述含GnRH的凝胶组合物可包含:a)激素;和b)药学上可接受的pH缓冲剂,以提供在约pH 4至约pH 9范围内的pH。本文描述的组合物的pH可在约4至约9的范围内。在其它实施方案中,该pH可在约4至约8、约4至约7、约4.5至约6.5、约4.5至约6、约5至约6或约5.3至5.7的范围内。
此外,可根据剂型经由通过适当与添加剂混合、用添加剂稀释或溶解于添加剂中的方法来产生所述混合物,所述添加剂诸如各种赋形剂、崩解剂、粘合剂、盐、润滑剂、局部麻醉剂(例如,利多卡因)、稀释剂、防腐剂、螯合剂、缓冲剂、张度剂、抗菌剂(antiseptic agent)、润湿剂、乳化剂、分散剂、稳定剂、助溶剂(solution adjuvant)或其组合。
说明性地,所述含GnRH的凝胶可具有,例如约10 (厘泊) cP至约300,000 cP的粘度。在各种说明性实施方案中,该粘度可为约100 cP至约100,000 cP、约250 cP至约400 cP、约300 cP至约400 cP、约500 cP至约100,000 cP、约700 cP至约100,000 cP、约200 cP至约20,000 cP、约200 cP至约10,000 cP、约200 cP至约5,000 cP、约200至约1,000 cP、约200 cP至约600 cP、约100 cP至约600 cP、约100 cP至约500 cP、约200 cP至约500 cP、约200 cP至约450 cP、或约100,000 cP至约250,000 cP。根据本文描述的各种实施方案,该粘度可为约200 cP、约250 cP、约300 cP、约400 cP、约500 cP、约1,000 cP、约15,000 cP、约20,000 cP、约30,000 cP、约40,000 cP、约50,000 cP、约75,000 cP、约100,000 cP、约200,000 cP或约300,000 cP。可使用粘度计,如流变仪基于本领域众所周知的技术测量溶液的粘度。
通常,如本文所述的含GnRH的凝胶组合物可包含约0.001至约3.0%重量/重量(w/w)的GnRH或其盐,更通常约0.5-5.0% (w/w)或约0.1-5.0% (w/w)的GnRH或其盐、防腐剂、胶凝剂(即,粘度调节剂)、用以维持约5至约6之间的pH的缓冲剂和用以维持约200至约400 mOsm/kG之间的张度的张度剂。
根据本文描述的任何实施方案,所述含GnRH的凝胶组合物足够粘性以使该组合物保持粘附在靶组织持续足够的时间以递送有效量的GnRH,和/或所述含GnRH的凝胶组合物可能有效,因为该含GnRH的凝胶组合物的粘度与细胞内粘度相似。典型的粘度将取决于诸如,例如GnRH的渗透速率和施加的激素量的因素。合适的胶凝剂包括但不限于,离子和非离子水溶性聚合物;交联的丙烯酸聚合物;亲水聚合物如聚氧化乙烯、聚氧乙烯-聚氧丙烯共聚物和聚乙烯醇;纤维素聚合物和纤维素聚合物衍生物如羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、羟丙基甲基纤维素邻苯二甲酸酯、甲基纤维素、羧甲基纤维素和醚化纤维素;胶(gum)如黄蓍胶和黄原胶;藻酸钠;明胶、透明质酸及其盐、壳聚糖、胞外多糖(gellans)或其任何组合。
所述胶凝剂可为凝胶、糊剂、乳膏、软膏等等的形式。在一个实施方案中,所述含GnRH的凝胶组合物包含激素和凝胶,作为粘度调节剂。在一个实施方案中,所述凝胶为水凝胶、脂质体凝胶(lipogel)或粘性溶胶。在另一个实施方案中,所述凝胶为水凝胶。可使用本领域已知的任何方法,例如,诸如美国专利号6,908,623和7,456,207中描述的那些方法来制备所述凝胶,所述专利通过引用并入本文。特别地,可如本文所述制备所述凝胶。
在本文描述的任何实施方案中,所述胶凝剂(即,粘度调节剂)包含多糖。根据本文描述的组合物,所述多糖可包括,例如,藻酸盐和葡萄糖,诸如糖原、淀粉(例如,直链淀粉和支链淀粉)、纤维素和葡聚糖。所述多糖可为,例如,甲基、乙基或丙基纤维素酯、醚、羟基醚、羟基烷基或羟基酯。为了获得所需的粘度,可使用足量的一种或更多种多糖。通常,约0.25至约10重量%的多糖(基于组合物的总重量)是合意的。在另一个实施方案中,多糖的重量%为约0.25重量%至约3.0重量%、约1.0重量%至约7重量%、约1.0重量%至约4.0重量%、或约1.0重量%至约2.0重量%。在其它实施方案中,多糖的重量%为约0.1%、约0.5%、约0.75%、约0.8%、约0.9%、约1.0%、约1.1%、约1.2%、约1.4%、约1.8%、约2.0%、约5%、约8%、或约10% (全部以重量/重量计)。为了增加组合物的粘度,可与本领域已知的一种或更多种非多糖增粘剂结合来使用所述多糖。可与一种或更多种多糖结合使用的可能的非多糖增粘剂的实例包括黄原胶、藻酸及其盐、硅酸镁铝、糊精、蔗糖及其衍生物,及其混合物。如果存在的话,非多糖增粘剂的量可为约0.1重量%至约10重量%,取决于所需的粘度。
在本文描述的任何实施方案中,所述胶凝剂包含纤维素。如本文所述的纤维素的说明性实施方案包括甲基纤维素、乙基纤维素、羟丙基纤维素、羧甲基纤维素、羟丙基甲基纤维素和羟乙基甲基纤维素。所述纤维素可为纤维素衍生物,优选非离子纤维素酯、醚、羟基醚或羟基酯,或者非离子淀粉衍生物。通常,约0.25重量%至约10重量%的纤维素(基于组合物的总重量)是合意的。在另一个实施方案中,纤维素的重量%为约0.25重量%至约3.0重量%、约0.5重量%至约3.0重量%、约0.5重量%至约4.0重量%、约1.0重量%至约7重量%、约1.0重量%至约4.0重量%、或约1.0重量%至约2.0重量%。在其它实施方案中,纤维素的重量%为约0.1%、约0.5%、约0.75%、约0.8%、约0.9%、约1.0%、约1.1%、约1.2%、约1.4%、约1.8%、约2.0%、约5%、约8%、或约10%(全部以重量/重量计)。如果期望均匀的凝胶,则可添加分散剂如乙醇、山梨醇或甘油,或者可通过tituration、机械混合或搅拌或其组合来分散胶凝剂。
用于所述组合物中的可接受的稳定剂包括L-氨基酸和L-甲硫氨酸。在其它实施方案中,可使用的稳定剂包括,但不限于,多糖如阿拉伯胶、琼脂、藻酸、瓜尔胶和黄蓍胶、明胶、以及合成和半合成聚合物如卡波姆树脂、纤维素醚以及羧甲基甲壳素。所述稳定剂一般为约0.05至约10%、约0.05至约5%、约0.05至约2.0%、约0.05至约1.0%、约0.05至约0.5%、约0.05至约0.2%、约0.1至约5%、约0.1至约10%、约0.1至约20%、约1至约5%、约1至约10%、约1至约20%的量(全部以重量/体积计)。在一个实施方案中,在如本文所述的稳定剂的存在下,所述组合物的贮存期限可为至少12个月、至少18个月或至少24个月。在另一个实施方案中,所述组合物可储存于在约2℃至约8℃范围内的温度下。还可包括惰性载体,如乳糖、淀粉、糊精、磷酸二钙和硫酸钙。在包括稳定剂的一个实施方案中,所述组合物是化学稳定的,并且持续至少三个月保持至少99%纯度、至少99.5%纯度或至少99.7%纯度。
所述张度剂可为非离子或离子的。说明性地,用于所述方法和组合物中的可接受的张度剂包括,例如,离子试剂如氯化钠、氯化钾或平衡盐溶液。根据一个实施方案,张度剂以获得约200-400 mOsm/kG、约220-380 mOsm/kG或约250-340 mOsm/kG之间的张度的量存在。非离子张度剂包括二醇,如甘油、甘露醇、赤藓醇、聚乙二醇、丙二醇;以及糖如蔗糖和右旋糖。张度剂一般为约0.05至约10%、约0.05至约5%、约0.05至约2.0%、约0.05至约1.0%、约0.05至约0.5%、约0.05至约0.2%、约0.1至约5%、约0.1至约10%、约0.1至约20%、0.5至约2.0%、约0.6至约2.0%、约0.5至约1.8%、约0.6至约1.8%、约1.0至约5.0%、约1.0至约10%、或约1.0至约20%的量(全部以重量/体积计)。
在本文描述的任何实施方案中,用于本文描述的组合物中的缓冲剂是本领域技术人员已知为pH缓冲剂或组合物的那些试剂,并且包括,例如乙酸盐、硼酸盐、碳酸盐、柠檬酸盐和磷酸盐缓冲剂,以及各种生物缓冲剂,例如TAPS、N,N-双(2-羟乙基)甘氨酸(Bicine)、三羟甲基氨基甲烷(Tris)、N-三(羟甲基)甲基甘氨酸(Tricine)、HEPES、TES、MOPS、PIPES、二甲胂酸盐(Cacodylate)和MES。其它缓冲剂包括盐酸、氢氧化钠、氧化镁、磷酸一钾、碳酸氢盐、氨、碳酸、柠檬酸钠、柠檬酸、乙酸、磷酸氢二钠、硼砂、硼酸等等。缓冲剂一般为约0.01至约10%、约0.02至约10%、约0.02至约5%、约0.02至约2.0%、约0.02至约1.0%、约0.02至约0.5%、约0.05至约10.0%、约0.05至约1.0%、约0.05至约0.5%、约0.05至约0.2%、约0.1至约5%、约0.1至约10%、约0.1至约20%、约1至约5%、约1至约10%、约1至约20%的量(全部以重量/体积计)。
用于本文描述的含GnRH的凝胶组合物中的缓冲剂可在用以获得期望pH范围所需的任何浓度下使用。例如,缓冲剂可在约0.001 M至约1 M、约0.001 M至约2 M、约0.001 M至约5 M、约0.05 M至约0.1 M、约0.05 M至约0.2 M、约0.05 M至约1 M、0.05 M至约2 M、约0.05至约5 M、约0.1 M至约1 M、约0.1 M至约2 M、约0.1 M至约5 M的浓度下使用。可在本文描述的制剂中使用用以获得期望pH范围所需的任何量的缓冲剂。通常,药学上可接受的缓冲剂可用于提供在约pH 4至约pH 9范围内的pH。本文描述的组合物的pH可在约3至约10、或约4至约9的范围内。在本文描述的任何实施方案中,pH可在约4至约8、约4至约7、约4.5至约6.5、约4.5至约6、约5至约6、约5至约5.5、约4至约6、约4.5至约5.5、或约5.3至5.7的范围内。
在本文描述的任何实施方案中,本文描述的含GnRH的凝胶组合物包含一种或更多种药学上可接受的防腐剂。如本文所使用,术语“防腐剂”包括辅助稳定组合物、抑制微生物生长或两者的试剂或试剂的组合。合适的防腐剂的实例包括对羟基苯甲酸酯(例如,对羟基苯甲酸的甲酯、乙酯、丙酯和丁酯)、没食子酸丙酯、山梨酸及其钠盐和钾盐、丙酸及其钙盐和钠盐、“二噁英(Dioxin)” (6-乙酰氧基-2,4-二甲基-间二噁烷)、“溴硝丙二醇(Bronopol)” (2-溴-2-硝基丙烷-1,3-二醇)和水杨酰替苯胺如二溴水杨酰替苯胺、三溴水杨酰替苯胺、“Cinaryl” 100和200或“Dowicil” 100和200 (1-(3-氯烯丙基-3,5,7-三氮杂-1-氮鎓金刚烷(azanidadamantane)氯化物)的顺式异构体)、六氯酚、苯甲酸钠、柠檬酸、乙二胺四乙酸及其碱金属盐和碱土金属盐、丁基羟基苯甲醚、丁羟甲苯、酚化合物如氯甲酚和溴甲酚以及氯二甲酚和溴二甲酚、季铵化合物如苯扎氯铵、芳族醇如苯乙醇、苄醇等,氯丁醇,喹啉衍生物如碘氯代羟基喹啉(iodochlorohydroxyquinolin)等等。当存在时,防腐剂的总量为约0.005重量%至约2重量%、约0.001重量%至1.0重量%、约0.005重量%至约0.25重量%、或约0.05重量%至约0.2重量%,通常约0.01重量%至约0.1重量% (全部以重量/重量计)。
在本文描述的任何实施方案中,含GnRH的凝胶组合物可包含螯合剂,如本领域技术人员已知的那些,例如,乙二胺四乙酸盐(ethylenediamine tetraacetate, EDTA)、二亚乙基三胺五乙酸(DTPA)和N,N-双(羧甲基)甘氨酸(NTA)、或其盐。含GnRH的凝胶组合物可含有约0.003重量%至约1.0重量%、约0.02重量%至约0.2重量%、约0.01重量%至约1.0重量%、或约0.02重量%至约0.5重量%(全部以重量/体积计)的螯合剂。
在本文描述的任何实施方案中,本文描述的含GnRH的凝胶组合物中可包括抗微生物剂。此类试剂可包括,但不限于5-氯-2-(2,4-二氯苯氧基)-苯酚、8-羟基喹啉、铜II化合物、邻苯二甲酸、氯己定、阿来西定、海克替啶、血根碱、苯扎氯铵、水杨酰替苯胺、溴化度米芬、西吡氯铵、氯化十四烷基吡啶鎓、氯化N-十四烷基-4-乙基吡啶鎓、奥替尼啶、碘、磺胺类、双缩二胍类(bisbiguanide)、酚类化合物、地莫匹醇、辛哌醇、和其它哌啶基衍生物、和烟酸(nicin)制备物、任何合适的抗生素如力百汀、阿莫西林、四环素、强力霉素、米诺环素、甲硝哒唑、新霉素、卡那霉素和克林霉素,和这些化合物中的任何种的任何盐(适用时),以及这些化合物的任何组合。在又一个实施方案中,可包括单独或与上述抗微生物剂中的任何种组合的抗真菌化合物。适合于在本文描述的含GnRH的凝胶组合物中使用的抗真菌剂包括,但不限于,制霉菌素、咪康唑、硝酸益康唑、克霉唑和氟胞嘧啶。可将抗微生物剂或抗真菌剂以约0.01至约10%、约0.01至约5%、约0.01至约2.0%、约0.01至约1.0%、约0.01至约0.5%、约0.01至约0.2%、0.05至约10%、约0.05至约5%、约0.05至约2.0%、约0.05至约1.0%、约0.05至约0.5%、约0.05至约0.2%、约0.1至约5%、约0.1至约10%、约0.1至约20%、约1至约5%、约1至约10%、约1至约20%的量(全部以重量/体积计)加入本文描述的制剂。
在本文描述的任何实施方案中,还可将抗氧化剂加入含GnRH的凝胶组合物。例如,本文使用的抗氧化剂可包括β-胡萝卜素、维生素E、维生素C、维生素A、生育酚、丁基化羟基甲苯、丁基化羟基苯甲醚、叔丁基氢醌、没食子酸丙酯、抗坏血酸、焦亚硫酸钠、尿酸、类胡萝卜素、类黄酮、褪黑激素和乙氧喹。可将抗氧化剂以约0.01至约10%、约0.01至约5%、约0.01至约2.0%、约0.01至约1.0%、约0.01至约0.5%、约0.01至约0.2%、0.05至约10%、约0.05至约5%、约0.05至约2.0%、约0.05至约1.0%、约0.05至约0.5%、约0.05至约0.2%、约0.1至约5%、约0.1至约10%、约0.1至约20%、约1至约5%、约1至约10%、约1至约20%的量(全部以重量/体积计)加入本文描述的制剂。
所述含GnRH的凝胶组合物还可包含合适的固体或凝胶相载体或赋形剂。此类载体或赋形剂的实例包括但不限于碳酸钙、磷酸钙、各种糖、淀粉、纤维素衍生物、明胶和聚合物如聚乙二醇。
如本文所述,含GnRH的凝胶组合物含有在没有发情检测的情况下有效同步猪的授精时间的量的促性腺激素释放激素、或其衍生物或类似物、及其组合。所述激素可为乙酸盐形式。此外,所述激素可为促性腺激素释放激素。如本文所使用,“促性腺激素释放激素” (GnRH)是指任何促性腺激素释放激素,包括促性腺激素释放激素类似物和衍生物,以及促性腺激素释放激素激动剂。在一个实施方案中,所述促性腺激素释放激素可为合成的。在另一个实施方案中,所述促性腺激素释放激素可为pGlu-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-GlyNH2(参见,例如美国专利号5,688,506,其通过引用并入本文)或曲普瑞林。
用于本文的促性腺激素释放激素的实例包括,但不限于,亮丙立德(leuprolide)、那法瑞林、布舍瑞林、[DAla6, 去Gly-NH210]GnRH、[DLys6]GnRH、[DAla6]GnRH、[2-Me-Ala6]GnRH、[D-α-氨基丁酰基6, 去-GlyNH210]GnRH、曲普瑞林、黄体瑞林、戈舍瑞林、地洛瑞林和组氨瑞林。一般而言,促性腺激素释放激素模仿天然促性腺激素释放激素十肽,通常在位置6和10处具有特定氨基酸取代而塑造的。曲普瑞林是仅在位置6处具有单一取代的促性腺激素释放激素的实例。
在本文描述的任何实施方案中,可使用具有式(I)的促性腺激素释放激素
(I)
或其溶剂化物、水合物,或药学上可接受的盐,其中
R1和R2在各种情况下独立地为氢,或独立地选自烷基、杂烷基、环烷基、杂环烷基、卤代烷基、芳基、杂芳基、芳基烷基和杂芳基烷基,其各自任选被取代,或者R1和R2和所连接的碳形成碳环或杂环;
R5为氢或烷基;以及
X为氢,或X选自烷基、环烷基、杂烷基、任选取代的亚烷基-甲酰胺和HNC(O)NR3R4,其中R3和R4在各种情况下独立地选自氢、烷基、杂烷基和卤代烷基。
在另一个实施方案中,R1为亚甲基-芳基。在另一个实施方案中,所述芳基是苯基或4-羟苯基。在另一个实施方案中,R1为亚甲基-杂芳基。在又一个实施方案中,所述杂芳基选自吡啶基、噻唑基、磺胺吡啶基(pyridazolyl)、嘧啶基、喹啉基、吡唑基、咪唑基、吡咯基、吲哚基、苯并吡唑基和苯并咪唑基;并且R2为氢或甲基。在各种其它实施方案中,R1为2-甲基丙基,R1为2-萘基甲基,R1为叔丁氧基甲基,R1为甲基,R1为4-氨基丁基,R1为乙基,R1和R2为甲基,R1为1H-吲哚-3-基-甲基,R1为1H-1-苄基-咪唑-4-基-甲基,或者R1为苄基。
在另外的实施方案中,R2为氢,R2为氢并且所述促性腺激素释放激素在R1所连接的碳处具有R-构型,R2为氢并且所述促性腺激素释放激素在R1所连接的碳处具有S-构型,或者R2为氢并且所述促性腺激素释放激素为在R1所连接的碳处具有R-构型和在R1所连接的碳处具有S-构型的促性腺激素释放激素的混合物。
在还有另外的实施方案中,X为CH2(CO)NH2,X为HN(CO)NH2,X为乙基,X为氢,R5为氢,或R5为甲基。
在另一个实施方案中,所述促性腺激素释放激素为具有式I的激素,其中R1为1H-吲哚-3-基-甲基,R2为氢,X为CH2(CO)NH2;R5为氢;并且R1所连接的碳的构型为R。
在另一个实施方案中,所述促性腺激素释放激素为具有式I的激素,其中R1为氢,R2为氢,X为CH2(CO)NH2;并且R5为氢。
在另一个实施方案中,所述促性腺激素释放激素为具有式I的激素,其中R1为1H-1-苄基-咪唑-4-基-甲基,R2为氢,X为乙基;并且R5为氢。
在另一个实施方案中,所述促性腺激素释放激素为具有式I的激素,其中R1为2-甲基丙基,R2为氢,X为乙基;并且R5为氢。
在又一个实施方案中,提供其中X为CH2C(O)NH2的先前描述的实施方案中的任一个。
在另一个实施方案中,所述促性腺激素释放激素为具有式I的激素,其中R1为2-萘基甲基,R2为氢,X为CH2(CO)NH2;并且R5为氢。
在另一个实施方案中,所述促性腺激素释放激素为具有式I的激素,其中R1为叔丁氧基甲基,R2为氢,X为乙基;R5为氢;并且R1所连接的碳的构型为R。
在另一个实施方案中,所述促性腺激素释放激素为具有式I的激素,其中R1为苄基,R2为氢,X为CH2(CO)NH2;R5为氢;并且R1所连接的碳的构型为R。
在另一个实施方案中,所述促性腺激素释放激素为具有式I的激素,其中R1为叔丁氧基甲基,R2为氢,X为HN(CO)NH2;并且R5为氢。
在另一个实施方案中,所述促性腺激素释放激素为具有式I的激素,其中R1为1H-吲哚-3-基-甲基,R2为氢,X为乙基;并且R5为氢。
在另一个实施方案中,所述促性腺激素释放激素为具有式I的激素,其中R1为甲基,R2为氢,X为氢;R5为氢;并且R1所连接的碳的构型为R。
在另一个实施方案中,所述促性腺激素释放激素为具有式I的激素,其中R1为1H-吲哚-3-基-甲基,R2为氢,X为乙基;R5为甲基;并且R1所连接的碳的构型为R。
在另一个实施方案中,所述促性腺激素释放激素为具有式I的激素,其中R1为甲基,R2为氢,X为CH2(CO)NH2;R5为氢;并且R1所连接的碳的构型为R。
本文中所使用的促性腺激素释放激素及其类似物(诸如上式中所描述的类似物)可以药学上可接受的无毒盐或复合物的形式施用。所述盐包括酸加成盐,诸如,例如盐酸盐、氢溴酸盐、硫酸盐、磷酸盐、硝酸盐、草酸盐、富马酸盐、葡糖酸盐、鞣酸盐、马来酸盐、乙酸盐、苯甲酸盐、琥珀酸盐、藻酸盐、苹果酸盐、抗坏血酸盐、酒石酸盐等等。所述复合物可具有金属诸如,例如锌、钡、钙、镁、铝等等。
根据本文描述的方法和组合物中使用的GnRH的有效量取决于许多参数,包括激素的分子量、其施用途径及其是否呈其天然形式。
在一个实施方案中,对本文描述的方法的改进包括使用反向运动混合器和批料冷却的作为最终复合方法步骤的另一混合步骤。在另一个实施方案中,在已添加所有化学组分并于初级复合相中混合之后,将该初级复合批料转移至具有反向运动混合能力的容器,在无源真空下混合,并然后用冷冻水冷却至15℃或以下。在又一个说明性方面,将所述批料储存于冷藏(2℃至8℃)中至少24小时直至准备好包装。
在另一个实施方案中,对于500 kg批料而言,最终混合步骤可在具有反向运动混合器的圆底、带夹套的、不锈钢1500 L压力/真空釜中进行。在又一个实施方案中,用冷冻水冷却至15℃或以下之后,将所述批料随后转移至作为最终的保持釜的圆底、带夹套的、不锈钢700 L釜,用于在冷藏(2℃至8℃)中保持至少24小时直至准备好包装。
在又一个说明性实施方案中,对于500 kg批料而言,为了混合提供初级复合批料的初级复合相,用于圆底、带夹套的、不锈钢700 L釜的分散搅拌机(dispersator)叶片可为14英寸分散搅拌机叶片,以更充分混合较大体积的产品,并且归因于产品的较大体积,可使用泵将对羟基苯甲酸酯相转移至最终复合相。
在另一个说明性方面,在如本文所述的最终复合相中,归因于较大的批料大小,额外的混合和冷却提供充分的混合和足够的时间来冷却所述批料并水合甲基纤维素。在另一个实施方案中,无源真空辅助对产品进行除气。在另一个说明性实施方案中,如由用改进方法制造的500 kg批料的稳定性数据所证明,额外的混合和冷却已显示出对药物产品的特性、强度、品质、纯度或效力不具有不利影响。如本文所使用,无源真空是当将容器排空至指定设置水平时所获得的压力,然后关闭真空泵直至或除非真空水平接近下规定限,此时打开泵以重新建立真空的设置水平。真空的设置水平可为,例如,约12英寸的汞,其中下规定限例如为约0英寸的汞。
在又一个实施方案中,在制造后,可将所述的含GnRH的凝胶组合物包装在例如玻璃瓶的主容器中,该玻璃瓶如具有橡胶塞和/或铝可撕开密封(tear-off seal)的琥珀色玻璃瓶。在另一个实施方案中,所述主容器可为塑料的或铝的,并且该主容器可被密封。在另一个实施方案中,可将所述主容器容纳在第二容器内,以进一步保护组合物免受光。所述第二容器可为例如纸板箱。
实施例
实施例
用于含GnRH的药物产品的建议制造方法概述于图1A中。较小规模的方法描述于WO 2010/124220 A1中。在图1A中,(**)表示步骤的改进。对于在表1-4中作为“未限定”列出的建议方法的某些值而言,参见下文中实施例1的值。
可行性实施例
500 KG药物产品制造方法
使用与图1A中概述的方法相似的制造方法制备了曲普瑞林凝胶,100 μg/mL的商业规模的可行性批料。将该批料转移以储存在不锈钢储存容器中。相对于以下规格对所述批料进行初步(0时间)测试和散装保持在室温下之后的测试。
粘度(250-400 cps)
曲普瑞林(90%-110% L,L=0.010% w/v) L=标示量
对羟基苯甲酸甲酯(钠盐) (80%-120% F,F=0.089% w/v) F=配方
对羟基苯甲酸丙酯(钠盐) (80%-120% F,F=0.010% w/v) F=配方
为了均匀性测试,在以下位置处从散装容器中取出样品,所述位置如图1中所示:TE 0°、TE 180°、TC、ME 0°、MC和B。
在0时间(初始时间),测试了来自顶部、中部和底部样品位置的粘度结果,并且在以下规格内:
粘度(250-400 cps)
T 385
M 356
B 345
曲普瑞林的结果并未满足规格。
使可行性批料在室温下经受散装保持研究,报道以下结果:
。
下文实施例包括以下改变中的一种或更多种,反映于图1B中:在初级复合相中,改进设备以在初级复合相中实现轻微增加(从12英寸至14英寸)。使用传送泵将对羟基苯甲酸酯相添加至最终复合相中的搅拌混合物。在转移前使批料冷却至15℃或以下。在转移后将批料保持在冷藏中至少24小时。
实施例1
改进的商业500 KG药物产品制造方法的描述
描述了作为最初用以提供安慰剂制剂的用于含GnRH的药物产品的改善的(改进的)制造方法。该方法例示表1和表2中省略的“建议方法”的时间和混合速度,而添加表3的第一CMM步骤,另外它提供用于表4的产品转移至保持步骤的混合速度。
通过pH检查相和以产品转移至保持于图1B中概述该改进方法。在图1B中,(**)表示步骤的改进,并且(*)表示新步骤。对羟基苯甲酸酯相、初级复合相、最终复合相、pH调节相和转移/过滤至保持相在阻挡或不发射UV-A、UV-B和UV-C波长的照明下进行,因为原料药(drug substance)应受保护免受光。保护散装产品免受光,并且在复合后和直至需要包装前将其储存于冷藏室中。下文提供所述相的描述。
对羟基苯甲酸酯相:在装有大约245 kg纯净水USP/EP的700 L圆底、带夹套的、不锈钢釜中制备对羟基苯甲酸酯相。将此置于具有10英寸标准溶解器叶片的60 HP溶解器下方。将该相在420 RPM下混合,同时添加对羟基苯甲酸甲酯钠盐(445 g)和对羟基苯甲酸丙酯钠盐(50.0 g)。在420 RPM下继续混合5分钟。添加氯化钠USP (4.51 kg)并在450 RPM下继续混合5分钟。向该批料添加L-甲硫氨酸USP (495 g)并在450 RPM下继续混合5分钟。添加柠檬酸钠USP (920 g)并在450 RPM下混合该相10分钟。
初级复合相:在装有219 kg纯净水USP/EP的700 L圆底、带夹套的、不锈钢釜中制备初级复合相。将此置于具有14英寸分散器叶片的60 HP溶解器下方。在383 RPM下混合该相,同时添加柠檬酸USP (345 g)。在383 RPM下继续混合5分钟。对于安慰剂而言,省略乙酸曲普瑞林;否则添加大约50.0 g乙酸曲普瑞林(针对效力调节)。在此之后用纯净水USP/EP (1000 g)冲洗乙酸曲普瑞林容器。在300-400 RPM下继续混合10-20分钟。使用60 GPM传送泵将对羟基苯甲酸酯相转移到初级复合相中。在此之后用纯净水USP/EP (7.50 kg)冲洗。在383 RPM下继续混合5分钟。将大约6.00 kg甲基纤维素USP (针对粘度调节)伴随在383至505 RPM下的混合缓慢加入该批料。在505 RPM下继续混合15分钟。
最终复合相:用反向运动混合(CMM)将药物产品转移至1500 L圆底、带夹套的、不锈钢压力/真空釜以获得最终复合相。通过无源真空将该批料转移至最终复合釜内。在此之后是使用无源真空的10.0 kg纯净水USP/EP冲洗同时在12 RPM下混合CMM。将该批料在无源真空下并用在15 RPM下的CMM混合60-90分钟。取出样品用于过程中的pH检查(规格范围:5.3-5.7)。如果不需调节,则将5.00 kg纯净水USP/EP加入该批料,并且在无源真空下、以15 RPM下CMM继续混合70分钟。
pH检查相:如果需要pH调节,则将所需量的柠檬酸USP溶解于以上5.00 kg纯净水USP/EP中,之后将其加入该批料。
转移/保持:在批料调和之后,伴随10 RPM下的CMM并使用具有带60目筛的1-ft筒式过滤器(canister filter)的60 GPM传送泵将该批料转移到700 L圆底、不锈钢釜内。在填充前对散装药物产品进行取样和测试。
实施例2
改进的商业500 KG药物产品制造方法的描述
描述了用于含GnRH的药物产品的改善的(改进的)制造方法。所述改进的方法概述于图1B中。较小规模的方法描述于WO 2010/124220 A1中。在图1B中,(**)表示步骤的改进,并且(*)表示新步骤。对羟基苯甲酸酯相、初级复合相、最终复合相、pH调节相和转移/过滤至保持相在阻挡或不发射UV-A、UV-B和UV-C波长的照明下进行,因为原料药应受保护免受光。保护散装产品免受光,并且在复合后和直至需要包装前将其储存于冷藏室中。下文提供所述相的描述。
对羟基苯甲酸酯相:在装有大约245 kg纯净水USP/EP的700 L圆底、带夹套的、不锈钢釜中制备对羟基苯甲酸酯相。将此置于具有10英寸标准溶解器叶片的60 HP溶解器下方。将该相在525-575 RPM下混合,同时添加对羟基苯甲酸甲酯钠盐(445 g)和对羟基苯甲酸丙酯钠盐(50.0 g)。在525-575 RPM下继续混合5-10分钟。添加氯化钠USP (4.51 kg)并在525-575 RPM下继续混合10-15分钟。向该批料中添加L-甲硫氨酸USP (495 g)并在525-575 RPM下继续混合5-10分钟。添加柠檬酸钠USP (920 g)并在525-575 RPM下混合该相10-20分钟。
初级复合相:在装有219 kg纯净水USP/EP的700 L圆底、带夹套的、不锈钢釜中制备初级复合相。将此置于具有14英寸分散器叶片的60 HP溶解器下方。在300-400 RPM下混合该相,同时添加柠檬酸USP (345 g)。在300-400 RPM下继续混合5-10分钟。添加大约50.0 g乙酸曲普瑞林(针对效力调节)。在此之后用纯净水USP/EP (1000 g)冲洗乙酸曲普瑞林容器。在300-400 RPM下继续混合10-20分钟。使用60 GPM传送泵将对羟基苯甲酸酯相转移到初级复合相中。在此之后用纯净水USP/EP (7.50 kg)冲洗。在300-400 RPM下继续混合5-10分钟。将大约6.00 kg甲基纤维素USP (针对粘度调节)缓慢加入该批料。在450-570 RPM下继续混合30-60分钟。
最终复合相:用反向运动混合(CMM)将药物产品转移至1500 L圆底、带夹套的、不锈钢压力/真空釜以获得最终复合相。通过无源真空将该批料转移到最终复合釜内。在此之后是使用无源真空的10.0 kg纯净水USP/EP冲洗同时在12 RPM下混合CMM。将该批料在无源真空下并用15 RPM下的CMM混合90-100分钟。取出样品用于过程中的pH检查(规格范围:5.3-5.7)。如果不需调节,则将5.00 kg纯净水USP/EP加入该批料,并且在无源真空下、以15 RPM下CMM和用冷冻水冷却至15℃或以下继续混合70-80分钟。
pH检查相:如果需要pH调节,则将所需量的柠檬酸USP溶解于以上5.00 kg纯净水USP/EP中,之后将其加入该批料。一旦完成冷却,如果需要pH调节,则取出样品用于最终pH检查。
转移/保持:在批料调和之后,伴随10 RPM下的CMM并使用具有带60目筛的1-ft筒式过滤器的60 GPM传送泵将该批料转移到700 L圆底、不锈钢釜内。将此储存于冷藏室中至少24小时,之后取样用于初步测试。从保持釜的各顶部、中部和底部收集样品用于测试。将样品和批料放回冷藏室。在填充前对散装药物产品进行取样和测试。
根据以上方案的500 kg规模的安慰剂(无活性剂)和活性剂的开发批料以及500 kg规模的工艺验证研究的散装保持报告满足产品规格,而不缺乏稳定性或均匀性,如下表中所展示,该表显示在保持于环境温度下之后,从最终保持釜转移至较小不锈钢容器(在保持于冷藏室中至少24小时之后)并如图2中所示进行取样的部分的结果:
曲普瑞林凝胶安慰剂
(70 L圆底带夹套釜中大约50 kg凝胶)
。
曲普瑞林凝胶100 μg/mL
(30 L圆底带夹套釜中大约20 kg凝胶)
。
曲普瑞林凝胶100 μg/mL
(70 L圆不锈钢储存容器中大约60 kg凝胶)
在第0、7、21和30天批料EMCR的曲普瑞林、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的测定结果示于下文并分别示于图3、图4和图5中。(因在复合区域中进行设施工作而未取出第14天样品。该区域被封闭并限制进入。)
曲普瑞林凝胶100 μg/mL
(70 L圆不锈钢储存容器中大约50 kg凝胶)
在第0、7、14、21和30天批料FECC的曲普瑞林、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的测定结果示于下文并分别示于图6、图7和图8中。
第0天
7)第0天结果是工艺验证初步取样结果
8)薄透明至稍混浊凝胶
9) Brookfield流变仪 型号DV-III,CP-40锭子,在5 RPM、25℃下。
第7天
11)薄透明至稍混浊凝胶
12) Brookfield流变仪 型号DV-III,CP-40锭子,在5 RPM、25℃下。
第14天
13)未取出样品,参见上文
14)薄透明至稍混浊凝胶
15) Brookfield流变仪 型号DV-III,CP-40锭子,在5 RPM、25℃下。
第21天
16)薄透明至稍混浊凝胶
17) Brookfield流变仪 型号DV-III,CP-40锭子,在5 RPM、25℃下。
第30天
18)薄透明至稍混浊凝胶
19) Brookfield流变仪 型号DV-III,CP-40锭子,在5 RPM、25℃下。
实施例
用于500 KG商业批料大小(OVUGEL™,曲普瑞林凝胶100 µG/ML)的制造方法和方法对照的描述
将用于曲普瑞林凝胶的500 kg商业批料大小的制造方法如上文实施例2中所述进行改进。所述改进虑及制备具有对于额外混合和冷却的需求的较大批料大小。在制剂、规格、方法、原材料或制造地点上不存在变化。批料的初步(散装)、释放和稳定性数据表明改进的制造方法对药物产品的特性、强度、品质、纯度或效力不存在不利影响。
对方法的改进包括使用反向运动混合器和批料冷却的作为最终复合方法步骤的另一混合步骤。在添加了所有化学组分并在初级复合相中混合之后,将批料转移至具有反向运动混合能力的容器,在无源真空下混合,并然后用冷冻水冷却至15℃或以下。然后,将该批料转移至700 L容器。将该批料储存于冷藏(2℃至8℃)中至少24小时直至准备好包装。另外,将用于初级复合相的分散搅拌机叶片的尺寸增加至14英寸分散搅拌机叶片,以更充分地混合较大体积的产品,并且由于产品的较大体积,使用泵将对羟基苯甲酸酯相转移至最终复合相。由于较大的批料大小,额外的混合和冷却提供充分的混合和足够的时间来冷却该批料并水合甲基纤维素。无源真空辅助对产品进行除气。
如由用修正方法制造的两种500 kg批料的稳定性数据所证明,额外的混合和冷却步骤已显示出对药物产品的特性、强度、品质、纯度或效力不具有不利影响。
建议的500 kg药物产品制造方法和改进的500 kg商业方法的方法和设备比较提供在表1-4中。
表1.方法和设备比较:对羟基苯甲酸酯相
。
表2.方法和设备比较:初级复合相
表3.方法和设备比较:最终复合相
。
表4.方法和设备比较:转移和保持
。
- 还没有人留言评论。精彩留言会获得点赞!