本发明涉及生物医学
技术领域:
,尤其涉及一种靶向载体、靶向药物及靶向药物的应用、靶向探针及靶向探针的应用。
背景技术:
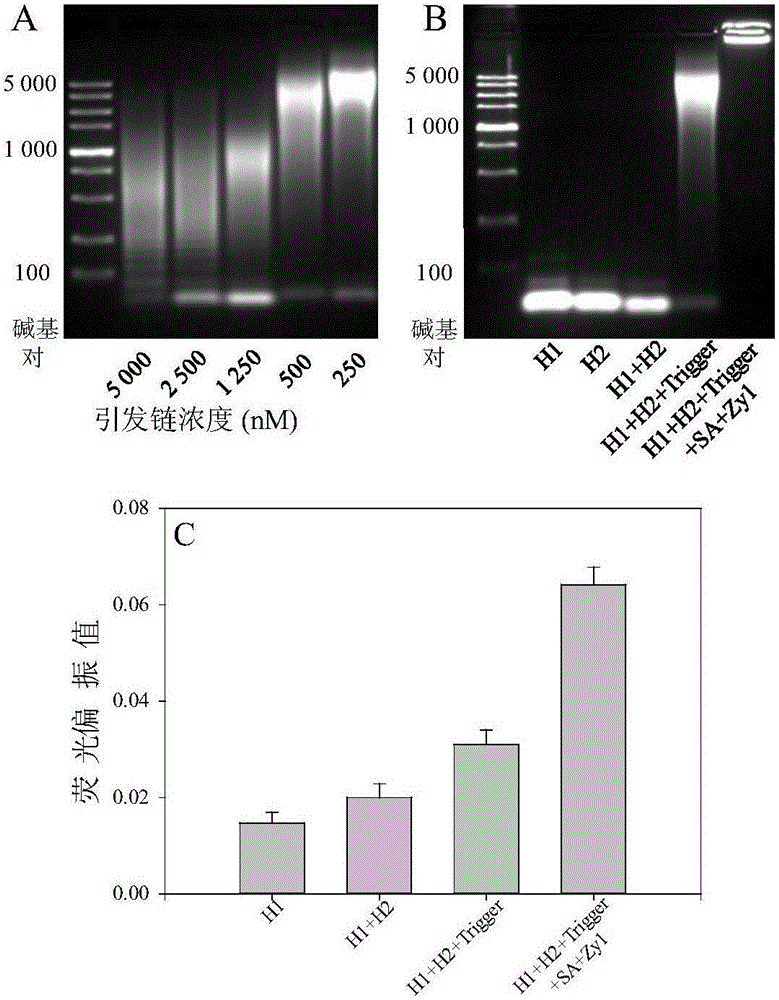
:癌症由于其易转移、可转化和无限增殖等特性,成为人类最可怕的疾病之一。统计显示2012年新增癌症患者1400万人并有820万人死亡,估计到2025年新增癌症患者将达到1900万人,全球癌症发病形势严峻,发病率和死亡率一直呈上升趋势。有效的改善诊断技术和治疗方法成为减少癌症发病率,降低死亡率的迫切需要。改善癌症的诊断,能够极早的发现癌症的早期患者并进行治疗,从而减轻患者痛苦和精神、经济负担,使癌症患者早日康复,开发一种能够灵敏检测癌症的技术方法成为提高医疗水平至关重要的一个部分。癌症治疗中常用方法的包括辐射治疗、外科手术切除和化疗。化疗作为一种全身性治疗方法被广泛的应用,尤其是当肿瘤发展到中晚期或者出现转移,辐射治疗和外科手术切除治疗方法存在明显的不足,化疗甚至成为唯一可行的治疗方法。但是化疗药物缺乏靶向性,在杀死肿瘤细胞的同时会对健康的组织和细胞造成损害,其次化疗药物由于稳定性差,溶解度低,容易引发多药耐药性等问题。因此,选择合适的载体将影像试剂或者化疗药物运输到靶细胞,对于提高肿瘤的诊断和治疗具有十分重要的意义。随着纳米技术的发展,不同类型的靶向载体(如聚合物、无机材料等)已经广泛的应用于肿瘤的诊断和治疗,然而这些载体需要高复杂的设计、专业的合成技术以及需要长时间的准备;其次,很多含金属或者硅成分的材料本身生物相容性差,聚合物材料在生物体内很难降解,不断聚集表现出毒性;最后,这些载体由于低的靶向效率,使得聚积在肿瘤细胞内部的化疗药物和影像试剂的达不到有效的浓度,用于肿瘤的诊断和治疗效果仍然不够理想。因此,发展一种高装载容量、高靶向能力、有效细胞内化以及良好生物相容性的载体能够克服以上问题,显著提高在临床的应用价值。生物分子因其良好的生物相容性好、生物可降解性、易设计易合成易修饰等优点成为广泛应用的载体构建材料。在靶向运输中,主动靶向能通过载体上的配体与靶细胞表面的受体特异结合,将生物成像剂和药物分子运输到靶细胞表面,并长时间保留在靶细胞,从而在靶细胞上达到高浓度的富集。能够显著的提高诊断的灵敏度,提高了药效、降低毒性,从而受得了研究者的广泛关注。靶向运输的关键是提高载体与靶细胞的特异性结合能力,这依赖于配体的高亲和力、高选择的结合,而获取高性能的配体是非常困难的工作。因此,在现在配体基础上,提高载体的特异性结合能力,对于临床上的癌症高灵敏诊断和治疗具有重要的意义。常用的配体包括抗体、叶酸和核酸适配体等,核酸适配体(Aptamer)是一段寡聚核苷酸,具有易筛选、易合成、易修饰、高亲和力、高生物相容性和生物可降解性等优点,并能高效、特异性地与靶分子结合。核酸适配体结合到载药骨架上时,由于两者形成了高分子量的复合物,会显著的降低核酸适配体的结合能力,从而影响结合能力。现有技术将核酸适配体用于靶向治疗,存在一系列缺陷,譬如载药量低、结合能力弱、需复杂的有机反应、反应产率低、稳定性差和化学修饰成本高。这些缺陷阻碍了它们在临床上的应用。技术实现要素:本发明要解决的技术问题是克服现有技术的不足,利用多价结合效应,将多倍的核酸适配体连接在纳米骨架上,形成的多价载体显著的提高了靶向结合能力和细胞内化效果,从而提供一种载药量高、具有很好的生物相容性和生物可降解性、稳定性好的靶向载体;还提供了一种靶向药物,对靶细胞的杀伤性强、对非靶细胞杀伤性小、副作用小,可作为癌症的治疗药物。本发明还提供了一种靶向探针,可用于癌症的靶向检测,检测效率高。为解决上述技术问题,提供了一种靶向载体,所述靶向载体包括双链多聚核糖核酸和配体;所述配体通过连接器连接在所述双链多聚核糖核酸上;所述双链多聚核糖核酸由核酸单体H1和核酸单体H2通过引发链引发后交替杂交形成,所述核酸单体H1的序列为SEDIDNO.1所示的序列,所述核酸单体H2的序列为SEDIDNO.2所示的序列。上述的靶向载体,优选的,所述核酸单体H1为生物素修饰的核酸单体H1,所述核酸单体H2为生物素修饰的核酸单体H2,所述配体为生物素修饰的配体,所述连接器为链霉亲和素;所述引发链的序列为SEDIDNO.3所示的序列。进一步优选的,所述核酸单体H1为FITC修饰的核酸单体H1,所述核酸单体H2为FITC修饰的核酸单体H2,所述配体为FITC修饰的配体。上述的靶向载体,优选的,所述配体为Zy1,所述Zy1的序列为SEDIDNO.4所示的序列。上述的靶向载体,优选的,所述生物素为Biotin。上述的靶向载体,优选的,所述引发链的浓度为250nM~5000nM;所述核酸单体H1的浓度为25μM;所述核酸单体H2的浓度为25μM。上述的靶向载体,优选的,所述引发链、核酸单体H1和核酸单体H2的浓度比为1~20∶100∶100。进一步优选的,所述引发链、核酸单体H1和核酸单体H2的浓度比为1∶100∶100。上述的靶向载体,优选的,所述配体的浓度为0.25μM~50μM。进一步优选的,所述配体的浓度为50μM。作为一个总的技术构思,本发明还提供了一种的靶向药物,包括上述的靶向载体和药物分子,所述药物分子通过共价修饰或非共价结合装载于所述靶向载体上。上述的靶向药物,优选的,所述药物分子为阿霉素。2μM阿霉素可装载在4nM的载体上,每个载体的最大药物装载量为500个药物分子。作为一个总的技术构思,本发明还提供了上述靶向药物在制备肿瘤药物中的应用。作为一个总的技术构思,本发明还提供了一种靶向探针,包括上述的靶向载体和生物成像剂,所述生物成像剂通过共价修饰或非共价结合装载于所述靶向载体上。上述的靶向探针,优选的,所述生物成像剂为荧光分子或SYBRGreenI。所述荧光分子通过共价修饰装载于所述靶向载体上。所述SYBRGreenI通过非共价结合装载与靶向载体上。1倍浓度的SYBRGreenI可装载在5nM载体上。作为一个总的技术构思,本发明还提供了一种上述的靶向探针制备肿瘤成像和癌细胞靶向检测的检测试剂盒和制备用于治疗肿瘤药物中的应用。与现有技术相比,本发明的优点在于:(1)本发明提供了一种靶向载体,现有载药体存在载药量低、复杂的合成步骤、反应产率低、化学修饰成本高、与靶细胞结合成立弱、选择性差、内化效果不明显等缺点。为了克服以上的不足,本发明利用自组装的方法,将生物素化的核酸、引发链、生物素化的核酸适配体以及链霉亲和素组装成具有靶向能力的运输载体。生物素化的核酸在引发链的触发下形成一系列长度可调的双链多聚核糖核酸,更长的双链多聚核糖核酸理论上应用更多的装载位点,从而实现更高的装载容量,同时,还可以结合多倍的生物素化的核酸适配体,多倍的配体能够显著的增强了多价结合效应,从而极大的提高了载体的靶向识别能力,实现更强的靶细胞结合能力,并且极大的促进细胞的内化,对于提高肿瘤的成像和治疗具有明显的效果。这种长度可调、配体数目可调的靶向载体,在临床上有着广泛的应用。(2)本发明提供了一种靶向载体,通过自组装的方法构建长链的结构,只需要按预先的设计投入反应物就能自发的进行组装,避免了复杂的合成步骤、专业的合成知识和有机溶剂的使用;其次,构建的材料是DNA,链霉亲和素等生物材料,由于他们良好的生物相容性和可降解性使得所制备的纳米蜈蚣也具有高生物相容性和生物可降解性。(3)本发明提供了一种靶向载体,由于生物材料的降解性,其作为载体很容易被血液中的酶降解,从而失去载体的功能。本发明经过灵巧的设计,获得了具有很好的抗酶切能力的靶向载体,并且在模拟的生理环境下没有失去选择性,稳定性好。(4)本发明提供了一种靶向载体,可由不同种类的核酸制备而成,可利用能特异识别不同疾病细胞的核酸适配体制备从而实现个性化治疗,可用于运输多种多样的生物成像剂或者药物分子,具有很高的普适性。(5)本发明提供了一种靶向药物,包括靶向载体和药物,靶向载体具有很长的躯干可以用来通过非共价结合的方式,实现在靶向载体上装载药物分子。本发明利用药物与双链DNA之间的特异结合,在靶向载体的躯干上设计了很多的结合位点,从而使得很长的纳米蜈蚣结构上可以结合很多药物分子。结合了药物的靶向载体,可用于癌细胞的靶向治疗。本发明的靶向载体利用可调的纳米蜈蚣长度和配体数目,获得了一系列的与靶细胞具体强结合能力的载体,具有很大的载药量。同时本发明的靶向药物具有对靶细胞的特异毒性,而对非靶细胞的杀伤性则较少,从而提高了在非靶细胞中药物的最大耐受浓度;降低了在健康细胞或组织药物的毒性,从而减少了副作用并提高了治疗效果。(6)本发明提供了一种靶向探针,包括靶向载体和生物成像剂,可用于癌细胞的靶向检测。附图说明为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整的描述。图1为本发明实施例1的靶向载体合成示意图。图2为本发明实施例1的靶向载体表征结果图;其中图2A为不同浓度的引发链与核酸单体H1、核酸单体H2形成的双链多聚核糖核酸的琼脂糖凝胶电泳分析结果;图2B为形成靶向载体后琼脂糖电泳分析结果;图2C为通过荧光偏振对所产生的靶向载体的表征图。图3为采用琼脂糖凝胶电泳分析本发明实施例1的靶向载体在酶中的稳定性结果图。图4为采用流式细胞术表征本发明实施例1的靶向载体对靶细胞强的结合能力结果图;图4A为靶向载体的长度对结合能力的影响结果;图4B为靶向载体上Zy1条数对结合能力的影响结果。图5为流式细胞术表征Zy1对靶细胞强的结合能力结果图。图6为流式细胞术分析本发明的实施例4的靶向探针对靶细胞的选择性;图6A为4℃下结合缓冲液中靶向探针对靶细胞识别的流式细胞术分析图;图6B为4℃下结合缓冲液中靶向探针对非靶细胞识别的流式细胞术分析图;图6C为37℃下结合缓冲液中的靶向探针对靶细胞识别的流式细胞术分析图;图6D为37℃下结合缓冲液中的靶向探针对非靶细胞识别的流式细胞术分析图;图6E为37℃下细胞培养基中的靶向探针对靶细胞识别的流式细胞术分析图;图6F为37℃下细胞培养基中的靶向探针对非靶细胞识别的流式细胞术分析图。图7为本发明实施例6的靶向探针的激光共聚焦成像分析图;图7A为靶向探针孵育的细胞荧光强度;图7B为Zy1孵育的细胞荧光强度。图8为本发明实施例7中不同价的靶向探针的激光共聚焦成像分析图。图9为本发明实施例9中的靶向药物的荧光光谱分析图。图10为本发明实施例10中的靶向药物的激光扫描共聚焦显微镜成像图;包括靶细胞经靶向载体运载的药物处理图;靶细胞经游离药物处理图;非靶细胞经靶向载体运载的药物处理图;非靶细胞经游离药物处理图。图11为本发明实施例11的靶向药物MTT实验图谱,图11A为靶向药物对靶细胞的作用结果;图11B为靶向药物对非靶细胞的作用结果;图11C为靶向药物本身的MTT结果。具体实施方式以下结合说明书附图和具体优选的实施例对本发明作进一步描述,但并不因此而限制本发明的保护范围。实施例以下实施例中所采用的材料和仪器均为市售。实施例1一种本发明的靶向载体,参见图1,包括双链多聚核糖核酸和Zy1;Zy1通过链霉亲和素连接在双链多聚核糖核酸上形成“纳米蜈蚣”;其中双链多聚核糖核酸由生物素标记的核酸单体H1和生物素标记的核酸单体H2通过引发链引发后交替杂交形成“纳米蜈蚣”的躯干;躯干的两侧接有特异性识别靶向细胞的生物素标记的Zy1,形成“纳米蜈蚣”的脚。核酸单体H1的序列为表1中SEDIDNO.1所示的DNA序列,核酸单体H2的序列为表1中SEDIDNO.2所示的DNA序列,引发链的序列为表1中SEDIDNO.3所示的DNA序列,Zy1的序列为表1中SEDIDNO.4所示的DNA序列。从图1中可以看出:“纳米蜈蚣”由“躯干”和“脚”两部分组成,“纳米蜈蚣”的“躯干”经过设计,可以装载化疗药物和生物成像剂,它的“脚”位于“躯干”的两侧是能选择性识别靶向疾病细胞或组织的核酸适配体,连接器可以方便的将脚连接到躯干上。表1分别为核酸单体H1、FITC标记的H1、核酸单体H2、FITC标记的H2、引发链、Zy1、FITC标记的Zy-1的DNA序列。表一:DNA序列探针序列核酸单体H15’-Biotin-CGTCGTGCAGCAGCAGCAGCAGCAACGGCTTGCTGCTGCTGCTGCTGC-3’(SEDIDNO.1)FITC标记的H15’-Biotin-CGTCGTGCAGCAGCAGCAGCAGCAACGGCTTGCTGCTGCTGCTGCTGC-FITC-3’核酸单体H25’-Biotin-TGCTGCTGCTGCTGCTGCACGACGGCAGCAGCAGCAGCAGCAAGCCGT-3’(SEDIDNO.2)FITC标记的H25’-Biotin-TGCTGCTGCTGCTGCTGCACGACGGCAGCAGCAGCAGCAGCAAGCCGT-FITC-3’引发链5’-TGCTGCTGCTGCTGCTGCACGACG-3’(SEDIDNO.3)Zy15’-ACGCGCGCGCGCATAGCGCGCTGAGCTGAAGATCGTACCGTGAGCGCGT(T)10-Biotin-3’(SEDIDNO.4)FITC标记的Zy-15’-FITC-ACGCGCGCGCGCATAGCGCGCTGAGCTGAAGATCGTACCGTGAGCGCGT(T)10-Biotin-3’一种实施例1的靶向载体的制备方法,包括以下步骤:(1)在磷酸缓冲液(磷酸缓冲液的成分为:10mMphosphatebuffer,137mMNaCl,2.7mMKCl,pH7.4,全文中磷酸缓冲液的成分均一致)中,将25μM的核酸单体H1和25μM的核酸单体H2混合物混合,分别与5000nM,2500nM,1250nM,500nM,250nM的引发链置于室温,反应24小时,得到双链多聚核糖核酸A1、A2、A3、A4、A5。用琼脂糖凝胶电泳分析双链多聚核糖核酸A1、A2、A3、A4、A5,分析结果参见图2A:随着引发链浓度的降低,形成的双链多聚核糖核酸的分子量越大,也就是长度越长。随着引发链浓度的下降,双链多聚核糖核酸变得越来越集中。由此可知,双链多聚核糖核酸的长度由引发链与核酸单体的浓度比来控制,浓度比越大,双链多聚核糖核酸的长度越长。(2)取步骤(1)中的双链多聚核糖核酸A5,加入链霉亲和素和核酸适配体Zy1孵育15min得到靶向载体。用琼脂糖凝胶电泳分析靶向载体,分析结果参见图2B:加入链霉亲和素和Zy1后条带集中在样品孔,说明形成了较大分子量的产物,说明“纳米蜈蚣”靶向载体形成。用荧光偏振分析核酸单体H1、核酸单体H2、双链多聚核糖核酸和靶向载体,分析结果参见图2C:通过荧光偏振对所产生的靶向载体的表征;在核酸单体H1中逐步引入核酸单体H2,引发链以及链霉亲和素和Zy1,可以发现偏振信号加强,说明自发的组装形成了大的复合物,最终形成了靶向载体。实施例2考察实施例1的靶向载体的抗酶切稳定性:在37℃下分别将实施例1的“纳米蜈蚣”靶向载体和实施例1中的双链多聚核糖核酸A5,与0.05unit/μL的核酸外切酶III在磷酸缓冲液反应0、1、2、4、8、12、24小时,用20mMEDTA中止反应。用琼脂糖凝胶电泳分析所得产物,分析结果参见图3:靶向载体在核酸外切酶III处理2小时后仍然能保持结构的完整(参见图3A),而双链多聚核糖核酸A5已经完全降解(参见图3B),说明靶向载体具有较好的抗酶切稳定性。实施例3一种靶向探针,包括靶向载体和生物成像剂,其中靶向载体为实施例1的靶向载体,生物成像剂为FITC,FITC通过共价修饰装载于靶向载体的配体上。一种本实施例的靶向探针的制备方法:(1)在磷酸缓冲液中,将25μM的核酸单体H1和25μM的核酸单体H2混合物混合,分别与5000nM,2500nM,1250nM,500nM,250nM的引发链置于室温,反应24小时,得到双链多聚核糖核酸B1、B2、B3、B4、B5。(2)在双链多聚核糖核酸B1、B2、B3、B4、B5中均加入50μM的链霉亲和素和50μM的标记了荧光分子(荧光分子为FITC)的Zy1得到靶向探针b1、b2、b3、b4、b5。(3)分别取步骤(2)中的靶向探针b1、b2、b3、b4、b5,逐级稀释成不同浓度(最终的Zy1浓度分别为20nM,10nM,5nM,2nM,1nM,0.5nM,0.2nM、0nM)。将稀释后的靶向探针与靶细胞SMMC-7721细胞在冰上孵育半小时,用洗涤缓冲液(洗涤缓冲液的成分为:10mMphosphatebuffer,137mMNaCl,2.7mMKCl,250mM葡萄糖,5mMMgCl2,pH7.4;全文的洗涤缓冲液的成分均一致)洗脱掉游离的靶向载体,将所得的细胞经流式细胞术分析细胞的平均荧光强度。结合能力用平均荧光强度(Y)与Zy1的浓度(X)根据公式Y=BmaxX/(Kd+X)。分析结果参见图4A:每一条靶向载体的Zy1数目和双链多聚核糖核酸长度成正相关,从而获得不同长度的靶向载体。在给定的将25μM的核酸单体H1和25μM的核酸单体H2下,低浓度的引发链(Trigger)获得更长的“纳米蜈蚣”(靶向载体),结果表明更长的“纳米蜈蚣”诱导更强的结合能力,因此,结合能力随着靶向载体的长度增加而增强。其最优的引发链浓度为250nM。实施例4一种靶向探针,包括靶向载体和生物成像剂,其中靶向载体为实施例1的靶向载体,生物成像剂为FITC,FITC通过共价修饰装载于靶向载体的配体上。一种本实施例的靶向探针的制备方法:(1)在磷酸缓冲液中,将25μM的核酸单体H1和25μM的核酸单体H2混合物混合,与250nM的引发链置于室温,反应24小时,得到双链多聚核糖核酸。(2)将双链多聚核糖核酸平均分为5份,加入浓度相同浓度的链霉亲和素和标记了荧光分子的Zy1,他们的浓度分别为0.25μM,1.25μM,2.5μM,5μM,12.5μM,25μM,50μM得到靶向探针c1、c2、c3、c4、c5。(3)分别取步骤(2)中的靶向探针c1、c2、c3、c4、c5,逐级稀释成不同浓度(最终的Zy1浓度分别为20,10,5,2,1,0.5,0.2,0nM),将靶向探针与靶细胞SMMC-7721细胞在冰上孵育半小时,用洗涤缓冲液洗脱掉游离的纳米蜈蚣,将所得的细胞经流式细胞术分析细胞的平均荧光强度。结合能力用平均荧光强度(Y)与Zy1的浓度(X)根据公式Y=BmaxX/(Kd+X)。分析结果参见图4B:在给定的25μM的核酸单体H1、25μM的核酸单体H2和250nM引发链下,加入不同浓度的链霉亲和素和Zy1,获得不同数目Zy1的靶向探针,每一条靶向探针中Zy1数目与Zy1的浓度成正相关,从而获得不同数目Zy1的靶向探针。结果表明更多数目Zy1的靶向探针诱导更强的结合能力;结合能力随着靶向探针上Zy1数目的增加而增强。其最优的链霉亲和素和Zy1浓度为50μM,将最优的靶向探针命名为Zy1-Nces。图5为流式细胞术表征Zy1对靶细胞SMMC-7721细胞的结合能力。将Zy1稀释成不同浓度(100,50,20,10,5,2,1,0nM)分别与靶细胞SMMC-7721细胞结合,流式细胞仪测定平均荧光强度,计算其亲和力为7.55±1.10nM。实施例5一种靶向探针,包括靶向载体和生物成像剂,其中靶向载体为实施例1的靶向载体,生物成像剂为FITC,FITC通过共价修饰装载于靶向载体的配体上。一种本实施例的靶向探针的制备方法:(1)在磷酸缓冲液中,将25μM的核酸单体H1和25μM的核酸单体H2混合物混合,与250nM的引发链置于室温,反应24小时,得到双链多聚核糖核酸。(2)在双链多聚核糖核酸加入浓度均为50μM的链霉亲和素和标记了荧光分子的Zy1得到靶向探针。(3)将靶向探针分别与靶细胞SMMC-7721细胞和非靶细胞L02细胞孵育30min,调节孵育温度和孵育环境;然后用洗涤缓冲液洗脱掉游离的纳米蜈蚣,将所得的细胞经流式细胞术分析细胞的平均荧光强度。考察结果参见图6:图6A为4℃下结合缓冲溶液中靶向探针对靶细胞识别的流式细胞术分析图;图6B为4℃下结合缓冲溶液中靶向探针对非靶细胞识别的流式细胞术分析图;图6C为37℃下结合缓冲溶液中靶向探针对靶细胞识别的流式细胞术分析图,图6D为37℃下结合缓冲溶液中靶向探针对非靶细胞识别的流式细胞术分析图;图6E为37℃下细胞培养基(含10%的牛血清)中靶向探针对靶细胞识别的流式细胞术分析图,图6F为37℃下细胞培养基(含10%的牛血清)中靶向探针对非靶细胞识别的流式细胞术分析图。对比图6中各图,表明:流式细胞术分析表明在实验条件下,靶向探针保留了核酸适配体对靶向疾病细胞的选择识别性。实施例6一种靶向探针,包括靶向载体和生物成像剂,其中靶向载体为实施例1的靶向载体,生物成像剂为FITC,FITC通过共价修饰装载于靶向载体的配体上。一种本实施例的靶向探针的制备方法:(1)在磷酸缓冲液中,将25μM的核酸单体H1和25μM的核酸单体H2混合物混合,与250nM的引发链置于室温,反应24小时,得到双链多聚核糖核酸。(2)在双链多聚核糖核酸中加入浓度为50μM的链霉亲和素和浓度为50μM的标记了荧光分子的Zy1得到靶向探针。(3)将靶向探针和Zy1与靶细胞SMMC-7721细胞在细胞培养箱孵育,分别于15min,30min,1h,2h,3h后取出,用洗涤缓冲液洗脱掉游离的靶向载体和Zy1,将所得的细胞经共聚焦成像分析细胞表面或细胞内部的荧光信号强度。检测结果参见图7:在相同条件下,靶向探针(如图7A)孵育的细胞荧光强度比Zy1(如图7B)更强,此分析可以验证靶向载体比自由Zy1有更好的内化效果,靶向探针能促进靶细胞的内吞,这将作为通过靶向载体提高药物输送效率的理论基础。实施例7一种靶向探针,包括靶向载体和生物成像剂,其中靶向载体为实施例1的靶向载体,生物成像剂为FITC,FITC通过共价修饰装载于靶向载体的配体上。一种本实施例的靶向探针的制备方法:(1)在磷酸缓冲液中,将25μM的核酸单体H1和25μM的核酸单体H2混合物混合,与250nM的引发链置于室温,反应24小时,得到双链多聚核糖核酸。(2)在双链多聚核糖核酸加入浓度均为250nM的链霉亲和素和标记了荧光分子的Zy1得到靶向探针。(3)将步骤(2)中非共价结合了荧光分子的靶向探针与靶细胞SMMC-7721细胞和非靶细胞L02分别在细胞培养箱孵育2h,用洗涤缓冲液(全文用的洗涤缓冲液是同一种)洗脱掉游离的“纳米蜈蚣”,将所得的细胞经用激光扫描共聚焦显微镜分析细胞表面或细胞内部的荧光信号强度。同时按照同样的方法考察实施例4的Zy1-Nces(核酸单体H1浓度为25μM、核酸单体H2浓度为25μM、引发链浓度为250nM、链霉亲和素浓度为50μM和标记了荧光分子的Zy1的浓度为50μM)。分析结果参见图8:Zy1-Nces孵育的靶细胞SMMC-7721细胞内比本实施例的靶向探针具有更强的荧光,说明其更好的内吞效果,而对于对照细胞L02细胞两者没有明显的荧光,说明两者都不能进入对照细胞。表明在靶向探针的内化依赖于更高价的Zy1。同时靶向探针在嵌入荧光染料后没有失去它的选择性,有对靶细胞的特异识别能力。实施例8一种靶向探针,包括靶向载体和生物成像剂,其中靶向载体为实施例1的靶向载体,生物成像剂为SYBRGreenI,SYBRGreenI通过非共价结合装载于靶向载体上。实施例9一种本发明的药物,包括靶向载体和药物,其中靶向载体为实施例1的靶向载体,药物分子为阿霉素。阿霉素通过非共价结合方式装载于靶向载体的双链多聚核糖核酸上。一种本实施例的药物的制备方法,包括以下步骤:(1)在磷酸缓冲液中,将25μM的核酸单体H1和25μM的核酸单体H2混合物混合,与250nM的引发链置于室温,反应24小时,得到双链多聚核糖核酸。(2)取步骤(1)中的双链多聚核糖核酸,加入浓度均为50μM的链霉亲和素和核酸适配体Zy1得到靶向载体。以引发链为对应靶向载体浓度,逐级将靶向载体稀释得到浓度分别为0.2nM、0.4nM、1nM、2nM、4nM、10nM的靶向载体。(3)将浓度为2μM的阿霉素和浓度分别为0nM、0.2nM、0.4nM、1nM、2nM、4nM、10nM的靶向载体在磷酸缓冲液中孵育,通过荧光光度计,比较相同浓度药物浓度和不同浓度靶向载体孵育后所得混合物中药物的荧光强度。参见图9,荧光光谱分析表明药物(阿霉素,英文简称为Dox)荧光在装载进入4nM的靶向载体后被淬灭,且根据药物分子和靶向载体的摩尔浓度比例为500∶1,纳米蜈蚣具有很高的药物装载量。实施例10一种本发明的药物,包括靶向载体和药物,其中靶向载体为实施例1的靶向载体,药物分子为阿霉素。阿霉素通过非共价结合方式装载于靶向载体的双链多聚核糖核酸上。一种本实施例的药物的制备方法,包括以下步骤:(1)在磷酸缓冲液中,将25μM的核酸单体H1和25μM的核酸单体H2混合物混合,与250nM的引发链置于室温,反应24小时,得到双链多聚核糖核酸。(2)取步骤(1)中的双链多聚核糖核酸,加入浓度均为50μM的链霉亲和素和核酸适配体Zy1得到靶向载体。以引发链为对应靶向载体浓度,按阿霉素与靶向载体的浓度比500∶1的比例,加入125μM阿霉素,得到含阿霉素浓度为2μM的靶向载体。(3)将含阿霉素浓度为2μM的靶向载体与靶细胞SMMC-7721细胞和对照细胞L02细胞在细胞培养液中孵育,经在细胞培养箱中培养2小时后,激光扫描共聚焦显微镜成像图。同时按照相同的条件将阿霉素与靶细胞SMMC-7721细胞和对照细胞L02细胞在细胞培养液中孵育。激光扫描共聚焦显微镜成像参见图10,第一行是靶细胞经靶向载体运载的药物处理图,第二行是靶细胞经游离药物处理图,第三行是非靶细胞经靶向载体运载的药物处理图,第四行是非靶细胞经游离药物处理图。对比图10可知:通过装载有荧光的药物分子(如阿霉素)到靶向载体上,靶向载体能够将药物选择性运输到靶细胞SMMC-7721细胞,而不能运输到对照细胞L02细胞;既可以通过释放后药物荧光信号增强的性质实时监控药物释放,又可以表现出靶向载体对靶细胞的选择性识别和药物运输;而自由的阿霉素没有选择性。实施例11一种本发明的药物,包括靶向载体和药物,其中靶向载体为实施例1的靶向载体,药物分子为阿霉素。阿霉素通过非共价结合方式装载于靶向载体的双链多聚核糖核酸上。一种本实施例的药物的制备方法,包括以下步骤:(1)在磷酸缓冲液(磷酸缓冲液的成分为:10mMphosphatebuffer,137mMNaCl,2.7mMKCl,pH7.4)中,将25μM的核酸单体H1和25μM的核酸单体H2混合物混合,与250nM的引发链置于室温,反应24小时,得到双链多聚核糖核酸。(2)取步骤(1)中的双链多聚核糖核酸,加入浓度分别为50μM的链霉亲和素和核酸适配体Zy1得到靶向载体。以引发链为对应靶向载体浓度,按阿霉素与靶向载体的浓度比500∶1的比例,加入125μM阿霉素得到混合溶液。以阿霉素的浓度为标准将上述混合溶液稀释;得到含阿霉素浓度为0.05μM,0.1μM,0.25μM,1μM,2.5μM,5μM的靶向载体。(3)将含阿霉素浓度为别为0.05μM,0.1μM,0.25μM,1μM,2.5μM,5μM的靶向载体与靶细胞SMMC-7721细胞和对照细胞L02细胞在细胞培养液中孵育,经在细胞培养箱中培养2小时后,除去上清中的细胞培养液,换上新鲜培养基,并接着培养48h。然后用MTT试剂测试细胞增殖速率,以测试药物对靶细胞和非靶细胞的毒性大小。测试结果参见图11,图11A表明经靶向载体(纳米蜈蚣)运输的药物具有对靶细胞(SMMC-7721)特异性的细胞生长抑制功能,图11B表明对非靶细胞(L02)则抑制能力较小;图11C表明靶向载体本身具体很好的生物相容性。通过MTT实验表明,经靶向载体运输的药物(包括阿霉素)具有对靶细胞(SMMC-7721)特异性的细胞生长抑制功能,而对非靶细胞(L02)则抑制能力较小。以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制。虽然本发明已以较佳实施例揭示如上,然而并非用以限定本发明。任何熟悉本领域的技术人员,在不脱离本发明的精神实质和技术方案的情况下,都可利用上述揭示的方法和技术内容对本发明技术方案做出许多可能的变动和修饰,或修改为等同变化的等效实施例。因此,凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所做的任何简单修改、等同替换、等效变化及修饰,均仍属于本发明技术方案保护的范围内。当前第1页1 2 3
