使用缓释组合物治疗患有中枢性性早熟儿童的方法与流程
使用缓释组合物治疗患有中枢性性早熟儿童的方法
发明领域
1.本技术涉及使用可生物降解的聚合物组合物治疗至少2岁儿童的中枢性性早熟(cpp)的领域,该组合物可以用注射器或针施用到体内以在延长的时间段将gnrh激动剂递送到体内。
2.发明背景
3.性早熟(pp)的特征在于至少2岁的儿童的青春期变化的早发。pp进一步分为两类:外周性性早熟(ppp)或中枢性性早熟(cpp)(fuqua js.“treatment and outcomes of precocious puberty:an update”.j clin endocrinol.metab.2013;98(6):2198-2207)。ppp定义为由异常内源性或外源性来源(如疾病或环境暴露)导致的性类固醇引起的早期性发育。ppp相关症状,如女性生殖器发育不明确或男性化,可能是由各种肿瘤(即性腺、肾上腺、生殖细胞肿瘤等)引起的雄激素水平不足导致的。相反,cpp定义为由正常内源性来源(包括下丘脑或垂体)产生和释放促性腺激素和/或性类固醇引起的早期性发育。cpp的鉴定可以通过使用刺激试验来进行(carretto,f.,et al.“the usefulness of the leuprolide stimulation test as a diagnostic method of idiopathic central precocious puberty in girls”.horm metab res.2014;46(13):959-963)。患有cpp的儿童的促性腺激素和/或性激素浓度水平的异常可能由多种来源导致,包括但不限于物理损伤、感染、遗传疾病或相关肿瘤。由遗传或未确定病理引起的cpp在本质上归类为特发性的,而由中枢神经系统(cns)肿瘤和/或病变引起的cpp在本质上归类为器质性的。cpp伴随有高龄骨龄、加速生长速度和下丘脑-垂体-性腺轴激活。特发性cpp在女性儿童中更为普遍,而男性则更常表现出可区分的器质性cpp病理。
4.特发性cpp和器质性cpp均可使用促性腺激素释放激素(gnrha)疗法治疗(antoniazzi,f.,“central precocious puberty:current treatment options”.paediatr.drugs.2004;6(4):211-231)。目前治疗患有cpp儿童的方法依赖于gnrh或gnrh激动剂的施用。gnrh或gnrh激动剂的持续递送导致垂体中gnrh受体的慢性刺激,其在最初的短暂增加后导致随后gnrh受体活性的下调。gnrh受体活性的下调会降低gnrh依赖性促性腺激素的分泌,其中gnrh依赖性促性腺激素包括但不限于促黄体激素(lh)和促卵泡激素(fsh),它们是青春期正常发育的关键驱动者。促性腺激素分泌降低,也称为性腺机能减退,因此有助于减缓并可能逆转与cpp相关的青春期变化和症状的早发。相反,gnrh和gnrh激动剂不用于治疗ppp,相反,ppp治疗选择包括但不限于使用p450抑制剂、抗雄激素、芳香酶抑制剂和雌激素受体抑制剂。
5.尽管基于gnrh的cpp治疗可得,但当前治疗选择的局限性强调持续需要有所需缓释特性的新型组合物,以延长释放gnrh或gnrh激动剂以治疗至少2岁儿童的cpp。基于使用gnrh激动剂治疗儿童的cpp的批准和上市的缓释产品包括但不限于:1)lupron基于醋酸亮丙瑞林的1或3个月的微球制剂,以1.0或1.5ml体积肌内施用,根据儿童体重和/或儿童对制剂的临床反应有不同和可调整的剂量(1个月7.5、11.25或15mg;3个月11.25或30mg);2)固定剂量(22.5mg),基于醋酸曲普瑞林的6
个月的微颗粒制剂,以2ml体积肌内施用;和3)supprelin固定剂量(50mg),基于醋酸组氨瑞林的12个月的、不可生物降解的、皮下植入的水凝胶聚合物储层。
6.然而,目前所有批准和上市的儿童的cpp的治疗都有局限性和缺点,如制剂制备和施用困难、剂量不一致问题、不充分/不方便的有效期(即,剂量间隔太短)、患者不适、患者不依从、患者与患者之间的变化性以及如果需要停止治疗则难以移除/清除制剂。例如,lupron和均由基于聚合物的微球或微粒组成,它们具有昂贵且复杂的制造要求。此外,已知微球会随着时间从溶液中沉淀出来。因此,基于微球的制剂,如lupron和必须由医生正确制备和施用,以确保实现和维持正确的剂量。lupron和均以大体积剂量(即每剂多达2ml)经由深层肌肉注射施用于儿童。此类注射可能非常痛苦且难以执行,尤其是对于较小且更容易受到惊吓的儿童。类似地,supprelin作为不可生物降解的植入物施用,其必须使用套管通过外科手术将其插入上臂的内侧,其通常在局部或全身麻醉或镇静下进行;移除植入物需要类似的外科手术程序。此外,lupron需要在整个治疗过程中根据儿童的体重和/或儿童对治疗的临床反应的充分性,不断个体化和调整施用剂量。
7.虽然lupron和supprelin分别提供持续释放gnrh激动剂1、3、6和12个月,但迫切需要用有效和方便的治疗来平衡患者的依从性和舒适度,这对小至2岁的儿童来说尤其困难。至少2岁儿童的cpp治疗可能需要持续数年,因此需要多次就诊。因此,本领域需要有效的、更耐受的治疗,其包括在临床有用的时间段内缓释gnrh或gnrh激动剂,以最大限度地降低重复施用和基于体重的剂量调整,同时也最大限度地降低与所述施用相关的困难、疼痛和出血。与当前的cpp治疗选择相比,此类治疗将非常有利。
8.发明概述
9.本发明提供了通过施用包含可生物降解的聚合物的缓释组合物的皮下注射来治疗患有中枢性性早熟(cpp)的至少2岁儿童(本文也称为儿科患者)的方法,当每六个月注射一次时,所述组合物能够在体内提供gnrh激动剂药物的缓释。包含可生物降解的聚合物的缓释制剂进一步包含gnrh激动剂,如亮丙瑞林或其药学上可接受的盐用于治疗cpp。本发明还提供了使用可选的刺激组合物与缓释组合物组合治疗至少2岁儿童的cpp的方法。刺激组合物包含gnrh或gnrh激动剂,或其药学上可接受的盐,并皮下施用于儿童以测量儿童体内的峰值刺激血清lh浓度。最后,本发明还提供一种试剂盒,其包含用于治疗患有cpp的儿童的缓释组合物和刺激组合物。
10.在第一方面,本公开提供了用于治疗至少2岁儿童的中枢性性早熟的缓释组合物。该缓释组合物包含有机溶剂、亮丙瑞林或其药学上可接受的盐,以及包含选自85:15聚(丙交酯-共-乙交酯)(plg)共聚物节段、85:15聚(乳酸-共-乙醇酸)(plga)共聚物节段、聚(丙交酯)(pl)聚合物节段、聚(乳酸)(pla)聚合物节段或它们的组合的可生物降解的聚合物,其中该聚合物基本上没有可滴定的羧酸基团并且其中该聚合物的至少一个远端基团是以羟基封端的。缓释组合物被配制成用于每六个月的皮下注射。缓释组合物中亮丙瑞林或其药学上可接受的盐的量与儿童的体重无关,并且在缓释组合物的后续施用中不会改变。当
缓释组合物与体液接触时,溶剂消散并且原位固体贮藏物形成。当每六个月施用时,缓释组合物降低儿童的峰值刺激血清lh浓度至《4iu/l的青春期前浓度水平。
11.在第二方面,本公开提供了用于治疗至少2岁儿童的中枢性性早熟的产品,该产品包含缓释组合物和刺激组合物。缓释组合物包含有机溶剂、亮丙瑞林或其药学上可接受的盐,以及包含选自85:15聚(丙交酯-共-乙交酯)(plg)共聚物节段、85:15聚(乳酸-共-乙醇酸)(plga)共聚物节段、聚(丙交酯)(pl)聚合物节段、聚(乳酸)(pla)聚合物节段或它们的组合的可生物降解的聚合物,其中该聚合物基本上没有可滴定的羧酸基团并且其中聚合物的至少一个远端基团是以羟基封端的。刺激组合物包含gnrh或gnrh激动剂,或其药学上可接受的盐。缓释组合物被配制成用于每六个月的皮下注射,且刺激组合物被配制成用于在缓释组合物之后三至六个月注射。缓释组合物中亮丙瑞林或其药学上可接受的盐的量与儿童的体重无关,并且在缓释组合物的后续施用中不会改变。当缓释组合物与体液接触时,溶剂消散并且原位固体贮藏物形成。当每六个月施用时,缓释组合物降低儿童的峰值刺激血清lh浓度至《4iu/l的青春期前浓度水平。刺激组合物确认抑制血清lh浓度至《4iu/l的水平。
12.在第一和第二方面的一些实施方案中,缓释组合物中亮丙瑞林或其药学上可接受的盐的量为约40mg-约50mg。
13.在第一和第二方面的一些实施方案中,亮丙瑞林或其药学上可接受的盐是醋酸亮丙瑞林,并且缓释组合物中的醋酸亮丙瑞林的量为约45mg。
14.在第一和第二方面的一些实施方案中,缓释组合物中亮丙瑞林或其药学上可接受的盐的量选自:约40mg-约45mg的亮丙瑞林游离碱等同量,和约42mg的亮丙瑞林游离碱等同量。
15.在第二方面的一些实施方案中,刺激组合物包含选自以下项组成的组的至少一种gnrh激动剂或其药学上可接受的盐:亮丙瑞林、戈那瑞林、戈舍瑞林、组氨瑞林、那法瑞林、布舍瑞林和曲普瑞林。
16.在第二方面的一些实施方案中,刺激组合物包含配制成用于皮下施用的剂量选自约2.5μg每kg体重的剂量和约100μg的总剂量的gnrh溶液。
17.在第二方面的一些实施方案中,刺激组合物包含配制成用于皮下施用的剂量选自约500μg-约1000μg的总剂量和约10μg-约20μg每kg体重的剂量的醋酸亮丙瑞林溶液。
18.在第二方面的一些实施方案中,刺激组合物包含配制成用于皮下施用的剂量选自约1μg每kg体重的剂量和约100μg的总剂量的醋酸那法瑞林溶液。
19.在第二方面的一些实施方案中,刺激组合物包含配制成用于皮下施用的总剂量为约100μg的布舍瑞林溶液。
20.在第二方面的一些实施方案中,刺激组合物包含配制成用于皮下施用的总剂量约为100μg的醋酸曲普瑞林溶液。
21.在第一和第二方面的一些实施方案中,缓释组合物:降低峰值刺激血清fsh至≤2.5iu/l的浓度;降低女性的峰值刺激血清雌二醇至《73.4pmol/l(《20pg/ml)的浓度;和/或降低男性的峰值刺激血清睾酮至《1nmol/l(《28.8ng/dl)的浓度。
22.在第一和第二方面的一些实施方案中,缓释组合物包含约165mg的n-甲基-2-吡咯烷酮(nmp)、约45mg的醋酸亮丙瑞林和约165mg的约85:15聚(dl丙交酯-共-乙交酯)(plg)共
聚物节段。
23.在第一和第二方面的一些实施方案中,可生物降解的聚合物具有选自15kda-45kda和20kda-26kda的重均分子量。
24.在第一和第二方面的一些实施方案中,可生物降解的聚合物包含下式的聚合物:
25.ho—(p)—c(
═
o)o—ra—o(o
═
)c—(p)—oh
26.其中,ra是包含约4-约8个碳的烷烃双基并且是烷烃二醇的残基,以及每个p独立地是聚合的和/或共聚物节段。
27.在第一和第二方面的一些实施方案中,缓释组合物:在约12个月的治疗期内,降低平均骨生长速度约25%;和/或在治疗结束时(在约12个月),在测量时将骨龄与实龄的平均比率降低了约5%。
28.在第一和第二方面的一些实施方案中,缓释组合物包含选自约0.5ml或更少和约0.375ml的注射剂量体积。
29.在第三个方面,本公开提供了缓释组合物在制备用于治疗至少2岁儿童的中枢性性早熟的药物中的用途。缓释组合物包含有机溶剂、亮丙瑞林或其药学上可接受的盐,以及可生物降解的聚合物,其包含选自以下项的聚合物节段:85:15的聚(丙交酯-共-乙交酯)(plg)共聚物节段、85:15的聚(乳酸-共-乙醇酸)(plga)共聚物节段、聚(丙交酯)(pl)聚合物节段、聚(乳酸)(pla)聚合物节段或其组合,其中聚合物基本上不具有可滴定的羧酸基团并且其中聚合物的至少一个远端基团是以羟基封端的。缓释组合物配制成用于每六个月的皮下注射。缓释组合物中亮丙瑞林或其药学上可接受的盐的量与儿童的重量无关,并且在缓释组合物的后续施用中不会改变。当缓释组合物与体液接触时,溶剂消散并且原位固体贮藏物形成。当每六个月施用时,缓释组合物降低儿童的峰值刺激血清lh浓度至《4iu/l的青春期前浓度水平。
30.在第四个方面,本公开提供了产品在制造用于治疗至少2岁儿童的中枢性性早熟的药物中的用途,该产品包含缓释组合物和刺激组合物。缓释组合物包含有机溶剂、亮丙瑞林或其药学上可接受的盐,以及可生物降解的聚合物,其包含选自以下项的聚合物节段:85:15的聚(丙交酯-共-乙交酯)(plg)共聚物节段、85:15的聚(乳酸-共-乙醇酸)(plga)共聚物节段、聚(丙交酯)(pl)聚合物节段、聚(乳酸)(pla)聚合物节段或其组合,其中聚合物基本上不具有可滴定的羧酸基团并且其中聚合物的至少一个远端基团是以羟基封端的。刺激组合物包含gnrh或gnrh激动剂,或其药学上可接受的盐。缓释组合物配制成用于每六个月的皮下注射,并且刺激组合物配制成用于在缓释组合物之后三至六个月注射。缓释组合物中亮丙瑞林或其药学上可接受的盐的量与儿童的体重无关,并且在缓释组合物的后续施用中不会改变。当缓释组合物与体液接触时,溶剂消散并且原位固体贮藏物形成。当每六个月施用时,缓释组合物降低儿童的峰值刺激血清lh浓度至《4iu/l的青春期前浓度水平。刺激组合物确认抑制血清lh浓度至《4iu/l的水平。
31.在第三和第四方面的一些实施方案中,缓释组合物中亮丙瑞林或其药学上可接受的盐的量为约40mg-约50mg。
32.在第三和第四方面的一些实施方案中,亮丙瑞林或其药学上可接受的盐是醋酸亮丙瑞林,并且缓释组合物中的醋酸亮丙瑞林的量为约45mg。
33.在第三和第四方面的一些实施方案中,缓释组合物中亮丙瑞林或其药学上可接受
的盐的量选自:约40mg-约45mg的亮丙瑞林游离碱等同量,和约42mg的亮丙瑞林游离碱等同量。
34.在第四方面的一些实施方案中,刺激组合物包含选自以下项组成的组的至少一种gnrh激动剂或其药学上可接受的盐:亮丙瑞林、戈那瑞林、戈舍瑞林、组氨瑞林、那法瑞林、布舍瑞林和曲普瑞林。
35.在第四方面的一些实施方案中,刺激组合物包含配制成用于皮下施用的剂量选自约2.5μg每kg体重的剂量和约100μg的总剂量的gnrh溶液。
36.在第四方面的一些实施方案中,刺激组合物包含配制成用于皮下施用的剂量选自约500μg-约1000μg的总剂量和约10μg-约20μg每kg体重的剂量的醋酸亮丙瑞林溶液。
37.在第四方面的一些实施方案中,刺激组合物包含配制成用于皮下施用的剂量选自约1μg每kg体重的剂量和约100μg的总剂量的醋酸那法瑞林溶液。
38.在第四方面的一些实施方案中,刺激组合物包含配制成用于皮下施用的总剂量为约100μg的布舍瑞林溶液。
39.在第四方面的一些实施方案中,刺激组合物包含配制成用于皮下施用的总剂量约为100μg的醋酸曲普瑞林溶液。
40.在第三和第四方面的一些实施方案中,缓释组合物降低峰值刺激血清fsh至≤2.5iu/l的浓度,降低女性的峰值刺激血清雌二醇至《73.4pmol/l(《20pg/ml)的浓度;和/或降低男性的峰值刺激血清睾酮至《1nmol/l(《28.8ng/dl)的浓度。
41.在第三和第四方面的一些实施方案中,缓释组合物包含约165mg的n-甲基-2-吡咯烷酮(nmp)、约45mg的醋酸亮丙瑞林和约165mg的约85:15聚(dl丙交酯-共-乙交酯)(plg)共聚物节段。
42.在第三和第四方面的一些实施方案中,可生物降解的聚合物具有选自15kda-45kda和20kda-26kda的重均分子量。
43.在第三和第四方面的一些实施方案中,可生物降解的聚合物包含下式的聚合物:
44.ho—(p)—c(
═
o)o—ra—o(o
═
)c—(p)—oh
45.其中,ra是包含约4-约8个碳的烷烃双基并且是烷烃二醇的残基,以及每个p独立地是聚合的和/或共聚物节段。
46.在第三和第四方面的一些实施方案中,缓释组合物在约12个月的治疗期内,降低平均骨生长速度约25%,和/或在治疗结束时(在约12个月),在测量时将骨龄与实龄的平均比率降低了约5%。
47.在第三和第四方面的一些实施方案中,缓释组合物包含选自约0.5ml或更少和约0.375ml的注射剂量体积。
48.在本发明的另一个实施方案中,每约六个月一次对患有cpp的至少两岁的儿童施用缓释组合物的皮下注射。缓释组合物包含有机溶剂、亮丙瑞林或其药学上可接受的盐和可生物降解的聚合物。缓释组合物中亮丙瑞林或其药学上可接受的盐的量与儿童的重量无关,并且在组合物的后续施用中不会改变。可生物降解的聚合物包含选自以下项的聚合物节段:85:15聚(丙交酯-共-乙交酯)(plg)共聚物节段、85:15聚(乳酸-共-乙醇酸)(plga)共聚物节段、聚(丙交酯)(pl)聚合物节段、聚(乳酸)(pla)聚合物节段或其组合。可生物降解的聚合物基本上不具有可滴定的羧酸基团并且聚合物的至少一个远端基团是以羟基封端
的。在与体液接触时,缓释组合物中的有机溶剂消散,因此原位固体贮藏物形成。当对患有cpp的儿童每约六个月一次施用时,缓释组合物降低儿童的峰值刺激血清lh浓度至《4iu/l的青春期前浓度水平。
49.在本发明的另一个实施方案中,每约六个月一次对患有cpp的两岁儿科患者施用缓释组合物的皮下注射。缓释组合物包含有机溶剂、亮丙瑞林或其药学上可接受的盐和可生物降解的聚合物。缓释组合物中亮丙瑞林或其药学上可接受的盐的量与儿童的重量无关,并且在组合物的后续施用中不会改变。可生物降解的聚合物包含选自以下项的聚合物节段:85:15聚(丙交酯-共-乙交酯)(plg)共聚物节段、85:15聚(乳酸-共-乙醇酸)(plga)共聚物节段或其组合。可生物降解的聚合物基本上不具有可滴定的羧酸基团并且聚合物的至少一个远端基团是以羟基封端的。在与体液接触时,缓释组合物中的有机溶剂消散,因此原位固体贮藏物形成。当对患有cpp的儿科患者每约六个月一次施用时,缓释组合物降低儿科患者的峰值刺激血清lh浓度至《4iu/l的青春期前浓度水平。在一些实施方案中,有机溶剂是n-甲基-2-吡咯烷酮(nmp)。
50.在本发明的另一个实施方案中,对患有cpp的至少两岁的儿童施用缓释组合物的皮下注射,该缓释组合物包含有机溶剂、亮丙瑞林或其药学上可接受的盐和可生物降解的聚合物。缓释组合物中亮丙瑞林或其药学上可接受的盐的量与儿童的重量无关,并且在组合物的后续施用中不会改变。可生物降解的聚合物包含选自以下项的聚合物节段:85:15聚(丙交酯-共-乙交酯)(plg)共聚物节段、85:15聚(乳酸-共-乙醇酸)(plga)共聚物节段、聚(丙交酯)(pl)聚合物节段、聚(乳酸)(pla)聚合物节段或其组合。可生物降解的聚合物基本上不具有可滴定的羧酸基团并且聚合物的至少一个远端基团是以羟基封端的。在施用缓释组合物后约三至六个月至少一次,对儿童施用刺激组合物的皮下注射,该刺激组合物包含gnrh或gnrh激动剂或其药学上可接受的盐,以确认抑制峰值血清lh浓度至儿童《4iu/l的水平。如果在施用缓释组合物后约3至约6个月的峰值刺激血清lh浓度《4iu/l,则缓释组合物和刺激组合物的额外施用可根据需要重复以继续治疗儿童的cpp。在与体液接触时,缓释组合物中的有机溶剂消散,因此原位固体贮藏物形成。当每约六个月一次对患有cpp的儿童施用时,缓释组合物降低儿童的峰值刺激血清lh浓度至《4iu/l的青春期前浓度水平。
51.在本发明的另一个实施方案中,对患有cpp的两岁或以上的儿科患者施用刺激组合物的皮下注射,以在施用刺激组合物约至少三十分钟内从儿科患者获得的血液样品测量峰值刺激血清lh的浓度。刺激组合物包含gnrh或gnrh激动剂或其药学上可接受的盐。如果儿科患者具有》5iu/l的峰值刺激血清lh浓度,则对该儿科患者随后施用有效治疗cpp约六个月的缓释组合物的皮下注射剂量。缓释组合物的剂量不是针对儿科患者个体化的。该药品还允许在具有足够皮下组织量的任何部位注射。该缓释组合物包含有机溶剂n-甲基-2-吡咯烷酮(nmp)、亮丙瑞林或其药学上可接受的盐和可生物降解的聚合物。可生物降解的聚合物包含选自以下项的聚合物节段:85:15聚(丙交酯-共-乙交酯)(plg)共聚物节段、85:15聚(乳酸-共-乙醇酸)(plga)共聚物节段、聚(丙交酯)(pl)聚合物节段、聚(乳酸)(pla)聚合物节段或其组合。可生物降解的聚合物基本上不具有可滴定的羧酸基团且聚合物的至少一个远端基团是以羟基封端的。在施用缓释组合物后约三至六个月时,向儿科患者施用刺激组合物的额外注射以确认抑制峰值刺激血清lh的浓度至的《4iu/l的水平,该确认来自在施用用于测量峰值刺激血清lh浓度的额外刺激组合物约至少三十分钟内从儿科患者获得的
血清样品。如果在施用缓释组合物后约3至约6个月的峰值刺激血清lh浓度《4iu/l,则缓释组合物和刺激组合物的额外施用可根据需要重复以继续治疗儿科患者的cpp。缓释组合物的剂量不是针对儿科患者个体化的,并且在与体液接触时,缓释组合物中的有机溶剂消散,因此原位固体贮藏物形成。当每约六个月一次对患有cpp的儿科患者施用时,缓释组合物降低儿童的峰值刺激血清lh浓度至《4iu/l的青春期前水平。
52.在一些实施方案中,缓释组合物中亮丙瑞林或其药学上可接受的盐的量为约40mg-约50mg。在其他实施方案中,亮丙瑞林或其药学上可接受的盐为约45mg量的醋酸亮丙瑞林。
53.在一些实施方案中,缓释组合物中亮丙瑞林或其药学上可接受的盐的量为约40mg-45mg的亮丙瑞林游离碱等同量。在其他实施方案中,缓释组合物中亮丙瑞林或其药学上可接受的盐的量为约42mg的亮丙瑞林游离碱等同量。
54.在一些实施方案中,给儿童皮下施用包含gnrh或gnrh激动剂或其药学上可接受的盐的刺激组合以在施用缓释组合物之前测量儿童体内的峰值刺激血清lh的浓度。在一些实施方案中,向儿科患者皮下施用包含gnrh或gnrh激动剂或其药学上可接受的盐的刺激组合物,以在施用缓释组合物之前测量儿科患者体内的峰值刺激血清lh的浓度,来确认基线峰值刺激血清lh浓度。在一些实施方案中,向儿科患者皮下施用包含gnrh或gnrh激动剂或其药学上可接受的盐的刺激组合物,以在施用缓释组合物后约三个月至约六个月时测量儿科患者体内峰值刺激血清lh的浓度,来确认抑制峰值刺激血清lh浓度至《4iu/l的青春期前水平。在一些实施方案中,在施用刺激组合物约至少三十分钟内获得来自儿童的血液样品以测量峰值刺激血清lh浓度。
55.在一些实施方案中,刺激组合物包含选自以下项组成的组的至少一种gnrh激动剂或其药学盐:亮丙瑞林、戈那瑞林、戈舍瑞林、组氨瑞林、那法瑞林、布舍瑞林和曲普瑞林。在一些实施方案中,刺激组合物可包含通常通过皮下注射施用的gnrh溶液,其剂量为:1)约2.5μg每kg儿童体重或2)总共约100μg。在一些实施方案中,刺激组合物可包含皮下施用的醋酸亮丙瑞林溶液,其剂量为:1)约10μg至约20μg每kg儿童体重或2)总共约500μg至约1000μg。在一些实施方案中,刺激组合物可包含皮下针施用的醋酸那法瑞林溶液,其剂量为:1)约1μg每kg儿童体重或2)总共约100μg。在一些实施方案中,刺激组合物可包含以总共约100μg的剂量皮下施用的布舍瑞林溶液。在一些实施方案中,刺激组合物可包含以总共约100μg的剂量皮下施用的醋酸曲普瑞林溶液。
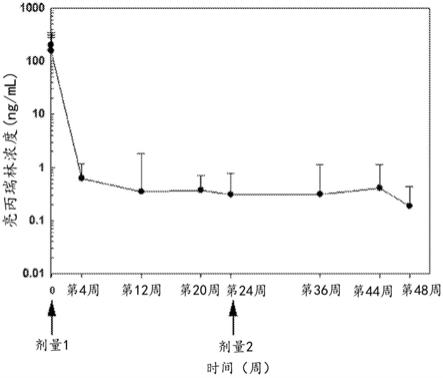
56.在一些实施方案中,一种或多种额外cpp相关的激素的峰值刺激血清浓度水平可以在施用刺激组合物后从儿童获得的血液样品内测量,其中cpp相关激素选自以下项组成的组:促卵泡激素(fsh)、睾酮和雌二醇。在一些实施方案中,施用缓释组合物可降低峰值刺激血清fsh至≤2.5iu/l的浓度。在一些实施方案中,施用缓释组合物可降低女性儿童的峰值刺激血清雌二醇至《73.4pmol/l(《20pg/ml)的浓度。在一些实施方案中,施用缓释组合物可降低女性儿科儿童的峰值刺激血清雌二醇至《73.4pmol/l(《20pg/ml)的浓度。在一些实施方案中,施用缓释组合物可降低男性儿童的峰值刺激血清睾酮至《1nmol/l(《28.8ng/dl)的浓度。在一些实施方案中,施用缓释组合物可降低男性儿科患者的峰值刺激血清睾酮至《1nmol/l(《28.8ng/dl)的浓度。
57.在一些实施方案中,缓释组合物的剂量可包含:1)约165mg的n-甲基-2-吡咯烷酮
(nmp),2)约165mg的约85:15聚(dl丙交酯-共-乙交酯)(plg)共聚物节段,和3)约45mg的醋酸亮丙瑞林。
58.在一些实施方案中,缓释组合物的可生物降解的聚合物可具有15kda至45kda之间,优选20kda至26kda之间的重均分子量。在一些实施方案中,缓释组合物的可生物降解的聚合物可具有15kda至45kda之间,优选20kda至26kda之间的重均分子量。
59.在一些实施方案中,缓释组合物的可生物降解的聚合物可包含下式的聚合物:ho—(p)—c(
═
o)o—ra—o(o
═
)c—(p)—oh,其中,ra是包含约4至约8个碳的烷烃双基且是烷烃二醇的残基且其中p是聚合的节段。
60.在一些实施方案中,缓释组合物可在约十二个月的治疗期将患有cpp的儿童的平均骨生长速度降低了25%。在一些实施方案中,缓释组合物的施用可在测量时将儿童的骨龄与实龄的平均比率在约六个月时降低了3%,并在治疗结束时(约十二个月时)降低了5%。在一些实施方案中,缓释组合物的施用可在约十二个月的治疗期测量时将儿童的骨龄与实龄的平均比率降低了约5%。
61.在一些实施方案中,缓释组合物包含约0.5ml或更少的注射剂量体积。在一些情况下,缓释组合物包含约0.375ml的注射剂量体积。
62.在一些实施方案中,患有cpp的儿科患者用缓释组合物治疗约6个月、约12个月、约18个月、约24个月或更长的时间段。
63.在一些实施方案中,缓释组合物在双注射器系统中提供,该系统包括含有约45mg的冻干醋酸亮丙瑞林或等同量的不同药学上可接受的亮丙瑞林的盐的第一注射器和含有。溶解在约165mg的n-甲基-2-吡咯烷酮(nmp)中的约165mg的约85:15的聚(丙交酯-共-乙交酯)(plg)共聚物节段溶液的第二注射器第一注射器连接到第二注射器,使得在第一注射器和第二注射器之间形成通道以允许可流动组合物从一个注射器流通到另一个注射器。缓释组合物是通过将第二个注射器的内容物与连接的双注射器系统的第一个注射器的内容物连续来回混合持续至少约45秒至约至少60秒或更长时间以形成均匀悬浮液来制备的。
64.在一些实施方案中,通过首先向患有cpp的2岁或以上的儿科患者施用包含gnrh或gnrh激动剂或其药学上可接受的盐的刺激组合物的注射来治疗患有cpp的2岁及以上的儿科患者,其中在施用刺激组合物的约三十分钟内获得儿科患者的血液样品以测量峰值刺激血清lh的浓度。其次,如果儿科患者具有》5iu/l的峰值刺激血清lh浓度,则施用约六个月的有效治疗cpp的缓释组合物的皮下剂量。缓释组合物包含n-甲基-2-吡咯烷酮(nmp)、亮丙瑞林或其药学上可接受的盐;和包含选自以下项聚合物节段的可生物降解聚合物:85:15聚(丙交酯-共-乙交酯)(plg)共聚物节段、85:15聚(乳酸-共-乙醇酸)(plga)共聚物节段或其组合,其中聚合物基本上不具有可滴定的羧酸基团并且其中聚合物的至少一个远端基团是羟基封端的。第三,在施用缓释组合物后约三至约六个月时向儿科患者施用刺激组合物的额外注射以确认抑制血清lh浓度至《4iu/l的青春期前水平,其中来自儿科患者的血液样品在施用随后的刺激组合物约至少三十分钟内获得,以测量峰值刺激血清lh浓度。最后,如果在第二步后约三至约六个月时第三步的峰值刺激血清lh浓度《4iu/l,则根据需要重复第二和第三步以治疗cpp。缓释组合物的剂量对于儿科患者不是个体化的,并且在缓释组合物与体液接触时,溶剂消散并且原位固体贮藏物形成。缓释制剂降低儿科患者的峰值刺激血清lh浓度至《4iu/l的青春期前浓度水平。
65.在本发明的另一个实施方案中,提供了用于治疗患有cpp的至少两岁儿童包的含至少一剂可注射刺激组合物和至少一剂可注射缓释组合物的试剂盒及其使用说明。刺激组合物剂量包含gnrh或gnrh激动剂,或其药学上可接受的盐,其有效测量儿童体内的峰值刺激血清lh的浓度。缓释组合物剂量包含有机溶剂n-甲基-2-吡咯烷酮(nmp)、约40mg至约50mg醋酸亮丙瑞林或亮丙瑞林的药学上可接受的盐和可生物降解的聚合物。可生物降解聚合物包含选自以下项的聚合物节段:85:15聚(丙交酯-共-乙交酯)(plg)共聚物节段、85:15聚(乳酸-共-乙醇酸)(plga)共聚物节段、聚(丙交酯)(pl)聚合物节段、聚(乳酸)(pla)聚合物节段或其组合。可生物降解的聚合物基本上没有可滴定的羧酸基团并且聚合物的至少一个远端基团是羟基封端的。当每约六个月一次施用时,缓释组合物剂量通过降低峰值刺激血清lh浓度至《4iu/l的青春期前浓度水平,有效治疗儿童的cpp。在与体液接触时,缓释组合物中的nmp消散,因此原位固体贮藏物形成。该试剂盒还包含其治疗儿童cpp的使用说明。
66.在本发明的另一个实施方案中,提供了用于治疗患有cpp的两岁或以上儿科患者的含至少一剂可注射刺激组合物和至少一剂可注射缓释组合物的试剂盒及其使用说明。刺激组合物剂量包含gnrh或gnrh激动剂,或其药学上可接受的盐,其有效测量儿童体内的峰值刺激血清lh的浓度。缓释组合物剂量包含有机溶剂n-甲基-2-吡咯烷酮(nmp)、约40mg至约50mg醋酸亮丙瑞林或亮丙瑞林的药学上可接受的盐和可生物降解聚合物。可生物降解聚合物包含选自以下项的聚合物节段:85:15聚(丙交酯-共-乙交酯)(plg)共聚物节段、85:15聚(乳酸-共-乙醇酸)(plga)共聚物节段或其组合。可生物降解聚合物基本上没有可滴定的羧酸基团并且聚合物的至少一个远端基团是羟基封端的。当每约六个月一次施用时,缓释组合物剂量通过降低峰值刺激血清lh浓度至《4iu/l的青春期前浓度水平,有效治疗儿科患者的cpp。在与体液接触时,缓释组合物中的nmp消散,因此原位固体贮藏物形成。该试剂盒还包含其治疗儿科患者cpp的使用说明。
67.在一些实施方案中,包含刺激组合物的试剂盒进一步包含选自以下项组成的组的至少一种gnrh激动剂或其药学盐:亮丙瑞林、戈那瑞林、戈舍瑞林、组氨瑞林、那法瑞林、布舍瑞林和曲普瑞林。在一些实施方案中,试剂盒包含预填充注射器、预填充小瓶或其组合,该试剂盒进一步含有足以施用以下任一项的皮下剂量的gnrh溶液的量:1)约2.5μg每kg儿童体重或2)总共约100μg。在一些实施方案中,试剂盒包含预填充注射器、预填充小瓶或其组合,该试剂盒进一步含有足以施用以下任一项的皮下剂量的醋酸亮丙瑞林溶液的量:1)约10μg至约20μg每kg儿童体重或2)总共约500μg至约1000μg。在一些实施方案中,试剂盒包含预填充注射器、预填充小瓶或其组合,该试剂盒进一步含有足以施用以下任一项的皮下剂量的醋酸那法瑞林溶液的量:1)约1μg每kg儿童体重或2)总共约100μg。在一些实施方案中,试剂盒包含预填充注射器、预填充小瓶或其组合,该试剂盒可含有足以施用总共约100μg的皮下剂量的布舍瑞林溶液的量。在一些实施方案中,试剂盒包含预填充注射器、预填充小瓶或其组合,该试剂盒可含有足以施用总共约100μg的皮下剂量的醋酸曲普瑞林溶液的量。
68.在一些实施方案中,试剂盒可包括一剂或多剂刺激组合物和缓释组合物,足以治疗患有cpp的至少2岁的儿童约6个月、约12个月、约18个月、约24个月或更长的时间段。在其他实施方案中,试剂盒可包括一剂、二剂、三剂、四剂、五剂、六剂、七剂、八剂、九剂或更多剂的刺激组合物。在其他实施方案中,试剂盒可包括一剂、二剂、三剂、四剂或更多剂的缓释组
合物。在一些实施方案中,缓释组合物包含约0.375ml的注射剂量体积。在一些实施方案中,每一剂量的刺激组合物可单独或一起包装到一个或多个预填充无菌小瓶、一个或多个预填充注射器或其组合中。在其他实施方案中,每个剂量的缓释组合物可以单独包装到预填充单注射器、预填充双注射器系统或其组合中。
69.在一些实施方案中,试剂盒可以包含双注射器系统,该系统由含有约45mg的冻干醋酸亮丙瑞林或等同量的不同药学上可接受的亮丙瑞林的盐的第一注射器和含有溶解在约165mg的n-甲基-2-吡咯烷酮(nmp)中的约165mg的约85:15聚(丙交酯-共-乙交酯)(plg)共聚物节段的溶液的第二注射器组成。在双注射器系统中,第一注射器可以连接到第二注射器,使得在第一注射器和第二注射器之间形成通道以允许可流动组合物从一个注射器流通到另一个注射器。在双注射器系统的一些实施方案中,缓释组合物是通过将第二个注射器的内容物与连接的双注射器系统的第一个注射器的内容物连续来回混合持续至少约45秒至约至少60秒或更长时间以形成均匀悬浮液来制备的。
70.在一些实施方案中,试剂盒可包含针、酒精拭子、血液样品采集瓶、以及其额外使用说明和标签。
71.附图简要说明
72.图1是显示了来自经历12个月治疗期的患有cpp的儿童的血清亮丙瑞林浓度的图表,该治疗期由两个剂量(第0周和第24周)的包含45mg的醋酸亮丙瑞林的本发明的缓释组合物组成。
73.图2是绘制了经历12个月治疗期的患有cpp的儿童的血清lh浓度随时间变化的图表,该治疗期由两个剂量(第0周和第24周)的包含45mg醋酸亮丙瑞林的本发明的缓释组合物组成。该图表显示了与治疗开始后立即释放醋酸亮丙瑞林的初始“爆发”阶段相关的lh浓度的瞬时激增(左侧)以及与在治疗过程中持续缓慢释放醋酸亮丙瑞林相关的lh浓度的持续降低(右侧)。
74.图3是绘制了经历12个月治疗期的患有cpp的儿童的平均峰值刺激血清lh浓度随时间变化的图表,该治疗期由两个剂量(第0周和第24周)的包含45mg的醋酸亮丙瑞林的本发明的缓释组合物组成。
75.图4是绘制了经历12个月治疗期的患有cpp的儿童的平均峰值刺激血清fsh浓度随时间变化的图表,该治疗期由两个剂量(第0周和第24周)的包含45mg的醋酸亮丙瑞林的本发明的缓释组合物组成。
76.图5是绘制了经历12个月治疗期的患有cpp的男性儿童的平均峰值刺激血清睾酮浓度随时间变化的图表,该治疗期由两个剂量(第0周和第24周)的包含45mg的醋酸亮丙瑞林的本发明的缓释组合物组成。
77.图6是绘制了经历12个月治疗期的患有cpp的女性儿童的平均峰值刺激血清雌二醇(也称为雌甾二醇)浓度随时间变化的图表,该治疗期由两个剂量(第0周和第24周)的包含45mg的醋酸亮丙瑞林的本发明的缓释组合物组成。通过免疫测定(灰色曲线)或lc-ms/ms(黑色曲线)从相同样品中测量雌二醇/雌甾二醇。
78.图7是绘制了经历12个月治疗期的患有cpp的儿童的平均生长速度随时间变化的图表,该治疗期由两个剂量(第0周和第24周)的包含45mg的醋酸亮丙瑞林的本发明的缓释组合物组成。
79.发明详述
80.现在将详细介绍本发明的某些实施方案和特征,其实施例在所附结构和式中说明。虽然将结合所列举的权利要求来描述本发明的实施方案,但是应当理解,这并不旨在将所要求保护的发明限于那些实施例。相反,本发明旨在涵盖所有可包括在由权利要求限定的本发明范围内的替代、修改和等同物。
81.本发明提供了通过施用缓释组合物的皮下注射的方法来用于有效治疗患有中枢性性早熟(cpp)的2岁及以上儿科患者(即患有cpp的至少2岁的儿童)的方法和试剂盒,其中缓释组合物包含可生物降解聚合物,该聚合物能够提供gnrh或gnrh激动剂药物在体内约六个月的缓慢释放。本发明详述了使用这种可流动的组合物在患有cpp的儿童体内提供原位可生物降解的贮藏物,经由调节下丘脑-垂体-性腺轴(hpg)轴来建立儿童体内的性腺机能减退症来对其进行有效治疗。此外,本发明和试剂盒包括包含gnrh激动剂的刺激组合物的任选用途,以用于正确诊断儿童是否患有cpp和用于测量缓释组合物在所述儿童体内建立和维持性腺机能减退以在有效治疗期间对cpp治疗。本发明的方法和试剂盒代表对现有方法的有利改进,因为对cpp的更简单的制备、长时间的作用、更容易的施用、固定剂量的疗法治疗提供了增强的功效和更好的患者护理及舒适度。
82.如下更详细的描述,本技术的发明人已经发现,当每约六个月一次施用时,包含有固定剂量的醋酸亮丙瑞林(gnrh激动剂)的可生物降解聚合物的缓释组合物可有效治疗有所需要的至少2岁儿童的cpp。缓释制剂以0.375ml的小体积作为可流动的液体制剂皮下施用,其与体液接触时形成固体、可生物降解的原位贮藏物。缓释制剂通过在可生物降解聚合物降解时醋酸亮丙瑞林持续长期缓慢释放到体内而建立至少6个月时段的性腺机能减退,从而有效治疗儿童的cpp。较小的注射剂量体积和皮下施用途径是优于当前方法的有利因素。例如,lupron1个月和3个月制剂需要分别为1.0和1.5ml的深层肌内注射剂量。有效6个月,需要2.0ml的深层肌内注射剂量。supprelin是3mm x 3.5cm的皮下外科手术植入物,需要大量的医师培训和准备以进行正确的切口、植入和缝合进入伤口的开口。植入后,supprelin在皮下仍可触及,并伴有相当大的生理和心理疼痛。因此,与本文公开的本发明的缓释组合物相关的较小注射剂量体积、皮下施用途径和没有手术植入在提供更容易的医师制备和施用(即更快的皮下注射vs更慢的深层肌内注射;非手术vs手术)方面提供了显著的益处,以及降低与治疗相关的生理和心理疼痛。由于骨或神经损伤和肌内血肿的可能性降低,皮下注射优于肌内注射。因此,本发明的缓释组合物通过提高儿科患者的耐受性来提供更好的患者护理以及对治疗护理和管理的依从性。最后,与其他亮丙瑞林制剂不同,如lupron1个月或3个月,本文公开的本发明的缓释组合物不需要根据每个儿童的体重或儿童对治疗的临床反应来连续个体化剂量。
83.术语“缓释组合物”可与但不限于与“控释组合物”、“延释组合物”、“治疗剂量”、“有效剂量”、“用于治疗cpp的剂量”、“治疗方案”或其任何进一步的变体互换使用。缓释组合物被定义为皮下注射液体聚合物制剂,其包含有机溶剂、可生物降解聚合物和亮丙瑞林或其药学上可接受的等同物或盐,其经由在六个月的时段持续释放亮丙瑞林到体内来形成可用于治疗儿童cpp的原位固体贮藏物。
84.类似地,术语“刺激组合物”可与但不限于与“刺激试验”、“诊断剂量”、“筛选剂量”、“cpp诊断剂量”、“cpp试验”或其任何进一步的变体互换使用。刺激组合物被定义为可用于刺激cpp相关激素释放的gnrh或gnrh激动剂的皮下注射溶液。
85.如本文所用,术语“下丘脑-垂体-性腺轴(hpg)”是指由这三个单独的内分泌腺体形成的集体实体。hpg通过gnrh、促性腺激素和性激素的受控调节释放在人发育中发挥关键作用。异常的hpg活性会导致相关的疾病状态。例如,gnrh或促性腺激素的过早释放可以启动儿童的早期青春期发育(即性早熟),这可以通过第二性征和身体特征来识别。术语“第二性征”是指男性或女性在青春期生体结构和生理的性征的发育和表现。随着他们进入从童年到青春期到成年期的过渡,青春期是个体性成熟的过程。女性的青春期一般发生在8至13岁之间。男性的青春期一般发生在9.5至13.5岁之间。青春期或青春期发育是从垂体发出促性腺激素信号开始的,这反过来又刺激性腺产生和释放额外的性激素。第二性征可能包括但不限于儿童大脑、骨、肌肉、血液、皮肤、头发、乳房、身高、体重、头部大小、生长速度、代谢活性、性器官的变化或其他与青春期相关的解剖学和生理学变化。术语第二性征在本文中可以与如“性征”、“性成熟”、“青春期发育”或任何其他类似含义的术语同义使用。然而,这些术语均不应与术语“主要性征”相混淆,后者在本文中定义为个体从出生起的性腺组成,其通常由个体的染色体组成(即xx或xy性染色体)确定。
86.如本发明通篇所用,术语“儿童”可与“至少2岁的儿童”或“2岁及以上的儿科患者”互换使用,并且被定义为任何年龄为2至12岁的儿童。早期出现与cpp相关的青春期体征和症状的儿童也可称为“患有cpp的儿童”、“患有cpp的儿科患者”或“青春期前儿童”。这些儿童被定义为通常年龄为2至9岁的男性儿童或通常年龄为2至8岁的女性儿童,其表现出与cpp相关的青春期体征或症状,如异常促性腺激素和/或性激素水平,和/或第二性征。儿童cpp的有效治疗包括建立“性腺机能减退”,其定义为性腺(即睾丸或卵巢)的功能活性降低,这可能进一步导致性激素的产生或释放降低。在一些情况下,低雄激素(即睾酮)水平可称为“雄激素缺乏”,而低雌激素(即雌二醇)水平可称为“雌激素缺乏”。术语“性腺机能减退”也可用于指在有效治疗下患有cpp的儿童恢复到正常的青春期前状态(例如抑制lh和fsh,随后抑制雌二醇和睾酮)。
87.重要的是,确定儿童相比于ppp是否患有cpp有助于为有其需要的所述儿童建立适当和有效的护理治疗。cpp vs ppp的鉴别诊断可以通过使用刺激试验来实现,该试验包括向怀疑患有pp的儿童皮下注射gnrh或gnrh激动剂(carretto,f.,et al.“the usefulness of the leuprolide stimulation test as a diagnostic method of idiopathic central precocious puberty in girls.”horm.metab.res.2014;46(13):959-963)。施用gnrh激动剂,例如醋酸亮丙瑞林的水溶液,会导致各种性激素的峰值刺激血清浓度发生瞬时变化。血液样品可在约3小时内从儿童体内获得,但在gnrh激动剂刺激试验的施用后三十分钟至约1小时之间可以很容易地获得。获得的血液样品可用于测量各种cpp相关性激素的浓度,所述性激素包括但不限于lh、fsh、睾酮和雌二醇。在gnrh激动剂刺激后约三十分钟或之后,lh的峰值刺激血清浓度》5iu/l可被认为是cpp的诊断依据。
88.cpp的额外支持性诊断标准包括在开始治疗之前记录的临床和身体参数的组合,包括但不限于tanner分期和骨龄。如本文所用,术语“tanner分期(tanner stage)”可与“tanner分级(tanner scale)”互换使用。tanner分期是通过测量主要和第二性征来对儿童
的身体发育进行分级。tanner分期不代表实龄,而是用来评估青春期的成熟度。相反,术语“骨龄”可与“骨龄比”或“骨龄与实龄比”同义使用,且术语“骨龄”定义为当与儿童的实龄相比儿童的结构骨龄(通过如非惯用手的x光分析的方法来确定,其中用来自x光的骨长度和骨骺板大小通过greulich和pyle方法来确定骨龄)(antoniazzi,f.,et.al.“central precocious puberty:current treatment options.”paediatr.drugs.2004;6(4):211-231)。骨龄≥1年的实龄表明骨生长加速(carel,j.c.,et.al.“clinical practice.precocious puberty.”n engl j med.2008;358(22):2366-2377)。特发性cpp可通过如神经检查和身体检查等二级实验室检查进一步与器质性cpp区分开来。mri扫描可用于验证不存在任何肿瘤。身体检查可用于检查其他体征和症状;例如,与mccune-albright综合征相关的浅棕色皮肤斑块的存在称为咖啡牛奶(caf
é‑
au-lait)斑,其与ppp相关。
89.先前已经描述了具有用于治疗化合物的缓慢释放的所需流动特性的各种长效释放聚合物制剂。有流动特性的聚合物制剂具有有利特性,包括但不限于易于施用、稳定性和释放动力学。本发明中使用的一种此类缓释聚合物组合物包含分散在生物相容性有机溶剂中的可生物降解的、水不溶性聚合物或共聚物和治疗化合物,如gnrh激动剂(即醋酸亮丙瑞林)。在经由皮下注射作为可流动的液态悬浮液施用后,缓释组合物固化为半固体至固体物质的原位贮藏物。如本文所用,术语“原位贮藏物”可与“植入物”或“固体物质”互换使用。原位贮藏物可定义为本发明的缓释组合物的所得产物,其在施用至体液或水性液体后随着生物相容性有机溶剂从聚合物-gnrh激动剂混合物中消散或扩散远离开始经由聚合物-gnrh激动剂混合物的凝结和/或沉淀固化成固体物质,并进入宿主组织。随着可生物降解的聚合物在约6个月(或约24周)的时段降解时,该剩余的固体物质充当缓释贮藏物,其允许治疗化合物连续、稳态地扩散释放到体内。
90.亮丙瑞林或其任何药学上可接受的等同物或盐是合成的gnrh激动剂肽类似物,其通过降低cpp相关激素,如lh和fsh的血清浓度来显示在治疗cpp中的有效使用(kim,y.j.,et al.“multicenter clinical trial of leuprolide acetate depot(luphere depot 3.75mg)for efficacy and safety in girls with central precocious puberty.”ann pediatr endocrinol metab.2013;18(4):173-178)。治疗后,垂体前叶对lh和fsh的抑制在本质上是可逆的。亮丙瑞林作用于垂体gnrh受体上。亮丙瑞林等同物,如醋酸亮丙瑞林,已被证明增加和/或恢复预计的成年身高,以及保护来防止与青春期症状早发相关的社会心理伤害。醋酸亮丙瑞林被证明可安全有效地用于治疗前列腺癌,剂量高达20mg/天长达2年,与1mg/天剂量超过2年观察到的不良反应没有不同。
91.在本发明的一个实施方案中,缓释组合物用于治疗至少2岁儿童的cpp,并且包含生物相容性有机溶剂、gnrh激动剂亮丙瑞林或其药学上可接受的盐,和可生物降解的聚合物,该缓释组合物在施用到体内后形成原位固体贮藏物,随后为儿童提供针对cpp的有效治疗约6个月(或约12周)。下文更详细地描述了缓释组合物的组分。
92.溶剂:
93.如本文所用,术语“生物相容性有机溶剂”可定义为可安全注射到人体内、优选在至少2岁的儿童体内安全的任何碳基溶剂。术语“生物相容性有机溶剂”可以与如但不限于与“有机溶剂”、“溶剂”或“基液”的术语互换使用。生物相容性溶剂在本质上可以是同质的或异质的。有机溶剂可以是极性非质子溶剂,其在体液中通常是无毒的。有机溶剂可能部分
至完全不溶于水。
94.在本发明的一些实施方案中,生物相容性有机溶剂可以是能够溶解可生物降解聚合物然后与gnrh或gnrh激动剂(如醋酸亮丙瑞林)当三种组分组结合时形成悬浮液的任何有机溶剂。此外,生物相容性有机溶剂可以是任何有机溶剂,其在施用后可部分或完全消散或扩散到宿主周围组织中。在施用到体液中时有机溶剂的扩散或消散允许聚合物和gnrh或gnrh激动剂经由两种组分在体液中的凝结或沉淀而固化为固体(即非液体)物质。有机溶剂的水不溶性程度可以根据所需的扩散到体液中的速率来调节,以控制聚合物固化的速率和范围。此外,可以调节有机溶剂的水不溶性程度以控制可流动的缓释组合物的粘度,这对于缓释组合物的容易制备和施用是重要的。
95.在一些实施方案中,生物相容性有机溶剂可以至少部分地由选自以下项组成的组一种或多种有机溶剂组成:酰胺、酸、醇、一元酸的酯、醚醇、亚砜、内酯、多羟基醇、多羟基醇的酯、酮和醚。
96.在一些实施方案中,生物相容性有机溶剂可以至少部分地由选自以下项组成的组一种或多种有机溶剂组成:n-甲基-2-吡咯烷酮(nmp)、2-吡咯烷酮、n-乙基-2-吡咯烷酮、n-环己基-2-吡咯烷酮、n-羟乙基-2-吡咯烷酮、二甲基乙酰胺、二甲基甲酰胺、乙酸、乳酸、乙醇、丙醇、乳酸甲酯、乳酸乙酯、乙酸甲酯、二甘醇单甲醚、糖原质、甘油缩甲醛、异丙叉甘油、二甲亚砜、e-己内酯、丁内酯、丙二醇、聚乙二醇、甘油、1,3-丁二醇、甲氧基聚乙二醇、甲氧基丙二醇、丙酮、甲基乙基酮和四氢呋喃。
97.在一些实施方案中,选择用于治疗cpp的缓释组合物中的有机溶剂是n-甲基-2-吡咯烷酮(nmp)。在本发明的一些实施方案中,约100mg、约105mg、约110mg、约115mg、约120mg、约125mg、约130mg、约135mg、约140mg、约145mg、约150mg、约155mg、约160mg、约165mg、约170mg、约175mg、约180mg、约185mg、约190mg、约195或约200mg的nmp可以在缓释组合物中使用。在一些情况下,约165mg的nmp可用作缓释组合物的有机溶剂。在本发明的一些实施方案中,缓释组合物中使用的nmp的量可以代表约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%或约50%的基于重量比(w:w)的缓释组合物。在一些情况下,缓释组合物包含约44%w:w的nmp。
98.gnrh或gnrh激动剂:
99.如本文所用,术语“gnrh”可指“促性腺激素释放激素”。gnrh是从人脑下丘脑区域释放的天然内源性神经激素。gnrh作用于位于人脑垂体区域的gnrh受体,刺激垂体促性腺激素的合成和全身释放。gnrh是肽激素,其靶向其他非源性内分泌腺。gnrh由人基因gnrh1作为前激素原合成,其随后在下丘脑-垂体-性腺轴的调节下加工成最终形式。“gnrh”的序列是容易知道和可获得的。gnrh以脉动方式从下丘脑分泌。“gnrh”浓度和功能活性在正常儿童时期非常低。青春期进入青少年期与gnrh水平和相关活性的增加有关。
100.如本文所用,术语“gnrh激动剂”可定义为模拟gnrh的结构和/或功能活性的任何物质,如通过结合并激活gnrh受体。gnrh激动剂可以是肽或小分子药品。gnrh可以与但不限于与术语“gnrha”、“gnrh类似物”、“gnrh配体”、“gnrh合成模拟物”或“gnrh调节剂”互换使用。术语gnrh激动剂可以进一步与更广泛的术语gnrh同义使用。gnrh激动剂本质上可以是天然的和/或合成的。gnrh激动剂本质上可以是天然的或合成的。gnrh激动剂以刺激性的方式作用于gnrh受体,以刺激位于大脑垂体区域内的促性腺激素细胞释放促性腺激素。然而,
延长暴露于gnrh或gnrh激动剂下会导致gnrh受体脱敏和下调,导致“性腺功能减退”。
101.在本发明的一些实施方案中,缓释组合物中使用的gnrh或gnrh激动剂可以是能够模拟gnrh的功能活性来结合和调节gnrh受体的肽或小分子药品。gnrh或gnrh激动剂可以是天然的或合成的,也可以是内源的或外源的来源。gnrh激动剂的实施例可包括但不限于亮丙瑞林(leuprolide(leuprorelin))、促性腺激素、戈舍瑞林、组氨瑞林、那法瑞林、布舍瑞林、曲普瑞林或任何已知的其药学上可接受的等同物或盐。gnrh或任何gnrh激动剂的序列是容易已知和可获得的。
102.在本发明的一个实施方案中,缓释组合物包含亮丙瑞林或其药学上可接受的等同物或盐作为活性药物成分(api)。亮丙瑞林是合成的gnrh激动剂肽类似物,可通过降低cpp相关促性腺激素和/或性激素的血清浓度来有效治疗cpp。亮丙瑞林对gnrh受体的作用类似于gnrh。延长暴露于亮丙瑞林可在个体内建立性腺机能减退,抑制垂体前叶的促性腺激素lh和fsh,在停止暴露于亮丙瑞林后本质上是可逆的。
103.已知的药学等同物(即亮丙瑞林的衍生物)包括但不限于亮丙瑞林6nmedleu、亮丙瑞林8nmearg、亮丙瑞林3nme1nal、亮丙瑞林2phe、亮丙瑞林2nmehis、亮丙瑞林2nmephe、亮丙瑞林10sarnh2、亮丙瑞林-乙基-d5、亮丙瑞林5nmetyr、亮丙瑞林7nmeleu、亮丙瑞林4nmeser和亮丙瑞林3-1nal。任何这些亮丙瑞林衍生物的序列和化学结构是容易已知和可获得的。在本发明的一些实施方案中,未修饰的亮丙瑞林是用于缓释组合物中的形式。
104.已知的亮丙瑞林的药学上可接受的盐包括但不限于醋酸亮丙瑞林、单乙酸亮丙瑞林、油酸亮丙瑞林、棕榈酸亮丙瑞林、甲磺酸亮丙瑞林、三氟乙酸(tfa)亮丙瑞林、三氟乙酸亮丙瑞林、亮丙瑞林(5-9)、(d-his2)-三氟乙酸(tfa)亮丙瑞林、盐酸(hcl)亮丙瑞林、醋酸亮丙瑞林-d5和亮丙瑞林(l-leu)。任何这些亮丙瑞林盐的序列和化学结构是容易已知和可获得的。在本发明的一些实施方案中,醋酸亮丙瑞林是缓释组合物中使用的盐形式。
105.在本发明的一些实施方案中,约40mg、约41mg、约42mg、约43mg、约44mg、约45mg、约46mg、约47mg、约48mg、约49mg、或约50mg的醋酸亮丙瑞林可用于缓释组合物中。在一些情况下,在缓释组合物中可以使用约45mg的醋酸亮丙瑞林。在本发明的一些实施方案中,缓释组合物中使用的醋酸亮丙瑞林的量可以代表约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%或约20%的基于w:w的缓释组合物。在一些情况下,缓释组合物包含约12%w:w的醋酸亮丙瑞林。
106.如本文所用,术语“游离碱等同物”可指含有胺的化合物或物质的共轭碱或去质子化形式。例如,42mg的亮丙瑞林代表45mg的醋酸亮丙瑞林的游离碱等同物。在一些实施中,缓释组合物中亮丙瑞林或其药学上可接受的等同物或盐的量可为约40mg、约41mg、约42mg、约43mg、约44mg、约45mg、约46mg、约47mg、约48mg、约49mg或约50mg的亮丙瑞林游离碱等同物。在一些情况下,缓释组合物中亮丙瑞林或其药学上可接受的等同物的量可为约42mg的亮丙瑞林游离碱等同物。
107.如本文所用,术语“gnrh受体”可定义为存在于位于人脑垂体区的促性腺激素细胞表面上的促性腺激素释放激素受体。gnrhr也可以在额外组织,如淋巴细胞、乳腺、卵巢和前列腺中找到。在一些情况下,gnrh受体可与“gnrhr”或“促黄体激素释放激素受体(lhrhr)”互换使用。然而,重要的是要注意术语lhrhr不应与术语lhr混淆,lhr在下面更详细地定义,
其负责结合lh。gnrh受体以两种主要形式从gnrhr和gnrhr2基因合成。gnrh受体与g蛋白偶联,当gnrh或gnrh激动剂与gnrh受体结合时g蛋白将信号转导传播到宿主细胞中。通过gnrh结合激活gnrh受体(即lhrhr)导致促性腺激素和性激素从大脑垂体区的促性腺激素细胞合成和释放到全身。响应gnrh或gnrh激动剂结合,gnrh受体可通过此类普遍的机制进行调节,该机制包括但不限于1)瞬时上调,2)脱敏,3)下调和/或4)调节(modulation)。任一gnrh受体形式的序列都是容易知道和可获得的。
108.如本文所用,术语“促性腺激素”或“促性腺激素细胞(gonadotrope cell)”可用于指能够产生和释放促性腺激素的内分泌细胞系。促性腺激素可与“促性腺细胞(gonadotrophic cell)”互换使用。促性腺激素细胞主要位于人脑的垂体前叶区域,通过细胞外gnrh或gnrh激动剂与促性腺细胞表面gnrh受体结合来调节。促性腺细胞也可以通过结合细胞外性激素如睾酮和雌二醇来调节。
109.如本文所用,术语“促性腺激素”可定义为由位于人脑垂体前叶区内的促性腺激素细胞分泌的一类糖蛋白多肽激素。促性腺激素可与但不限于与“gn”、“垂体促性腺激素”以及在某些情况下与“垂体激素”互换使用。促性腺激素可包括但不限于促黄体激素(lh)、促卵泡激素(fsh)和绒毛膜促性腺激素(cg)。促性腺激素全身释放到体内使它们能够作用于性腺(睾丸和卵巢)以延长性激素和配子的产生。促性腺激素分泌以脉动方式发生。促性腺激素释放降低导致性腺机能减退。任何感兴趣的促性腺激素的序列都是容易知道和可获得的。
110.在一些实施方案中,gnrh激动剂亮丙瑞林或其药学上可接受的等同物作为缓释组合物中的活性药物成分(api)的施用可用于激活gnrh受体,类似于重新合成(de novo)gnrh。与gnrh类似,通过亮丙瑞林或其药学上可接受的等同物或盐对gnrhr的刺激导致酪氨酸磷酸酶激活,最终导致促性腺激素如lh和fsh的细胞外释放,以及随后释放额外的性激素。然而,延长gnrhr暴露于亮丙瑞林或其药学上可接受的等同物可用于实现抑制促性腺激素全身释放到体内。持续暴露于亮丙瑞林导致gnrhr脱敏和下调。因此,gnrh激动剂亮丙瑞林或其药学上可接受的等同物作为缓释组合物中的api可在医学上有效地用于在患有cpp的至少2岁儿童体内建立性腺机能减退。
111.在一些实施方案中,亮丙瑞林或其药学上可接受的等同物的初始施用可导致gnrhr的瞬时兴奋性激活,这导致促性腺激素细胞向体内释放的促性腺激素暂时增加。这种短暂的出现可以同义地称为初始“突然发作”反应,并且在施用gnrh和其他gnrh激动剂时同样可见。
112.本发明的缓释组合物的一个优点是缓释组合物中gnrh或gnrh激动剂如亮丙瑞林或其药学上可接受的等同物的量与接受治疗的儿童的体重无关和/或在治疗期间与儿童的临床反应无关。特别地,缓释组合物中的gnrh或gnrh激动剂如亮丙瑞林或其药学上可接受的等同物的量从缓释组合物向儿童的初始施用至后续施用没有改变。换言之,本发明的缓释组合物向所有用该组合物治疗的儿童提供固定剂量的gnrh或gnrh激动剂,无论儿童体重、儿童对治疗的临床反应或任何其他可能的相关因素,该剂量在治疗过程中未改变。不需要调整缓释组合物中gnrh激动剂的量或缓释组合物本身的量,代表了相对于lupron1个月和3个月制剂的改进,lupron与本发明的制剂不同,其需要根据儿童的体重和/或对治疗的临床反应不断调整剂量,以便在每个单独儿童中实
现有效的治疗。因此,本发明受益于提供用于治疗任何患有cpp的儿童的单一标准剂量方案和促进患有该病况儿童的治疗的依从性的改进。
113.聚合物:
114.如本文所用,术语“聚合物”可定义为大分子有机化合物,其主要但不一定排他地由共价结合在链中的重复单元形成,所述链可为直链或支链。“重复单元”是大分子的结构部分,它可以在大分子结构中发现不止一次。通常,聚合物包含大量仅几种类型的重复单元,这些重复单元通过共价化学键连接在一起形成线性主链,取代基可能或可能不以支化方式依赖于该主链。重复单元可以彼此相同,但不一定如此。因此,-a-a-a-a-型结构(其中a是重复单元)是聚合物,其被称为均聚物。而-a-b-a-b-或-a-a-a-b-a-a-a-b-型结构(其中a和b是重复单元)也是聚合物,其有时也称为共聚物。-a-a-a-c-a-a-a或a-b-a-c-a-b-a型结构(其中a和b是重复单元但c不是重复单元(即,c在大分子结构中仅发现一次))也是本文定义下的聚合物。当c两边侧翼是重复单元时,c被称为“核心”或“核心单元”。由多达约10个重复单元形成的短聚合物被称为“寡聚物”。聚合物中重复单元的数量理论上没有上限,但实际上单个聚合物分子中重复单元的数量上限可能约为一百万。然而,在本发明的聚合物中,重复单元的数量通常为数百个。在一些实施方案中,术语“聚合物”可以与术语“可生物降解聚合物”互换使用。
115.术语“共聚物”可用于指包含不同重复单元的多种聚合物。“共聚物”在由多于一种类型的重复单元定义的序列中可以是规则的或无规的。一些类型的共聚物是无规共聚物、接枝共聚物(graft copolymer)和嵌段共聚物(block copolymer)。
116.类似地,本文所用的术语“聚合物节段”或“共聚物节段”可以指较大分子的部分(portion)或部分(moiety),其中该片段分别是聚合物或共聚物的段(section)。它与其他部分(portion)或部分(moiety)结合组成更大分子。当聚合物节段或共聚物节段仅在该片段的一端连接到较大的分子时,连接端是“近端”,而另一个游离端是“远端”。
117.在本发明的一些实施方案中,缓释组合物中使用的可生物降解聚合物可以是通式的聚合物:
118.ho—(p)—c(
═
o)o—ra—o(o
═
)c—(p)—oh
119.其中ra是核心单元,p是聚合物节段。在一些实施方案中,本发明的可生物降解聚合物可包含选自以下项的聚合物节段:聚(丙交酯-共-乙交酯)(plg)、聚(乳酸-共-乙醇酸)(plga)、聚丙交酯(pl)、聚(乳酸)(pla)或其组合。在一些实施方案中,聚合物通过使用合适的催化剂从核心单元起始的丙交酯和乙交酯单体的开环聚合而形成。开环丙交酯和乙交酯单体经由共价键共价连接至核心单元,因此聚合物不包含可滴定的羧基远端。与本领域已知的许多聚合物相比,本发明的可生物降解聚合物不包含任何可滴定的羧酸基团,而是包含plg、plga、pl和/或pla聚合物的至少一个羟基封端的远端片段。在一些实施方案中,如上式所示,共聚物的两个远端都是羟基封端的。
120.如本文所用,术语“催化剂”可以指能够引发或和/或增加聚合速率的任何合适的物质。在一些实施方案中,催化剂可以是任何适用于开环聚合的催化剂。例如,有机酸的锡盐可以用作聚合催化剂。锡盐可以是亚锡(二价)或锡(四价)形式。在一些情况下,可以使用催化剂辛酸亚锡。催化剂可以以任何合适的量存在于聚合反应混合物中,通常在约百分比0.01至1.0的范围内。
121.术语“核”或“核心单元”在本文中可用于指聚合物的部分(portion)或部分(moiety),其本身不是共聚物节段,但并入聚合物链内并具有至少一种聚合物或共聚物节段结合到它。核可在与选择的合适催化剂接触时变成能够聚合的化学反应性种类。核在聚合反应期间可由并入到从中生长的聚合物链中的分子形成。核可具有与其结合的两个或更多个聚合物或共聚物节段。
122.在一些实施方案中,聚合物的核心单元可以是烷烃二醇。在一些情况下,本文使用的烷烃二醇可以是约4至约8个碳原子的饱和、支链或直链或环状烷烃二醇。烷烃二醇可以转化为具有两个单价自由基中心的烷烃双基,所述单价自由基中心是经由催化剂从亲本烷烃二醇的不同碳原子上除去两个氢原子而衍生的,其中每个单价自由基中心带有羟基。因此,烷烃二醇是二羟基烷烃。由烷烃双基引发的丙交酯和乙交酯单体的开环聚合导致单体经由共价酯键与核心单元连接,使得聚合物不包含可滴定的羧基末端。
123.在一些实施方案中,可用于本发明的烷烃二醇可包括但不限于:1,4-丁烯(—ch2ch2ch2ch2—)、2,3-丁烯(ch3chchch3)、1,6-己烯(—ch2ch2ch2ch2ch2ch2—)、1,4-环己烷二甲基(-ch
2-环己基-ch
2-)等。因此,在一些进一步的情况下,本发明的典型烷烃二醇可包括但不限于1,4-丁二醇(hoch2ch2ch2ch2oh)、2,3-丁二醇(ch3ch(oh)ch(oh)ch3)、1,6-己二醇(hoch2ch2ch2ch2ch2ch2oh)、环己烷-1,4-二甲醇等。在其他情况下,烷烃二醇可以任选地被形成烷烃部分的碳原子上的其他官能团取代,包括但不限于如烷氧基、羟基、卤素、氰基、羧基、烷基羧基、羧酰胺基、烷基或二烷基羧酰胺基、烷基或芳基硫代、氨基、烷基或二烷基氨基、芳基或杂芳基的基团。在一些进一步的实施方案中,α,ω-二醇是指烷烃二醇,其中两个羟基分别位于烷烃链的两个端的碳原子上,可以用作聚合物的核心单元(即α,ω-二醇包含两个伯羟基)。典型的α,ω-二醇可包括但不限于:1,4-丁二醇和1,6-己二醇。在一些实施方案中,选择的烷烃二醇可以以约0.05%至约5.0%范围内的量存在于聚合反应混合物中。在一些情况下,聚合反应混合物中使用的选择的烷烃二醇的量为约0.5%至约2.0%。重量百分比越大,聚合反应混合物中烷烃二醇的摩尔分数越大,连接到烷烃二醇核心的聚合物的链长越短,这是由于每个引发羟基的丙交酯或乙交酯试剂分子的可用性降低。
124.在本发明的其他实施方式中,聚合物的核心单元可以是单官能醇。在本发明中用作核心单元的醇包括但不限于甲醇、乙醇或1-十二烷醇,它们将提供具有核心单元的聚合物,该聚合物在一个远端为末端的酯基,而在另一个远端为羟基。在本发明的一些实施方案中,使用单官能醇作为核心单元形成的可生物降解的聚合物可以是以下通式的聚合物:
125.ch3—(ch2)n—c(
═
o)o—(p)—oh
126.其中n可为≥0的整数且p为聚合物节段。
127.如本文所用,术语“丙交酯”可在本文中使用,当指化合物本身时,例如作为“丙交酯试剂”或“丙交酯反应物”是指乳酸的二聚环酯:
[0128][0129]
在本文术语的含义内,丙交酯可以在手性碳原子(带有甲基)处具有任何构型。它也可以是在手性碳原子处具有不同构型的分子的混合物。因此,丙交酯可以是dd-、dl-、
ld-、ll-丙交酯或其任何混合物或组合。
[0130]
在一些实施方案中,当提及聚合物如含有“丙交酯”单元的“聚(丙交酯-乙交酯)”时,术语“丙交酯”或“丙交酯单元”是指由两个通过酯键连接的乳酸单元组成的开环种类,其可以进一步与其他此类单元或与其他类型的重复单元并入到聚合链中。丙交酯单元的一端包含羧基,该羧基可经由酯键或酰胺键或经由羧基可形成的任何其他类型的键与相邻原子结合。丙交酯单元的另一端包含羟基,该羟基可以经由酯键、醚键或经由羟基可以形成的任何其他类型的键与相邻原子结合。因此,聚丙交酯聚合物中的“丙交酯”是指聚合物的重复单元,从结构上看,它是由一对乳酸分子形成的,应理解波浪线表示与相邻基团的连接点:
[0131]
同样,手性碳原子处的构型包括任何和所有可能的构型及其混合物,如上文对环状二聚体所述。
[0132]
当指化合物本身时,术语“乙交酯”在本文中可用,如“乙交酯试剂”或“乙交酯反应物”时,意指乙醇酸的二聚环酯:
[0133][0134]
当提到聚合物中的“乙交酯”单元时,该术语指的是重复单元,如下所示乙醇酸的二聚体:
[0135]
类似于丙交酯单元,在一些实施方案中,乙交酯单元的一端可包含经由酯键或酰胺键或经由羧基可形成的任何其他类型的键与相邻原子结合的羧基,乙交酯单元的另一端包含羟基,该羟基可以经由酯键、醚键或经由羟基可以形成的任何其他类型的键与相邻原子结合。
[0136]
应当理解,本领域技术人员理解,本文所用的“丙交酯”或“乙交酯”在任一意义上本身分别是乳酸或乙醇酸的二聚体,其为环状或线性的。在包含此类二聚分子种类的聚合物中,如本文所定义的重复单元因此在形式上本身是二聚体。这种类型的聚合物在本文中称为“聚丙交酯”或“聚(丙交酯-乙交酯)”。此外,众所周知,本领域还有其他已知聚合物为“聚乳酸”或“聚乙醇酸”,它们由单体(乳酸(lactate)(乳酸(lactic acid))或乙醇酸(glycolate)(乙醇酸(glycolic acid)))聚合形成,。本领域还存在已知的为“聚(乳酸-乙醇酸)(poly(lactic acid-glycolic acid))”或“聚(乳酸-乙醇酸)(poly(lactate-glycolate))”的共聚物。在这种类型的聚合物中,重复单元是包含乳酸、乙醇酸或两者的单体。
[0137]
当聚合物仅由乳酸单元或仅由乙醇酸单元形成时,除了关于制作聚合物的方法之
外,区别相对不显著。然而,当聚合物由乳酸和乙醇酸单元的混合物形成时,这种区别在结构上很重要。例如,由单体乳酸和乙醇酸单元形成的聚合物可以包含-l-g-l-g-类型的序列,其中l是乳酸单元并且g是乙醇酸单元。然而,在由丙交酯和乙交酯单元形成的聚合物中,除非发生重排,否则不会发现此类序列,因为重复单元将聚合物连接为乳酸和乙醇酸单元对。因此,如-l-l-g-g-或-l-l-l-l-g-g-的序列将代表由丙交酯和乙交酯单元形成的聚合物,并且偶然也可以在由单体乳酸和乙醇酸单元形成的聚合物中发现。在由二聚单元形成的聚合物中,每种类型的重复单元将基本上总是包含一对相同的单体单元。因此,人们不会预期找到-l-g-l-g-类型的序列。由于这种潜在的歧义,区分这两种类型的聚合物很重要。
[0138]
术语“聚(丙交酯-乙交酯)”、“聚(丙交酯-共-乙交酯)”或“plg”在本文中可用于仅指由二聚重复单元形成的共聚物或共聚物节段,其中二聚丙交酯和二聚乙交酯单元构成聚合物链。“聚(丙交酯-乙交酯)”通常通过环状二聚体丙交酯和乙交酯的聚合形成,尽管理论上它也可以通过其中在聚合过程的给定步骤中引入二聚单元的任何过程形成。术语“聚丙交酯”和“pl”是指其中仅存在丙交酯重复单元的聚合物或聚合物节段。聚丙交酯以两种立体形式存在,用d或l表示右旋或左旋,或用dl表示外消旋混合物,例如聚(d,l-丙交酯)或聚(d,l-丙交酯-共-乙交酯)。
[0139]
如本文所用,术语“聚(乳酸-乙醇酸(lactic acid-glycolic acid))”、“聚(乳酸-共-乙醇酸)(poly(lactic acid-co-glycolic acid))”、“聚(乳酸-乙醇酸(lactate-glycolate))”、“聚(乳酸-共-乙醇酸)(poly(lactate-co-glycolate))”或“plga”可仅用于指代由单体重复单元形成的聚合物,其中单体乳酸和乙醇酸单元构成聚合物链。聚(乳酸-乙醇酸)通过单体乳酸和单体乙醇酸或这些酸的衍生物如低级烷基酯的聚合而形成。类似地,术语“聚乳酸(polylactate)”、“聚(乳酸)(poly(lactic acid))”和“pla”是指其中仅存在乳酸重复单元的聚合物或聚合物节段。它们是由乳酸聚合而形成的。聚(乳酸)以两种立体形式存在,用d或l表示右旋或左旋,或用dl表示外消旋混合物,例如聚(d,l-乳酸)或聚(d,l-乳酸-共-乙醇酸)。
[0140]
在本发明的一些实施方案中,本发明的可生物降解聚合物可包含选自以下项的聚合物节段:聚(丙交酯-共-乙交酯)(plg)共聚物、聚(乳酸-共-乙醇酸)(plga)共聚物或其组合,其中单体丙交酯或乳酸与乙交酯或乙醇酸的比例可为约45:55至约99:1。在一些情况下,本发明的可生物降解聚合物包含选自以下项的聚合物节段:聚(丙交酯-共-乙交酯)(plg)共聚物、聚(乳酸-共-乙醇酸)(plga)共聚物或其组合,其中单体丙交酯或乳酸与乙交酯或乙醇酸的比例可为约85:15。例如,聚合物可包含由重量比约85:15的dl-丙交酯与乙交酯组成的plg共聚片段。类似地,聚合物可包含由重量比约85:15的dl-乳酸与乙醇酸组成的plga聚合物节段。聚合物可包含plg和plga共聚片段的组合,各自分别由重量比约85:15的dl-丙交酯与乙交酯或d,l-乳酸与乙醇酸组成。
[0141]
在本发明的一些实施方案中,约100mg、约105mg、约110mg、约115mg、约120mg、约125mg、约130mg、约135mg、约140mg、约145mg、150mg、约155mg、约160mg、约165mg、约170mg、约175mg、约180mg、约185mg、约190mg、约195或约200mg的可生物降解聚合物可用于缓释组合物中。在一些情况下,在缓释组合物中可以使用约165mg的可生物降解聚合物。在本发明的一些实施方案中,缓释组合物中使用的可生物降解聚合物的量可以代表基于w:w约40%、
约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%或约50%的缓释组合物。在一些情况下,缓释组合物包含约40%w:w的可生物降解聚合物。
[0142]
术语“数均分子量”可以指定义为样品总重量除以样品中聚合物分子总数的标准聚合物参数:
[0143]
mn=∑inimi∑ini
[0144]
其中ni是分子量为mi的分子数。
[0145]
术语“重均分子量”可以指标准聚合物参数,定义为:
[0146]
mw=∑inimi2∑inimi
[0147]
其中ni是分子量为mi的分子的数目。
[0148]
在一些实施方案中,可生物降解聚合物可包含约6kda至约45kda的重均分子量。在一些进一步的实施方案中,本发明的可生物降解聚合物可包含约20kda、约21kda、约22kda、约23kda、约24kda、约25kda或约26kda的重均分子量。应当理解,两个l/g共聚物节段不必相同,并且可能在给定聚合物分子中每个共聚物节段的序列或分子量上不相同。此外,聚合物样品中每个分子的具体组成以相同的方式变化。聚合物中丙交酯或乙交酯重复单体单元的重量百分比和由此的摩尔百分比可以通过改变聚合反应混合物中存在的两种反应物的重量百分比来改变。
[0149]
如本文所用,术语“可滴定的羧酸基团”可用于指游离形式的羧酸基团,即,未结合为酯或其他衍生物,其中该羧酸基团可带有可在水溶液中离解(离子化)形成羧酸根阴离子和质子(酸)的游离质子。因此,没有可滴定的羧酸基团的有机聚合物不是酸性聚合物,并且聚合物中的所有羧酸根部分都结合成酯、酰胺或其他非酸性衍生物。
[0150]
在本发明的聚合物中不存在可滴定的羧酸基团意味着存在于聚合物的末端上(即,在连接至核心单元的共聚物节段的远端的基团上)的化学官能团,是化学中性的。如本文所用,术语“化学中性”定义为不存在任何性质为酸性或碱性的聚合物端基,因此在约中性ph的水溶液中不可离子化。聚合物的化学中性是有利的,因为聚合物中不存在酸性基团以通过聚合物酯键的水解引起自催化降解,或催化含有的药物如肽类似物亮丙瑞林的降解,或与含有的药物反应,如与肽类似物亮丙瑞林上的胺基反应。
[0151]
因此,在一些实施方案中,缓释组合物的聚合物包含化学中性特征,其有助于防止将聚合物节段与核心单元连接的键的自催化降解,以及防止缓释组合物含有的gnrh或gnrh激动剂(即醋酸亮丙瑞林)的催化降解。本文所用的聚合物的化学中性有利于通过从原位贮藏物连续缓释亮丙瑞林或其药学上可接受的等同物,在组合物的单次剂量后维持对至少2岁儿童的cpp的有效治疗持续至少6个月。此外,当施用可生物降解的缓释组合物给患有cpp的至少2岁儿童的身体时,当可生物降解的缓释组合物在体内降解时,在至少6个月或更长时间段内没有显示相关的毒性。
[0152]
在本发明的一些实施方案中,可生物降解的聚合物基本上不溶于水,随后可以配制在生物相容性有机溶剂中,如前文所定义,从而制备本发明的用于治疗患有cpp的至少2岁的儿童的缓释组合物。在一些实施方案中,不溶性可生物降解聚合物可以溶解或悬浮在生物相容性有机溶剂如nmp中。在一些情况下,溶解或悬浮的聚合物-有机溶剂混合物然后可用于悬浮一定量的gnrh或gnrh激动剂,如醋酸亮丙瑞林。或者,在另一种情况下,可将可生物降解的聚合物溶解或悬浮在已经含有一定量的gnrh或gnrh激动剂(如醋酸亮丙瑞林)
的生物相容性有机溶剂中。可生物降解的聚合物与生物相容性有机溶剂和gnrh或gnrh激动剂的组合产生本发明的最终缓释组合物。
[0153]
刺激组合物部分
[0154]
在本发明的一些实施方案中,本文用于有效治疗至少2岁儿童的cpp的缓释组合物可以与施用一种或多种刺激组合物的组合方案一起使用。如下文进一步详述的,刺激组合物可用于测量刺激后从个体获得的血液样品的一种或多种促性腺激素和/或性激素的峰值血清浓度。刺激组合物(例如包含gnrh或gnrh激动剂(如醋酸亮丙瑞林)的刺激组合物),当皮下注射时,刺激位于脑垂体前叶区域内的促性腺细胞的细胞表面上的促性腺激素受体的激活。以下信号激活会激活促性腺激素、lh和fsh的脉动释放,其随后触发下游性激素(如睾酮和雌二醇)从外周性组织(即睾丸和卵巢)的释放。通过使用刺激组合物确定的促性腺激素和/或性激素的峰值刺激血清浓度水平在医学上可用于诊断和/或监测cpp的进展,以及监测对特定疗法或治疗选择的治疗反应。在一些情况下,刺激组合物的使用可用于确定感兴趣的个体(如正在接受cpp治疗的儿童)内的性腺机能减退的不存在、存在和/或程度。
[0155]
如本文所用,术语“峰值刺激血清浓度”可定义为从血液样品测量的任何cpp相关激素包括但不限于lh、fsh、睾酮或雌二醇的血清浓度,其中血液样品是在施用刺激测试组合物后约0.5小时、约0.75小时、约1.0小时、约1.25小时、约1.5小时、约1.75小时、约2.0小时、约2.25小时、约2.5小时、约2.75小时、约3小时或更长时间内从儿童体内获得的。然后对从儿童体内获得的血液样品进行标准实验室测试,以测量一种或多种cpp相关激素如lh、fsh、睾酮或雌二醇的浓度。在本发明的一些实施方案中,可以在施用缓释组合物之前或之后获得峰值刺激血清浓度。在施用缓释组合物之前获得的峰值刺激血清浓度也可以称为“基线峰值刺激血清浓度”。
[0156]
本文使用的术语“非峰值血清浓度”可以定义为在没有施用刺激测试组合物的情况下从儿童体内获得的血液样品测量的任何cpp相关激素的血清浓度,所述激素包括但不限于lh、fsh、睾酮或雌二醇。在本发明的一些实施方案中,非峰值血清浓度可在缓释组合物施用之前或之后获得。在施用缓释组合物之前获得的非峰值血清浓度也可称为“基线非峰值血清浓度”或“基础血清浓度”。在本发明的一些实施方案中,基线非峰值血清浓度可用于筛查怀疑患有cpp的儿童的诊断目的。由于非峰值血清浓度不依赖于刺激组合物的施用,因此通常可以在施用缓释组合物之前或之后的任何时间点从儿童体内获得血液样品。然而,在施用缓释组合物后立即(即约在约6小时或更短的时间内)从儿童体内获得的血液样品中获得的非峰值血清浓度可表明由于施用缓释组合物lh和fsh浓度的瞬时激增。然后对获得的血液样品进行标准实验室测试,以测量一种或多种cpp相关激素如lh、fsh、睾酮或雌二醇的浓度。
[0157]
在一些实施方案中,刺激组合物可包含gnrh或至少一种gnrh激动剂或其药学等同物或盐,其选自基本上由以下项组成的组:亮丙瑞林(leuprolide(leuprorelin))、戈那瑞林、戈舍瑞林、组氨瑞林、那法瑞林、布舍瑞林和曲普瑞林。
[0158]
在一些实施方案中,刺激组合物可包含gnrh或gnrh激动剂,其溶解或悬浮为在一个或多个无菌容器(即小瓶)内的液体溶液中,其准备好立即施用。在一些情况下,gnrh或gnrh激动剂可以作为干燥的冻干粉末储存在无菌容器中,然后在施用前将其溶解或悬浮为液体溶液。在一些实施方案中,单剂量的刺激组合物可制备为适用于注射的10μg至约1000μ
g的刺激组合物在约100μl至约2000μl的水中的液体溶液。例如,可以将1000μg醋酸亮丙瑞林制备在约200μl水中并用于皮下注射在患有cpp的儿童中。在一些情况下,制备的刺激组合物可以制备为单剂量或多剂量液体溶液以用于皮下注射到患有cpp的儿童中。在一些情况下,gnrh或gnrh激动剂可以溶解或悬浮在选择的缓冲液中,诸如,但不限于适合注射的无菌水。
[0159]
在一些情况下,刺激组合物可包含以总共约100μg的剂量的皮下施用的gnrh溶液。或者,在一些情况下,刺激组合物可包含剂量为约2.5μg每kg儿童体重的皮下施用的gnrh溶液。在一些情况下,刺激组合物可包含剂量为总共约500μg至约1000μg的皮下施用的醋酸亮丙瑞林溶液。或者,在一些情况下,刺激组合物可包含剂量为约10μg至约20μg每kg儿童体重的皮下施用的醋酸亮丙瑞林溶液。在一些情况下,刺激组合物可包含剂量为总共约100μg的皮下施用的醋酸那法瑞林溶液。或者,在一些情况下,刺激组合物可包含剂量为约1μg每kg儿童体重的皮下施用的醋酸那法瑞林溶液。在一些情况下,刺激组合物可包含剂量为总共约100μg的皮下施用的布舍瑞林溶液。在一些情况下,刺激组合物可包含剂量为总共约100μg的施用的醋酸曲普瑞林溶液。
[0160]
在一些实施方案中,刺激组合物可用于在施用如本文所公开根据本发明的缓释组合物之前的至少2岁的儿童的cpp的初始诊断,用于治疗其cpp。在其他实施方案中,刺激组合物可用于在施用任何一种或多种如本文所公开的根据本发明的缓释组合物后监测至少2岁的儿童的cpp的持续诊断,用于治疗其cpp。在其他实施方案中,刺激组合物可用于在施用如本文所公开的根据本发明的任何一种或多种缓释组合物后监测至少2岁儿童的cpp的治疗的进展或功效。在gnrh激动剂刺激后约三十分钟,lh的峰值刺激血清浓度》5iu/l可被认为是cpp的诊断依据。
[0161]
在一些情况下,可以将刺激组合物皮下施用给有其需要的儿童以测量一种或多种cpp相关激素的峰值刺激血清浓度。在一些情况下,刺激组合物可以皮下施用给有其需要的儿童以测量峰值刺激血清lh的浓度。在一些情况下,刺激组合物可以皮下施用给有其需要的儿童以测量峰值刺激血清fsh的浓度。在一些情况下,刺激组合物可以皮下施用给有其需要的男性儿童以测量峰值刺激血清睾酮的浓度。在一些情况下,可以将刺激组合物皮下施用给有其需要的女性儿童以测量峰值刺激血清雌二醇的浓度。
[0162]
cpp缓释组合物的施用
[0163]
如本文所公开,本发明的缓释组合物包含生物相容性有机溶剂、gnrh激动剂和基本上没有可滴定羧基末端并且具有至少一个远羟基封端的端基的可生物降解的聚合物,其可用于通过每约6个月(或约24周)施用一次的治疗2岁或以上儿科患者的cpp的有效方法。当皮下注射给患有cpp的至少2岁儿童时,缓释组合物通过生物相容性有机溶剂的消散或扩散远离缓释组合物的注射部位并进入周围的宿主组织中而形成原位贮藏物,所述原位贮藏物包含水不溶性可生物降解的聚合物和gnrh激动剂作为凝结或沉淀的固态物质。在一些实施方案中,可生物降解的聚合物包含选自以下项的聚合物节段:85:15聚(丙交酯-共-乙交酯)(plg)共聚物节段、85:15聚(乳酸-共-乙醇酸)(plga)共聚物节段或其组合。在一些实施方案中,可生物降解的聚合物包含聚丙交酯(pl)或聚(乳酸)(pla)聚合物节段或其组合。在一些实施方案中,gnrh激动剂是亮丙瑞林或其药学上可接受的等同物,包括但不限于醋酸亮丙瑞林。在一个实施方案中,缓释组合物作为45mg(醋酸亮丙瑞林)的单次皮下注射每六
个月施用一次。在一些实施方案中,生物相容性有机溶剂是nmp。在一些实施方案中,本发明的缓释组合物经由调节下丘脑-垂体-性腺轴来建立性腺机能减退,从而可用于治疗2岁或以上儿科患者的cpp。在一些实施方案中,缓释组合物通过抑制促性腺激素(如lh或fsh)和/或性激素(如睾酮或雌二醇)来建立性腺机能减退用于有效治疗儿童cpp。
[0164]
在一些实施方案中,在开始治疗之前,cpp的临床诊断应通过测量促黄体激素(lh)(基础的或用gnrh激动剂刺激的)的血清浓度、性类固醇和骨龄相对于实龄的评估来确认。在一些情况下,基线评估可包括身高和体重测量、大脑诊断成像(以排除颅内肿瘤)、盆腔/睾丸/肾上腺超声(以排除类固醇分泌性肿瘤)、人绒毛膜促性腺激素水平(以排除绒毛膜促性腺激素分泌肿瘤)和肾上腺类固醇测量以排除先天性肾上腺增生。上文已详细描述了使用有gnrh激动剂的刺激试验来测量lh的血清浓度。
[0165]
在一些实施方案中,本发明的缓释组合物应由医疗专业人员施用。在某些情况下,与通过皮下注射施用的其他药物一样,注射部位可能需要定期变化。在一些实施方案中,所选择的特定注射位置应该是具有足够柔软或松散皮下组织的区域,避免具有粗壮或纤维状皮下组织的区域或可能被摩擦或压缩(即,腰带或衣服腰带)的位置。
[0166]
如本文所用,术语“促黄体激素(lh)”可以指包含由基因cga和lhb编码的异二聚体糖蛋白的促性腺激素,并且可以与但不限于与“lutrophin”、“促黄体素(lutropin)”或“男性间质细胞刺激素(icsh)”互换使用。lh经由刺激睾丸中的睾丸间质细胞,在调节男性中睾酮产生中发挥着至关重要的作用。在女性中,lh负责通过刺激卵巢中的卵囊膜细胞来调节排卵、维持黄体和分泌雌激素,如雌二醇。lh的活性与fsh的活性具有协同作用。睾酮和/或雌二醇的刺激通过抑制gnrh释放来支持负反馈回路,从而抑制lh释放。在正常青春期发育之前,儿童体内的lh浓度通常非常低。然而,在年龄小于与正常青春期开始相关年龄(即女性和男性分别为8岁或9岁)的儿童中lh水平》5iu/l可被认为是在该儿童中存在cpp的诊断依据。
[0167]
如本文所用,术语“促卵泡激素(fsh)”可定义为包含由基因cga和fshb编码的异二聚体糖蛋白的促性腺激素。fsh刺激雄性激素结合蛋白的产生,从而使精子形成能够开始。在女性中,fsh刺激卵巢内卵泡的成熟。fsh的活性与lh的活性具有协同作用。在正常青春期发育之前,儿童体内的fsh浓度通常非常低。然而,在年龄小于与正常青春期开始相关年龄的儿童中(即女性和男性分别为《10岁或《9岁)fsh水平》2.5iu/l可被认为是儿童中cpp存在的诊断依据。
[0168]
术语“促性腺激素受体”可以包括但不限于“促黄体激素受体(lhr)”和“促卵泡激素受体(fshr)”。如前所述,lhr不应与lhrhr(即gnrhr)混淆。lhr和fshr分别由lhcgr基因和fshr基因编码。lhr、fshr或任何其他促性腺激素受体的序列是容易知道和可获得的。促性腺激素受体,如lhr和fshr,是主要位于卵巢、睾丸和/或子宫组织内的跨膜受体,并与g蛋白偶联以进行信号转导。促性腺激素受体的激活对于刺激性激素的产生和释放至关重要。lhr和fshr可由各种促性腺激素和/或性激素通过包括但不限于1)上调、2)脱敏、3)下调和/或4)调节的机制进行调节。
[0169]
如本文所用,术语“性激素”可以指结合雄激素或雌激素受体的甾体激素。性激素可以与但不限于与“性类固醇”或“外周性类固醇”同义使用。性激素分为三大类:1)孕激素,2)雄激素和3)雌激素。孕激素包括但不限于在妊娠和胚胎形成中起关键作用的孕酮(p4)。
雄激素包括但不限于睾酮,它是男性性发育中的主要性激素。雌激素包括但不限于雌二醇(e2),它是女性性发育中的主要性激素。需要注意的是,虽然lh和fsh通常不被视为性激素,但在某些情况下,术语“性激素”可能被解释为暗示lh和fsh。睾酮和雌二醇的释放对于青春期各种生理组织中发生的第二性征的发育和成熟至关重要,因此其受到严格调控。性激素具有多种细胞内结合受体,其有助于调节组织对性激素浓度增加的特异性反应。此外,性激素的释放可以对下丘脑-垂体-性腺轴内的各种组织具有额外的激活或抑制特性。例如,雄激素和雌激素都有助于负反馈回路,以分别降低男性和女性下丘脑和垂体中gnrh和促性腺激素的产生和释放。
[0170]
在一些情况下,随着缓释组合物经历部分或完全固化成原位贮藏物,施用后缓释组合物可在“爆发”阶段中释放初始量的gnrh或gnrh激动剂。在某些情况下,“爆发”阶段可能会在施用后约6小时或更短的时间内发生。在某些情况下,“爆发”阶段可能会导致儿童促性腺激素(如lh或fsh)和/或性激素(如睾酮或雌二醇)的峰值刺激和/或非峰值血清浓度的暂时增加。在其他实施方案中,“爆发”阶段之后是“平台”阶段,该平台阶段中,gnrh或gnrh激动剂的释放在血液中保持在连续水平。gnrh或gnrh激动剂从作为将缓释组合物施用到至少2岁儿童的结果而形成的原位贮藏物中连续释放,提供了随着时间的推移促性腺激素,如lh或fsh和/或性激素(如睾酮或雌二醇)的儿童峰值刺激和/或非峰值血清浓度的降低。促性腺激素和/或性激素的峰值刺激血清浓度可从在施用刺激测试组合物后约0.5小时、约0.75小时、约1.0小时、约1.25小时、约1.5小时、约1.75小时、约2.0小时、约2.25小时、约2.5小时、约2.75小时、约3小时、约4小时、约5小时、约6小时或更长时间内从儿童体内获得的血液样品测量,其中刺激组合物的施用可能发生在施用缓释组合物之前、或施用缓释组合物之后的任何时间。在一些情况下,促性腺激素和/或性激素的峰值刺激血清浓度可以在施用刺激组合物后短短30分钟内从儿童体内获得的血液样品中测量。
[0171]
约每6个月一次(或约每24周一次)施用缓释组合物后,儿童促性腺激素和/或性激素的峰值刺激血清浓度的降低提供了对所述儿童的cpp持续约6个月(或约24周)时间的有效疗法治疗。降低促性腺激素(如lh或fsh)和/或性激素(如睾酮或雌二醇)可用于建立个体的性腺机能减退,这在医学上可用于2岁及以上儿科患者的cpp的有效治疗。经由抑制促性腺激素和/或性激素来建立性腺机能减退能够减缓和/或停止与青春期发育相关的第二性征的发育或进展。与更短效的治疗选择(如lupron1个月和3个月)相比,在单次剂量后诱导性腺机能减退持续约6个月(或约24周)或更长时间是本发明的缓释组合物的有利特性,从而提高患者的依从性。相反,缓释组合物的0.375ml的较小注射剂量体积和更容易和更少疼痛的皮下施用途径优于类似和/或更持久的治疗选择,如和supprelin
[0172]
在一些实施方案中,在开始治疗后约3至约6个月时,可以通过gnrh激动剂刺激测试、基础血清lh水平或性类固醇水平的血清浓度来监测在皮下施用时对缓释组合物的反应,并进一步根据临床恰当来判断,以确认对垂体促性腺激素、性类固醇和第二性征进展的充分抑制。此外,在一些情况下,可以在约每6个月至约每12个月评估身高(用于计算生长速度)和骨龄。
[0173]
在一些实施方案中,缓释组合物降低lh的峰值刺激血清浓度至约《4iu/l的青春期前水平。在一些情况下,到施用第一剂的缓释组合物后约3个月(或约12周)或更长时间,缓
释组合物降低lh的峰值刺激血清浓度至约《4iu/l的青春期前水平。在一些情况下,缓释组合物的施用对于超过约50%、超过约55%、超过约60%、超过约65%、超过约70%、超过约75%、超过约80%、超过约85%、超过约90%、超过约95%或约100%的接受缓释组合物治疗的儿童在施用第一剂后约3个月(或12周)或更长时间可以降低lh的峰值刺激血清浓度至约《4iu/l的水平。在一些情况下,到施用第一剂的缓释组合物后约6个月(或约24周)或更长时间,缓释组合物降低lh的峰值刺激血清浓度至约《4iu/l的青春期前水平。在一些情况下,缓释组合物的施用对于超过约50%、超过约55%、超过约60%、超过约65%、超过约70%、超过约75%、超过约80%、超过约85%、超过约90%、超过约95%或约100%的接受缓释组合物治疗的儿童在施用第一剂后约6个月或更长时间可以降低lh的峰值刺激血清浓度至约《4iu/l的水平。
[0174]
然而,在一些实施方案中,如果在施用第一剂的缓释组合物后约3个月(或约12周)或约6个月(或约24周)施用刺激组合物后,峰值刺激血清浓度为约4iu/l或更高,则可以停止使用缓释组合物对患有cpp的儿童进行治疗。在施用第一剂缓释组合物后约3个月(或12约12周)或约6个月(或约24周)时,峰值刺激血清浓度为约4iu/l或更高的情况,可被视为儿童对缓释组合物无反应。作为一个非限制性实施例,对治疗的无反应性可以是cpp潜在误诊的一个指标,因此除了本文本发明的缓释组合物之外,还应该重新评估儿童的其他更有效的治疗方法。
[0175]
在一些实施方案中,缓释组合物降低fsh的峰值刺激血清浓度至约≤2.5iu/l的水平。在一些情况下,在施用第一剂的缓释组合物后约3个月(或约12周)缓释组合物降低fsh的峰值刺激血清浓度至约《2.5iu/l的水平。在一些情况下,缓释组合物的施用对于超过约50%、超过约55%、超过约60%、超过约65%、超过约70%、超过约75%、超过约80%、超过约85%、超过约90%、超过约95%或约100%的接受缓释组合物治疗的儿童在施用第一剂后约3个月(或12周)或更长时间可以降低fsh的峰值刺激血清浓度至约≤2.5iu/l的水平。在一些情况下,在施用第一剂的缓释组合物后约6个月(或约24周)缓释组合物降低fsh的峰值刺激血清浓度至约≤2.5iu/l的水平。在一些情况下,缓释组合物的施用对于超过约50%、超过约55%、超过约60%、超过约65%、超过约70%、超过约75%、超过约80%、超过约85%、超过约90%、超过约95%或约100%的接受缓释组合物治疗的儿童在施用第一剂后约6个月(或约24周)或更长时间可以降低fsh的峰值刺激血清浓度至约≤2.5iu/l的水平。
[0176]
在一些实施方案中,缓释组合物降低女性儿童中雌二醇的峰值刺激血清浓度至约《73.4pmol/l(即20pg/ml;美国境内的医生通常使用'pg/ml'雌二醇浓度的单位符号)的水平。在一些情况下,在施用第一剂缓释组合物后约3个月(或约12周)时,缓释组合物降低女性儿童的雌二醇峰值刺激血清浓度至约《73.4pmol/l的水平。在一些情况下,缓释组合物的施用对于超过约50%、超过约55%、超过约60%、超过约65%、超过约70%、超过约75%、超过约80%、超过约85%、超过约90%、超过约95%或约100%的接受缓释组合物治疗的女性儿童在施用第一剂后约3个月(或约12周)或更长时间可以降低雌二醇的峰值刺激血清浓度至约《73.4pmol/l的水平。在一些情况下,在施用第一剂的缓释组合物后约6个月(或约24周)缓释组合物降低女性儿童的雌二醇的峰值刺激血清浓度至约《73.4pmol/l的水平。在一些情况下,缓释组合物的施用对于超过约50%、超过约55%、超过约60%、超过约65%、超过约70%、超过约75%、超过约80%、超过约85%、超过约90%、超过约95%或约100%的接受
缓释组合物治疗的女性儿童在施用第一剂后约6个月(或约24周)或更长时间可以降低雌二醇的峰值刺激血清浓度至约《73.4pmol/l的水平。
[0177]
在一些实施方案中,缓释组合物降低男性儿童中睾酮的峰值刺激血清浓度至约《1.0nmol/l(即约28.8ng/dl;美国境内的医生通常使用'ng/dl'睾酮浓度的单位符号)的水平。在一些情况下,缓释组合物在施用第一剂缓释组合物后约3个月(或约12周)时,缓释组合物降低男性儿童的睾酮峰值刺激血清浓度至约《1.0nmol/l的水平。在一些情况下,缓释组合物的施用对于超过约50%、超过约55%、超过约60%、超过约65%、超过约70%、超过约75%、超过约80%、超过约85%、超过约90%、超过约95%或约100%的接受缓释组合物治疗的男性儿童在施用第一剂后约3个月(或约12周)或更长时间可以降低睾酮的峰值刺激血清浓度至约《1.0nmol/l的水平。在一些情况下,在施用第一剂的缓释组合物后约6个月(或约24周)缓释组合物降低男性儿童的睾酮的峰值刺激血清浓度至约《1.0nmol/l的水平。在一些情况下,缓释组合物的施用对于超过约50%、超过约55%、超过约60%、超过约65%、超过约70%、超过约75%、超过约80%、超过约85%、超过约90%、超过约95%或约100%的接受缓释组合物治疗的男性儿童在施用第一剂后约6个月(或约24周)或更长时间可以降低睾酮的峰值刺激血清浓度至约《1.0nmol/l的水平。
[0178]
在一些实施方案中,缓释组合物可通过降低至少一种或多种第二性征的发育、进展或严重性来有效治疗至少2岁儿童的cpp。在一些情况下,第二性征可包括但不限于骨生长速度、骨生长年龄、tanner分期、身高或体重。
[0179]
在一些情况下,缓释组合物可以在包括缓释组合物的初始施用和第一次后约6个月(或约24周)的缓释组合物的第二次施用的约12个月(或约48周)时间段内,降低儿童的骨生长速度多达约25%。然而,骨生长速度的降低受患者群体的影响,因此,缓释组合物可能能够降低任何给定的cpp患者群体的骨生长速度,降低了约超过0%、约超过5%、约超过10%、约超过15%、约超过20%、约超过25%、约超过30%、约超过35%、约超过40%、约超过45%或约超过50%。在一些情况下,缓释组合物可降低儿童的平均骨生长速度,在治疗开始后约4周时减至每年约9cm或更少,并且在治疗开始后减至每年约7cm或更少。在其他情况下,在超过约50%接受缓释组合物治疗的儿童中在施用后约3个月(或约12周)、约6个月(或约24周)或更长时缓释组合物可以降低儿童的生长速度,该生长速度从施用后约1个月或)约4周他们的生长速度来降低。
[0180]
术语“剂量”可用于表示向“儿童”(儿科患者)皮下施用的缓释组合物、刺激组合物或两者的剂量。在一些实施方案中,缓释组合物的注射剂量体积可为每次施用约0.25ml至约0.5ml。在一些情况下,缓释组合物的注射剂量体积可为每次施用约0.375ml。皮下递送的本发明的缓释组合物的较小注射剂量体积比使用经由更困难和更痛苦的施用途径递送的大得多的注射体积的其他已批准和上市的cpp治疗选择更有利;例如,使用2ml剂量体积通过深层肌内注射给儿童来施用。
[0181]
如本文所用,术语“给药剂量方案”可用于表示皮下施用至少一剂的缓释组合物约每六个月一次至有此需要的患有cpp的儿童(即患有cpp的2岁及以上的儿科患者),在规定的时间点任选施用至少一剂的刺激组合物。在一些实施方案中,任选的刺激组合物可以在施用缓释组合物之前施用至少一次,以测量一种或多种cpp相关激素的峰值刺激血清浓度(即基线峰值刺激)。在其他实施方案中,任选的刺激组合物可在施用缓释组合物后约3个月
(或约12周)至约6个月(或约24周)施用至少一次,用于测量一种或多种cpp相关激素的峰值刺激血清浓度。在其他实施方案中,任选的刺激组合物可以在施用缓释组合物之前施用至少一次,用于测量一种或多种cpp相关激素的峰值刺激血清浓度(即基线峰值刺激),然后可以在在施用缓释组合物后约3个月(或约12周)至约6个月(或约24周)施用至少一次,用于测量一种或多种cpp相关激素的峰值刺激血清浓度。在其他实施方案中,给药剂量方案可包含足够剂量的缓释组合物和足够剂量的任选刺激组合物以完成约6个月(或约24周)的一个治疗周期、约12个月(或约48周)的两个治疗周期、约18个月(或约72周)的三个治疗周期、约24个月(或约96周)的四个治疗周期、或更多,根据有效治疗有此需要的患有cpp的儿科患者的需要。例如,作为非限制性实例,6、12、18和24个月的给药剂量方案可分别包含1、2、3或4剂的缓释组合物,以及有效监测缓释组合物的功效所必需的足够剂量的刺激组合物。
[0182]
在一些实施方案中,在约6个月(或约24周)或更长的时段内,儿童的lh的峰值刺激血清浓度可通过以下方式降低或抑制至约《4iu/l的青春期前的水平:施用一种或多种给药剂量方案,其包括一剂或多剂的缓释组合物,其中将一剂或多剂任选的刺激组合物并入给药剂量方案以确认cpp的初始诊断和/或监测用缓释组合物治疗儿童。作为非限制性实例,在一些情况下,通过降低儿童的lh峰值刺激血清浓度至约《4iu/l的青春期前水平可用于有效治疗至少2岁儿童的cpp的给药剂量方案,可包括缓释组合物的初始剂量,随后在前一剂量后约每6个月(或约24周)施用一剂或多剂后续剂量的缓释组合物一次,直至儿童不再需要有效的cpp治疗。缓释组合物在有效治疗患有cpp的儿童中的功效可以经由测量在施用每个继续施用剂量的缓释组合物之后约3个月(或约12周)至约6个月(或约24周)的时段的响应于施用一个或多个刺激组合物剂量的儿童的lh峰值刺激血清浓度水平来监测。
[0183]
缓释组合物和刺激组合物试剂盒
[0184]
除了使用缓释组合物和刺激组合物有效治疗患有cpp的2岁及以上儿科患者的方法之外,本发明公开了一种试剂盒,其包含至少一剂的缓释组合物,至少一剂的刺激组合物,以及医生或其他医疗专业人员在治疗所述儿科患者时的使用试剂盒的说明书。在一些实施方案中,试剂盒在一个或多个无菌预填充、预包装的单注射器或双注射器系统中包含至少一剂的缓释组合物。在一些实施方案中,试剂盒在一个或多个无菌预填充、预包装注射器或小瓶中包含至少一剂的刺激组合物。在一些实施方案中,试剂盒进一步可包括但不仅限于足以满足当治疗患有cpp的儿童时医生或其他医疗专业人员使用的需要的额外的针、注射器、小瓶、酒精拭子、血液样品采集小瓶、止血带、绷带/敷料和/或标签。在一些情况下,试剂盒中使用的针可以是安全针。
[0185]
在一些实施方案中,试剂盒可以在至少一个单注射器系统中含有缓释组合物,其中它可以是单隔室注射器、两隔室注射器或其他类型的混合注射器。在一些实施方案中,单注射器系统可以预先包装有有效量的生物相容性有机溶剂、亮丙瑞林或其药学上可接受的等同物或盐、以及用于产生如本文所述的本发明的缓释组合物的可生物降解的聚合物。在一些情况下,试剂盒的单注射器可含有有效量的nmp用于产生如本文所述的本发明的缓释组合物。在一些情况下,试剂盒的单注射器可含有约165mg的nmp,用于产生如本文所述的本发明的缓释组合物。在一些情况下,试剂盒的单注射器可含有有效量的亮丙瑞林或其药学上可接受的等同物或盐,用于产生如本文所述的本发明的缓释组合物。在一些情况下,试剂盒的单注射器可含有约45mg的醋酸亮丙瑞林。在一些情况下,试剂盒的单注射器可含有提
供42mg的亮丙瑞林游离碱等同量的一定量的亮丙瑞林的药学上可接受的盐。在一些情况下,该试剂盒的单注射器可含有有效量的可生物降解的聚合物,该聚合物包含选自以下项的聚合物节段:85:15聚(丙交酯-共-乙交酯)(plg)共聚物节段、85:15聚(乳酸-共-乙醇酸)(plga)共聚物节段或其组合,其中聚合物基本上不具有可滴定的羧酸基团,并且其中聚合物的至少一个远端基团是羟基封端的,用于产生如本文所述的本发明的缓释组合物。在一些情况下,试剂盒的单注射器可含有约165mg的可生物降解的聚合物,该聚合物包含选自以下项的聚合物节段:85:15聚(丙交酯-共-乙交酯)(plg)共聚物节段、85:15聚(乳酸-共-乙醇酸)(plga)共聚物节段或其组合,其中聚合物基本上不具有可滴定的羧酸基团,并且其中聚合物的至少一个远端基团是羟基封端的。在一些情况下,试剂盒的单注射器可含有有效量的可生物降解的聚合物,该聚合物包含选自以下项的聚合物节段:聚(丙交酯)(pl)聚合物节段、聚(乳酸)(pla)聚合物节段或其组合,其中聚合物基本上不具有可滴定的羧酸基团,并且其中聚合物的至少一个远端基团是羟基封端的,用于产生如本文所述的本发明的缓释组合物。
[0186]
在一些实施方案中,试剂盒可以在至少一个双注射器系统中含有缓释组合物。在一些实施方案中,双注射器系统包括第一和第二注射器,它们可以经由滑动尖端或鲁尔锁型连接器相互连接,其中连接形成通道,在该通道中可流动的液体可以从第一注射器转移到第二注射器,反之亦然。
[0187]
在一些实施方案中,试剂盒的双注射器系统的第一注射器可以预先包装有有效量的生物相容性有机溶剂和本发明的可生物降解的聚合物,其中可生物降解的聚合物溶解在生物相容性有机溶剂中用于产生如本文所述的本发明的缓释组合物。在一些情况下,试剂盒的双注射器系统的第一注射器可以含有溶解给定量的可生物降解的聚合物所需的有效量的nmp。在一些情况下,试剂盒的双注射器系统的第一注射器可含有约165mg的nmp。在一些情况下,试剂盒的双注射器系统的第一注射器可以含有有效量的可生物降解的聚合物,该聚合物包含选自以下项的聚合物节段:85:15聚(丙交酯-共-乙交酯)(plg)共聚物节段、85:15聚(乳酸-共-乙醇酸)(plga)共聚物节段、聚(丙交酯)(pl)聚合物节段、聚(乳酸)(pla)聚合物节段或其组合,其中聚合物基本上不具有可滴定的羧酸基团,并且其中聚合物的至少一个远端基团是羟基封端的。在一些情况下,试剂盒的双注射器系统的第一注射器可含有约165mg的可生物降解的聚合物,该聚合物包含选自以下项的聚合物节段:85:15聚(丙交酯-共-乙交酯)(plg)共聚物节段、85:15聚(乳酸-共-乙醇酸)(plga)共聚物节段、聚(丙交酯)(pl)聚合物节段、聚(乳酸)(pla)聚合物节段或其组合,其中聚合物基本上不具有可滴定的羧酸基团,并且其中聚合物的至少一个远端基团是羟基封端的。在一些情况下,试剂盒的双注射器系统的第二注射器可以含有有效量的醋酸亮丙瑞林,其中亮丙瑞林或其药学上可接受的等同物或盐,其中它可以是干燥的冻干粉。在一些情况下,试剂盒的双注射器系统的第二注射器可以含有约45mg的醋酸亮丙瑞林,其中它可以是干燥的冻干粉。
[0188]
在一些实施方案中,在试剂盒的两个注射器系统内含有的本发明的缓释组合物可由医师或其他医疗专业人员在施用于需要此治疗的患有cpp的2岁或以上的儿科患者(儿童)之前制备。在一些情况下,在试剂盒的两个注射器系统内含有的本发明的缓释组合物可由医师或其他医疗专业人员在施用于需要此治疗的患有cpp的2岁或以上的儿科患者之前的30分钟内制备。
[0189]
在一些实施方案中,在试剂盒的两个注射器系统内含有的本发明的缓释组合物可由医师或其他医疗专业人员通过以下方式来制备:将第一注射器连接到第二注射器并使第一注射器中含有的生物相容性有机溶剂-可生物降解的聚合物混合物连续来通过递进入第二注射器以重悬亮丙瑞林或其药学上可接受的等同物或盐。在一些情况下,亮丙瑞林或其药学上可接受的等同物或盐在生物相容性有机溶剂-可生物降解聚合物混合物中的均匀重悬液可通过以下方法实现:将内容物在第一和第二注射器之间连续来回通过,持续约至少30秒、持续约至少35秒、持续约至少40秒、持续约至少45秒、持续约至少50秒、持续约至少55秒、持续约至少60秒、持续约至少65秒、持续约至少70秒、持续约至少75秒、持续约至少80秒、持续约至少85秒、持续约至少90秒或更长,以确保完全重悬。应当理解,阐明的实例均不意味着涵盖所有可能的缓释组合物可以被制备和/或包装在试剂盒内的变化。
[0190]
在一些实施方案中,试剂盒可以在一个或多个无菌预填充、预包装注射器或小瓶中含有至少一个剂量的刺激组合物。在一些情况下,该试剂盒可含有一个或多个注射器和/或小瓶,该注射器和/或小瓶含有用于产生缓释组合物的有效量的gnrh或gnrh激动剂,其中gnrh或gnrh激动剂可以作为干燥的冻干粉末或作为在任何合适的缓冲液(即适合注射的水)中的液体重悬液或溶液存在。在一些实施方案中,合适的缓冲剂还可包含至少一种防腐剂和至少一种张力调节剂。在一些情况下,防腐剂可包括但不限于苯甲醇。在其他情况下,张力调节剂可以是但不限于nacl。
[0191]
在一些情况下,试剂盒可以含有一个或多个注射器和/或小瓶,该注射器和/或小瓶含有用于至少一个或多个剂量的足够量的gnrh或gnrh激动剂。例如,作为非限制性实例,试剂盒可含有至少一个小瓶,该小瓶含有有效量的gnrh或gnrh激动剂,由医生或其他医疗专业人员将重悬为单一剂量以用作刺激组合物。在此类实例中,试剂盒在必要时进一步含有含有有效量的缓冲液的至少一个辅助注射器和/或小瓶。类似地,作为进一步的非限制性实例,试剂盒可含有至少一个小瓶,该小瓶含有有效量的gnrh或gnrh激动剂,医生或其他医疗专业人员将其重悬为多个剂量以用作刺激组合物。在此类实例中,试剂盒在必要时进一步含有至少一个辅助注射器和/或小瓶,其含有有效量的缓冲液。或者,作为又一非限制性实例,试剂盒可含有一个或多个注射器和/或小瓶,该注射器和/或小瓶已预先填充有至少一种或多种单剂量或多剂量的量的gnrh或gnrh激动剂,这些gnrh或gnrh激动剂必要时重悬在适量的缓冲液中。作为非限制性阐明实例,试剂盒可包含含有无菌、多剂量醋酸亮丙瑞林溶液的小瓶。在该实例中,多剂量小瓶可含有重悬在约2.8ml的合适缓冲液中的约14mg的醋酸亮丙瑞林溶液。每次注射可以使用大约0.2ml的这种5mg/ml的溶液(即,每个刺激组合物剂量总共使用1000μg的醋酸亮丙瑞林),从而提供多达约14个剂量。在一些实施方案中,使用的适当的缓冲剂可进一步含有一定量的至少一种防腐剂和一定量的至少一种张力调节剂。在一些情况下,防腐剂可包括但不限于苯甲醇。在其他情况下,张力调节剂可以是,但不限于,nacl。作为非限制性样品,试剂盒可含有小瓶,该小瓶具有用于制备5mg/ml的醋酸亮丙瑞林溶液的适当的缓冲液,其中该适当的缓冲液包含用作防腐剂的约9mg/ml的苯甲醇和用于维持溶液的张力的约6.3mg/ml的nacl。应当理解,阐明的实例均不意味着涵盖所有可能的刺激组合物可以被制备和/或包装在试剂盒内的变化。
[0192]
在一些情况下,试剂盒可包含用于任何所需给药剂量方案所需的足够剂量的刺激组合物,其中根据每一剂量的包含在试剂盒中的缓释组合物而使用至少一种或多种刺激组
合物,其中缓释组合物可包含在单注射器或双注射器系统中。例如,作为非限制性实例,用于6个月(或约24周)给药剂量方案的试剂盒可包含1、2、3或更多个刺激组合物剂量以及单一缓释组合物剂量。类似地,用于12个月(或约48周)给药剂量方案的试剂盒可包含1、2、3、4、5、6或更多个刺激组合物剂量以及两个缓释组合物剂量。类似地,用于18个月(或约72周)给药剂量方案的试剂盒可包含1、2、3、4、5、6、7、8、9或更多个刺激组合物剂量以及三个缓释组合物剂量。最后,用于24个月(或约96周)给药剂量方案的试剂盒可包含1、2、3、4、5、6、7、8、9、10、11、12或更多个刺激组合物剂量以及四个缓释组合物剂量。
[0193]
在一些情况下,预填充的无菌容器和/或注射器可含有多个剂量的刺激组合物。例如,含有3个剂量的干燥冻干醋酸亮丙瑞林粉末的无菌容器可以包含在用于6个月(或约12周)给药剂量方案的试剂盒中,该给药剂量方案由以下项组成:要施用于儿童的初始、3个月(或约12周)和6个月(或约24周)的刺激组合物。在此类实例中,干燥的、冻干的醋酸亮丙瑞林可以重悬为含有用于3次单独注射的3个剂量的液体溶液,其中容器及其内容物被适当地储存直到每次后续施用需要时。或者,在另一个实例中,用于6个月给药剂量方案的试剂盒可由3个单独的、无菌的容器或注射器组成,每个容器或注射器各自独立地填充有单一刺激组合物剂量用于即使施用。应当理解,阐明的实例均不意味着涵盖所有可能的刺激组合物可以被制备和/或包装在试剂盒内的变化。
[0194]
所有出版物、专利和专利文件均通过引用并入本文,如同单独通过引用并入一样。现在将用以下非限制性实施例阐明本发明。
实施例
[0195]
实施例1-可生物降解的聚合物制备的一般程序
[0196]
在带夹套的不锈钢聚合器皿中,加入适量的丙交酯和乙交酯,并将器皿内容物置于氮气氛下。升高器皿的温度直到试剂熔化。然后加入适量的烷烃二醇,接着加入辛酸亚锡催化剂。然后将器皿在氮气氛下在约135-145℃加热约3-4小时并持续搅拌。然后,为了除去未反应的丙交酯和乙交酯单体,将器皿抽真空并将单体从聚合混合物中真空蒸馏出来。然后将热熔物挤出到冷却盘中。冷却后,将固体物质低温研磨成细粉并干燥。
[0197]
实施例2-醋酸亮丙瑞林缓释组合物的制备和施用
[0198]
使用如实施例1中所制备的可生物降解的聚合物来制备缓释组合物,该缓释组合物用于在2岁或以上的儿科患者中用作皮下原位贮藏物以用作对cpp的有效治疗。本发明的缓释组合物的组分详述于下表1中:
[0199]
表1:缓释组合物重构药物产品
[0200][0201]
缓释组合物包含溶解在165mg的nmp有机溶剂中的165mg的85:15聚(d,l-丙交酯-共-乙交酯)(plg)共聚物节段。该可生物降解的聚合物是使用1,6-己二醇核心单元聚合而
成,因此在其远端是羟基封端的并且基本上不含可滴定的羧酸基团。该可生物降解的聚合物具有20kda至26kda之间的重均分子量。随后将该液体聚合物混合物放到第一无菌注射器中并进行辐照。将45mg的冷冻干燥的冻干醋酸亮丙瑞林粉末(代表大约42mg的游离亮丙瑞林碱)放到第二无菌注射器中。
[0202]
在皮下注射前30分钟,允许第一和第二注射器升温至室温,然后经由鲁尔锁型(luer-lock type)连接器组装成相互连接的2-注射器装置。然后由医生或其他医疗专业人员在室温下将第一注射器的液体聚合物混合物来回通过到第二注射器中持续至少45秒,直到所有醋酸亮丙瑞林粉末重悬成均匀的悬浮液。所制备混合物的最终体积为0.375ml,具有足够的流动性以作为可流动的缓释组合物通过5/8英寸的18号注射针。在将液体聚合物与醋酸亮丙瑞林粉末混合的≤30分钟内,将制备好的剂量皮下注射到先前诊断患有cpp的儿童体内。
[0203]
实施例3-治疗患有cpp儿童的12个月临床研究
[0204]
进行多中心、开放标签、单臂、适应性设计以评价实施例2中描述的缓释组合物在治疗患有cpp的2岁或更大的儿科患者中的功效和安全性。对114名疑似患有cpp但尚未接受过基于gnrh激动剂疗法治疗的男性和女性儿童施用刺激组合物的皮下注射来确认cpp的初步诊断,其中刺激组合物由醋酸亮丙瑞林溶液组成,取决于医生的判断其剂量为20μg/kg或总共500μg。在登记和筛选的114名受试者中,50名儿童没有接受任何剂量的缓释组合物,因为他们未能满足除确认的cpp诊断之外的额外筛选标准,因此被排除在当时的临床试验之外。治疗开始时的平均年龄为7.5岁(范围4-9岁)。阳性cpp诊断的额外临床标志物包括具有tanner 2或3期状态(即分别为女性乳房发育或男性睾丸体积≥4ml)和/或骨龄与实龄差异≥1年的儿童。此外,还测量和评估了身高和体重。
[0205]
然后将所有64名受试者纳入由2剂实施例2中描述的缓释组合物组成的12个月给药剂量方案。在经由如上所述的刺激测试组合物进行cpp诊断确认后,儿童皮下注射第一剂的缓释组合物。优选的注射位置包括没有过多色素沉着、结节、病变或毛发的皮下组织的任何区域,如儿童的腹部或上臀部。小心避免使用以前使用过的注射位置。64名儿童接受了至少一个剂量的缓释组合物的治疗。在缓释组合物的第一注射剂量后约6个月,向60名受试者施用第二相等剂量(四名受试者仅接受了第一剂)。重要的是,任何时候都没有改变缓释组合物的剂量。所有儿童,无论性别、年龄、体型、种族、治疗持续时间或cpp诊断的严重程度,均使用完全相同的剂量进行治疗。
[0206]
在最初开始用第一剂的缓释组合物治疗后的3、6、9和12个月,评估儿童的治疗功效、安全性和药代动力学。在64名研究受试者中,有4名提前终止治疗,即用于治疗的缓释组合物和/或用于监测所述治疗的刺激组合物的所有后续施用均被终止。剩余的60名受试者中,58名为女性2名为男性。所有剩余的60名患有cpp的儿童都未曾接受过之前cpp的gnrh激动剂治疗,并接受了两个剂量的缓释组合物,并被观察了12个月。治疗开始时的平均年龄为7.5岁(范围4-9岁)。
[0207]
缓释组合物的药代动力学显示醋酸亮丙瑞林的初始爆发释放在初始注射剂量后4小时达到峰值,c
max
为215.7ng/ml,任何后续施用剂量均无明显爆发。初始爆发阶段之后是醋酸亮丙瑞林的平台期释放,范围从0.18ng/ml到0.63ng/ml从4周到48周,平均值为0.37ng/ml。额外的药代动力学结果显示在下表2中:
[0208]
表2:患有cpp的受试者中亮丙瑞林的平均药代动力学参数
[0209][0210]
早在初始起始剂量后3个月,缓释组合物就可有效减少各种cpp相关激素。第一剂的缓释组合物维持对这些cpp相关激素的抑制继续长达6个月。在治疗开始后6个月时,皮下施用第二剂的缓释组合物,其能够继续抑制cpp相关激素。此外,第一剂和第二剂均能有效减缓骨生长速度。缓释组合物在抑制患有cpp的儿童的促性腺激素、性激素和生长速度的功效显示在下表3和表4中,其通过基于免疫的测定法和/或高灵敏度质谱法(lc-ms/ms)确定:
[0211]
表3:45mg缓释组合物在患有cpp的儿童中的疗效
[0212][0213]1gnrh激动剂刺激后
[0214]2主要疗效终点
[0215]
从筛选到研究结束的研究期间促性腺激素和性腺性激素的抑制(gnrh激动剂刺激测试后)和生长速度如表4所示。
[0216]
表4:45mg缓释组合物在患有cpp的儿童中随时间变化的关键终点的平均值
[0217][0218]1gnrh激动剂刺激后
[0219]2在第4周计算
[0220]
结果表明,在患有cpp的儿童中,缓释组合物将刺激的和基础的促性腺激素降低至青春期前水平。至第6个月,缓释组合物可有效地将88.1%的研究受试者中的峰值刺激血清lh浓度抑制至《4iu/l。几乎所有受试者都在6个月评估时实现将雌二醇或睾酮浓度抑制至青春期前水平。在12个月评估时,除了2名受试者(1名男性和1名女性)外,抑制在整个研究中保持(见表3)。
[0221]
此外,所有研究受试者中超过一半都经历了青春期临床症状的停滞或逆转,伴随
着骨生长速度和骨龄的降低。平均生长速度降低了大约25%,从第4周的8.54cm/年降低到治疗结束时的6.29cm/年。在第一剂后的6个月内,在第4周和第24周之间,平均生长速度降低了约19%,平均生长速度为6.92cm/年。在第二剂后的6个月内,在第24周和第48周之间,平均生长速度为5.79cm/年(sd=2.213),这代表与基线相比降低了大约32%。测量时骨龄与实龄的平均比率从基线到治疗结束降低了4.9%。
[0222]
7名女性受试者在6个月时不满足lh《4iu/l的主要功效标准。在七名受试者中的四名中,6个月时的lh水平介于4.2和4.8iu/l之间。其余三名受试者的lh水平》5iu/l。然而,在每次评估中,所有七名受试者的雌二醇都被抑制到青春期前水平。
[0223]
除了有效抑制cpp相关激素之外,缓释组合物还有效地减缓或逆转了患有cpp的儿童的如他们tanner分期状态的变化所见的第二性征。与基线相比,男性在接受12个月的治疗后,关于外生殖器发育从tanner 3期逆转到tanner 2期。12个月后,大约55%的女性在乳房发育的tanner分期评估中经历了至少或更多的降低转移。对于男孩和女孩,大约80%的研究受试者在治疗12个月后阴毛发育的tanner分期状态没有变化。在剩下的中,1/3经历状态降低,另外2/3经历上升,都只是1个阶段的方向转变(shift in direction of only 1stage)。
[0224]
虽然已经详细描述了本发明的各种实施方案,但是显然本领域技术人员将想到那些实施方案的修改和改编。然而,应当清楚地理解,此类的修改和修改如所附权利要求中阐述的在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1