一种无糖型肠炎宁片剂的制备方法与流程
1.本发明属于医药领域,尤其涉及一种无糖型肠炎宁片的制备方法。
背景技术:
2.肠炎是由细菌、病毒、真菌和寄生虫等引起肠道疾病,临床表现主要有腹痛、腹泻,稀水样便或粘液脓血便,故亦称感染性腹泻。肠炎可分为急性和慢性两类,急性肠炎的主要症状为恶心、呕吐、腹泻,在我国以夏秋两季发病率较高,一般潜伏期为12~36小时。慢性肠炎临床表现为长期慢性或反复发作的腹痛、腹泻以及消化不良等症,该病症已严重影响到患者的日常生活,如病情恶化将有转变为肠癌的可能性。目前临床一般用于治疗胃肠道炎症等疾病均采用抗生素,造成抗生素的使用泛滥、耐药性患者增加、副作用较大,而目前市场上针对胃肠道炎症疾病作用力强、副作用小的中药复方制剂占少数份额,其中以肠炎宁中药复方制剂最为突出。
3.肠炎宁中药复方制剂处方为民间经验方,该处方由地锦草、金毛耳草、樟树根、香薷、枫香树叶五味药材组成,具有清热利湿,行气的功效。用于大肠湿热所致的泄泻、痢疾,症见大便泄泻、或大便脓血、里急后重、腹痛腹胀;急慢性胃肠炎、腹泻、细菌性痢疾、小儿消化不良等症。该中药制剂处方疗效确切,在治疗胃肠道疾病有着较高的市场前景,受到广大医生患者的一致好评。
4.目前,国内市场上有关肠炎宁的中药复方制剂常用剂型有片剂、颗粒剂、胶囊剂、口服液、糖浆剂等,其中肠炎宁片为康恩贝中药制药厂独家品种收载于《中国药典》2020版一部成方制剂和单味制剂中,该剂型有着剂量准确、服用方便、受外界环境影响较小,化学性质稳定等特点。但根据肠炎宁片及其相关中药固体制剂(胶囊剂、颗粒剂)上市产品的调查结果,发现其主要制剂多为含糖型,由于含糖量高,服用量大,糖尿病、肥胖症患者不宜服用,限制了该药的应用范围。由于肠炎宁片采用中药材细粉为原料,中药材细粉具有纤维性较强,粘性及可压性较差等缺点,不仅会直接影响到压片前中间体的物理性质(休止角、振实密度、粒径),还会进一步导致生产过程中裂片、松片、硬度、脆碎度不合格等现象频繁出现,故传统的肠炎宁片需要以粘性较强、可压性较好的糖粉作为主要辅料,从而导致制备的肠炎宁片为多糖型。
5.因此,如何在现有肠炎宁片剂处方的基础上,在保持制药成效不变的前提下,研究出一种无糖型肠炎宁片的制备方法,扩大其临床应用范围,增加患者适用人群,创造更大的经济和社会效益是目前肠炎宁片剂亟待需要解决的技术问题。
技术实现要素:
6.本发明要解决的技术问题是克服现有技术的不足,提供一种无糖型肠炎宁片的制备方法,该方法制备的无糖型肠炎宁片,不会造成血糖升高,满足三高人群、追求健康人们的需要。
7.本发明提出的技术方案为:
8.一种无糖型肠炎宁片的制备方法,包括以下步骤:
9.(1)将地锦草、金毛耳草、樟树根、香薷、枫香树叶制备成中间体浸膏粉;
10.(2)将中间体浸膏粉和无糖型复合辅料混合均匀,然后加入粘合剂进行流化床制粒,干燥,过筛,得到中间体颗粒;
11.(3)将中间体颗粒和硬脂酸镁混合均匀,压片,得到无糖型肠炎宁片。
12.优选的,步骤(1)中,中间体浸膏粉的粒径为180μm~850μm。
13.优选的,步骤(1)中,以重量份计,地锦草660份、金毛耳草900份、樟树根660份、香薷330份、枫香树叶330份。
14.优选的,中间体浸膏粉的具体制备过程为:
15.将地锦草、5%~10%的香薷粉碎,过80~100目筛,待用;剩余药材加8~10倍水煎煮1~2小时,过滤,收集滤液,药渣加6~8倍水煎煮1~2小时,过滤,合并滤液,浓缩至相对密度为1.25~1.30,加入粉碎后的地锦草、香薷细粉搅拌均匀,真空带式干燥,破碎,得中间体浸膏粉。
16.优选的,步骤(2)中,所述无糖型复合辅料为山梨醇、麦芽糊精、甘露醇、微晶纤维素、聚乙烯吡咯烷酮、微粉硅胶中的至少两种。
17.优选的,步骤(2)中,中间体浸膏粉和复合辅料的质量比为(70~90):(10~30)。
18.优选的,步骤(2)中,所述粘合剂为质量比为100:(10~50):(10~50)的浓度为50%~95%乙醇溶液、山梨醇和聚乙烯吡咯烷酮,或者为质量比为100:(10~50的浓度为50%~95%乙醇溶液和山梨醇,或者为质量比为100:(10~50)的50%~95%乙醇溶液和聚乙烯吡咯烷酮。
19.优选的,步骤(2)中,所述粘合剂的质量为物料总质量的5%~10%。
20.优选的,步骤(2)中,流化床制粒过程的工艺参数为:进风频率12~18hz,进风温度为60~70℃,雾化压力为0.2~0.6mpa,进料速度为40~60ml/min。
21.优选的,步骤(2)中,过筛是指过20目筛。
22.优选的,步骤(3)中,中间体颗粒和硬脂酸镁的质量比为(99~99.5):(0.5~1)。硬脂酸镁起到防止粘冲的作用。
23.本发明的优点在于:
24.(1)本发明将浸膏浓缩液与生药粉混合经真空带式干燥,再加入复合辅料、粘合剂进行流化床制粒,通过控制生药粉及中间体浸膏粉的粒径、无糖型复合辅料、粘合剂的种类联合复配使用,控制压片前物料之间的粘性,从而保证中间体颗粒的物理性质(休止角、堆密度、粒径),防止压片时物料流动性及可压性差所导致的装量差异不稳、裂片、松片、崩解等不合格现象发生。
25.(2)本发明提供的无糖型肠炎宁片的制备方法,可以有效的减少现有制剂处方的辅料用量,降低产品生产成本,提高成品率,缩短工艺时间;并且制备的无糖型肠炎宁片满足特殊人群(糖尿病、高血压、肥胖症等慢性疾病患者)的使用要求,具有较好的开发前景,为奠定肠炎宁片中药大品种的市场地位创造有利条件。
具体实施方式
26.为了便于理解本发明,下文将结合较佳的实施例对本发明作更全面、细致地描述,
但本发明的保护范围并不限于以下具体的实施例。
27.下述实施例所采用的中间体浸膏粉均采用以下制备方法制备而成:
28.(1)准备处方量的各原料备用:地锦草660份、金毛耳草900份、樟树根660份、香薷330份、枫香树叶330份;
29.(2)将处方中的地锦草、10%的香薷进行粉碎,过100目筛待用;
30.(3)将处方中剩余药材加10倍水煎煮2小时,过滤,收集滤液,药渣加8倍水煎煮2小时,过滤,合并滤液,浓缩至相对密实ρ为1.30,加入步骤(2)粉碎后地锦草、香薷细粉,搅拌均匀,真空带式干燥干燥,破碎干膏,得到粒度为500μm的中间体浸膏粉。
31.实施例1:
32.本实施例的无糖型肠炎宁片的制备方法,步骤如下:
33.(1)将90份中间体浸膏粉和无糖型复合辅料(山梨醇9份、微粉硅胶1份)混合均匀,然后加入占中间体浸膏粉和无糖型复合辅料总量10%的粘合剂(由质量比为100:25:25的浓度为85%的乙醇溶液、山梨醇和聚乙烯吡咯烷酮组成)进行流化床制粒,干燥,过20目筛,得到中间体颗粒;其中,流化床制粒过程中:进风频率16hz,进风温度65℃,雾化压力0.4mpa,进料速度60ml/min;
34.(2)将中间体颗粒和硬脂酸镁按照99.5:0.5的质量比混合均匀,压片,得到无糖型肠炎宁片。
35.实施例2:
36.本实施例的无糖型肠炎宁片的制备方法,步骤如下:
37.(1)将90份中间体浸膏粉和无糖型复合辅料(山梨醇7份、甘露醇2份、微粉硅胶1份)混合均匀,然后加入占中间体浸膏粉和无糖型复合辅料总量10%的粘合剂(由质量比为100:20:10的浓度为85%的乙醇溶液、山梨醇和聚乙烯吡咯烷酮组成)进行流化床制粒,干燥,过20目筛,得到中间体颗粒;其中,流化床制粒过程中:进风频率16hz,进风温度65℃,雾化压力0.4mpa,进料速度60ml/min;
38.(2)将中间体颗粒和硬脂酸镁按照99.5:0.5的质量比混合均匀,压片,得到无糖型肠炎宁片。
39.实施例3:
40.本实施例的无糖型肠炎宁片的制备方法,步骤如下:
41.(1)将90份中间体浸膏粉和无糖型复合辅料(山梨醇5份、聚乙烯吡咯烷酮4份、微粉硅胶1份)混合均匀,然后加入占中间体浸膏粉和无糖型复合辅料总量10%的粘合剂(由质量比为100:30浓度为85%的乙醇溶液和山梨醇组成)进行流化床制粒,干燥,过20目筛,得到中间体颗粒;其中,流化床制粒过程中:进风频率16hz,进风温度65℃,雾化压力0.4mpa,进料速度60ml/min;
42.(2)将中间体颗粒和硬脂酸镁按照99.5:0.5的质量比混合均匀,压片,得到无糖型肠炎宁片。
43.实施例4:
44.本实施例的无糖型肠炎宁片的制备方法,步骤如下:
45.(1)将80份中间体浸膏粉和无糖型复合辅料(山梨醇10份、微晶纤维素10份)混合均匀,然后加入占中间体浸膏粉和无糖型复合辅料总量8%的粘合剂(由质量比为100:20:
30浓度为75%的乙醇溶液、山梨醇和聚乙烯吡咯烷酮组成)进行流化床制粒,干燥,过20目筛,得到中间体颗粒;其中,流化床制粒过程中:进风频率16hz,进风温度65℃,雾化压力0.4mpa,进料速度60ml/min;
46.(2)将中间体颗粒和硬脂酸镁按照99:1的质量比混合均匀,压片,得到无糖型肠炎宁片。
47.实施例5:
48.本实施例的无糖型肠炎宁片的制备方法,步骤如下:
49.(1)将80份中间体浸膏粉和无糖型复合辅料(山梨醇15份、预胶化淀粉5份)混合均匀,然后加入占中间体浸膏粉和无糖型复合辅料总量8%的粘合剂(由质量比为100:30浓度为75%的乙醇溶液和聚乙烯吡咯烷酮组成)进行流化床制粒,干燥,过20目筛,得到中间体颗粒;其中,流化床制粒过程中:进风频率16hz,进风温度65℃,雾化压力0.4mpa,进料速度60ml/min;
50.(2)将中间体颗粒和硬脂酸镁按照99:1的质量比混合均匀,压片,得到无糖型肠炎宁片。
51.实施例6:
52.本实施例的无糖型肠炎宁片的制备方法,步骤如下:
53.(1)将80份中间体浸膏粉和无糖型复合辅料(聚乙烯吡咯烷酮10份、微晶纤维素10份)混合均匀,然后加入占中间体浸膏粉和无糖型复合辅料总量8%的粘合剂(由质量比为100:50浓度为75%的乙醇溶液和山梨醇组成)进行流化床制粒,干燥,过20目筛,得到中间体颗粒;其中,流化床制粒过程中:进风频率16hz,进风温度65℃,雾化压力0.4mpa,进料速度60ml/min;
54.(2)将中间体颗粒和硬脂酸镁按照99:1的质量比混合均匀,压片,得到无糖型肠炎宁片。
55.实施例7:
56.本实施例的无糖型肠炎宁片的制备方法,步骤如下:
57.(1)将70份中间体浸膏粉和无糖型复合辅料(山梨醇10份、微晶纤维素10份、麦芽糊精10份)混合均匀,然后加入占中间体浸膏粉和无糖型复合辅料总量5%的粘合剂(由质量比为100:20浓度为60%的乙醇溶液和山梨醇组成)进行流化床制粒,干燥,过20目筛,得到中间体颗粒;其中,流化床制粒过程中:进风频率16hz,进风温度65℃,雾化压力0.4mpa,进料速度60ml/min;
58.(2)将中间体颗粒和硬脂酸镁按照99:1的质量比混合均匀,压片,得到无糖型肠炎宁片。
59.实施例8:
60.本实施例的无糖型肠炎宁片的制备方法,步骤如下:
61.(1)将70份中间体浸膏粉和无糖型复合辅料(山梨醇10份、聚乙烯吡咯烷酮10份、预胶化淀粉10份)混合均匀,然后加入占中间体浸膏粉和无糖型复合辅料总量5%的粘合剂(由质量比为100:25:25的浓度为60%的乙醇溶液、山梨醇和聚乙烯吡咯烷酮组成)进行流化床制粒,干燥,过20目筛,得到中间体颗粒;其中,流化床制粒过程中:进风频率16hz,进风温度65℃,雾化压力0.4mpa,进料速度60ml/min;
62.(2)将中间体颗粒和硬脂酸镁按照99:1的质量比混合均匀,压片,得到无糖型肠炎宁片。
63.实施例9:
64.本实施例的无糖型肠炎宁片的制备方法,步骤如下:
65.(1)将70份中间体浸膏粉和无糖型复合辅料(山梨醇10份、微晶纤维素20份)混合均匀,然后加入占中间体浸膏粉和无糖型复合辅料总量5%的粘合剂(由质量比为100:50的浓度为60%的乙醇溶液和聚乙烯吡咯烷酮组成)进行流化床制粒,干燥,过20目筛,得到中间体颗粒;其中,流化床制粒过程中:进风频率16hz,进风温度65℃,雾化压力0.4mpa,进料速度60ml/min;
66.(2)将中间体颗粒和硬脂酸镁按照99:1的质量比混合均匀,压片,得到无糖型肠炎宁片。
67.对比例1:
68.本对比例的肠炎宁片的制备方法,步骤如下:
69.(1)将90份中间体浸膏粉和10份糖粉混合均匀,然后加入占中间体浸膏粉和糖粉总量5%的粘合剂(由质量比为100:50的浓度为85%的乙醇溶液和糖粉组成)进行流化床制粒,干燥,过20目筛,得到中间体颗粒;其中,流化床制粒过程中:进风频率16hz,进风温度65℃,雾化压力0.4mpa,进料速度60ml/min;
70.(2)将中间体颗粒和硬脂酸镁按照99:1的质量比混合均匀,压片,得到无糖型肠炎宁片。
71.对比例2:
72.本对比例的肠炎宁片的制备方法,步骤如下:
73.(1)将80份中间体浸膏粉和20份糖粉混合均匀,然后加入占中间体浸膏粉和糖粉总量8%的粘合剂(由质量比为100:40的浓度为75%的乙醇溶液和糖粉组成)进行流化床制粒,干燥,过20目筛,得到中间体颗粒;其中,流化床制粒过程中:进风频率16hz,进风温度65℃,雾化压力0.4mpa,进料速度60ml/min;
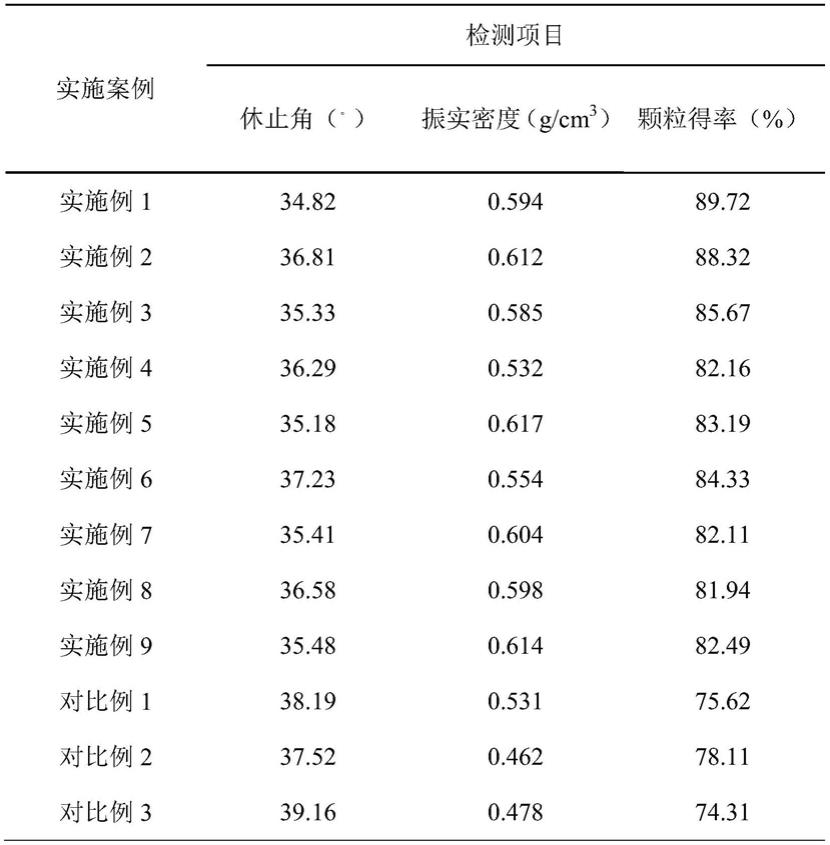
74.(2)将中间体颗粒和硬脂酸镁按照99:1的质量比混合均匀,压片,得到无糖型肠炎宁片。
75.对比例3:
76.本对比例的肠炎宁片的制备方法,步骤如下:
77.(1)将70份中间体浸膏粉和30份糖粉混合均匀,然后加入占中间体浸膏粉和糖粉总量10%的粘合剂(由质量比为100:30的浓度为60%的乙醇溶液和糖粉组成)进行流化床制粒,干燥,过20目筛,得到中间体颗粒;其中,流化床制粒过程中:进风频率16hz,进风温度65℃,雾化压力0.4mpa,进料速度60ml/min;
78.(2)将中间体颗粒和硬脂酸镁按照99:1的质量比混合均匀,压片,得到无糖型肠炎宁片。
79.对上述实施例1-9和对比例1-3制备的中间体颗粒和肠炎宁片剂进行检测,以休止角、堆密度、颗粒得率、片剂硬度、脆碎度、崩解时限等《中国药典》2020版附录中片剂常规检查项目为指标,进行综合评价,具体实验数据结果见表1、2。
80.表1肠炎宁片中间体颗粒检测指标结果
[0081][0082]
表2肠炎宁片片剂检测指标结果
[0083]
[0084][0085]
表中的检测方法包括:
[0086]
休止角:指在重力场中,粒子在粉体堆积层的自由斜面上滑动时所受重力和粒子之间摩擦力达到平衡而处于静止状态下测得的最大角,休止角越小颗粒流动性越好,片重差异越小。(休止角<40时,流动性最好)。
[0087]
振实密度:指在规定条件下容器中的粉经振实后所测得的单位容积的质量,振实密度越高表明颗粒间间隙越大,压片填充时装量可操作性越强。(振实密度>0.5时,装量差异越小)。
[0088]
水分:按照《中国药典》2020版水分测定第二法(烘干法)进行测定,水分越高易发生粘冲及压片物料架桥等现象,水分越小颗粒成型和压片成型时会影响物料之间的粘结性导致颗粒得率及片剂硬度下降。
[0089]
颗粒得率:以药典筛2~5号筛为目标粒径进行分筛测定,称重,计算颗粒占总物料投入量比例。(颗粒得率>60%,片剂硬度有所提高)。
[0090]
片剂硬度:硬度是直接影响片剂成型及崩解时限的关键指标,硬度过大会影响崩解时限过长,硬度过小易发生松片、裂片导致片剂质量不合格。(硬度控制范围5~10kg)。
[0091]
脆碎度:收载于2020版《中国药典》三部制剂通则中,是反映片剂抗震耐磨能力的指标,是影响片剂包衣、运输等过程中不可避免关键因素,脆碎度过大包衣时易产生片剂缺角、麻面,运输时与内包装摩擦易产生掉粉等现象。(脆碎度<1%)。
[0092]
崩解时限:收载于2020版《中国药典》三部制剂通则中,是指固体制剂中的药物在被吸收前,必须经过崩解和溶解然后转为溶液的过程,是评价片剂质量的重要指标之一。(崩解时限<1小时)。
[0093]
通过表1和表2检测项目数据可知,实施例与对比例的中间体颗粒粉体学指标休止角均<40,说明两者流动性较好无差别,而从振实密度、颗粒得率分析,虽然各指标均达到片剂成型基本要求,但对比组实验数据结果均低于实施例,说明本发明所制备的无糖型肠炎宁中间体颗粒均优于有糖型。本发明根据2020版《中国药典》三部制剂通则中片剂硬度、脆碎度、崩解时限等相关检查项要求对实施例及对比例所制备片剂进行检测,发现实施例其片剂硬度均在6~9kg,脆碎度<1%,崩解时限<1小时,全部符合要求,而且均优于对比例实验样品,从而进一步证明了本发明的无糖型肠炎宁片的处方及工艺的稳定可行,而且
产品质量均在科学合理的控制范围内。
[0094]
上述实施案例为本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出相关改进及优化,这些改进和优化也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1