降解周期可控的载药PVA水凝胶的制备方法与流程
降解周期可控的载药pva水凝胶的制备方法
技术领域
1.本发明涉及生物医学材料技术领域,特别涉及一种降解周期可控的载药pva水凝胶的制备方法。
背景技术:
2.水凝胶是一种功能高分子材料,由三维网络结构的高分子和充塞其网链间隙中的水分子介质构成。聚乙烯醇(pva)水凝胶作为药物的载体,具有良好的组织亲和性与生物降解性。现有水凝胶的降解时间难以精细调控,不能满足不同领域的药物缓释。
技术实现要素:
3.针对现有技术的不足,本技术提供一种降解周期可控的载药pva水凝胶的制备方法,由于1799型pva制作的pva水凝胶,其降解周期较长或者说难以实现完全降解,所以本技术通过加入适当比例的0588型pva来缩短其降解周期,即通过控制1799型pva和0588型pva的混合比例、以及冷冻-解冻的循环次数来实现pva水凝胶降解周期的精细调控。
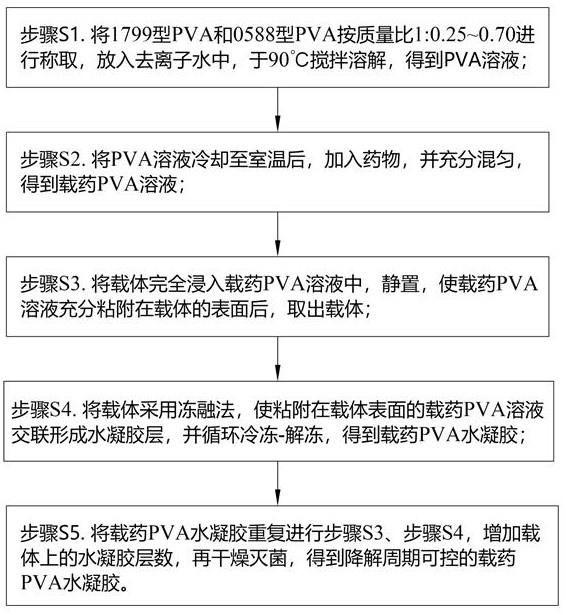
4.本发明采用的技术方案是:降解周期可控的载药pva水凝胶的制备方法,其特征在于,包括以下步骤:步骤s1. 将1799型pva和0588型pva按质量比1:0.25~0.70进行称取,放入去离子水中,于90℃搅拌溶解,得到pva溶液;步骤s2. 将pva溶液冷却至室温后,加入药物,并充分混匀,得到载药pva溶液;步骤s3. 将载体完全浸入载药pva溶液中,静置使载药pva溶液充分粘附在载体的表面后,取出载体;步骤s4. 将载体采用冻融法,使粘附在载体表面的载药pva溶液交联形成水凝胶层,并循环冷冻-解冻,得到载药pva水凝胶;步骤s5. 将载药pva水凝胶重复进行步骤s3、步骤s4,增加载体上的水凝胶层数,再干燥灭菌,得到降解周期可控的载药pva水凝胶。
5.在本技术公开的降解周期可控的载药pva水凝胶的制备方法中,所述步骤s1中,pva的总浓度为0.05g/ml~0.15g/ml。
6.在本技术公开的降解周期可控的载药pva水凝胶的制备方法中,所述步骤s2中,药物的浓度为0.10mg/ml~30mg/ml。
7.在本技术公开的降解周期可控的载药pva水凝胶的制备方法中,所述步骤s2中,药物为青霉素、曲安奈德、万古霉素、骨形态发生蛋白中的一种。
8.在本技术公开的降解周期可控的载药pva水凝胶的制备方法中,所述步骤s3中,载体为骨组织工程支架或其它固体支撑材料。
9.在本技术公开的降解周期可控的载药pva水凝胶的制备方法中,所述步骤s2中的载药pva溶液通过添加化学交联剂,也可得到降解周期可控的载药pva水凝胶。
10.在本技术公开的降解周期可控的载药pva水凝胶的制备方法中,所述步骤s4中,冻
融法为:将载体在-10℃~-30℃下冷冻10~24h,取出于室温解冻2~8h。
11.在本技术公开的降解周期可控的载药pva水凝胶的制备方法中,所述步骤s4中,冷冻-解冻的循环次数为3~7次。
12.在本技术公开的降解周期可控的载药pva水凝胶的制备方法中,所述步骤s5中,增加的水凝胶层数不少于1层。
13.在本技术公开的降解周期可控的载药pva水凝胶的制备方法中,所述步骤s5中,干燥灭菌的方法为:在冷冻真空干燥箱中进行干燥,干燥时间为24h,干燥后采用环氧乙烷灭菌。
14.发明的有益效果是:(1)该制备方法通过控制1799型pva和0588型pva的混合比例,以及冷冻-解冻的循环次数来实现pva水凝胶降解周期的精细调控,并且根据实际需求增加pva水凝胶在载体表面的层数以达到药物持续释放的目的,可以满足不同领域的药物缓释需求。
15.(2)豚鼠对该制备方法得到的pva水凝胶未出现过敏反应,该pva水凝胶可广泛应用于药物释放体系(药物载体为骨组织工程支架或其它固体支撑材料)、细胞固定载体、伤口敷料、角膜接触镜、传感器、致动器等领域,并可负载bmp(骨形态发生蛋白)、抗菌性药物(青霉素、万古霉素)、曲安奈德等众多缓释药物。
附图说明
16.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
17.图1为本技术的降解周期可控的载药pva水凝胶的制备方法的流程图。
具体实施方式
18.为使本技术的上述目的、特征和优点能够更为明显易懂,下面结合附图,对本技术的具体实施方式做详细的说明。可以理解的是,此处所描述的具体实施例仅用于解释本技术,而非对本技术的限定。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本技术保护的范围。
19.本技术中的术语“包括”和“具有”以及它们任何变形,意图在于覆盖不排他的包含。例如包含了一系列步骤或单元的过程、方法、系统、产品或设备没有限定于已列出的步骤或单元,而是可选地还包括没有列出的步骤或单元,或可选地还包括对于这些过程、方法、产品或设备固有的其它步骤或单元。
20.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“及/或”包括一个或多个相关的所列项目的任意的和所有的组合。
21.在本技术中提及“实施例”意味着,结合实施例描述的特定特征、结构或特性可以包含在本技术的至少一个实施例中。在说明书中的各个位置出现该短语并不一定均是指相
同的实施例,也不是与其它实施例互斥的独立的或备选的实施例。本领域技术人员显式地和隐式地理解的是,本文所描述的实施例可以与其它实施例相结合。
22.请参见图1所示,本技术公开了一种降解周期可控的载药pva水凝胶的制备方法,包括以下步骤:步骤s1. 将1799型pva和0588型pva按质量比1:0.25~0.70进行称取,放入去离子水中,于90℃搅拌溶解,得到pva溶液。
23.步骤s2. 将pva溶液冷却至室温(25
±
2℃)后,加入药物,并充分混匀,得到载药pva溶液。
24.步骤s3. 将载体完全浸入载药pva溶液中,静置使载药pva溶液充分粘附在载体的表面后,取出载体。
25.步骤s4. 将载体采用冻融法,使粘附在支架表面的载药pva溶液交联形成水凝胶层,并循环冷冻-解冻,得到载药pva水凝胶。
26.步骤s5. 将载药pva水凝胶重复进行步骤s3、步骤s4,增加载体表面的水凝胶层数,再干燥灭菌,得到降解周期可控的载药pva水凝胶。
27.聚乙烯醇(pva)水凝胶作为药物的载体,具有良好的组织亲和性与生物降解性,但是1799型pva制作的pva水凝胶,其降解周期较长或者说难以实现完全降解,所以加入适当比例的0588型pva来缩短其降解周期,即通过控制1799型pva和0588型pva的混合比例、以及冷冻-解冻的循环次数来实现pva水凝胶降解周期的精细调控,并且根据实际需求增加pva水凝胶在载体表面的层数以达到药物持续释放的目的,可以满足不同领域的药物缓释需求。
28.在一个实施例中,步骤s1中,pva的总浓度为0.05 g/ml ~0.15g/ml。具体地,pva的总浓度可以为0.05g/ml、0.08g/ml、0.10g/ml、0.12g/ml、0.15ml等,优选为0.10 g/ml。
29.在一个实施例中,步骤s2中,药物的浓度为0.10mg/ml~30mg/ml。具体地,药物的浓度可以为0.10mg/ml、0.20mg/ml、0.5mg/ml、1mg/ml、5 mg/ml、10 mg/ml、15 mg/ml、30mg/ml等,可根据不同的药物选择不同的药物浓度。
30.在一个实施例中,步骤s2中,药物为青霉素、曲安奈德、万古霉素、骨形态发生蛋白中的一种。具体地,本技术的 pva水凝胶可用于负载bmp(骨形态发生蛋白)、抗菌性药物(青霉素、万古霉素)、曲安奈德等众多缓释药物。
31.在一个实施例中,步骤s3中,载体为骨组织工程支架或其它固体支撑材料,可用于搭载pva水凝胶,实现药物缓释。
32.在一个实施例中,步骤s2中的载药pva溶液通过添加化学交联剂,也可得到降解周期可控的载药pva水凝胶。载药pva水凝胶可用于制作微球、细胞固定载体、角膜接触镜等。该载药pva水凝胶也可用于传感器、致动器等领域。
33.在一个实施例中,步骤s3中,静置的时间为0.5~2h。具体地,静置的时间可以为0.5h、1h、2h等,优选为1h。
34.在一个实施例中,步骤s4中,冻融法为:将载体在-10℃~-30℃下冷冻10~24h,取出于室温解冻2~8h。具体地,冻融温度可以为-10℃、-18℃、-20℃、-23℃、-25℃、-30℃等,优选为-18℃;冷冻时间可以为10h、12h、15h、20h、24h等,优选为12h;解冻时间可以为2h、3h、5h、8h等,优选为2h。
35.在一个实施例中,步骤s4中,冷冻-解冻的循环次数为3~7次。具体地,循环次数可以为3次、4次、5次、6次和7次,将粘附在载体表面的载药pva溶液反复冷冻-解冻,循环次数的增加可提高水凝胶的降解周期。
36.在一个实施例中,步骤s5中,增加的水凝胶层数不少于1层。具体地,将载药pva水凝胶重复进行步骤s3、步骤s4,增加载体上的水凝胶层数,增加的水凝胶层数可以为1层、2层、3层等,可根据实际需求增加水凝胶的层数以达到药物持续释放的目的。
37.在一个实施例中,步骤s5中,干燥灭菌的方法为:在冷冻真空干燥箱中进行干燥,干燥时间为24h,干燥后采用环氧乙烷灭菌。
38.在一个具体的实施方式中,1799型pva和0588型pva的质量比为1:0.67,冷冻-解冻循环4次,制成的水凝胶在91天左右完全降解,并且在循环4次的基础上每增加1次(最多为7次),降解周期增加5-7天。
39.在一个具体的实施方式中,1799型pva和0588型pva的质量比为1:0.43,冷冻-解冻循环4次,制成的水凝胶在95天左右完全降解,并且在循环4次的基础上每增加1次(最多为7次),降解周期增加5-7天。
40.在一个具体的实施方式中,1799型pva和0588型pva的质量比为1:0.25,冷冻-解冻循环4次,制成的水凝胶在98天左右完全降解,并且在循环4次的基础上每增加1次(最多为7次),降解周期增加5-7天。
41.本技术的制备方法通过控制1799型pva和0588型pva的混合比例,以及冷冻-解冻的循环次数来实现载药pva水凝胶降解周期的精细调控,满足不同领域的药物缓释需求。
42.在一个具体的实施场景中,准确称取1799型pva 3g,0588型pva 2g,一起加入含有50ml去离子水的烧杯中,在90℃下搅拌至完全溶解,得到pva溶液。将pva溶液冷却至室温后,加入10mg bmp-2冻干粉末并充分混匀,得到载药pva溶液。然后将骨组织工程支架完全浸入载药pva溶液中,静置1h使载药pva溶液充分粘附在支架表面,取出支架。将支架采用反复冻融法使粘附在支架表面的含bmp-2 pva溶液交联形成水凝胶。具体做法为:将支架取出,在-18℃下冷冻12h取出,然后在室温下解冻2h,由此进行4个冷冻-解冻循环之后,于冷冻干燥箱中干燥24h,环氧乙烷灭菌,得到负载bmp-2 pva水凝胶的支架。
43.对上述制备的支架进行bmp-2体外释放试验将支架置于透析袋中,透析袋置于20ml含0.2%叠氮化钠的ph为7.0的pbs缓冲液中。静置于37℃下,在1d、2d、4d、7d、14d、28d、42d、56d、70d、84d、91d分别取样1ml(随后补充含0 .2%叠氮化钠的,ph7 .0的pbs缓冲液1ml),做4组平行实验,分别为例1、例2、例3、例4,按照试剂盒的说明以elisa法测定bmp-2浓度,换算计算累计释放百分数。
44.结果如表1所示,bmp-2释放过程中伴随着pva水凝胶的降解,支架中的bmp-2在91天左右时基本释放完成,基本与骨修复中骨组织的生长周期相对应。
45.表1 bmp-2累计释放百分数
对pva水凝胶进行过敏实验选取体重约400g的雄性豚鼠20只,实验组和空白对照组各10只,实验组和空白对照组饲养条件均相同。在实验的第1、4日,实验组腹腔注射含2 .0mg pva(1799:0588=1:0.67)的水溶液,空白对照组不进行注射,在实验的第7日,实验组再注射含3 .0mg相同比例的pva水溶液。
46.在实验1、4、10日称量豚鼠体重,在实验第7-10日观察过敏反应情况。评价指标包括过敏反应阴性(正常),过敏反应弱阳性(躁动、颤抖、搔鼻),过敏反应阳性(喷嚏、呼吸急促、排尿粪、流泪),过敏反应强阳性(呼吸困难、哮鸣音、紫癜、步态不稳、痉挛、旋转),过敏反应极强阳性(死亡)。
47.实验结果显示,豚鼠平均体重变化情况基本一致(到第10日均增重约30-35g),且豚鼠生命体征正常,均未出现过敏反应。
48.本技术提供了一种降解周期可控的载药pva水凝胶的制备方法,该制备方法通过控制1799型pva和0588型pva的混合比例,以及冷冻-解冻的循环次数来实现pva水凝胶降解周期的精细调控,并且根据实际需求增加pva水凝胶在载体表面的层数以达到药物持续释放的目的,可以满足不同领域的药物缓释需求。豚鼠对该制备方法得到的pva水凝胶未出现过敏反应,该pva水凝胶可广泛应用于药物释放体系(药物载体为骨组织工程支架或其它固体支撑材料)、细胞固定载体、伤口敷料、角膜接触镜、传感器、致动器等领域,并可负载bmp(骨形态发生蛋白)、抗菌性药物(青霉素、万古霉素)、曲安奈德等众多缓释药物。
49.以上仅为本发明的优选实施例而已,不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1