VPS13B基因突变体及其应用的制作方法
本发明涉及VPS13B基因突变体及其应用。具体地,本发明涉及分离编码VPS13B突变体的核酸、分离的多肽、筛选易患科恩综合症的生物样品的系统、用于筛选易患科恩综合症的生物样品的试剂盒、构建体、重组细胞以及构建药物筛选模型的方法。
背景技术:
科恩综合症(Cohen syndrome)是一种遗传病,在阿米甚人的发生率约为1/15000,而其它地方未确定;其遗传方式为常染色体隐性遗传。科恩综合症的首次有文献记载的描述是在1973年,其特点为婴幼儿时期生长迟滞与低肌张力、发展迟缓、小头畸形,青少年后中广型肥胖,合并进行性视网膜脉络膜失养症(retinochoroidal dystrophy)及近视、中性球低下以及反复感染。部分患者会出现嘴部溃疡(aphthous ulcers)、患者性格开朗、关节松弛并有特别的脸部特征等。通常对该综合征的临床诊断主要参考八个临床表征,包括:1)高度近视伴随视网膜失养症;2)小头症;3)发展迟缓;4)高延展的关节表现;5)典型的脸部特征:浓密的头发和眉毛、长睫毛、异常眼形(呈现向下倾斜和波浪型眼睑缝隙)、蒜头鼻,上唇与鼻子之间距离较一般人短且平滑,上排牙齿突出,因此呈现嘴开的外观;6)躯干肥胖但四肢纤细(中广型肥胖);7)过度友好的社交行为(个性开朗);8)中性白血球低下。如果有超过六项或更多项符合,大致上可被确认为科恩综合症,若只有五项或更少项符合,则只能归类为类科恩综合症。目前该综合症的已知基因只有VPS13B(COH1),该基因位于8号染色体的长臂2区2带(8q22),有61个外显子,编码一种跨膜蛋白,主要的功能可能与调控细胞内液泡分类与蛋白质的运输有关,在发育及眼部功能形成,中枢神经系统中起重要作用。虽然已经发现了很多该基因的突变会导致科恩综合症,但是仍有许多患者病因未明,该基因上的新突变或者其他基因的突变可能也是导致该综合征的病因。
因而,目前对科恩综合症尤其是其致病基因的研究仍有待深入。
技术实现要素:
本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明的一个目的在于提出一种能够有效筛选易患科恩综合症的生物样品的手段。
本发明是基于发明人的下列工作完成的:
发明人发现,目前的致病基因和致病突变挖掘的研究中,多使用全外显子组测序法。全外显子组测序是利用特制的DNA序列探针将全基因组中的外显子区域捕获下来,然后针对每个外显子进行深度测序的技术。利用外显子组测序找出孟德尔遗传病致病基因的案例很多,比如Sarah等人在2009年利用外显子组测序找到米勒综合症的一个致病突变,这也是外显子组测序的首次成功应用;对于科恩综合症,André Mégarbané等人利用目标区域测序找到了VPS13B的一个剪接位点突变导致了该病。随着外显子组测序技术的广泛应用和日渐成熟,一批新的致病基因(突变)被相继发现,极大地推动了相关疾病诊断及治疗的研究进展。
因而,发明人针对自行收集的一个黎巴嫩近亲结婚的科恩综合症患者家系,通过外显子组测序、连锁分析联合Sanger测序验证的方法进行致病突变挖掘和验证,最终确定了科恩综合症的一个新的致病突变——VPS13B基因的c.11327_11327delA突变。
进而,根据本发明的第一方面,本发明提出了一种分离的编码VPS13B突变体的核酸。根据本发明的实施例,所述核酸与野生型VPS13B基因相比,具有c.11327_11327delA突变,即相对于野生型VPS13B基因,本发明的VPS13B基因突变体的cDNA缺失第11327位碱基A。其中,需要说明的是,基于野生型VPS13B基因cDNA的第11326位和第11327位碱基均为A,因而,c.11327_11327delA突变也可以看作是缺失第11326位碱基A,即“c.11327_11327delA突变”表示:相对于野生型VPS13B基因,本发明的VPS13B基因突变体的cDNA缺失第11326位或11327位的碱基A。根据本发明的实施例,发明人确定了VPS13B基因的突变体,该突变体与科恩综合症的发病密切相关,从而通过检测该突变体在生物样品中是否存在,可以有效地检测生物样品是否易患科恩综合症。具体地,当生物样品或生物体中仅存在本发明的VPS13B基因突变体,而不存在野生型VPS13B基因时,则可以有效预测该生物样品或生物体易患科恩综合症。
根据本发明的第二方面,本发明提出了一种分离的多肽。根据本发明的实施例,与野生型VPS13B相比,所述分离的多肽具有p.Asn3776Thrfs*102突变,即该突变是由于c.11327_11327delA突变而引起的,具体地,相对于野生型VPS13B,本发明的分离的多肽(即VPS13B突变体)氨基酸序列第3776位的天冬酰胺突变为苏氨酸,之后还有100个氨基酸(数目和顺序与野生型不同)。通过检测生物样品中是否表达该多肽,可以有效地检测生物样品是否易患科恩综合症。具体地,当生物样品或生物体中仅存在本发明的VPS13B突变体,而不存在野生型VPS13B时,则可以有效预测该生物样品或生物体易患科恩综合症。
根据本发明的第三方面,本发明提出了一种筛选易患科恩综合症的生物样品的系统。根据本发明的实施例,该系统包括:核酸提取装置,所述核酸提取装置用于从所述生物样品提取核酸样本;核酸序列确定装置,所述核酸序列确定装置与所述核酸提取装置相连,用于对所述核酸样本进行分析,以便确定所述核酸样本的核酸序列;判断装置,所述判断装置与所述核酸序列确定装置相连,以便基于所述核酸样本的核酸序列或其互补序列,与野生型VPS13B基因相比,是否具有c.11327_11327delA纯合突变,判断所述生物样品是否易患科恩综合症。利用该系统,能够有效地筛选易患科恩综合症的生物样品。具体地,当生物样品或生物体中仅存在本发明的VPS13B基因突变体,而不存在野生型VPS13B基因时,则可以有效预测该生物样品或生物体易患科恩综合症。
根据本发明的第四方面,本发明提出了一种用于筛选易患科恩综合症的生物样品的试剂盒。根据本发明的实施例,该试剂盒含有:适于检测VPS13B基因突变体的试剂,其中与野生型VPS13B基因相比,该VPS13B基因突变体具有c.11327_11327delA突变。利用根据本发明的实施例的试剂盒,通过筛选仅包含上述VPS13B基因突变体而不包含野生型VPS13B基因的生物样品,即能够有效地筛选易患科恩综合症的生物样品。具体地,当生物样品或生物体中仅存在本发明的VPS13B基因突变体,而不存在野生型VPS13B基因时,则可以有效预测该生物样品或生物体易患科恩综合症。
根据本发明的第五方面,本发明还提出了一种构建体。根据本发明的实施例,该构建体包含前面所述的分离的编码VPS13B突变体的核酸。由此,利用本发明的构建体转化受体细胞获得的重组细胞,能够有效地用于筛选治疗科恩综合症的药物。
根据本发明的第六方面,本发明还提出了一种重组细胞。根据本发明的实施例,该重组细胞是通过前面所述的构建体转化受体细胞而获得的。根据本发明的一些实施例,利用本发明的重组细胞,能够有效地筛选治疗科恩综合症的药物。
根据本发明的第七方面,本发明还提出了一种构建药物筛选模型的方法。根据本发明的实施例,该方法包括:使动物的至少一部分细胞仅表达前面所述的编码VPS13B突变体的核酸而不表达野生型VPS13B基因。由此,利用本发明的药物筛选模型,能够有效地筛选治疗科恩综合症的药物。
需要说明的是,本发明发现的科恩综合症致病基因VPS13B的一个新移码突变,该突变位点可以用于早期筛查科恩综合症致病突变携带者,进而在携带者发病之前进行早期干预治疗;也可用于科恩综合症患者的分子诊断及与相关疾病的的鉴别诊断,并且快速、准确、高效、简便、早期诊断率高,检测结果可以为科恩综合症的早期诊断、鉴别诊断及开发科恩综合症治疗药物提供科学依据。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
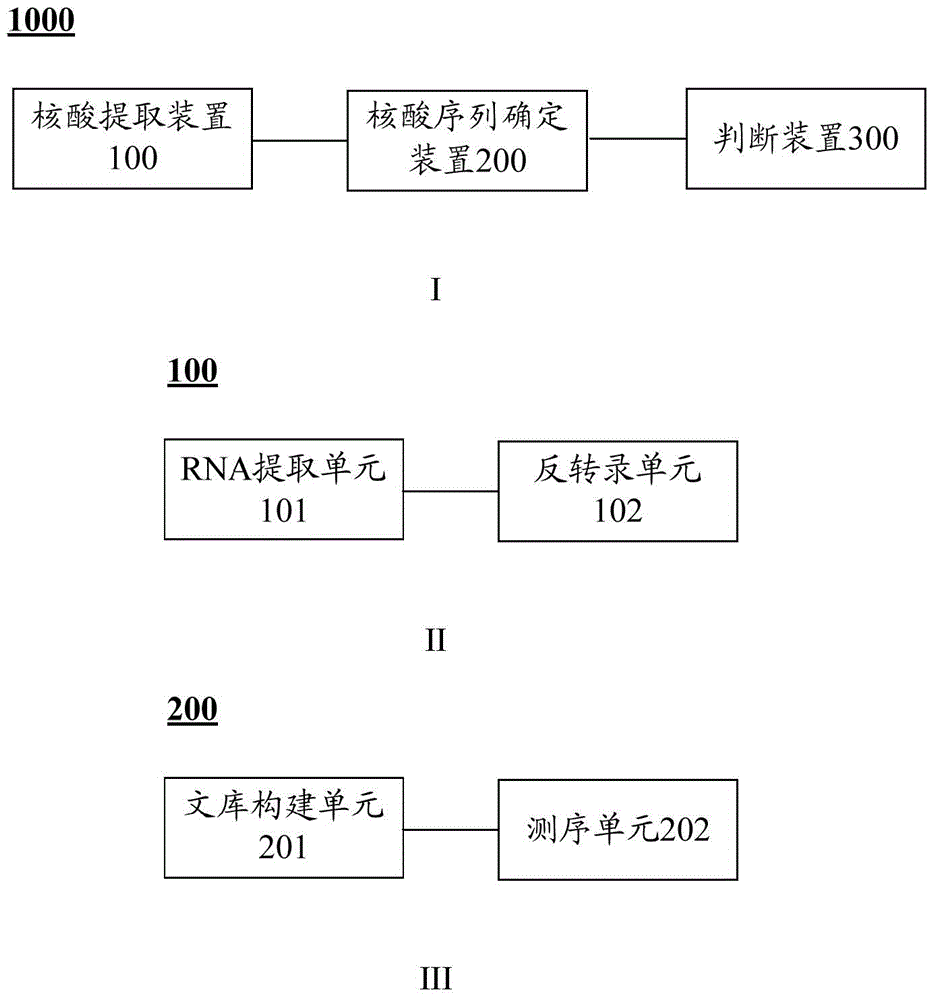
图1显示了根据本发明实施例的筛选易患科恩综合症的生物样品的系统及其组成部分的示意图,其中,
图1 I为根据本发明实施例的筛选易患科恩综合症的生物样品的系统的示意图,
图1 II为根据本发明实施例的核酸提取装置的示意图,
图1 III为根据本发明实施例的核酸序列确定装置的示意图;
图2显示了根据本发明一个实施例的科恩综合症患者家系的家系图;
图3显示了根据本发明的一个实施例所提供的关于VPS13B基因c.11327_11327delA突变位点的Sanger测序验证峰图,其中所述VPS13B基因来自于图2所示科恩综合症患者家系中的所有家系成员。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
VPS13B基因突变体
根据本发明的第一方面,本发明提出了一种分离的编码VPS13B突变体的核酸。根据本发明的实施例,所述核酸与野生型VPS13B基因相比,具有c.11327_11327delA突变。
在本文中所使用的表达方式“编码VPS13B突变体的核酸”,是指与编码VPS13B突变体的基因相对应的核酸物质,即核酸的类型不受特别限制,可以是任何包含与VPS13B突变体的编码基因相对应的脱氧核糖核苷酸和/或核糖核苷酸的聚合物,包括但不限于DNA、RNA或cDNA。根据本发明的一个具体示例,前面所述的编码VPS13B突变体的核酸为DNA。根据本发明的实施例,发明人确定了VPS13B基因的突变体,该突变体与科恩综合症的发病密切相关,从而通过检测该突变体在生物样品中是否存在,可以有效地检测生物样品是否易患科恩综合症,也可以通过检测该突变体在生物体中是否存在,可以有效地预测生物体是否易患科恩综合症。具体地,当生物样品或生物体中仅存在本发明的VPS13B基因突变体,而不存在野生型VPS13B基因时,则可以有效预测该生物样品或生物体易患科恩综合症。
该编码VPS13B突变体的核酸,是本申请的发明人通过外显子组测序、连锁分析联合Sanger测序验证的方法确定的科恩综合症的致病基因VPS13B的新的致病突变。该致病突变位点在现有技术中并未被提到。
其中,野生型VPS13B基因的cDNA序列可以从下述网址获得:http://www.ncbi.nlm.nih.gov/CCDS/CcdsBrowse.cgi?REQUEST=GV&DATA=426849&BUILDS=CURRENTBUILDS,
其编码的蛋白质(即野生型)的氨基酸序列可从下述网址获得:http://www.ncbi.nlm.nih.gov/CCDS/CcdsBrowse.cgi?REQUEST=GV&DATA=426849&BUILDS=CURRENTBUILDS。
发明人发现的VPS13B基因突变体与野生型VPS13B基因相比,具有c.11327_11327delA突变,即相对于野生型VPS13B基因,本发明的VPS13B基因突变体的cDNA缺失第11326位或11327位的碱基A。
目前,尚未见VPS13B基因的c.11327_11327delA突变为科恩综合症的致病突变的相关报道。
根据本发明的第二方面,本发明提出了一种分离的多肽。根据本发明的实施例,与野生型VPS13B相比,该分离的多肽具有p.Asn3776Thrfs*102突变,即该突变是由于c.11327_11327delA突变而引起的,具体地,相对于野生型VPS13B,本发明的分离的多肽(即VPS13B突变体)氨基酸序列第3776位置的天冬酰胺突变为苏氨酸,之后还有100个氨基酸。其中,这100个氨基酸的数目和顺序与野生型VPS13B的不同,具体地,上述与野生型不同的100个氨基酸的具体氨基酸序列如SEQ ID NO:3所示:
SRKHLRHRLQQDTRPRVSSRVWGKESWGCSQSPSEELLSWCHRLAMVFYMELDFLSFPNSAISQVIYMLTRLQTAMSNMSGKCFSLWADQKSTWPWTWFW*(SEQ ID NO:3)
根据本发明的一些具体示例,该多肽是由前述分离的编码VPS13B突变体的核酸编码的。通过检测生物样品中是否表达该多肽,可以有效地检测生物样品是否易患科恩综合症,也可以通过检测这些多肽在生物体中是否存在,可以有效地预测生物体是否易患科恩综合症。具体地,当生物样品或生物体中仅存在本发明的VPS13B突变体,而不存在野生型VPS13B时,则可以有效预测该生物样品或生物体易患科恩综合症。
筛选易患科恩综合症的生物样品的系统和试剂盒
根据本发明的第三方面,本发明提出了一种能够有效实施上述筛选易患科恩综合症的生物样品的方法的系统。
参考图1,根据本发明的实施例,该筛选易患科恩综合症的生物样品的系统1000包括核酸提取装置100、核酸序列确定装置200以及判断装置300。
根据本发明的实施例,核酸提取装置100用于从生物样品提取核酸样本。根据本发明的实施例,生物样品的类型并不受特别限制,只要从该生物样品中能够提取到反映生物样品VPS13B是否存在突变的核酸样本即可。根据本发明的实施例,生物样品可以为选自人体血液、皮肤、皮下组织的至少一种,优选外周血。由此,可以方便地进行取样和检测,从而能够进一步提高筛选易患科恩综合症的生物样品的效率。根据本发明的实施例,这里所使用的术语“核酸样本”应做广义理解,其可以是任何能够反映生物样品中VPS13B是否存在突变的样本,例如可以是从生物样品中直接提取的全基因组DNA,也可以是该全基因组中包含VPS13B编码序列的一部分,可以是从生物样品中提取的总RNA,也可以是从生物样品中提取的mRNA。根据本发明的一个实施例,所述核酸样本为全基因组DNA。由此,可以扩大生物样品的来源范围,并且可以同时对生物样品的多种信息进行确定,从而能够提高筛选易患科恩综合症的生物样品的效率。另外,根据本发明的实施例,核酸样本的类型并不受特别限制,对于采用RNA作为核酸样本,则核酸提取装置进一步包括RNA提取单元101和反转录单元102,其中,提取单元101用于从生物样品提取RNA样本,反转录单元102与RNA提取单元101相连,用于对RNA样本进行反转录反应,以便获得cDNA样本,所得到的cDNA样本构成核酸样本。由此,可以进一步提高利用RNA作为核酸样本筛选易患科恩综合症的生物样品的效率。
根据本发明的实施例,核酸序列确定装置200与核酸提取装置100相连,用于对核酸样本进行分析,以便确定核酸样本的核酸序列。根据本发明的实施例,确定所得到核酸样本的核酸序列的方法和设备并不受特别限制。根据本发明的具体实施例,可以采用测序的方法确定核酸样本的核酸序列。由此,根据本发明的一个实施例,所述核酸序列确定装置200可以进一步包括:文库构建单元201以及测序单元202。文库构建单元201用于针对核酸样本,构建核酸测序文库;测序单元202与文库构建单元201相连,用于对核酸测序文库进行测序,以便获得由多个测序数据构成的测序结果。
关于针对核酸样本,构建测序文库的方法和流程,本领域技术人员可以根据不同的测序平台进行适当选择,关于流程的细节,可以参见测序仪器的厂商例如Illumina公司所提供的规程,例如参见Illumina公司Multiplexing Sample Preparation Guide(Part#1005361;Feb 2010)或Paired-End SamplePrep Guide(Part#1005063;Feb 2010),通过参照将其并入本文。根据本发明的实施例,从生物样品提取核酸样本的方法和设备,也不受特别限制,可以采用商品化的核酸提取试剂盒进行。
需要说明的是,在这里所使用的术语“核酸序列”应作广义理解,其可以是在对核酸样本进行测序得到的测序数据进行组装后得到的完整的核酸序列信息,也可以是直接采用通过对核酸样本进行测序所得到的测序数据(reads)作为核酸序列,只要这些核酸序列中含有对应VPS13B的编码序列即可。
另外,根据本发明的实施例,可以对核酸样本进行筛选,富集VPS13B外显子,该筛选富集可以在构建测序文库之前,构建测序文库过程中,或者构建测序文库之后进行。由此,文库构建单元201可以进一步包括PCR扩增模块(图中未示出),在该PCR扩增模块中设置有VPS13B外显子特异性引物,以便利用VPS13B外显子特异性引物,对所述核酸样本进行PCR扩增。由此,可以通过PCR扩增,富集VPS13B外显子,从而能够进一步提高筛选易患科恩综合症的生物样品的效率。根据本发明的具体实施例,VPS13B外显子特异性引物具有如SEQ ID NO:1和2所示的核苷酸序列:
正向引物:5’-GGTAAACAAATGGGTAGTAAAG-3’(SEQ ID NO:1);
反向引物:5’-ATGCAAATCAGTAACGTCTGG-3’(SEQ ID NO:2)。
发明人惊奇地发现,通过采用上述引物,可以在PCR反应体系中显著有效地完成对VPS13B外显子的扩增。需要说明的是,这些SEQ ID NO:1和SEQ ID NO:2所示的核苷酸序列是本发明的发明人在付出了艰苦的劳动后,意外获得的。
对于本发明说明书和权利要求书中,提及核酸,本领域技术人员应当理解,实际包括互补双链的任意一条,或者两条。为了方便,在本说明书和权利要求书中,虽然多数情况下只给出了一条链,但实际上也公开了与之互补的另一条链。例如,提及SEQ ID NO:1,实际包括其互补序列。本领域技术人员还可以理解,利用一条链可以检测另一条链,反之亦然。
根据本发明的实施例,可以用于进行测序的设备并不受特别限制。根据本发明的实施例,可以采用第二代测序平台,也可以采用第三代以及第四代或者更先进的测序平台。根据本发明的具体示例,测序单元202可以为选自HISEQ2000、SOLiD、454和单分子测序装置的至少一种。由此,结合最新的测序技术,针对单个位点可以达到较高的测序深度,检测灵敏度和准确性大大提高,因而能够利用这些测序装置的高通量、深度测序的特点,进一步提高对核酸样本进行检测分析的效率。从而,提高后续对测序数据进行分析时的精确性和准确度。
根据本发明的实施例,判断装置300与核酸序列确定装置200相连,适于将核酸样本的核酸序列进行比对,以便基于核酸样本的核酸序列与野生型VPS13B基因的区别判断生物样品是否易患科恩综合症。由此,利用该系统,能够有效地筛选易患科恩综合症的生物样品。
具体地,基于核酸样本的核酸序列与野生型VPS13B基因相比,是否具有c.11327_11327delA突变,判断生物样品是否易患科恩综合症。如前所述,根据本发明的一个实施例,核酸样本的核酸序列与野生型VPS13B基因相比,具有c.11327_11327delA纯合突变,是生物样品易患科恩综合症的指示。具体地,当生物样品或生物体中仅存在本发明的VPS13B基因突变体,而不存在野生型VPS13B基因时,则可以有效预测该生物样品或生物体易患科恩综合症。根据本发明的实施例,对核酸序列与野生型VPS13B基因进行比对的设备并不受特别限制,可以采用任意常规的软件进行操作,根据本发明的具体实例,可以采用SOAP软件进行比对。
根据本发明的第四方面,本发明提出了一种用于筛选易患科恩综合症的生物样品的试剂盒。根据本发明的实施例,该用于筛选易患科恩综合症的生物样品的试剂盒包括:适于检测VPS13B基因突变体的试剂,其中与野生型VPS13B基因相比,该VPS13B基因突变体具有c.11327_11327delA突变。利用根据本发明的实施例的试剂盒,能够有效地筛选易患科恩综合症的生物样品。具体地,当生物样品或生物体中仅存在本发明的VPS13B基因突变体,而不存在野生型VPS13B基因时,则可以有效预测该生物样品或生物体易患科恩综合症。
在本文中,所使用的术语“适于检测VPS13B基因突变体的试剂”应做广义理解,即可以是检测VPS13B编码基因的试剂,也可以是检测VPS13B突变体多肽的试剂,例如可以采用识别特异性位点的抗体。根据本发明的一个实施例,所述试剂为核酸探针或引物,优选地,所述核酸探针或引物具有如SEQ ID NO:1-2所示的核苷酸序列。由此,可以高效地筛选易患科恩综合症的生物样品。
需要说明的是,在本文前面筛选易患科恩综合症的生物样品的系统部分中所描述的特征和优点,同样适用于筛选易患科恩综合症的生物样品的试剂盒,在此不再赘述。
构建体及重组细胞
根据本发明的第五方面,本发明还提出了一种构建体。根据本发明的实施例,该构建体包含前面所述的分离的编码VPS13B突变体的核酸,即本发明的VPS13B基因突变体。由此,利用本发明的构建体转化受体细胞获得的重组细胞,能够有效地用于筛选治疗科恩综合症的药物。其中,所述受体细胞的种类不受特别限制,例如可以为大肠杆菌细胞、哺乳动物细胞,优选该受体细胞来源于哺乳动物。
在本发明中所使用的术语“构建体”是指这样的一种遗传载体,其包含特定核酸序列,并且能够将目的核酸序列转入宿主细胞中,以获得重组细胞。根据本发明的实施例,构建体的形式不受特别限制。根据本发明的实施例,其可以为质粒、噬菌体、人工染色体、粘粒(Cosmid)、病毒的至少一种,优选质粒。质粒作为遗传载体,具有操作简单,可以携带较大片段的性质,便于操作和处理。质粒的形式也不受特别限制,既可以是环形质粒,也可以是线性质粒,即可以是单链的,也可以是双链的。本领域技术人员可以根据需要进行选择。在本发明中所使用的术语“核酸”可以是任何包含脱氧核糖核苷酸或者核糖核苷酸的聚合物,包括但不限于经过修饰的或者未经修饰的DNA、RNA,其长度不受任何特别限制。对于用于构建重组细胞的构建体,优选所述核酸为DNA,因为DNA相对于RNA而言,其更稳定,并且易于操作。
根据本发明的第六方面,本发明还提出了一种重组细胞。根据本发明的实施例,该重组细胞是通过前面所述的构建体转化受体细胞而获得的。从而,本发明的重组细胞能够表达构建体所携带的VPS13B基因突变体。根据本发明的一些实施例,利用本发明的重组细胞,能够有效地筛选治疗科恩综合症的药物。根据本发明的实施例,受体细胞的种类不受特别限制,例如可以为大肠杆菌细胞、哺乳动物细胞,优选所述受体细胞来源于非人哺乳动物。
构建药物筛选模型的方法
根据本发明的第七方面,本发明还提供了一种构建药物筛选模型的方法。根据本发明的实施例,该方法包括:使动物的至少一部分细胞仅表达前述的编码VPS13B突变体的核酸而不表达野生型VPS13B基因。根据本发明的实施例,所述动物为小鼠、猪、狗、灵长类动物。根据本发明的一些实施例,利用本发明的药物筛选模型,能够有效地筛选治疗科恩综合症的药物。
需要说明的是,本发明的构建药物筛选模型的方法不受特别的限制,只要使动物的至少一部分细胞仅表达前述的编码VPS13B突变体的核酸而不表达野生型VPS13B基因即可。例如,可以用采用基因转化的方法,将前面所述的本发明的构建体转入受体动物(非人),从而使得动物的至少一部分细胞仅表达前述的VPS13B基因突变体;也可以采用CRISPR/Cas9基因编辑技术,使受体动物的VPS13B基因发生c.11327_11327delA纯合突变,并有效表达前述的多肽,从而该受体动物能够发生科恩综合症,进而能够有效地用于筛选治疗科恩综合症的药物,也即能够有效用作药物筛选模型。
需要说明的是,科恩综合症的临床早期诊断比较困难,这是因为该综合征的表征比较复杂,特别是儿童期有些表征不易检测出,因此基因层面的诊断是十分重要的。与传统的连锁分析、候选基因关联分析技术相比,外显子组测序技术针对基因组内编码蛋白质的外显子区域,目标集中,测序深度和精度更高。本发明采用新一代的全外显子组测序技术,针对一个科恩综合症患者家系进行全基因组外显子组测序分析,从而发现了一个科恩综合症致病基因VPS13B的新的纯合突变。由此,本发明丰富了VPS13B基因的致病突变图谱,进一步阐明了科恩综合症的分子发病机制,对于科恩综合症的早期致病基因筛查和干预治疗提供科学依据。
下面参考具体实施例,对本发明进行说明,需要说明的是,这些实施例仅仅是说明性的,而不能理解为对本发明的限制。
若未特别指明,实施例中所采用的技术手段为本领域技术人员所熟知的常规手段,可以参照《分子克隆实验指南》第三版或者相关产品进行,所采用的试剂和产品也均为可商业获得的。未详细描述的各种过程和方法是本领域中公知的常规方法,所用试剂的来源、商品名以及有必要列出其组成成分者,均在首次出现时标明,其后所用相同试剂如无特殊说明,均以首次标明的内容相同。
实施例1确定科恩综合症致病突变
1、样本收集
发明人收集到一个黎巴嫩近亲结婚的科恩综合症患者家系,其家系图见图2。如图2所示,其中,○表示正常女性,□表示正常男性,■表示男性患者,●表示女性患者。即该家系包括父母和两个孩子(两个孩子均患病),I1是父亲,I2是母亲,II1是患病男孩,II2是患病女孩。患者表现出头小畸形,发育迟缓,智力缺陷,近视,听力缺陷,面部轻度畸形,但是没有开嘴型特征。
发明人采集了该家系4个成员(2个患者,2个正常的携带者)的外周血,所有血样均签属知情同意书,并获得伦理委员会批准。
2、目标区域捕获测序
发明人利用Aglient SureSelect Human All Exon kit(Agilent Technologies,Santa Clara,CA,USA)结合Solexa高通量测序技术,对上述科恩综合症患者家系中的两名患者II1、II2的外显子组序列进行了测序。
具体如下:
2.1DNA提取
采集图2所示科恩综合症患者家系中患者II1、II2的外周血,利用常规酚-氯仿法抽提外周血白细胞中的基因组DNA,并利用分光光度计测量DNA的浓度及纯度,所得各基因组DNA的OD260/OD280均应位于1.7-2.0之间,浓度不少于200纳克/微升,总量不少于30微克。
2.2目标区域捕获与测序
利用超声波仪(CovarisS2,Massachusetts,USA)将各基因组DNA样本随机打断成200-300bp左右的片段,随后按照制造商提供的操作说明书,在片段两端分别连接上接头制备文库(可参见:http://www.illumina.com/提供的Illumina/Solexa标准建库说明书,通过参照将其全文并入本文)。文库经纯化后经过Ligation-mediated PCR(LM-PCR)的线性扩增与捕获试剂SureSelect Biotiny lated RNA Library(BAITS)进行杂交富集,再经过LM-PCR的线性扩增,文库检测合格后即可上机测序,以便获得原始测序数据。其中,测序平台为Illumina Hiseq 2000,读取长度为100bp,各样本的平均测序深度最少为50×。
3、变异检测、注释及数据库比较
利用Illumina basecalling Software 1.7对上述获得的原始测序数据进行处理,并过滤低质量reads和包含接头污染reads。然后,使用Burrows-Wheeler Aligner(BWA)(可参见:H.Li and R.Durbin,Fast and accurate short read alignment with Burrows-Wheeler transform,Bioinformatics.,25(2009)1754-1760.,通过参照将其全文并入本文)和Short Oligonucleotide Analysis Package(SOAPaligner 2.21)(可参见:R.Li,C.Yu,et al,SOAP2:an improved ultrafasttool for short read alignment,Bioinformatics.,25(2009)1966-1967.,通过参照将其全文并入本文)将高质量reads比对到参考基因组(hg19),获得比对到基因组上的唯一比对reads。然后对SOAP比对的结果用SOAPsnp1.05(可参见:R.Li,Y.Li,et al,SNP detection for massively parallel whole-genome resequencing,Genome Res.,19(2009)1124-1132.,通过参照将其全文并入本文)进行SNP的检测,对BWA比对的结果用Genome Analysis Tool Kit(GATK1.4)(可参见:M.A.DePristo,E.Banks,et al,A framework for variation discovery and genotyping using next-generation DNA sequencing data,Nat.Genet.,43(2011)491-498.,通过参照将其全文并入本文)进行indel的检测。
对检出的SNP和indel变异进行注释,即确定变异所处基因组环境,以及变异的类型。本实验关注非同义突变、剪接受体/供体位点突变和编码区插入和缺失突变这三类最有可能与疾病相关的突变。发明人将检出的变异与dbSNP数据库(http://hgdownload.cse.ucsc.edu/goldenPath/hg19/database/snp135.txt.gz.)、HapMap数据库(ftp://ftp.ncbi.nlm.nih.gov/hapmap)、千人基因组数据库(ftp://ftp.1000genomes.ebi.ac.uk/vol1/ftp)、炎黄数据库(http://yh.genomics.org.cn/)等公共数据库、ESP数据库等公共数据库进行了比较,保留了低频的变异(MAF≤0.01)。根据遗传模式(近亲结婚,隐性病),发明人选取了患者中为隐性纯合而正常的父母均为杂合的位点进行优先考虑,而对于位于疾病已知基因上的候选致病突变,还进行了sanger验证。
通过以上分析,发明人在患者的VPS13B基因上发现了未报道过的纯合突变c.11327_11327delA(或c.11326_11326delA,因为基因组上这个位置是连续的2个A,无法判断是哪个A的缺失),p.(Asn3776Thrfs*102),该突变在两个患者中是纯合,在父母中是杂合。由此,发明人认为,VPS13B基因的c.11327_11327delA突变为科恩综合症的致病突变。
实施例2 Sanger法测序验证
分别对实施例1中所述的科恩综合症患者家系中的所有家系成员(包括2个患者,2个正常的携带者)以及1200名家系外正常人的VPS13B基因进行检测:针对VPS13B基因的c.11327_11327delA突变设计引物,然后通过PCR扩增、产物纯化和测序的方法获得突变位点有关序列,根据确定序列测定结果属于突变型还是野生型,验证VPS13B基因及该突变与科恩综合症之间的相关性。
具体方法步骤如下:
1、DNA提取
按照实施例1中所述的提取DNA的方法,分别提取制备受试者外周静脉血中的基因组DNA,备用。
2、引物设计及PCR反应
首先,参考人类基因组序列数据库hg19/build36.3,设计得到具有SEQ ID NO:1-2所示核苷酸序列的VPS13B基因外显子特异性引物,具体序列如下:
正向引物:5’-GGTAAACAAATGGGTAGTAAAG-3’(SEQ ID NO:1);
反向引物:5’-ATGCAAATCAGTAACGTCTGG-3’(SEQ ID NO:2)。
接着,分别按照以下配比配制各基因组DNA样本的PCR反应体系以及进行PCR反应:
反应体系(25μl):
PCR反应条件:
由此,获得各受试者基因组DNA样本的PCR扩增产物。
3、测序
将步骤2中获得的各受试者基因组DNA样本的PCR扩增产物直接进行DNA测序。其中,测序采用ABI3730型测序仪进行。
基于测序结果,在本发明的科恩综合症患者家系中对VPS13B基因的该突变位点进行突变排查,结果发现该家系中患者(II1和II2)均携带c.11327_11327delA(p.Asn3776Thrfs*102)纯合突变,而表现正常的家系成员(I1和I2)均携带c.11327_11327delA(p.Asn3776Thrfs*102)杂合突变。此外,1200名受试的家系外正常人均不携带该突变。其中,图3显示了上述科恩综合症患者家系中所有成员的的VPS13B基因c.11327_11327delA突变位点的Sanger测序验证峰图。
由此,进一步证明VPS13B基因为科恩综合症的致病基因,VPS13B基因的c.11327_11327delA突变为该病的致病突变。
实施例3检测试剂盒
制备一检测试剂盒,其包含能够检测VPS13B基因的c.11327_11327delA突变的引物,用于筛选易患科恩综合症的生物样品,其中这些引物为VPS13B基因外显子特异性引物,其序列如实施例2中所述SEQ ID NO:1-2所示。
利用上述试剂盒筛选易患科恩综合症的生物样品的具体步骤为:按照实施例2的步骤1所述的方法提取待测者DNA,以所提取的DNA为模板与上述VPS13B基因的外显子特异性引物进行PCR反应,并按照本领域常规方法对PCR产物纯化,将纯化的产物进行测序,然后通过观察测序所得到的序列中是否仅具有c.11327_11327delA突变,而不具备野生型VPS13B基因序列,能够有效地检测本发明的VPS13B基因突变体在待测者DNA中是否存在,从而能够有效地检测待测者是否易患科恩综合症,进一步,能够从待测者中筛选出易患科恩综合症的生物样品。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
尽管已经示出和描述了本发明的实施例,本领域的普通技术人员可以理解:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!