高效分离体外诱导的RPE细胞和RPC的方法与流程
本发明涉及生物技术领域,尤其是涉及一种高效分离体外诱导的RPE细胞和RPC的方法。
背景技术:
视网膜变性疾病是全球首要的致盲原因。在该疾病中,视网膜色素上皮细胞(retinal pigment epithelium,RPE)的损伤和功能异常导致光感受器细胞(photoreceptor)变性,最终影响病人视力直至失明。由于RPE和光感受器细胞的不可再生,至今在临床上缺乏对这类疾病的有效治疗措施。相较于其他治疗方法,细胞治疗对视网膜退行性疾病的治疗有更大的前景。
由于胚胎干细胞(embryonic stem cells,ESCs)具有无限增殖和分化为各种细胞的能力,因此可以作为理想的移植细胞的来源。已有报道证实ESCs-RPE应用于人类视网膜退行性疾病临床研究的可行性与安全性,尽管病人术后视力与正常生活的要求还有很大差距。那么,一套稳定有效的体外全能干细胞向RPE细胞分化的方法对视网膜退行性疾病的治疗和制药研究显得尤为重要。
在过去的十几年间,多种方法被报道可以控制胚胎干细胞向视网膜色素上皮细胞分化,并且在多种动物病变模型中发挥保护作用。但是这些报道的方法多数在后期形成含有色素团块的混合细胞群体,一般采用机械挑传方法分离细胞。这种方法存在耗时长、批次间差异大和细胞得率低等问题。
因此,需要一种分离体外诱导的RPE细胞和视网膜神经元前体细胞(neural retina progenitor cells,RPC)的方法,可以同时得到成熟的RPE细胞和RPC细胞,并且能够做到方法简单、时间快捷和细胞得率高等优点。
技术实现要素:
本发明的目的就是为了克服上述现有技术存在的缺陷而提供一种高效分离体 外诱导的RPE细胞和RPC的方法,本发明方法可以简单、有效的实现两种细胞的分离纯化。
本发明的目的可以通过以下技术方案来实现:
一种高效分离体外诱导的视网膜色素上皮细胞(retinal pigmented epithelium,RPE)和视网膜神经元前体细胞(neural retina progenitor cells,RPC)的方法,包括以下步骤:
a、对人胚胎干细胞(human embryonic stem cells,hESCs)来源的具有色素团块的混合细胞进行酶处理成单细胞,离心后弃上清,添加培养基重悬并接种于培养皿中悬浮培养;
b、培养1天后形成黑白混合的细胞悬球,定期换液并培养;
c、培养7天混合的细胞悬球会形成黑白两个部分,然后机械分离得到两种类型的细胞悬球;
d、收集不同细胞悬球并分别接种到培养皿中,放置培养并定期换液即可分别得到成熟的RPE细胞和RPC。
优选的,步骤a中所述hESCs来源的具有色素团块的混合细胞为hESCs通过诱导分化或者自发分化的方法得到的;所述酶处理成单细胞为应用0.25%胰酶在37℃条件下处理20分钟,并用移液器吹打成单细胞然后终止胰酶反应;所述离心后弃上清为用水平离心机1800rpm离心5分钟后弃掉上清;所述培养基成分为:DMEM/F12基础培养基、血清替代物、非必须氨基酸、青霉素、链霉素、谷氨酰胺及β-巯基乙醇,其中,血清替代物的体积分数为20%,非必须氨基酸的浓度为0.01mmol/L,青霉素的浓度为100U/ml,链霉素的浓度为100ug/ml,谷氨酰胺的浓度为1mmol/L,β-巯基乙醇浓度为0.1mmol/L。所述培养是在37℃和5%CO2培养箱中进行;所述培养皿为非粘附的细菌培养皿。
优选的,步骤b中所述定期换液为每天换液,收集细胞悬球至15毫升离心管,用水平离心机400rpm离心3分钟,弃上清加入新鲜培养基;所述培养是在37℃和5%CO2培养箱中进行。
优选的,步骤c中所述形成黑白两个部分为混合悬球中的黑白细胞分别聚集并分离形成两个粘连的黑色悬球与白色悬球;所述培养是在37℃和5%CO2培养箱中进行;所述机械分离为用灭菌的刀片在黑白悬球的粘连出切割使两悬球分离。
优选的,步骤d中所述收集不同细胞悬球为用移液器根据颜色收集黑色与白色 两种细胞悬球;所述培养皿为100ug/ml Matrigel包被的细胞培养皿;所述定期换液为隔天换液;所述成熟的RPE细胞为具有鹅卵石样形态,色素积累,表达相关蛋白并具有吞噬功能的细胞;所述培养是在37℃和5%CO2培养箱中进行;所述RPC为表达相关蛋白的神经元细胞。
本发明提供了一种分离体外诱导的RPE细胞和RPC的方法,可以简单,有效的从hESCs来源的混合细胞群体中分离纯化得到大量成熟的RPE细胞和RPC。与现有的技术相比,本发明适用于hESCs来源的含有色素团块的混合细胞;相较于传统的机械分离法,本发明方法简单,重复性好,成功率高,细胞纯度和得率高,并且同时分离得到RPE细胞和RPC。
附图说明
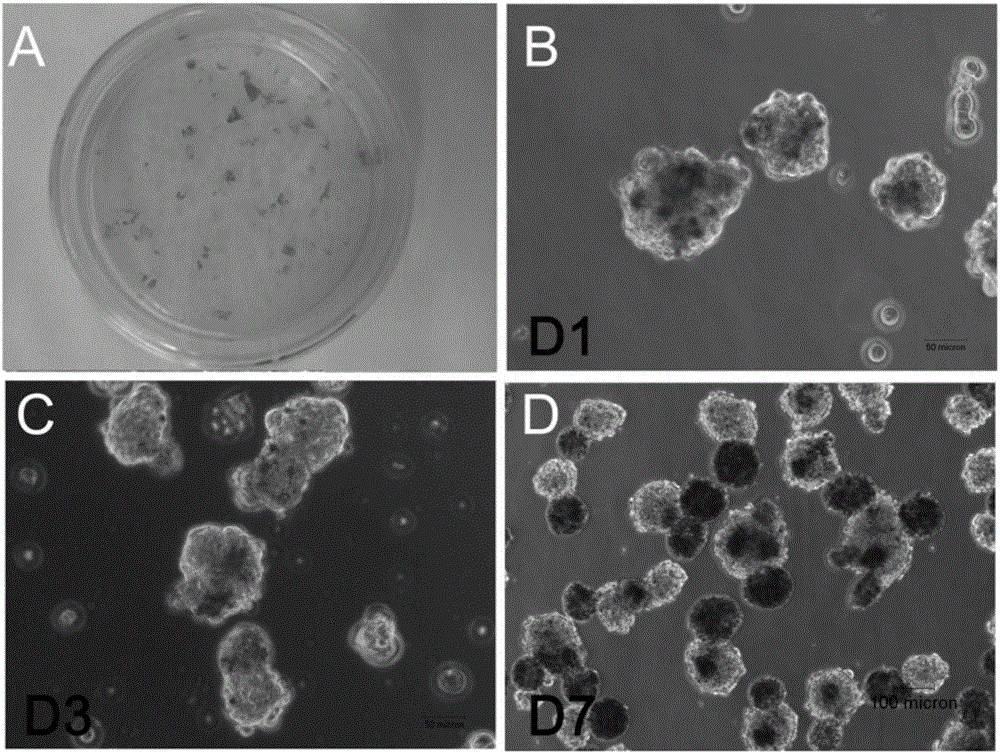
图1为本发明人胚胎干细胞系H1来源的含色素的混合分化细胞及酶处理后悬浮培养的示意图;
图2为本发明黑色与白色细胞悬球机械分离并收集的示意图;
图3为本发明黑白悬球分别贴壁并长期培养的的细胞形态示意图;
图4为本发明分离纯化的H1来源RPE细胞形态及鉴定示意图;
图5为本发明分离纯化的H1来源的RPC的免疫荧光鉴定示意图。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明。
实施例
本实施例为高效分离体外诱导的视网膜色素上皮细胞和视网膜神经元前体细胞的方法。
本实施例中,所述混合细胞为多干细胞分化得到的含有色素团块的混合细胞群体,均能利用本方法实现分离目的。
本实施例中,所述分离细胞的方法包括如下步骤:
a.对hESCs来源的具有色素团块的混合细胞进行酶处理成单细胞,离心后弃上清,添加培养基重悬并接种于培养皿中悬浮培养;
本步骤中所述hESCs为第50代的H1细胞系;所述具有色素团块的混合细胞为通过定向诱导分化hESCs45天后得到的,如图1A;所述酶处理成单细胞为应用 0.25%胰酶在37℃条件下处理20分钟,并用移液器吹打成单细胞然后终止胰酶反应;所述离心后弃上清为用水平离心机1800rpm离心5分钟后弃掉上清;所述培养基成分为:DMEM/F12基础培养基、血清替代物、非必须氨基酸、青霉素、链霉素、谷氨酰胺及β-巯基乙醇,其中,血清替代物的体积分数为20%,非必须氨基酸的浓度为0.01mmol/L,青霉素的浓度为100U/ml,链霉素的浓度为100ug/ml,谷氨酰胺的浓度为1mmol/L,β-巯基乙醇浓度为0.1mmol/L;所述培养是在37℃和5%CO2培养箱中进行;所述培养皿为非粘附的细菌培养皿。
b.培养1天后形成黑白混合的细胞悬球,定期换液并培养;
本步骤中所述一天后形成的黑白细胞混合的细胞悬球如图1B所示;所述定期换液为每天换液,收集细胞悬球至15毫升离心管,用水平离心机400rpm离心3分钟,弃上清加入新鲜培养基;所述培养是在37℃和5%CO2培养箱中进行。
c.培养7天混合的细胞悬球会形成黑白两个部分,然后机械分离得到两种类型的细胞悬球;
本步骤中所述形成黑白两个部分为混合悬球中的黑白细胞分别聚集并分离形成两个粘连的黑色悬球与白色悬球如图1C和1D所示3天和7天的细胞悬球状态;所述培养是在37℃和5%CO2培养箱中进行;所述机械分离为用灭菌的刀片在黑白悬球的粘连出切割使两悬球分离如图2A和2B。
d.收集不同细胞悬球并分别接种到培养皿中,放置培养并定期换液即可分别得到成熟的RPE细胞和RPC。
本步骤中所述收集不同细胞悬球为用移液器根据颜色收集黑色与白色两种细胞悬球如图2C和2D;所述培养皿为100ug/ml Matrigel包被的细胞培养皿;所述定期换液为隔天换液;所述成熟的视网膜色素上皮细胞为具有鹅卵石样形态,色素积累,表达相关蛋白并具有吞噬功能的细胞,如图3A和3C为黑色细胞悬球贴壁1周和3周的细胞形态图;所述培养是在37℃和5%CO2培养箱中进行;所述视网膜神经元前体细胞为表达相关蛋白的神经元细胞,如图3B和3D为白色细胞悬球贴壁1周和3周的细胞形态图。
进一步对分离纯化的H1来源的RPE细胞(H1-RPE)进行免疫组化鉴定,发现H1-RPE细胞具有典型的鹅卵石样形态和色素积累;表达成熟的RPE细胞相关蛋白ZO-1,并且具有吞噬外节的能力,如图4。对分离纯化的H1来源的视网膜神经元前体细胞进行免疫组化鉴定,发现白色悬球在贴壁培养4周后表达视网膜神经 元相关蛋白GFAP(胶质神经元标记),Rho,Crx和Recoverin(视杆细胞标记),如图5。
最后说明的是,上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!