一种从含铬酵母中提取葡萄糖耐量因子的方法与流程
本发明涉及一种提取葡萄糖耐量因子的方法,具体涉及一种从含铬酵母中提取葡萄糖耐量因子的方法。
背景技术:
酵母源性葡萄糖耐量因子(Glucose Tolerance Factor,GTF)是铬和小分子蛋白(肽)的复合物,三价有机铬是其重要活性成分和活性中心。GTF可加强胰岛素、促进糖代谢和脂代谢,逆转葡萄糖耐受不良,提高糖耐量;保护胰岛素B细胞,提高胰岛素受体的数量和亲和力;改善脂肪代谢、提高畜禽生产性能、提高酮体品质及免疫应答等多种生理功能,被广泛应用于药物、功能食品、饲料等领域。
糖尿病是一种常见的慢性内分泌代谢障碍性疾病。是一种因部分或完全胰岛素缺失、活细胞胰岛素受体减少、或受体敏感性降低导致的疾病。微量元素铬作为一种不可缺少的微量金属在维持血糖的动态平衡中具有重要的作用,铬的缺乏或其生物活性形式的缺乏都会导致葡萄糖不耐受。人体不能自身合成铬,只能从食物中摄取。在美国和一些工业发达国家,膳食铬的摄入量都未达到ESADDI所规定的下限(50μg/d)。
目前用于糖尿病研究中铬的补充剂种类较多,除了经典的GTF以外,苯基丙氨酸铬、吡啶酸铬、烟酸铬、三核丙酸盐复合物铬以及三氯化铬等。酵母中的GTF同机体内的铬调素来源一样,为生物金属蛋白,比较安全。啤酒酵母是GTF的最丰富来源。发酵过程中,酵母富集到菌体内的铬离子不全部是GTF的组成部分。只有通过生物吸附、生物转化富集环境中金属离子、生成GTF,转化为有机铬;而单纯吸附在菌体表面的,未发生生物转化的铬,是无机铬。GTF的精深加工以及科学研究中,有效提取GTF(有机铬部分),同时最大程度减少杂蛋白的方法显得至关重要。
技术实现要素:
本发明的目的是提供一种从含铬酵母中提取葡萄糖耐量因子的方法,本发明方法的提取物中总有机铬的含量较高,蛋白杂质较少。
本发明所提供的从含铬酵母中提取葡萄糖耐量因子的方法,包括如下步骤:
1)对含铬酵母粉进行氨水提取,得到氨水提取液;
2)冰浴条件下,利用乙醇水溶液对所述氨水提取液进行提取,离心后收集上清液,去除乙醇即实现葡萄糖耐量因子的提取。
上述的方法中,步骤1)中,所述含铬酵母粉的目数为20~200目。
上述的方法中,步骤1)中,所述提取采用震荡提取的方式,在25~50℃的温度下进行,如在37℃下进行;
所述震荡提取的震荡频率为100~400转/分,如200转/分;
所述震荡提取的时间为60~300分钟,如3小时。
上述的方法中,步骤1)中,所述氨水的浓度为0.05~0.25mol/L,具体为0.1mol/L;
所述氨水的用量为:1g所述含铬酵母粉需要10~50mL所述氨水,如1g所述含铬酵母粉需要20mL所述氨水。
上述的方法中,步骤2)中,所述乙醇水溶液的体积百分浓度为95%;
所述乙醇水溶液的加入量为所述氨水提取液的体积的15%~70%,具体可为15%~60%、15%、30%、40%、50%或60%。
上述的方法中,步骤2)中,所述提取的时间为30~1200分钟,具体可为30~60分钟、30分钟或60分钟。
上述的方法中,步骤2)中,采用旋转真空浓缩的方式去除乙醇;
所述旋转真空浓缩的条件如下:在转速为100~1000r/min的条件下进行,温度为30~60℃,真空度为0.08MPa,如在温度为50℃、真空度为0.08MPa以及转速为800r/min的条件下进行。
本发明提供的方法中可对高含GTF酵母中的葡萄糖耐量因子进行提取,其中高含GTF酵母可利用菌株YSI-3.7(CGMCC No2687)发酵制备得到。
本发明提取方法是基于如下原理:小分子蛋白和铬的复合物(即GTF)可以溶解在氨水和醇溶液中,而菌体内未发生生物转化作用的无机铬则不溶于醇溶液或在氨水溶液中沉淀。基于酵母中GTF含量低的特点,本发明采用氨水提取与乙醇沉淀提取相结合的方法,提高了GTF提取物中GTF的含量,并较大程度降低了杂质蛋白的含量,为一种有效提取GTF的方法。
附图说明
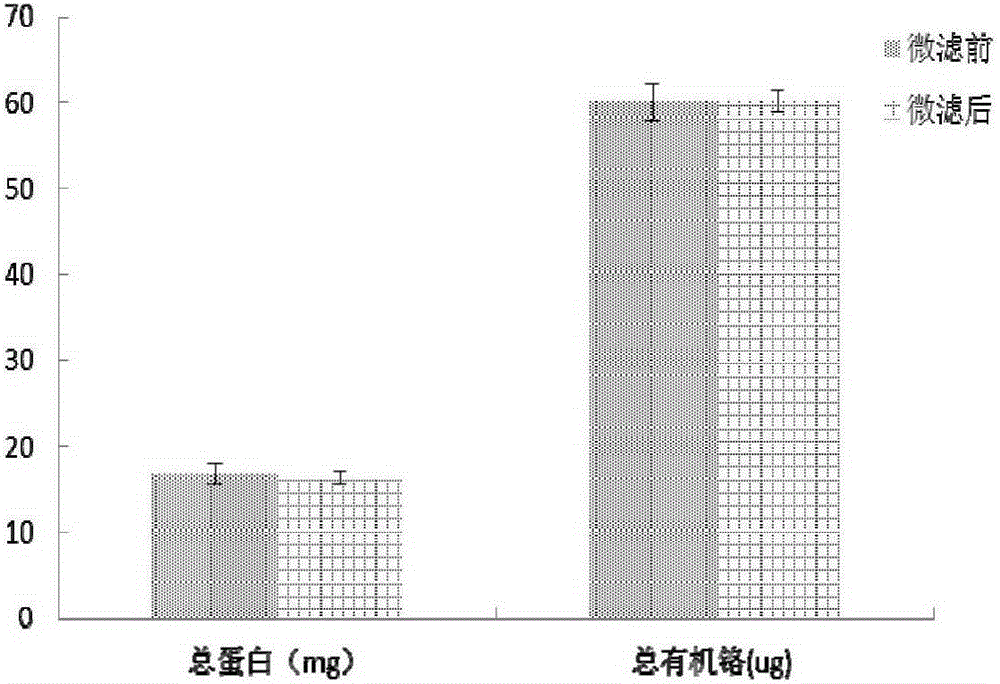
图1为实施例2中提取液微滤过程中GTF及蛋白的含量变化示意图。
图2为实施例2中SuperdexG75的纯化GTF图谱。
图3为实施例2中Sephadex G25凝胶层析图谱。
图4为实施例2中RP-HPLC分离纯化图。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实例中所用高含GTF酵母是利用菌株YSI-3.7(CGMCC No2687)按照如下方法发酵制备得到:
液体培养基(YPD):葡萄糖20g;酵母浸粉10g;大豆蛋白粉20g;蒸馏水1L;于pH 5.8,121℃、20min灭菌备用。
种子液培养:
一、二级种子培养:250mL三角瓶的装液量为50mL。取1mL甘油冷冻保藏的原始菌种YSI-3.7接种于50mLYPD培养基中,于转速200r/min,培养温度28℃,培养15小时;按10%接种量接种在50mLYPD培养基中,于转速200r/min,培养温度28℃,培养10~12小时。接种前取部分培养液在显微镜下镜检。
工作发酵液发酵:
50L发酵罐,每次发酵装液量为30L,接种量为10%。YPD培养基作为发酵工作液,其中葡萄糖、铬液单独罐外灭菌(121℃,15min),将酵母浸粉与大豆蛋白胨溶解于罐内,进行实罐在位灭菌(121℃,20min)。发酵时将葡萄糖无菌加入罐内。开动搅拌器,搅拌均匀。发酵过程中,将转速与溶氧串联,由溶氧控制转速,保持发酵过程中溶氧高于40%,培养温度28℃,培养时间44h。
铬液添加方式:
发酵开始一次性加铬液,中间二次流加补铬:发酵液初始铬离子浓度为400μg/mL。发酵至24h时,再流加铬液,流加在4h内完成,使得发酵液中最终铬离子浓度达至500μg/mL。
发酵结束后,下罐,收集发酵液,采用管式离心机离心(10000r/min),收集菌体,用去离子水洗三次,冷冻干燥。
所制备得到的高含GTF酵母中,其中有机铬含量为1234μg/g菌体。
下述实施例中蛋白质的含量是采用Bradford方法进行测定的。
下述实施例中铬提取液采用微波消化法消化,消化后铬含量是参照GB/T15555.6-1995,采用火焰原子吸收法(采用AA6300火焰原子吸收分光光度)进行测定。
微波消化法进行消化的步骤如下:
预处理:将GTF提取液置于溶样杯内,加入6mL硝酸,置于加热板上,条件为160℃下进行30min。
微波消化:将预处理液稍冷后,再加入0.5mL高氯酸和5%(质量分数)过硫酸铵溶液5mL。将此混合物按表1所示消化参数置于微波消解仪内进行消解。
表1 酵母菌体微波消解仪消化参数表
实施例1、从高含GTF酵母中提取GTF
1)将干燥的高铬酵母菌粉碎后(粉碎的目数为100目),用0.1mol/L的氨水溶液在37℃下以200r/min的震荡速率下进行震荡提取3小时。然后于转速10000r/min下离心30min收集上清液即为GTF的氨水提取液。其中酵母菌粉与氨水溶液的配比为1g∶20mL。
该步骤所得GTF的氨水提取液中,有机铬含量为5.80μg/mL,总有机铬含量为145.07μg,蛋白质含量为18.16mg/mL,总蛋白含量为181.62mg。铬(μg)/蛋白(mg)比为0.80。
2)将步骤1)中所得GTF的氨水提取液量取体积。然后置于冰浴中。在冰浴条件下,将体积百分浓度95%的乙醇溶液分别以60%、50%、40%、30%和15%的比例加入氨水提取液中静置30分钟进行杂蛋白的沉淀。于转速10000r/min的条件下离心30分钟,分别收集上清液和沉淀。
3)将步骤2)中所得不同浓度的醇提取液量取体积。然后分别进行旋转真空浓缩以除去乙醇,真空浓缩条件为温度50℃、真空度为0.08MPa以及旋转转速为800r/min。然后经真空冷冻干燥得到含GTF的提取物。
对步骤2)和3)中不同提取方法中的上清液中蛋白含量和铬的含量变化进行了动态监测,并计算出了提取过程中铬/蛋白的提取效率,如表2所示。
表2 不同提取方法的提取效率比较
由表1中的数据可以看出,氨水提取配合50%乙醇溶液提取,其体系内总有机铬含量为101.13μg,蛋白含量为17.02μg,Cr/蛋白比为5.94,相比于氨水提取液中的Cr/蛋白0.8以及蛋白含量181.62μg,氨水提取配合50%乙醇溶液提取方法的铬蛋白比提 高了7.4倍左右;体系内杂蛋白含量较少,铬蛋白的纯化率得到大幅提高。
实施例2、从高含GTF酵母中提取,并进行纯化
1)将干燥的高铬酵母菌粉碎后(粉碎的目数为100目),用0.1mol/L的氨水溶液在37℃条件下以200r/min的震荡频率进行震荡提取3小时。于转速10000r/min下离心30min收集上清液即为GTF的氨水提取液。其中酵母菌粉与氨水提取溶液的配比为1g∶20mL。
该步骤所得GTF的氨水提取液中,有机铬含量5.80μg/ml,总有机铬含量145.07μg,蛋白质含量为18.16mg/ml,总蛋白含量为181.62mg,铬(μg)/蛋白(mg)比为0.80。
2)将步骤1)中所得GTF的氨水提取液量取体积。然后置于冰浴中。在冰浴条件下,将体积百分浓度95%的乙醇以50%比例加入氨水提取液中静置60分钟进行杂蛋白的沉淀,于转速10000r/min的条件下离心30分钟,收集上清液。
3)将步骤2)中所得不同浓度的醇提取液量取体积。然后分别置于旋转真空浓缩以除去乙醇。真空浓缩条件为温度50℃,真空度为0.08MPa,800r/min。
对步骤3)中的上清液中蛋白含量和铬的含量变化测定,该步骤所得提取液中总有机铬含量为101.13μg,总蛋白含量为17.02mg,铬(μg)/蛋白(mg)为5.94。
4)将步骤3)中所得GTF的乙醇提取液进行0.22μm膜微滤。
微滤前后提取液中GTF及蛋白的变化如图1所示,由图1可以看出,微滤过程对GTF的含量没有影响,仅会去除杂质颗粒。
5)将步骤4)中所得微滤液上凝胶层析Superdex G75进样,规格为1.6×80cm。洗脱液为pH6.0、50mM醋酸氨缓冲液,洗脱速率为0.5mL/min。收集管数为20~30的洗脱液,即图2中的铬峰。
6)将上述收集的洗脱液经浓缩后置于-20℃进行冷冻,进行真空冷冻干燥得到含GTF的提取物。
7)用去离子水溶解步骤6)中所得的提取物,上凝胶层析Sephadex G25柱进行凝胶层析,规格为1.6×80cm。洗脱液为去离子水,洗脱速率为0.3mL/min。收集管数为20~32的洗脱液,即图3中的铬峰。
8)将上述收集的洗脱液经浓缩后置于-20℃进行冷冻,进行真空冷冻干燥得到含GTF的提取物。
9)用去离子水溶解冷冻干燥Sephadex G25凝胶过滤层析铬峰洗脱液,进一步用反相高效液相色谱(RP-HPLC)制备层析柱纯化,洗脱条件如表2所示。收集洗脱液,对洗脱液进行254nm检测,同时进行微波消解,测定洗脱液中铬含量。收集铬峰。
图4为HPLC纯化图谱。
表2 RP-HPLC洗脱条件
将收集的纯化液进行真空浓缩,将浓缩后的浓缩液置于-20℃冷冻,进行真空冷冻干燥得到含GTF纯化样品,总有机铬含量为25ug,总蛋白含量为0.2mg,铬(μg)/蛋白(mg)比为125。
- 还没有人留言评论。精彩留言会获得点赞!