一株碱性蛋白酶高产菌株及其所产的碱性蛋白酶的制作方法
本发明属于生物工程,涉及菌种诱变,尤其涉及一种碱性蛋白酶高产菌株及其所产的碱性蛋白酶。
背景技术:
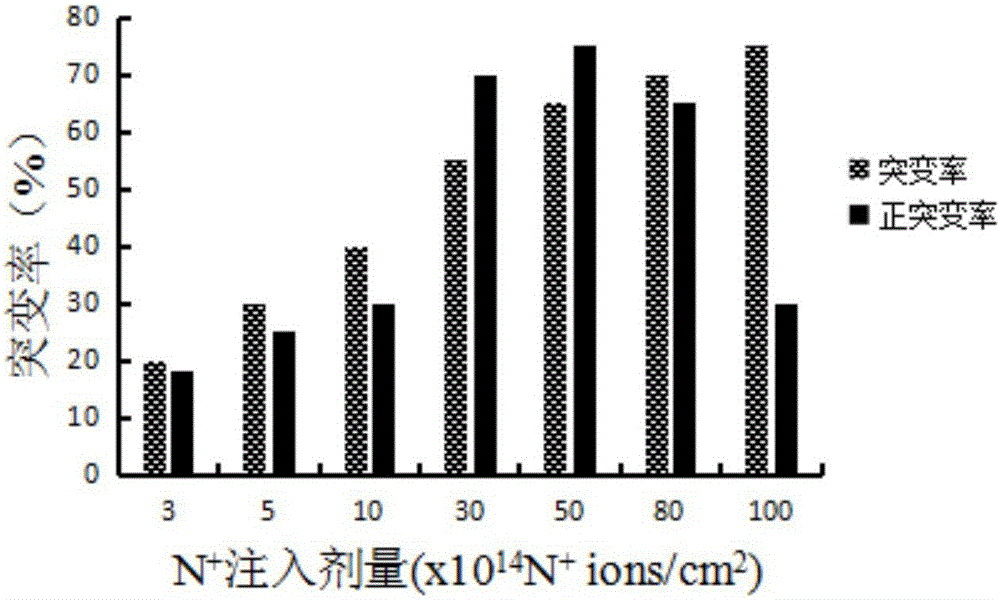
:碱性蛋白酶(AlkalineProtease)是指在pH值为碱性的条件下水解蛋白质肽键的酶类,其最适pH一般为9~11,属内肽酶中的丝氨酸蛋白水解酶类,主要应用于加酶洗涤剂工业,在制革、丝绸、饲料、医药、食品、环保等工业也有广泛的应用。碱性蛋白酶最早在猪的胰脏中发现。1914年,德国科学家Rohm和Haas首先将胰蛋白酶和碳酸钠混合剂作为洗涤浸泡剂(Burnus)使用。1945年,瑞士的Dr.Jaag等发现了微生物碱性蛋白酶,使蛋白酶有可能广泛应用于洗涤剂工业。1956年,第一种含有微生物产碱性蛋白酶洗涤剂进入市场。1963年,诺和诺德公司(现诺维信公司)发现了更适用于洗涤剂的碱性蛋白酶Alcalase,此后,酶制剂被广泛地应用于洗涤剂产品中。随后的20年中,细菌类蛋白酶是唯一被应用于洗涤剂的商品化酶制剂。目前,在世界范围内蛋白酶是工业酶种中用得最多的一种,约占酶总量的60%,其中碱性蛋白酶就占25%,它在商业中的巨大应用前景和在基础研究中的重要作用,吸引着国际国内的许多公司及研究单位竞相对其进行多方面的研究。今天,Novozyme和GenencorInternational控制着全球碱性蛋白酶95%的份额。近年来,离子束作为一种新的诱变源在诱变育种方面因其独特的诱变机理和生物学效应而发展极为迅速,与传统诱变源相比,离子注入除了具有能量沉积效应外,还具有动量传递、质量沉积及电荷中和与交换等效应,它将物理诱变与化学诱变特性集于一身,能够在低剂量注入的情况下,显著提高生物的变异率,获得损伤轻、突变率高、突变谱广、遗传稳定的诱变效果。离子注入技术被广泛应用于微生物优良菌株的选育和改良研究中,已选育出一些在工业上具有较大应用前景的生物新品种,并取得了显著的经济效益和社会效益。同时,常压室温等离子体诱变(ARTP)作为一种物理诱变手段,是指使用育种机的等离子体发射源,放射一束等离子体,直接照射裸露的样品,具有条件温和且能快速使菌体突变,操作简便,不需要真空装置,对人体无副作用,对环境无污染等优点。等离子体是大量相互作用的但仍处于非束缚状态下的带电粒子组成的宏观体系,是与固态、液态、气态处于同一层次上的物质的第四态。等离子是电离气体,这些物质能与生物体内的生物大分子(酶或DNA)相互作用,从而引起生物体的死亡或突变。将等离子体诱变应用于微生物诱变育种是一项崭新的技术。技术实现要素:本发明的目的是提供一种采用低能N+离子注入技术和常压室温等离子诱变技术诱变选育得到的高产碱性蛋白酶的克劳氏芽孢杆菌,本方法有效提高克劳氏芽孢杆菌产碱性蛋白酶的能力。所述克劳氏芽孢杆菌具体为克劳氏芽孢杆菌(Bacillusclausii)L-7。该菌株已于2016年9月12日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮编100101,保藏编号为CGMCCNo.12953。所述克劳氏芽孢杆菌L-7经:出发菌株筛选→N+离子注入诱变→诱变后平板初筛(高产)→摇瓶复筛(高产)→常温室压等离子诱变→平板初筛(高产)→摇瓶复筛(高产)→传代稳定性试验等步骤筛选获得。所述克劳氏芽孢杆菌L-7发酵生产碱性蛋白酶的方法如下:(1)种子培养:从斜面上挑取一环新培养的克劳氏芽孢杆菌L-7接入种子培养液中,200r/min,34℃培养12h;(2)发酵罐培养:按照5%(v/v)的接种量转接入发酵罐,发酵罐装液量70%(发酵培养基),温度:34℃;转速:100~600r/min;通风量:1∶0.5~1∶2.5;溶氧维持在20~30%;发酵过程中自动流加氨水及20%(v/v)的盐酸,使发酵液pH值维持在7.0;发酵时间50-60h;所述种子培养基为(g/L):酵母浸粉5,胰蛋白胨5,葡萄糖10,K2HPO418,pH自然;所述发酵培养基为(g/L):酵母浸粉17,棉籽饼粉30,麦芽糊精100,柠檬酸钠3,氯化钙2.6,K2HPO418,pH自然。克劳氏芽孢杆菌L-7所产碱性蛋白酶酶学性质如下:(1)所述碱性蛋白酶的最适作用温度为40℃;(2)所述碱性蛋白酶的最适作用pH为11;(3)所述碱性蛋白酶的酶活性:碱性蛋白酶的摇瓶酶活力的最大值达79000U/mL,较出发菌株提高了51.9%,60T规模发酵罐酶活力达到88000U/mL;(4)pH稳定性和热稳定性:在pH6~12、40℃保温1h,残余酶活为86%以上;在40~50℃、pH11保温1h,残余酶活在74%以上,具有良好的pH稳定性和热稳定性。有益效果:1、本发明中诱变获得的产碱性蛋白酶菌株是由克劳氏芽孢杆菌在经过低能N+离子注入诱变的基础上,再经过常压室温等离子诱变而得的碱性蛋白酶高产菌株,有效地提高了菌株的产酶能力,其碱性蛋白酶的摇瓶发酵酶活力最大值达到79000U/mL,较出发菌株提高了51.9%,60T规模发酵罐酶活力达到88000U/mL,可降低生产成本,获得良好的经济效益。2、本发明中,由筛选的菌株发酵获得的碱性蛋白酶的最适作用pH为11,最适作用温度为40℃,大大提高了酶的最适pH,增加了酶的使用范围。3、本发明的碱性蛋白酶在pH6~12、40℃保温1h,残余酶活为86%以上;在40~50℃、pH11保温1h,残余酶活在74%以上,具有良好的pH稳定性和热稳定性。附图说明图1为本发明N+离子注入对菌株存活率的影响曲线;图2为本发明N+离子注入对菌株突变及正突变率的影响;图3为本发明等离子诱变对菌株存活率的影响曲线;图4为本发明等离子诱变对菌株突变率及正突变率的影响;图5为本发明经低能N+离子注入技术和常压室温等离子体诱变技术得到的碱性蛋白酶高产菌株L-7的摇瓶发酵产酶曲线;图6为本发明碱性蛋白酶高产菌株L-7的60T发酵罐发酵产酶曲线;图7为本发明碱性蛋白酶电泳图;其中,A.Marker,B.纯化后碱性蛋白酶蛋白,C.发酵液;图8为本发明碱性蛋白酶在不同pH下的相对酶活;图9为本发明碱性蛋白酶在不同温度下的相对酶活;图10为本发明碱性蛋白酶在不同pH下40℃保温1h后的残余酶活;图11为本发明碱性蛋白酶在pH11下、40、50、60℃分别保温2h的残余酶活。具体实施方式下面通过具体实施例对本发明作进一步详述,以下实施例只是描述性的,不是限定性的,不能以此限定本发明的保护范围。下述实施例所用培养基:(1)保藏/活化培养基(g/L):牛肉膏8,酵母浸粉2,多聚蛋白胨5,NaCl2,琼脂17,酪蛋白4,K2HPO418,pH自然。(2)种子培养基(g/L):酵母浸粉5,胰蛋白胨5,葡萄糖10,K2HPO418,pH自然。(3)发酵培养基(g/L):酵母浸粉17,棉籽饼粉30,麦芽糊精100,柠檬酸钠3,氯化钙2.6,K2HPO418,pH自然。(4)牛奶培养基(g/L):脱脂奶粉100,琼脂20,pH自然。实施例1、菌种诱变1、出发菌株的筛选从斜面(由本实验室筛选获得)上挑取一环新培养的克劳氏芽孢杆菌接入种子培养液(种子培养基)中,于34℃、200r/min培养12h,然后涂布到固体培养基(种子培养基添加1%琼脂)中,在34℃的培养箱中继续培养48h,从中挑取20个单菌落转接入斜面,再将这20个斜面菌株接到种子培养基中,每瓶(50mL种子培养基/250mL三角瓶)接种一个单菌落,200r/min,34℃培养12h,观察菌液变浑浊、无异味后按2%(v/v)接种量转接至液体发酵培养基。34℃,200r/min,挡板三角瓶(50mL发酵培养基/250mL挡板三角瓶)中振荡培养50h,将发酵液离心后,以福林酚法测定粗酶液活力,结果如表1所示。表1原始菌株的酶活原始出发菌株经过复壮后,菌种发酵液的酶活平均值为48000U/mL~52000U/mL。测定碱性蛋白酶活力后,选择酶活较高且较稳定的菌株作为出发菌株。Y-18最高,为52000U/mL。将上述试验中酶活较高的菌株Y-18进行传代试验,连续传代20次考察菌株遗传性状的稳定性。其结果为(见表2):此菌株高产且稳定性好,适合作为离子注入诱变的出发菌株。表2出发菌株传代试验结果2、N+离子注入诱变(1)样品的前处理:将克劳氏芽孢杆菌出发菌株Y-18于产芽孢培养基(种子培养基)中培养至产芽孢期,取0.1mL芽孢悬液均匀地涂布于无菌平板(种子培养基)上,用无菌风吹干后,然后将平板放入低能加速器靶室,靶室抽真空,用能量为30keV的不同剂量的、N+离子束进行注入。(2)离子注入条件:注入能量为30keV,靶室真空度为5-6×10-3Kpa,以6s脉冲式注入,间隔为60s,单次注入剂量为1×1014N+ions/cm2;注入剂量分别为5、10、15、20、30、40、50、70、100、200。每个注入剂量做一个真空对照。每个处理及其相应的真空对照在离子注入前预抽真空5min,以消除因真空干燥程度不同可能带来的影响;(3)样品的后处理:将经过N+离子注入的培养皿和真空对照的培养皿分别用无菌水洗脱制备菌悬液,适当稀释后涂布于活化平板(活化培养基)上,置34℃下培养48h后计数,用于单菌落的计数和存活率的挑选。存活率为经N+离子注入处理的存活菌落数与经真空对照处理的存活菌落数的比值。(4)存活率曲线的绘制:吸取离子注入后的菌悬液1mL,注入装有9mL无菌水的试管中,制成10-1稀释液;反复吹吸10-1的稀释液,使其混合均匀后吸取1mL,注入装有9mL无菌水的试管中,制成10-2稀释液;按上述程序操作,制备10-3稀释液;选择适宜浓度的稀释液,分别取0.1mL涂布于平皿中,每个稀释度做3个平行;于34℃恒温培养箱中培养48h后,取出计数。以注入剂量为横坐标,存活率为纵坐标,绘制存活率与注入剂量的关系曲线。存活率(%)=N+注入处理菌落数/真空对照菌落数×100%。其结果为(见图1):在N+离子注入剂量达到30×1014N+ions/cm2前,菌株存活率随N+离子注入剂量的增加而迅速降低;注入剂量超过200×1014N+ions/cm2后,存活率基本为零。当N+离子注入剂量在30×1014~50×1014N+ions/cm2范围内时,菌种的存活率呈现高-低-高的“马鞍型”变化趋势,这种特有的变化被认为是能量、动量作用下损伤效应和质量、电荷作用下的保护和刺激综合作用的结果。(5)N+离子注入对菌株突变率的影响采用初筛法检测每个注入剂量下的菌落透明圈直径与菌落直径之比变化情况,规定透明圈直径大于对照株5%的突变株称为正突变,小于5%的为负突变,±5%之间为未突变。试验结果见图2。由图2可知,随着离子注入剂量的增加,菌株突变率随之增加;注入剂量在30×1014~50×1014N+ions/cm2范围内菌株的正突变率较高(22%~26%),注入剂量超过50×1014N+ions/cm2以后,菌株的突变率继续增加,但其正突变率呈降低的趋势。分析原因,可能是由于低剂量注入后的菌株容易发生回复突变,而高剂量使DNA及生物膜等生物大分子的损伤严重造成较高的突变率和较低的正变率。在“马鞍”区域内,注射剂量适宜,突变率相对较高,正突变率也较高。3、经过N+离子注入诱变的高产菌株初次筛选将涂布有菌液的平板在最佳注入剂量下(即N+离子注入剂量为40×1014N+ions/cm2时)进行N+离子注入诱变处理,适当稀释后涂布于初筛平板上。初筛选用双层平板,下层为发酵固体培养基(发酵培养基添加1%琼脂),上层为牛奶培养基,将随机挑选的100株菌依次编号H-1—H-100,一一对应点接于平板下层培养基;每板点接5株诱变菌,每株菌作一支平行,并点接原始菌做对照,34℃培养48h后,将定量的牛奶培养基均匀倾注于平板上,10℃放置12h,计算透明圈直径与菌落直径之比,挑选比值大于原始菌的突变株。按此方法筛选3轮,初步选定H-3、H-6、H-33、H-66、H-78、H-90六株突变株进行复筛。4、经过N+离子注入诱变的高产菌株的再次筛选将初筛筛得的6株菌分别进行摇瓶发酵培养(发酵培养基),以50h酶活力作为复筛标准,重复三次。各个突变株酶活如表3所示,其中突变株H-6产酶活力最高,达65000U/mL,比初始菌株提高了25%。表3经N+离子注入诱变的碱性蛋白酶高产菌株的复筛结果5、碱性蛋白酶高产菌株的确定对突变株H-6连续传代5次,以50h发酵粗酶液活力为标准,结果如表4所示,传代五次后,产酶能力保持稳定,菌株的优良性状可稳定遗传,突变株H-6即为高产碱性蛋白酶突变菌株。表4H-6遗传稳定性酶活力(U/mL)相对酶活(%)F165000100F264675±64999.5±0.8F364935±45699.9±0.6F465845±828101.3±1.0F566300±729102.0±0.96、等离子诱变(1)样品的前处理:将经过N+离子注入诱变筛选的高产突变菌株H-6于产芽孢培养基(种子培养基)中培养至产芽孢期,将高产突变菌株H-6的新鲜菌液制成芽孢悬液后分散均匀,用生理盐水调节芽孢悬液浓度为105-106mL-1。取10uL的芽孢悬液,将其滴加在灭菌冷却后的载玻片上。(2)等离子诱变条件:将载物台上的载片放置区域紫外灭菌30min,将制得的样品载片置于载台上,使载片与射流出口的距离为2mm;打开工作气体阀门,工作气体即放电气体为氦气;打开外源气体,外加200V、13.56MHz的射频电压,此时射流温度为室温。对样品进行辐照,辐照时间为80-180s。(3)样品的后处理:将经过诱变后的芽孢用无菌水洗下,适当稀释后涂布于活化平板(活化培养基)上,置34℃下培养48h后计数,用于单菌落的计数和存活率的挑选。存活率为经等离子诱变后的存活菌落数与诱变前的存活菌落数的比值。(4)存活率曲线的绘制:吸取等离子诱变后的芽孢悬液1mL,注入装有9mL无菌水的试管中,制成10-1稀释液;反复吹吸10-1的稀释液,使其混合均匀后吸取1mL,注入装有9mL无菌水的试管中,制成10-2稀释液;按上述程序操作,制备10-3稀释液;选择适宜浓度的稀释液,分别取0.1mL涂布于平皿中,每个稀释度做3个平行;于34℃恒温培养箱中培养48h后,取出计数。以诱变时间为横坐标,存活率为纵坐标,绘制存活率与诱变时间的关系曲线。存活率(%)=等离子诱变处理后菌落数/处理前菌落数×100%。其结果为(见图3):在ARTP照射时间达到120s前,菌株存活率随ARTP照射时间的增加而迅速降低;照射时间超过180s后,存活率基本为零。当ARTP照射时间在120~160s范围内时,菌种的存活率呈现高-低-高的“马鞍型”变化趋势。(5)等离子诱变对菌株突变率的影响采用初筛法检测ARTP不同照射时间下的菌落透明圈直径与菌落直径之比变化情况,规定透明圈直径大于对照株5%的突变株称为正突变,小于5%的为负突变,±5%之间为未突变。试验结果见图4。由图4可知,随着ARTP照射时间的增加,菌株突变率随之增加;照射时间在120-160s范围内菌株的正突变率较高(18%~26%),照射时间140s以后,菌株的突变率继续增加,但其正突变率呈降低的趋势。分析原因,可能是由于照射时间过长后的菌株容易发生回复突变,而长时间的等离子照射使DNA及生物膜等生物大分子的损伤严重造成较高的突变率和较低的正变率。在“马鞍”区域内,ARTP照射时间适宜,突变率相对较高,正突变率也较高。最终确定最佳的ARTP照射时间为140s。7、高产突变株H-6再经过等离子诱变后的双重突变高产菌株的初次筛选将高产突变株H-6的菌悬液在最佳ARTP照射时间(即ARTP照射时间为140s时)诱变处理,适当稀释后涂布于初筛平板(活化培养基)上。初筛选用双层平板,下层为发酵固体培养基(发酵培养基),上层为牛奶培养基,将随机挑选的100株菌依次编号L-1—L-100,一一对应点接于平板下层培养基;每板点接5株诱变菌,每株菌作一支平行,并点接原始菌做对照,34℃培养48h后,将定量的牛奶培养基均匀倾注于平板上,10℃放置12h,计算透明圈直径与菌落直径之比,每板挑选2个比值大于原始菌的突变株。按此方法筛选3轮,初步选定L-2、L-7、L-32、L-65、L-77、L-89六株突变株进行复筛。8、双重突变高产菌株的再次筛选将初筛筛得的6株菌分别进行摇瓶发酵培养(发酵培养基),以50h酶活力作为复筛标准,重复三次。各个突变株酶活如表5所示,其中突变株L-7产酶活力最高,达79000U/mL,比初始菌株提高了51.9%。表5经过双重诱变后的碱性蛋白酶高产菌株的复筛结果9、碱性蛋白酶高产菌株的确定对以上诱变试验中筛选得到的高产双重突变株进行连续传代试验,测其酶活力,考察其遗传性状的稳定性,筛选到可以最终应用于生产上的菌株。对突变株L-7连续传代5次,以50h发酵粗酶液活力为标准,结果如表6所示,传代五次后,产酶能力保持稳定,这与报道的经过离子注入诱变和等离子诱变后,菌株的优良性状可稳定遗传相一致,突变株L-7即为高产碱性蛋白酶菌株。表6L-7遗传稳定性酶活力(U/mL)相对酶活(%)F179000100F278642±64999.5±0.8F378914±45699.9±0.6F480006±828101.3±1.0F580552±729102.0±0.9实施例2、碱性蛋白酶高产菌株摇瓶水平发酵产蛋白酶从斜面上挑取一环新培养的克劳氏芽孢杆菌L-7接入种子培养基中(50mL种子培养基/250mL三角瓶),200r/min,34℃培养12h,2%(v/v)接种量转接至发酵培养基,34℃,200r/min,挡板三角瓶(50mL发酵培养基/250mL挡板三角瓶)中振荡培养,每间隔一定时间后,将发酵液离心,以福林酚法测定粗酶液活力,结果附图5所示。实施例3、碱性蛋白酶高产菌株60T发酵罐发酵工艺从斜面上挑取一环新培养的克劳氏芽孢杆菌L-7接入种子培养液中(100mL种子培养基/500mL挡板三角瓶),200r/min,34℃培养12h,按照5%(v/v)的接种量转接入60T发酵罐,发酵罐装液量70%(发酵培养基)。温度:34℃;转速:300r/min;通风量:1∶1.5;溶氧维持在25%。发酵过程中自动流加氨水及20%(v/v)的盐酸,使发酵液pH值维持在7.0。采用该工艺连续发酵三批,如附图6所示,发现在该流加工艺控制工艺下,30h以后,碱性蛋白酶大量合成,到达55h时,酶活力最高88000U/mL。54h以后,产酶速度变慢,活力下降,很快菌体进入消亡期,同时pH值迅速上升。如附图7所示,SDS-PAGE蛋白电泳表明纯化后的样品己达到电泳纯,分子量为28kDa。实施例4、对酶的性质进行研究(1)酶活测定①碱性蛋白酶活力的测定以轻工业部颁标准QB/T1803-93(Folin试剂显色法):1毫升酶液在40℃,pH11,每分钟反应产生1μg酪氨酸所需要的酶量为1个酶活力单位(U/mL)。②标准曲线的绘制配制不同浓度的酪氨酸标准溶液(0、10、20、30、40、50、60μg/mL)。取酪氨酸标准溶液1.00mL,加0.4mol/L的碳酸钠溶液5.00ml、福林试剂溶液1.00mL,置于40±0.2℃水浴中显色20min。取出,用分光光度计分别测定其吸光度A680(以不含酪氨酸的管为空白)。以吸光度A680为纵坐标,酪氨酸的浓度c为横坐标,绘制标准曲线(此线应通过零点)。③测定步骤(1)将发酵液8000r/min离心10min,取上清液以硼砂-氢氧化钠缓冲溶液稀释至适当浓度,作为待测酶液。(2)将酪素、三氯乙酸溶液放入40±0.2℃恒温水浴中,预热5min。(3)按下列程序操作:④酶活计算方法X=A×K×4/10×n=0.4×A×K×nX—样品的酶活力,u/mLA—样品平行试验的平均吸光度K—吸光常数4—反应试剂的总体积,mLn—稀释倍数(2)酶的纯化工艺:取发酵液100ml,8000r/min离心10min。取上清液,以饱和度70%的固体硫酸按进行盐析,8000r/min离心10min收集沉淀。将沉淀溶于Tris-HCI(pH8.8)缓冲液中,在相同的缓冲液中进行透析除盐。离心除去少量不溶物,取上清液过DEAE-SepharoseCL-6B离子交换柱进行纯化,以20mMTris-Hcl(pH8.8,含10mMNacl)缓冲液进行洗脱。碱性蛋白酶未被吸附,先被洗脱下来,得到无色透明的液体。收集酶液进行真空冷冻干燥,得到纯酶粉进行进一步分析。(3)酶学性质研究以酪蛋白为底物,以轻工业部颁标准QB/T1803-93(Folin试剂显色法),即福林(Folin)法;分别研究该碱性蛋白酶的最适pH、最适温度、pH稳定性和温度稳定性。测定最适pH:在40度条件下,分别测定碱性蛋白酶在pH5、6、7、8、9、10、11、12、13下的相对酶活(附图8)。测定最适温度:在pH11的条件下,分别测定碱性蛋白酶在30、40、50、60、70、80、90℃下的相对酶活(附图9)。测定pH稳定性:将酶液于pH5、6、7、8、9、10、11、12、13和40℃条件下保温1h后,在最适温度和最适pH条件下测定残余酶活(附图10);残余酶活是指在不同pH和40℃条件下保温后的酶液在最适条件下测定的酶活值,相对于酶液在不保温时在最适条件下测定的酶活值的百分数。测定温度稳定性:将酶液于40、50、60℃和pH11的条件下保温2h后,在最适温度和最适pH条件下测定残余酶活(附图11);残余酶活是指在不同温度和pH11条件下保温后的酶液在最适条件下测定的酶活值,相对于酶液在不保温时在最适条件下测定的酶活值的百分数。结论:由图8可知:该酶的最适作用pH为11;由图9可知:该酶的最适作用温度为40℃;由图10可知:该酶在pH6~12的范围内稳定;由图11可知:该酶在40~50℃左右有较好的热稳定性。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1