抗EGFR和抗CD3双特异抗体及其应用的制作方法
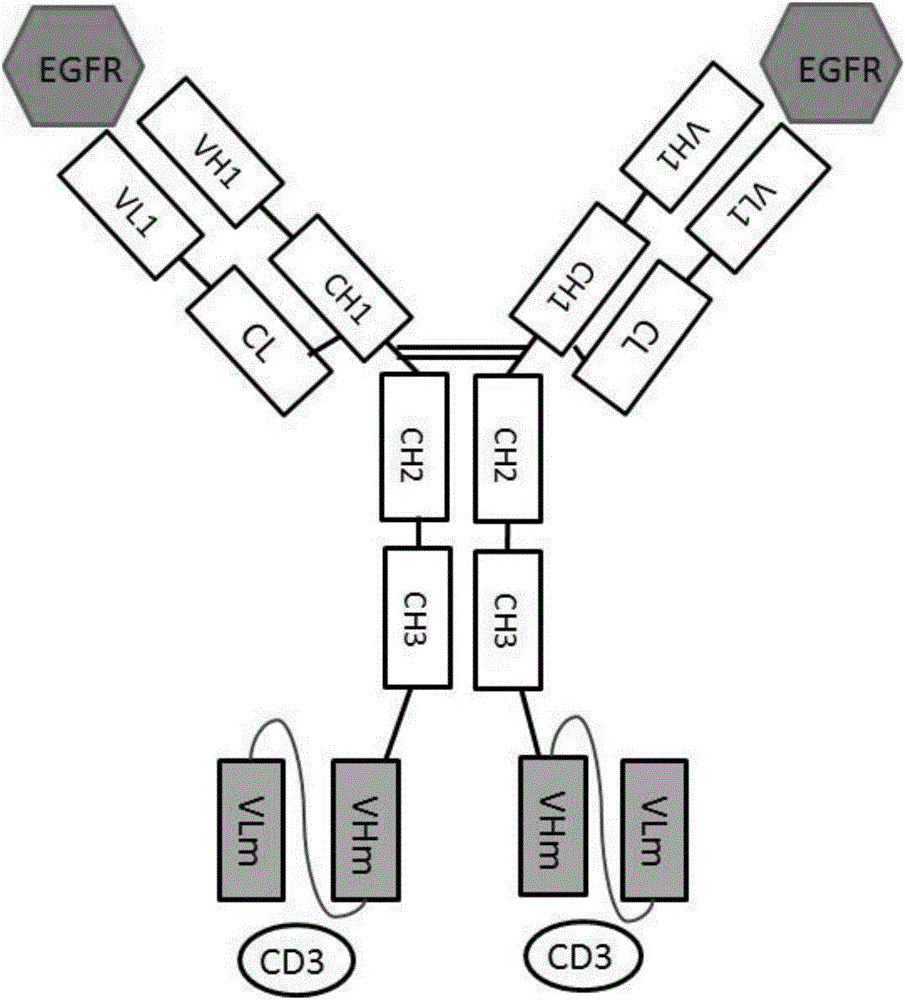
本发明涉及生物技术领域,具体涉及一种针对EGFR和CD3的双特异性抗体的构建和制备方法,以及该抗体在疾病中的应用。
背景技术:
双特异性抗体(bispecific antibody,BiAb)是由两种不同的抗体片段构成的人工抗体,能够特异性识别和结合两个不同的抗原或两个不同的抗原表位。
单克隆抗体广泛应用于癌症、炎症和其它疾病的治疗,由于这些抗体所针对的都是单一的靶标,很多患者不能充分响应单一的疗法,时常出现抗药性。双特异性抗体能够同时识别两个不同的抗原或抗原表位,可以作为一种媒介重新定向免疫效应细胞,如自然杀伤细胞和T细胞,加强对肿瘤细胞的杀伤功能。此外,双特异性抗体还可以定位于同一个细胞的两个不同的抗原,导致细胞信号的改变,包括癌症扩散信号或炎症信号。经过长时间的研究和发展,出现了多种形式的双特异性抗体,如双特异性微抗体、双链抗体、单链双价抗体和多价双特异性抗体等。这些双特异性抗体基本上分为两大类:含有Fc的和不含有Fc的。前者具有较好的溶解性、稳定性和半衰期,而Fc介导的抗体依赖的细胞毒性作用(ADCC)和补体依赖性细胞溶解效应(CDC)可以带来一些治疗所需的附加效应。相比之下,缺乏Fc的双特异性抗体完全依赖其抗原结合能力发挥其治疗作用;另外Fc蛋白可以延长药物蛋白(或多肽)在体内的半衰期,从而延长活性分子在体内的作用时间。
肿瘤细胞表面抗原表皮生长因子受体(EGFR):表皮生长因子受体广泛分布于除血管组织外的上皮细胞膜上,是一个跨膜蛋白,分子量约为l80KDa,具有配体诱导酪氨酸蛋白激酶活性,它是ErbB这个保守的受体家族中的一员,这个家族的其他成员包括HER2/Neu/ErbB2,HER3/ErbB3和HER4/ErbB4。ErbB受体的共同特征是:包含一个胞外(EC)配体结合区,由两个重复的富含半胱氨酸的区域组成的单一跨膜区,以及含有酪氨酸蛋白激酶和自身磷酸化位点的胞内序列;配体和受体结合后,引起受体的二聚化作用,形成同型或异型二聚体;二聚化的受体发生交联磷酸化,激活胞内区的TK亚区,从而激发下一级信号传导,导致细胞增殖、转化。EGFR与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡的抑制有关,其机制包含有:EGFR的高表达引起下游信号传导的增强,突变型EGFR受体或配体表达的增加导致EGFR的持续活化,自分泌环的作用增强,受体下调机制的破坏,异常信号传导通路的激活等。研究表明EGFR在很多实体瘤中高表达或异常表达,与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡的抑制有关。EGFR的过表达在肿瘤的演进中发挥着重要作用,如胶质细胞瘤、肺癌、前列腺癌、胰腺癌等组织中都有EGFR的过度表达。
免疫细胞表面抗原分化簇3(CD3):CD3分子是T细胞膜上的重要分化抗原,是成熟T细胞的特征性标志,由6条肽链组成,以非共价键与T细胞抗原受体(TCR)组成TCR-CD3复合体,不仅参与TCR-CD3复合体的胞浆内组装,而且通过各多肽链胞浆区的免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motif,ITAM)传递抗原刺激信号。CD3分子的主要功能为:稳定TCR结构,传递T细胞活化信号,当TCR特异性识别并结合抗原后,CD3参与将信号转导到T细胞胞浆内,作为诱导T细胞活化的第一信号,在T细胞抗原识别和免疫应答产生过程中具有极其重要的作用。
在医学中,特别是肿瘤的免疫治疗中,双特异性抗体具有良好的效果和前景,能够同时结合肿瘤细胞和免疫细胞上的特异性抗原-抗免疫活性细胞CDl6或CD3的部分,具有激活NK细胞或T细胞作用,而抗肿瘤的特异性抗原部分可以结合肿瘤细胞,将免疫细胞靶向到肿瘤细胞,提高局部NK细胞或T细胞浓度,从而使免疫效应细胞对肿瘤细胞起到特异性杀伤作用。现有技术中,还没有成功上市的EGFR和CD3双特异性抗体药物产品,该项技术有待研究。
相对于中国专利CN201510030519.9,本发明是采用四价双特异性抗体,完整的保留了抗EGFR抗体的生物学活性;四价双特异能够更好的识别肿瘤抗原和效应细胞(T细胞和NK细胞等),从而能够更好地发挥双特异抗体的生物学活性。美国专利US9249217B2则采用ScFv-ScFv(BITE)形式,而BITE是二价的且没有Fc片段。与BITE相比,本发明除了具有四价抗体的优势外,还含有Fc片段;Fc片段可以延长效应分子在体内的半衰期,从而延长了效应分子在体内的作用时间。
技术实现要素:
本发明中提供了一种双特异性抗体,该双特异性抗体在抗EFGR的C-端增加了抗CD3的ScFv序列,这种双特异抗体保留了抗EGFR抗体完整分子结构,同时增加了结合CD3抗原的能力,这样既保持了原有EGFR抗体在体内生物学活性,同时通过特异性识别两种不同的抗原,靶向免疫效应细胞到肿瘤细胞,从而增加了免疫效应细胞杀伤肿瘤细胞的效果。
本发明提供了抗EGFR和抗CD3双特异抗体及其应用,
包含(a)完整的单克隆抗体,(b)单链抗体ScFv和(c)连接子;所述(a)与EGFR抗原特异性结合并且由两条抗体重链和两条抗体轻链组成;所述(b)与免疫细胞抗原CD3特异性结合,所述(b)为两条单链抗体ScFv;所述(b)为两条单链抗体ScFv;所述(b)的两条单链抗体ScFv分别通过所述(c)连接子linker与所述(a)的两条重链的C末端连接。
其中,所述双特异抗体中所述(c)连接子linker的氨基酸序列为(GGGGX)n,X包含Ser或Ala,X优选Ser;n为1-4的自然数,n优选3。
其中,所述双特异性抗体(a)完整的单克隆抗体是由两条轻链和两条重链组成,每条重链和轻链之间通过二硫键连接,两条重链之间通过铰链区的二硫键连接。所述重链和轻链的可变区特异性结合肿瘤细胞表面EGFR抗原。
其中,所述(a)完整的单克隆抗体的重链恒定区为IgG1、IgG2、IgG3或IgG4中的一种,优选IgG2。
其中,所述(a)完整的单克隆抗体的重链可变区氨基酸序列为SEQ ID NO 1、SEQ ID NO 2或SEQ ID NO 3中的一种;所述(a)完整的单克隆抗体的轻链可变区的氨基酸序列为SEQ ID NO 4、EQ ID NO 5或SEQ ID NO 6中的一种。所述(b)单链抗体ScFv的重链可变区的氨基酸序列为SEQ ID NO 8,所述(b)单链抗体ScFv的轻链可变区的氨基酸序列为SEQ ID NO 9。
其中,所述(b)两条单链抗体ScFv的氨基酸序列均为SEQ ID NO 7。
其中,每个(b)单链抗体ScFv是由重链可变区、(c)连接子linker和轻链可变区组成,所述重链可变区和轻链可变区特异性结合免疫细胞表面CD3抗原;所述(c)连接子linker的氨基酸序列为(GGGGS)n,n为1-4的自然数,优选为(GGGGS)3。
其中,构建双特异抗体的表达载体,其中所述双特异抗体可以构建到一个载体中,或者分别构建到两个不同的载体上。
其中,通过基因工程方法将构建好的载体转染到宿主细胞中,所述宿主细胞包含原核细胞、酵母或哺乳动物细胞,如CHO细胞、NS0细胞或其他哺乳细胞,优选为CHO细胞。
其中,通过常规的免疫球蛋白方法,包含蛋白质A亲和层析和离子交换、疏水层析或分子筛方法获得所述双特异性抗体。
其中,所述双特异性抗体用于EGFR高表达或非正常表达的肿瘤组织的治疗及其他EGFR过表达引起疾病的治疗。
其中,所述完整的单克隆抗体为全长抗体。
采用上述技术方案,包括以下有益技术效果:
本发明的双特异性抗体是采用四价抗体的形式,这种形式的四价抗体完整的保留了结合肿瘤抗原的抗体序列,具有较高的亲和力。同时四价双特异抗体可以更好的连接肿瘤细胞和效应细胞,从而更有利于发挥双特异抗体的生物学功能。相对于现在常用的BITE双特异抗体形式,本发明中的分子还包括了Fc片段;Fc片段的存在可以延长药物分子在体内的半衰期,从而能够使药物分子更好的发挥作用,降低病人用药频率,减轻病人的痛苦。本发明用于高表达或非正常表达EGFR肿瘤组织的治疗,以及其他EGFR过表达引起疾病的治疗。
附图说明
图1示例性示出了双特异抗体的分子示意图;
图2示例性示出了双特异分子质粒表达的构建图;
图3示例性示出了纯化后的双特异分子的变性SDS电泳图;
图4示例性示出了ELISA法检测双特异分子与抗原的结合能力;
图5示例性示出了双特异抗体与A431细胞的结合;
图6示例性示出了双特异抗体与Jukart细胞的结合;
图7示例性示出了双特异抗体介导的PBMC对A431的结合;
图8示例性示出了双特异抗体介导的PBMC对H520的杀伤效果。
具体实施方式
下面通过具体的实施例并结合附图对本发明做进一步的详细描述。
本发明提供了抗EGFR和抗CD3双特异抗体及其应用,包含(a)完整的单克隆抗体,(b)单链抗体ScFv和(c)连接子;所述(a)与EGFR抗原特异性结合并且由两条抗体重链和两条抗体轻链组成;所述(b)与免疫细胞抗原CD3特异性结合,所述(b)为两条单链抗体ScFv;所述(b)为两条单链抗体ScFv;所述(b)的两条单链抗体ScFv分别通过所述(c)连接子linker与所述(a)的两条重链的C末端连接。
进一步优选地,所述双特异抗体中所述(c)连接子linker的氨基酸序列为(GGGGX)n,X包含Ser或Ala,X优选Ser;n为1-4的自然数,n优选3。
进一步优选地,所述双特异性抗体(a)完整的单克隆抗体是由两条轻链和两条重链组成,每条重链和轻链之间通过二硫键连接,两条重链之间通过铰链区的二硫键连接。所述重链和轻链的可变区特异性结合肿瘤细胞表面EGFR抗原。
进一步优选地,所述(a)完整的单克隆抗体的重链恒定区为IgG1、IgG2、IgG3或IgG4中的一种,优选IgG2。
进一步优选地,所述(a)完整的单克隆抗体的重链可变区氨基酸序列为SEQ ID NO 1、SEQ ID NO 2或SEQ ID NO 3中的一种;其中,
SEQ ID NO 1(尼妥珠单克隆抗体的重链可变区氨基酸序列):
QVQLQQPGAELVKPGASVKLSCKASGYTFTNYYIYWVKQRPGQGLEWIGGINPTSGGSNFNEKFKTKATLTVDESSTTAYMQLSSLTSEDSAVYYCTRQGLWFDSDGRGFDFWGQGTTLTVSS;
SEQ ID NO 2(西妥昔单克隆抗体的重链可变区氨基酸序列):QVQLKQSGPGLVQPSQSLSITCTVSGFSLTNYGVHWVRQSPGKGLEWLGVIWSGGNTDYNTPFTSRLSINKDNSKSQVFFKMNSLQSNDTAIYYCARALTYYDYEFAYWGQGTLVTVSA;
SEQ ID NO 3(帕尼单抗单克隆抗体的重链可变区氨基酸序列):
QVQLQESGPGLVKPSETLSLTCTVSGGSVSSGDYYWTWIRQSPGKGLEWIGHIYYSGNTNYNPSLKSRLTISIDTSKTQFSLKLSSVTAADTAIYYCVRDRVTGAFDIWGQGTMVTVSS。
其中,所述(a)完整的单克隆抗体的轻链可变区的氨基酸序列为SEQ ID NO 4、EQ ID NO 5或SEQ ID NO 6中的一种,
SEQ ID NO 4(尼妥珠单克隆抗体的轻链可变区氨基酸序列):
DVLMTQIPLSLPVSLGDQASISCRSSQNIVHSNGNTYLDWYLQKPGQSPNLLIYKVSNRFSGVPDRFRGSGSGTDFTLKISRVEAEDLGVYYCFQYSHVPWTFGGGTKLEIK;
SEQ ID NO 5(西妥昔单克隆抗体的轻链可变区氨基酸序列):
DILLTQSPVILSVSPGERVSFSCRASQSIGTNIHWYQQRTNGSPRLLIKYASESISGIPSRFSGSGSGTDFTLSINSVESEDIADYYCQQNNNWPTTFGAGTKLELK;
SEQ ID NO 6(帕尼单抗单克隆抗体的轻链可变区氨基酸序列):
DIQMTQSPSSLSASVGDRVTITCQASQDISNYLNWYQQKPGKAPKLLIYDASNLETGVPSRFSGSGSGTDFTFTISSLQPEDIATYFCQHFDHLPLAFGGGTKVEIK。
进一步优选地,所述(b)单链抗体ScFv的重链可变区的氨基酸序列为SEQ ID NO 8,所述(b)单链抗体ScFv的轻链可变区的氨基酸序列为SEQ ID NO 9;其中,
SEQ ID NO 8(抗CD3单链抗体的重链可变区氨基酸序列):
DIKLQQSGAELARPGASVKMSCKTSGYTFTRYTMHWVKQRPGQGLEWIGYINPSRGYTNYNQKFKDKATLTTDKSSSTAYMQLSSLTSEDSAVYYCARYYDDHYCLDYWGQGTTLTVSS;
SEQ ID NO 9(抗CD3单链抗体的轻链可变区氨基酸序列):
DIQLTQSPAIMSASPGEKVTMTCRASSSVSYMNWYQQKSGTSPKRWIYDTSKVASGVPYRFSGSGSGTSYSLTISSMEAEDAATYYCQQWSSNPLTFGAGTKLELK。
进一步优选地,所述(b)两条单链抗体ScFv的氨基酸序列均为SEQ ID NO 7;其中,
SEQ ID NO 7(抗CD3单链抗体氨基酸序列):
DIKLQQSGAELARPGASVKMSCKTSGYTFTRYTMHWVKQRPGQGLEWIGYINPSRGYTNYNQKFKDKATLTTDKSSSTAYMQLSSLTSEDSAVYYCARYYDDHYCLDYWGQGTTLTVSSGGGGSGGGGSGGGGSDIQLTQSPAIMSASPGEKVTMTCRASSSVSYMNWYQQKSGTSPKRWIYDTSKVASGVPYRFSGSGSGTSYSLTISSMEAEDAATYYCQQWSSNPLTFGAGTKLELK。
进一步优选地,每个(b)单链抗体ScFv是由重链可变区、(c)连接子linker和轻链可变区组成,所述重链可变区和轻链可变区特异性结合免疫细胞表面CD3抗原;所述(c)连接子linker的氨基酸序列为(GGGGS)n,n为1-4的自然数,优选为(GGGGS)3。
进一步优选地,将构建好的载体转染到宿主细胞中,所述宿主细胞包含原核细胞、酵母或哺乳动物细胞,如CHO细胞、NS0细胞或其他哺乳细胞,优选为CHO细胞。
进一步优选地,所述双特异性抗体用于EGFR高表达或非正常表达的肿瘤组织的治疗及其他EGFR过表达引起疾病的治疗。
具体实施例1、双特异抗体分子的表达载体的构建
a)双特异瞬时表达载体构建
按照图1中双特异抗体的形式设计相应的基因序列。选择PTSE作为表达载体去克隆和表达抗EGFR的轻链基因和抗EGFR重链—CD3的ScFV融合基因。轻链基因和融合基因分别在编码区序列两侧加入Sall、BamHl酶切位点,两条基因由中美泰和生物技术(北京)有限公司合成并分别克隆到PUC19载体中。将两个质粒分别转化到TOP感受态(汇天东方,货号HT702-03)中,用康为世纪小提试剂盒(货号CW0500)进行小提后与载体分别用限制性内切酶Sall-HF和BamHI-HF酶切,进行同源重组,分别得到含有轻链及融合基因的表达载体(示意图见图2A和图2B),质粒分别命名为:PTSE-JY016L-TetBiAb、PTSE-JY016H-TetBiAb。
b)双特异稳转表达载体构建
选择PGN-2CMV作为表达载体去克隆和表达抗EGFR的轻链基因和抗EGFR重链-CD3的ScFV融合基因,该载体包括筛选标记Neomycin和GS,含有两个CMV启动子及相应的结构单元。设计轻链及融合基因的引物并引入Kozak序列、信号肽及相应的酶切位点,由中美泰和生物技术(北京)有限公司进行合成。以质粒PTSE-JY016L-TetBiAb、PTSE-JY016H-TetBiAb为模板,PCR扩增出相应的条带并与载体进行同源重组(质粒图谱见图2C)。
具体实施例2、双特异抗体分子的表达与纯化
a)四价抗体的表达
利用无内毒素大提试剂盒(康为世纪,CW2104)进行质粒大提,具体操作步骤按照试剂盒提供的说明书进行操作。
人胚肾细胞(HEK293ES悬浮细胞)在FreeStyle 293Expressi on Medium(Gibco,12338-026)中培养,细胞每隔一到两天传代一次,传代后细胞起始密度维持在0.2~0.6×106/ml,细胞培养体积为摇瓶容积的15~35%,细胞培养瓶放在摇床(摇床转速:135rpm,温度:37℃,CO2:5%)中培养。转染前一天,将处于对数生长期,生长状态良好的HEK293ES细胞,传代到细胞密度为0.5×106/ml,放摇床(135rpm,37℃,5%CO2)培养过夜,待第二天进行转染。
转染前将准备好的1×106/ml细胞悬液在摇床(135rpm,39℃,5%CO2)培养2h,转染时,依次加入PTSE-antiEGFR-H-TetBiAb(终浓度0.5μg/ml)、PTSE-antiEGFR-L(终浓度0.5μg/ml)、聚乙烯亚胺PEI(Sigma)(终浓度2ug/ml),混匀,一起共转染到HEK293ES悬浮细胞中,之后,置于摇床(135rpm,39℃,5%CO2)培养40min。转染后的细胞继续在135rpm,37℃,5%CO2摇床中培养,表达抗EGFR×CD3的四价抗体。转染96小时后离心收获表达上清。
b)四价双特异抗体的纯化
表达上清用0.22uM滤膜过滤,利用亲和层析柱从表达上清中获得带有Fc结构域的抗体。平衡缓冲液和洗脱缓冲液分别为50mM Tris-HCl0.15M NaCl PH7.0和0.1M柠檬酸-柠檬酸钠PH3.0。通过阳离子交换层析获得目标双特异抗体,阳离子交换柱为HiTrap SP FF,通过平衡缓冲20mM PB PH6.3平衡SP层析柱,用洗脱缓冲液20mMPB+1M NaCl(PH6.3)进行洗脱,最后用PBS缓冲液进行换液浓缩。纯化后的双特异分子还原SDS-PAGE如图3所示。其中Bispecific-1的EGFR抗体序列为尼妥珠单抗(nimotuzumab)序列;Bispecific-2的EGFR抗体序列为西妥昔单抗(Cetuximab);Bispecific-3的EGFR抗体序列为帕尼单抗(Panitumumab)。
具体实施例3:双特异抗体分子与CD3和EGFR分子结合情况
用pH9.6的碳酸盐缓冲液包被EGFR胞外区或者CD3E与CD3G亚基胞外区的二聚体,100ng/孔/100ul,4℃包被过夜。用300ul/孔含0.1%的PBS(PBS-T)缓冲液洗五次,再加入1%BSA-PBS溶液在室温封闭2h。加入不同稀释度的双特异抗体或者是对应的抗体。各种双特异抗体(或抗体)最高浓度是1uM,3倍稀释做10个梯度,最后一个孔只加稀释液PBS作为阴性对照,37℃孵育1h。用300ul/孔PBS-T溶液洗五次,再加入用1%BSA-PBS溶液1:40000稀释的Anti-Human Fc-HRP二抗37℃孵育1h。用100ul/孔的TMB显色试剂盒显色,室温显色8min,然后用2M H2SO4终止显色,50ul/孔,450nm/630nm读数。实验结果如图4所示,所有双特异抗体结合EGFR的能力均与其对应的单抗能力相似[即由尼妥珠单抗序列构建的双特异抗体结合EGFR的能力与尼妥珠单抗的相似(图4A);由西妥昔单抗序列构建的双特异抗体结合EGFR的能力与西妥昔单抗的相似(图4B);由帕尼单抗序列构建的双特异抗体结合EGFR的能力与帕尼单抗的相似(图4C)];而各种双特异抗体结合CD3E和CD3G二聚体的能力相近(图4D)。结果表明了文中采用的双特异抗体的形式几乎完整的保留了原先抗体结合抗原的能力;而且CD3的ScFv结合CD3的能力与其连接的不同抗体无关(图4D)。
具体实施例4、双特异抗体分子与过表达EGFR或CD3细胞结合情况
a)双特异性抗体与A431细胞的结合情况
本发明采用过表达EGFR的肿瘤细胞系(A431)来检测不同的双特异抗体与细胞表面EGFR的结合情况,采用相对应的抗体做阳性对照,用人的IgG(hIgG)作为同型对照。用0.25%胰酶消化、离心收集A431细胞。同时稀释各种抗体,最高浓度为1uM,3倍梯度稀释。将收集的细胞用PBS+1%BSA洗三遍,再加PBS+1%BSA重悬细胞,然后铺细胞于96孔板中,每孔1×105个细胞,加入100ul稀释好的双特异性抗体,室温孵育1小时;离心去上清,用PBS洗细胞三遍,再用稀释好的Alexa488标记的抗人IgG-Fc抗体重悬细胞,室温避光孵育1小时,PBS洗三遍,再用100ul PBS重悬,用流式细胞仪检测荧光强度。结果用Graphpad Prism分析。结果显示(图5),每种双特异抗体与A431的结合能力与其对应的抗体具有可比性,而hIgG与A431的结合力很弱。证明双特异抗体较好的保持了其母本抗体的特异结合细胞表面EGFR特异结合的活性。
b)双特异抗体与Jurkat细胞结合情况
Jurkat细胞过表达CD3,可以用来检测双特异抗体与细胞表面CD3的结合情况。双特异抗体与Jurkat细胞结合情况实验过程与实施例4a类似,区别在于Jurkat细胞是悬浮细胞,而A431是贴壁细胞。离心收集Jurkat细胞,加入各种抗体,其余操作与A431实验相同。结果显示(图6),同型对照结合Jurkat的能力很弱;不同的双特异抗体均能够很好的结合细胞,而且三种双特异抗体结合Jurkat细胞的能力一致,表明了图1的双特异抗体中抗CD3的ScFv结合细胞表面抗原的能力不受与它连接的抗体影响。
具体实施例5、双特异抗体分子介导的PBMC对效应细胞的杀伤作用
a)A431或H520细胞PKH26标记
A431是一种过表达EGFR的肿瘤细胞株;而H520则不表达EGFR。本实验采用A431作为实验细胞株;而H520作为阴性对照。
取2×106个细胞于1.5ml离心管中1500rpm离心5min,弃完全培养基,用无血清的培养基分别清洗细胞两次;用PKH26试剂盒中的DiluentC溶液重悬细胞,然后加入等体积的2×P KH26染料液(配制比例:0.4μl染料原液溶于100μl的Diluent C),混匀后室温放置1min。反应结束后,立即加入与管中溶液等体积的0.5%BSA-PBS溶液终止反应,再加入1ml相应的完全培养基稀释重悬细胞,1500rpm离心5min收集细胞沉淀。用完全培养基重悬后与细胞培养瓶中培养待用。
b)PBMC分离
在50ml管中加入20ml单个核细胞分离液;用全血稀释液将采集到的血液按1:1进行稀释处理,混匀后沿康宁管内壁匀速缓慢的铺至分离液上层,每管内加入稀释后全血体积为20ml;待各管加液完毕后放入提前预冷至22℃的离心机内,600g水平离心15min(加减速设置为1);离心完成后取出离心管,用移液器小心吸取置于分离液和血清间呈圆弧状分布的细胞层—单个核细胞(PBMC),置于新的50ml管中;按照1:5比例在细胞液中加入细胞洗涤液,充分混匀后离心,弃上清,再重复洗涤一次,收集细胞沉淀,用RPMI-1640培养基重悬,培养于细胞瓶中待用。
c)CD3+T细胞磁珠分选
PBS(Ph7.2,含0.5%BSA,2mM EDTA),过滤除菌,同时避免产生气泡。
离心去血小板(20度,200g,10-15分钟),然后30μm滤膜去除细胞团块。收集PBMC细胞:200g离心10分钟,弃上清。2x107细胞重悬于60μl buffer+20μl FcR Blocking Reagent中。加入20μl磁珠,混匀,2-8℃孵育15分钟;加入1-2ml buffer,300g,离心10分钟,弃尽上清;500μl重悬。将分选柱置于分选架上,500μl润洗;加入细胞悬液,收集未结合细胞;柱体顶端液体流尽后,500μl洗三次;将分选柱从分选架上取下,置于收集管中,1ml快速冲洗,收集细胞,计数并观察活细胞比例。
d)双特异抗体效应功能检测
按照终浓度1uM起,1:3倍比稀释,10梯度,2复孔;同时设立2个无药物对照孔,用培养基补足体积,将标记后的A431或H520细胞(2×104个/孔/50μl)与CD3+T细胞(2×105个/孔/50μl),按照所需用量混匀后分至V-bottom 96孔板各孔,同时设立以下三个流式对照孔:①无标记的Raji细胞(2×104个/孔)②PKH26标记后的细胞(2×104个/孔);③CD3+T细胞(2×105个/孔)。培养18小时,孵育结束后按照1:50000的比例加入TO-PRO3染料,37℃避光孵育10min;同时设立一个流式对照④TO-PRO3标记后的细胞。3000rpm离心5min后弃部分培养基上清,用0.5%BSA-PBS溶液重悬,流式检测。
计算公式:
细胞死亡率%=(1-PKH26+TOPRO3-细胞数目(药物作用组)/PKH26+TOPRO3-细胞数目(无药物作用组))X100
e)结果分析
由图7可知,双特异抗体分子介导的PBMC对过表达EGFR的A431效应细胞有非常好的杀伤作用;而他们对应的抗体和hIgG则杀伤效果很弱。同时所有的双特异抗体对不表达EGFR的H520细胞杀伤效果都非常弱,且与同型对照hIgG类似(图8)。这表明了所有构建的双特异抗体对靶细胞的杀伤作用是特异的;三种不同的双特异抗体杀伤特异性靶细胞的能力相似,而且细胞死亡率在80%左右。以上表明了图1中双特异抗体具有良好的生物学活性。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺