基于恶性疟原虫环状体独有基因的环介导等温扩增法的制作方法
本发明属于恶性疟原虫检测技术领域,具体涉及基于恶性疟原虫环状体独有基因的环介导等温扩增法。
背景技术:
疟疾是严重危害人类健康的全球三大公共卫生问题之一,在可引起人体疟疾的5种疟原虫中,由恶性疟原虫引起的恶性疟最为严重,常以畏寒、发热、头痛为首发症状,并发症多,若不及时治疗容易危及生命。该病在撒哈拉以南非洲地区流行普遍,发病率和死亡率极高,特别是孕妇和五岁以下儿童深受其害。
20世纪70年代以后,随着疟疾疫情下降,低原虫血症患者所占比例增大,混合感染病例增多。此外,病人药物治疗后的复查或正处于慢性感染阶段等对镜检的要求提高。常规血膜涂片染色镜检法很可能会导致误诊或漏诊,因此,作为金标准的镜检已难以适应疫情变化后的检测需求。此外,由于镜检需要长时间观察、专业判别和复核,难以广泛应用。同时,免疫学方法的不稳定,PCR耗时长、花费高,使得一直以来都难以找到一种实用性和适用性兼备的恶性疟原虫检测方法。2016年世界疟疾报告显示,2015年全球约有2.12亿疟疾新增病例,其中死亡病例约429000例。目前,我国疟疾疫情已经由本地病例为主转变为输入性病例为主,且输入性病例比例逐年上升。特别是近年来,随着国内外经贸往来频繁,出国经商、旅游、留学和度假日益增多,造成我国输入性疟疾疫情愈来愈突出。因此,寻找一种操作简单、快速高效、高特异性和高灵敏度的检测方法迫在眉睫。传统的疟疾检测方法是厚薄血膜涂片经染色后镜检。其优点是操作简单、成本低,能够进行虫种鉴别;不足之处在于其费时、费力,对检验者的专业要求高,特别是检测低原虫血症样本时易漏诊。因此,研究人员建立了基于酶联免疫吸附试验(ELISA)和间接免疫荧光试验(IFA)的疟疾免疫学快速诊断方法。这些方法能够实现检出疟原虫感染的目的,敏感性可与专业镜检媲美,然而其检测效能并不稳定。随后,研究人员开发了基于DNA扩增的分子生物学技术,最常用的有PCR、巢式PCR和实时定量PCR。与镜检相比,分子生物学方法具有更高的灵敏度(最低可检测1~5个疟原虫/μl)和更好的特异性;但该技术存在费用高、须由专业高科技人员操作,且只能在设施配置齐全的实验室进行,从而限制了其在基层医院和医疗卫生条件相对较差地区的应用,而这些地区通常又是疟疾流行范围最广、危害最严重的地区。因此,迫切需要研发一种新的疟疾诊断技术,以弥补镜检、免疫学和常规分子生物学方法的不足。
环介导等温扩增法(Loop-mediated isothermal amplification,LAMP)是2000年开发出来的一种新的恒温核酸扩增技术。其特点是针对靶基因的6个区域设计4种特异引物,利用一种链置换DNA聚合酶在等温条件(63℃左右)下温育30~60min即可完成DNA扩增反应。与普通PCR相比,LAMP技术不需要模板热变性、复杂的温度循环、长时间电泳及凝胶成像等过程,具有简单、快速、高度灵敏、特异性强的特点,这些独特的优势使其更能为广大医务工作者所接受。目前,已建立了基于恶性疟原虫编码CSP蛋白基因和18S rRNA的LAMP技术,并广泛应用于现场调查。然而,此类高度保守基因在疟原虫属乃至疟原虫科都广泛存在,加之LAMP法是一种高敏感性和特异性的技术,极易造成假阳性,从而导致虫种误判。
技术实现要素:
基于上述技术问题,本发明提供了基于恶性疟原虫环状体独有基因的环介导等温扩增法,用以解决现有恶性疟原虫检测方法存在误判等诸多的问题。
为实现上述技术目的,本发明采用的技术方案如下:
基于恶性疟原虫环状体独有基因的环介导等温扩增法,包括以下步骤:
步骤一,生物信息学分析:搜索PlasmoDB数据库,筛选仅在恶性疟原虫红细胞内期环状体期高表达(前20%)且该种疟原虫特有基因,利用OrthoMCL database验证其在真核生物不同种属间的分布情况,同时,筛选仅在恶性疟原虫红内期滋养体或裂殖体阶段高表达(前20%)且其特有基因各一个,做为平行对照;
步骤二,LAMP引物设计:利用LAMP在线设计软件PrimerExplorerV4对步骤一所筛选到的特有基因进行LAMP引物设计,参数设置为默认值,选择分数排名前二至前五的LAMP引物,然后进行LAMP引物合成;
步骤三,模版DNA制备:使用血液基因组DNA提取试剂盒分别提取含有恶性疟原虫、间日疟原虫、约氏疟原虫的全血基因组DNA;使用血液/细胞/组织基因组DNA提取试剂盒提取感染弓形虫的小鼠腹水DNA;上述试剂盒所提取的基因组DNA即为LAMP使用的模板DNA;
步骤四,引物配制:
LAMP引物存储液配制:将步骤二得到的置于1.5ml离心管的LAMP引物干粉在12000r/min下离心1min,以使粘在管盖和管壁的粉末全部集中在管底。
配制母液:根据引物干粉摩尔数溶解干粉于1.5ml离心管,配制内引物(FIP/BIP)母液的浓度为200pmol/μl,外引物(F3/B3)母液的浓度为100pmol/μl,将配制好的内引物(FIP/BIP)母液和外引物(F3/B3)母液室温放置5min,振荡混合均匀后放入离心机,在12000r/min下离心1min;
LAMP引物工作液PM制备:取200pmol/μl的FIP母液和BIP母液各4μl、100pmol/μl的F3母液和B3母液各1μl,最后加入10μl超纯水制备成20μl工作液备用;
步骤五,LAMP法的建立和敏感性、特异性评价:
A.LAMP反应体系包括12.5μl 2×RM反应液,1μl步骤四得到的LAMP引物工作液PM,1μl和相对应基因的DNA模板,1μl Bst DNA Polymerase,加超纯水至25μl,混合均匀后加入12.5μl密封液再次离心,最后将1μl显色液滴在PCR管盖中间,轻轻盖紧管盖,恒温金属浴内反应,终止反应后颠倒PCR管数次或1000~16000r/min离心30sec~3min,使显色液与反应混合液充分混匀,短暂离心后观察反应液颜色变化,若呈现绿色则为阳性(有核酸扩增),若呈现棕红色则为阴性(无核酸扩增);
B.将步骤三得到的含有恶性疟原虫基因组DNA的全血DNA用超纯水进行倍比稀释,然后按照步骤五中A所述的LAMP染色法检测,评价所检测基因的敏感性;
C.将步骤三得到的含有恶性疟原虫基因组DNA的全血DNA、含有间日疟原虫基因组DNA的全血DNA、含有约氏疟原虫基因组DNA的全血DNA、含有弓形虫基因组DNA的腹水DNA;按照步骤五中A所述的LAMP染色法检测,以18S rRNA设计的LAMP引物作为阳性对照引物,进行特异性评价,同时设立空白对照和阴性对照。
作为优选的,所述步骤一中恶性疟原虫特有基因为PF3D7_1253300,PF3D7_0202200,PF3D7_0702300,PF3D7_1001900,PF3D7_1002000,PF3D7_1148900,PF3D7_1240100,PF3D7_1301700与PF3D7_1334700,这样的设计,可以更好的对恶性疟原虫更好的区别,更好的进行检测。
作为优选的,所述步骤一中恶性疟原虫红内期滋养体阶段高表达(前20%)特有基因为PF3D7_0220300,这样的设计,对比性较强。
作为优选的,所述步骤一中恶性疟原虫红内期裂殖体阶段高表达(前20%)特有基因为PF3D7_1401600,这样的设计,参照、对比性较强。
作为优选的,所述步骤三中血液/细胞/组织基因组DNA提取试剂盒的提取方法为疟原虫滤纸血斑DNA提取,所述疟原虫滤纸血斑DNA方法为:用打孔器取少许滤纸,所述滤纸含血样,置于1.5ml离心管,先加入1.0ml无菌水浸泡2h,然后在16000r/min下离心5min,弃上层清液;再加160μl 5%chelex-100混悬液,56~65℃加热1~2h后在95~98℃变性5~10min,振荡30s~3min,然后取在12000~16000r/min下离心3~5min,吸取上清150±10μl,在-20℃下保存。
作为优选的,所述打孔器取3mm*3mm滤纸,所述滤纸含10±0.5μl血样,这样的设计,可以获得足够多的血样。
作为优选的,所述步骤三中含有恶性疟原虫的全血的原虫密度为50000个/μl,这样的设计,可以使在检测的时候能够更好的检测。
作为优选的,所述步骤五中恒温金属浴内的温度为60~65℃,这样的设计,能够使检测效果更明显。
作为优选的,所述步骤五中恒温金属浴内的反应时间为30~90min,这样的设计,可以使检测精度更高。
作为优选的,所述步骤五中恶性疟原虫DNA用超纯水按照10-1、10-2、10-3、10-4和10-5倍比稀释,这样的设计,可以更好检测对比。
本发明的有益效果:
1、环介导等温扩增法对恶性疟原虫环状体基因检测更加的快速、高效;
2、本发明能够检测恶性疟原虫环状体的特有基因,从而却别其它疟原虫;
3、本发明相对与其它检测方法,对恶性疟原虫的检测更准确,误判更低。
附图说明
本发明可以通过附图给出的非限定性实施例进一步说明;
图1为本发明基于恶性疟原虫环状体独有基因的环介导等温扩增法实施例的LAMP检测体系质控示意图;
图2为本发明基于恶性疟原虫环状体独有基因的环介导等温扩增法实施例的建立与敏感性评价示意图;
图3为本发明基于恶性疟原虫环状体独有基因的环介导等温扩增法实施例的特异性评价示意图;
图4为本发明基于恶性疟原虫环状体独有基因的环介导等温扩增法实施例的临床样本检测评价示意图。
具体实施方式
为了使本领域的技术人员可以更好地理解本发明,下面结合附图和实施例对本发明技术方案进一步说明。
实施例
步骤一,结合恶性疟原虫全基因组和转录组数据库,从5403个基因中一共筛选了1799个在环状体期前20%高表达的基因,占比33.30%;经过比对分析,最终在1799个基因中选定了九个特有基因作为候选基因用于LAMP研究;在九个基因中,PF3D7_1253300是假基因,其余八个PF3D7_0202200,PF3D7_0702300,PF3D7_1001900,PF3D7_1002000,PF3D7_1148900,PF3D7_1240100,PF3D7_1301700与PF3D7_1334700是编码蛋白基因;根据OrthoMCL数据库分析结果显示,PF3D7_0702300,PF3D7_1001900,PF3D7_1253300和PF3D7_1301700四个基因仅在恶性疟原虫中存在,未在其他疟原虫中发现;同时选取滋养体前20%高表达独有基因PF3D7_0220300和裂殖体期高表达前20%独有基因PF3D7_1401600做为平行对照;
步骤二,LAMP引物的筛选与设计:
利用LAMP在线设计软件PrimerExplorerV4对步骤一中的九个基因一共筛选了31套LAMP引物用于后续研究,具体为PF3D7_0202200,PF3D7_0702300,PF3D7_1001900,,PF3D7_1002000,PF3D7_1148900,PF3D7_1240100,PF3D7_1253300,PF3D7_1301700和PF3D7_1334700分别选取了5,3,2,4,2,3,5,2,和5套LAMP引物(见表1)。同时选取滋养体前20%高表达独有基因PF3D7_0220300和裂殖体期高表达前20%独有基因PF3D7_1401600分别筛选一对引物(见表1)。
表1恶性疟原虫独有基因LAMP引物
步骤三,模板DNA的制备:使用血液基因组DNA提取试剂盒分别提取含有恶性疟原虫、间日疟原虫、约氏疟原虫的全血DNA;使用血液/细胞/组织基因组DNA提取试剂盒提取弓形虫小鼠腹水DNA,将提取的DNA分别制造为DNA模版;血液基因组DNA提取试剂盒的提取方法为疟原虫滤纸血斑DNA提取,所述疟原虫滤纸血斑DNA方法为:用打孔器取3mm×3mm滤纸,10±0.5μl血样,置于1.5ml离心管,先加入1.0ml无菌水浸泡2h,然后在16000r/min下离心5min,弃上层清液;再加160μl 5%chelex-100混悬液,56℃加热2h后在95℃变性8min,振荡30s,然后取在16000r/min下离心5min,吸取上清150±10μl,在-20℃下保存。
步骤四,引物配制:
LAMP引物存储液配制:将步骤二得到的31套LAMP引物制成干粉,然后将干粉装入1.5ml离心管,在12000r/min下离心1min;
配制母液:根据31套LAMP引物干粉摩尔数溶解干粉,分别配制各个LAMP引物内引物(FIP/BIP)母液和环引物(LPF/LPB)母液的浓度均为200pmol/μl,外引物(F3/B3)母液的浓度为100pmol/μl,将配制好的内引物(FIP/BIP)母液、环引物(LPF/LPB)母液和外引
物(F3/B3)母液室温放置5min,振荡混合均匀后放入离心机,在12000r/min下离心1min;
LAMP引物工作液PM制备:取配制好的200pmol/μl的FIP母液和BIP母液各4μl、和相对应的100pmol/μl的F3母液和B3母液各1μl,最后加入10μl超纯水制备成20μl工作液备用。
步骤五,LAMP法的建立和敏感性、特异性评价:
LAMP反应体系包括12.5μl 2×RM反应液,1μl步骤四得到的LAMP引物工作液PM,1μl步骤三得到的DNA模板,1μl Bst DNA Polymerase,加超纯水至25μl,混合均匀后加入12.5μl密封液再次离心,最后将1μl显色液滴在PCR管盖中间,轻轻盖紧管盖。恒温金属浴内65℃反应60min,终止反应后颠倒PCR管数次,使显色液与反应混合液充分混匀,短暂离心后观察反应液颜色变化,若呈现绿色则为阳性(有核酸扩增),若呈现棕红色则为阴性(无核酸扩增),得到的数据见表二;
表二恶性疟原虫独有基因LAMP引物敏感性评价结果
备注:P,W和N分别为阳性、弱阳性和阴性。10倍倍比稀释中1至0.00001为疟原虫血症50000原虫/μl的恶性疟原虫DNA提取后用纯水稀释后的浓度。
通过表二,我们可以发现,基因PF3D7_0112300(18S rRNA)和PF3D7_0220300(滋养体期基因)、PF3D7_1401600(裂殖体期基因)分别作为阳性和平行对照,在原始浓度时(50000parasite/μl),PF3D7_0112300,PF3D7_0220300和PF3D7_1401600LAMP检测结果分别为阳性、弱阳性和阴性(图1)。
图1中P、B、N分别为试剂盒自带的阳性、阴性和空白对照;C、T、S分别代表PF3D7_0112300,PF3D7_0220300和PF3D7_1401600LAMP三个基因。
针对九个独有基因的LAMP检测结果显示,有来自8个基因的23套LAMP检测结果为阳性,4个基因的5套引物检测结果为弱阳性,2个基因的3套引物检测结果为阴性。具体为来自PF3D7_1148900的LAMP引物检测的结果均为阴性;来自PF3D7_0702300,PF3D7_1001900,和PF3D7_1301700基因LAMP检测显示分别有一套引物阳性;PF3D7_1240100有三套LAMP引物检测显示阳性;PF3D7_1002000,PF3D7_0202200,和PF3D7_1334700三个基因分别有四套引物显示阳性;特别是PF3D7_1253300五套LAMP检测结果均为阳性。
随后,利用倍比稀释的DNA对独有基因的敏感性进行了评价。在对照中,PF3D7_0112300在10-1,10-2两个梯度显示阳性,在10-3~10-5三个梯度显示阴性;PF3D7_0220300和PF3D7_1401600在10-1至10-5五个梯度均显示阴性(表2)。在独有基因检测中,10-1稀释时有来自6个基因的13套LAMP引物显示阳性,来自8个基因的11套LAMP引物显示弱阳性,来自5个基因的7套LAMP引物显示阴性;10-2稀释时有来自6个基因的8套LAMP引物显示阳性,来自5个基因的10套LAMP引物显示弱阳性,来自7个基因的13套LAMP引物显示阴性;10-3稀释时有来自7个基因的11套LAMP引物显示弱阳性,来自8个基因的20套LAMP引物显示阴性;10-4和10-5稀释时有来自3个基因的5套LAMP引物显示弱阳性,其余均为阴性(图2、表2)。
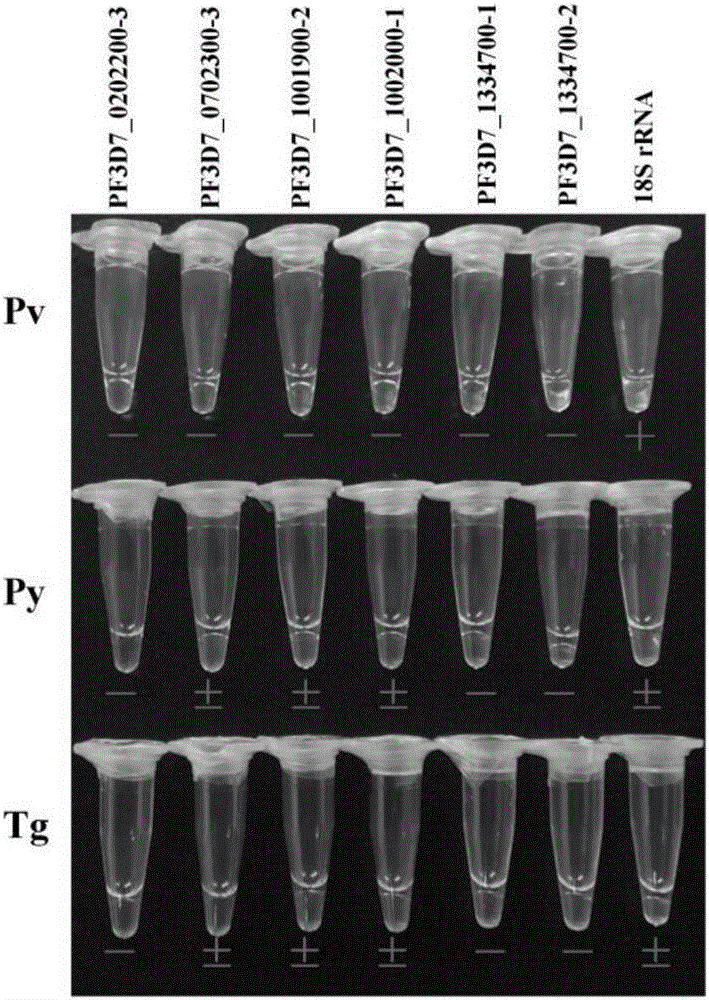
在特异性评价中,来自于5个基因的6套引物进行了LAMP检测,再利用恶性疟原虫、间日疟原虫、约氏疟原虫和刚地弓形虫DNA进行LAMP检测时显示PF3D7_0202200-3,PF3D7_1334700-1和PF3D7_1334700-2均为阴性,不存在交叉反应;PF3D7_0702300-3,PF3D7_1001900-2和PF3D7_1002000-1在检测约氏疟原虫和刚地弓形虫时显示弱阳性,存在一定的交叉反应。作为对照,PF3D7_0112300(18S rRNA)在检测间日疟原虫时显示强阳性,在检测约氏疟原虫和刚地弓形虫时显示弱阳性,均存在一定的交叉反应见图3。
独有基因LAMP检测的临床评价
在临床检测评价中,选定2个基因的3套引物PF3D7_0202200-3,PF3D7_1334700-1和PF3D7_1334700-2进行了LAMP检测。随机选取了不同原虫血症的临床样本30份,分为低度原虫血症(≤5000parasite/μl)、中度原虫血症(5000-50000parasite/μl)和重度原虫血症(≥50000parasite/μl)三组,每组10份。在三组样本中,PF3D7_0112300的阳性检出率分别为60%、70%和100%。检测结果显示2个基因的3套引物能够有效的检测30分临床样本见图4A。对照组PF3D7_0112300与检测组PF3D7_0202200-3,PF3D7_1334700-1和PF3D7_1334700-2之间无统计学差异(χ2=1.847,P=0.397)。
在低度原虫血症组中,PF3D7_0202200-3,PF3D7_1334700-1和PF3D7_1334700-2阳性检出率分别为10%,30%和20%;见图4B。在中度原虫血症组中,PF3D7_0202200-3,PF3D7_1334700-1和PF3D7_1334700-2阳性检出率分别为70%,100%和70%;见图4C。在重度原虫血症组中,PF3D7_0202200-3,PF3D7_1334700-1和PF3D7_1334700-2阳性检出率均为90%;见图4D。在中、重度原虫血症组中,其检测敏感性与PF3D7_0112300无统计学差异(P=0.096、P=0.287、P=1.0)。
恶性疟原虫临床样本疟原虫血症
基于疟原虫血症分为低度原虫血症(≤5000parasite/μl)、中度原虫血症(5000-50000parasite/μl)和重度原虫血症(≥50000parasite/μl)三组,每组10份;然后按照上述方法进行检测。可以得到更加准确的数据。
上述实施例仅示例性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!