一种枸杞红素的制备方法与流程
本发明属于天然活性物质的提取方法领域,具体涉及一种枸杞红素的制备方法。
背景技术:
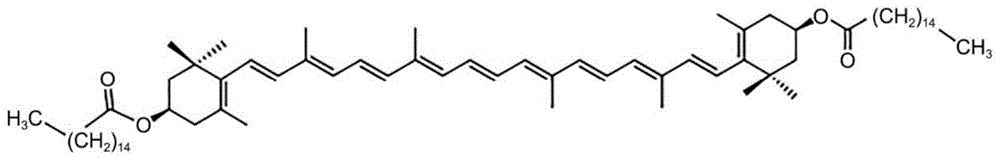
枸杞(lyciumchinensemiller)是茄科植物,枸杞果实枸杞子是我国传统的药食同源药材,《中药大辞典》记载枸杞子具有滋补肝肾、益精明目的功效[1]。枸杞子含有枸杞多糖[2]、黄酮、多酚[3]、类胡萝卜素[4]等多种活性物质,具有抗氧化、降血脂、抗衰老、保肝等生物活性。枸杞子中最主要的类胡萝卜素是枸杞红素,化学名称为玉米黄素二棕榈酸酯(zeaxanthindipalmitate)。枸杞红素是一种富含氧的类胡萝卜素,分子结构上含多个不饱和双键,分子式为c72h116o4(cas号:144-67-2),其化学结构参照附图1。
枸杞红素经皂化反应后可脱去二棕榈酸生成玉米黄素(zeaxanthin),玉米黄素和叶黄素是人类视网膜上的主要色素。玉米黄素与叶黄素是人体视网膜的黄斑部位唯一的类胡萝卜素,是黄斑色素的主要组成色素(clinicsindermatology(2009)27,195–201)。玉米黄素主要集中在视网膜的黄斑区中心,叶黄素则遍及视网膜。玉米黄素具有特异性的吸收紫外线中蓝光的作用,可避免蓝光对视网膜损伤,同时玉米黄素和叶黄素还具有抗氧化的作用,可防止视网膜、上皮细胞、脉络膜等由于氧化引起的眼损伤,因此玉米黄素和叶黄素对于人体视力和眼睛的营养保护具有重要的作用(brjophthalmol199983:867-877)。实验证明玉米黄素比叶黄素对于眼睛的作用更为重要,当玉米黄素供应不足时人体会将叶黄素自动转化为玉米黄素。老年性黄斑变性(amd)是老年人视力障碍和致盲的首要眼病,amd的患病风险与人体血液中的玉米黄素和叶黄素浓度密切相关,大量研究证明每日摄入6mg玉米黄素和叶黄素可有效降低老年性黄斑变性风险,减缓老年性黄斑变性进程。黄斑性色素玉米黄素和叶黄素还可改善眼睛畏光、眩光恢复、黄昏黎明视觉、暗反应等眼部问题(academyofophthalmiceducation)。人体无法自身合成玉米黄素,只能通过食物摄取(foodandchemicaltoxicology49(2011)2841–2848)。枸杞子是含有枸杞红素含量最高的植物之一,枸杞子的益精明目功效与其富含枸杞红素密切相关。
而现有技术中,对于枸杞色素的提取往往集中于针对枸杞中类胡萝卜素的提取,并没有针对枸杞红素提取的文献报道,涉及枸杞红素大多是基于色谱方法鉴定,或是直接使用枸杞红素标准品的活性试验。并且针对于色素的提取纯度最高,且可以应用于实际应用的是制备色谱的应用,但是由于制备色谱的仪器设备前期的方法建立过于复杂。
技术实现要素:
针对于现有技术中的问题,本发明提供的枸杞红素的制备方法,通过有机溶剂提取以及固体吸附剂吸附材料,实现了对枸杞红素的高效提取,同时可大量减少有机溶剂的用量,工艺简单、效率高、易于工业放大,可应用于食品、保健食品、药品、化妆品等领域,具有良好的工业应用前景。
为实现上述目的,本发明采用的技术方案如下:
一种枸杞红素的制备的方法,其特征在于:
1)将干枸杞粉碎,与溶剂a按质量体积比1:10-100混合,搅拌1-10小时,经过滤,得到滤渣;
2)将所述步骤(1)的滤渣冷冻干燥后再次粉碎,将得到的粉碎滤渣与提取溶剂b按质量体积比1:(10-125)混合,搅拌萃取0.5-8小时,过滤,得到提取液经浓缩,得到浓缩提取液;
3)向所述步骤2)中的浓缩提取液加入固体吸附剂,搅拌0.5-10小时,静置分离,收集所述固体吸附剂;用洗脱溶剂将所述固体吸附剂冲洗至ph为中性;
4)向所述步骤3)获得的固体吸附剂中加入萃取溶剂缓慢震荡1-5小时,静置分离,除去固体吸附剂,将所得溶剂浓缩干燥得到枸杞红素;
所述溶剂a为:水、甲醇中的一种或两种溶剂混合物;
所述提取溶剂b为:甲醇、乙醇、丙醇、丁醇、乙酸乙酯、二氯甲烷、三氯甲烷、乙醚、丙酮、环己烷、正己烷、石油醚中的一种或两种以上的溶剂混合物。
所述步骤1)中,其目的是去除枸杞中如枸杞多糖、多酚等杂质,为后面提取枸杞红素去除杂质干扰。本发明中,枸杞红素是脂溶性的色素,不溶于水,这一步提取步骤,不会对后续提取枸杞红素产生影响。所述步骤2)中,滤渣提取的目的是提取枸杞红素,使用有机溶剂提取色素的方法,使用有机溶剂提取脂溶性的色素,这一步的是主要的提取步骤,提取大部分的枸杞红素。
所述步骤3)中,固体吸附剂,使用方法简便,避免了纯化色素要使用的高效液相色谱法、制备色谱法。且色素回收步骤中,有机溶剂可循环回收利用,降低成本。
同时利用固体吸附剂原位富集从枸杞中提取枸杞红素,可大量减少有机溶剂的用量,工艺简单、效率高、易于工业放大。
使用固体吸附获得色素可协同上步骤提取共同提高枸杞色素的提取率,搅拌时间、温度根据吸附材料在最佳的吸附效果来制定的。
所述步骤4)中,加入萃取溶剂把枸杞红素从洗脱溶剂中萃取下来,以便后续的溶剂浓缩干燥。
所述步骤1)中,枸杞粉碎为初步粗粉碎,所用粉碎装置可为:jyl-d050料理机,产品转速为:18000-22000转/分,功率为:250w(九阳股份有限公司)。
优选地,所述步骤1)中,溶剂a为水。
所述步骤1)中,在优选的技术方案中,当溶剂a为水时,可将色素与水进行有效分离,从而不会对后续提取枸杞红素产生影响。
优选地,所述步骤1)中,搅拌处理温度为25-40℃。
优选地,所述步骤2)中,滤渣粉碎的粒度为0.01-0.5mm。
所述步骤2)中,滤渣粉碎中所用粉碎装置可为:高速万能粉碎机,转速为24000rpm(天津市泰斯特仪器有限公司)。
优选地,所述步骤2)中,提取溶剂b为正己烷。
优选地,所述步骤2)中,提取溶剂b为正己烷与乙醇的混合。
更优选地,所述步骤2)中,提取溶剂b由正己烷与乙醇按照体积比(1-5):1混合组成。本发明发现,当在滤渣中加入提取溶剂b的组成为正己烷与乙醇时,特别是当二者体积比为(1-5):1时,其对枸杞红素的提取具有显著的促进作用,
更优选地,所述步骤2)中,提取溶剂b由正己烷与乙醇按照体积比(2-3):1混合组成。
所述步骤2)中,溶剂b为最优溶剂为正己烷:乙醇。方法相比于乙酸乙酯减少了成本的利用,可通过冷凝法、吸附法、吸收法、膜分析法等方法进行回收,以减少成本,并且提取多次,即将滤渣冷冻干燥后粉碎,加入提取溶剂,搅拌萃取,后过滤,滤渣在按照上述方法再次提取,在滤渣再次加入提取溶剂,搅拌萃取,多次提取,相比于其他方法可以更加彻底提取枸杞红素。
优选地,所述步骤2)中,提取温度为45-65℃。
优选地,所述步骤2)中,将所述滤渣按照所述步骤2)方法再次循环重复提取,直至提取液无色。
优选地,所述步骤3)中,固体吸附剂为:c8修饰的二氧化硅、c18修饰的二氧化硅、c30修饰的二氧化硅、羟丙基葡聚糖凝胶、聚苯乙烯树脂中的一种或两种以上。
更优选地,所述步骤3)中,固体吸附剂为:c30修饰的二氧化硅。
针对枸杞红素的不饱和双键,选择使用c30修饰的吸附剂,可以提高对于枸杞红素的制备量。
优选地,所述步骤3)中,固体吸附剂的加入量为枸杞原料质量的0.1-10倍。
优选地,所述步骤3)中,洗脱溶剂为:甲醇、乙醇、丙二醇中的一种或两种以上。
优选地,所述步骤3)中,固体吸附剂与洗脱溶剂的质量体积比为1:2-20(m/v)。
所述步骤3)中,洗脱溶剂的加入量是根据试验中固体吸附材料的饱和吸附度和干枸杞中总色素类胡萝卜素的含量决定的,枸杞中类胡萝卜素含有量约为20.36-89.92mg/100g,鲜果经过干燥后总色素含量会有一定程度的下降。
优选地,所述步骤3)中,提取温度为20-60℃。
优选地,所述步骤4)中,萃取溶剂与洗脱溶剂的体积比为1:1。
优选地,所述步骤4)中,所述萃取溶剂为:甲醇、乙醇、丙醇、丁醇、乙酸乙酯、二氯甲烷、三氯甲烷、乙醚、丙酮、正己烷中的一种或两种以上;
优选地,所述步骤4)中,所述萃取溶剂为三氯甲烷。
本发明的另一目的是提供由上述方法制备的枸杞红素,所述枸杞红素提取率≥58%。
有益效果:
1、本发明首次通过溶剂提取协同吸附的方式提取枸杞红素:
此前文献大多数都是针对枸杞中类胡萝卜素的提取,并没有针对枸杞红素提取的文献报道,涉及枸杞红素大多是基于色谱方法鉴定,或是直接使用枸杞红素标准品的活性试验。并且针对于色素的提取纯度最高,且可以应用于实际应用的是制备色谱的应用,但是由于制备色谱的仪器设备前期的方法建立过于复杂。而本发明单纯使用有机溶剂提取以及固体吸附剂吸附材料,实现了对枸杞红素的高效提取,并且在提取过程中具有以下显著的优势:
(1)效率高。采用本发明的制备工艺,从枸杞中获得的枸杞红素收率为10mg/g(干重)以上。
(2)绿色环保。本发明的提取和纯化一步完成,简化了生产工艺,减少有机溶剂的使用量,具有绿色环保的特点。且提取过程中所用的有机溶剂、固体吸附材料都可以回收,可以显著降低工业生产的成本。
(3)具有良好的应用前景。枸杞红素是强抗氧化剂,同时对眼疲劳等有很好的缓解作用,天然提取的玉米黄素安全性高,因此在食品、保健品、药品、化妆品等领域有良好的应用前景。
附图说明
图1为枸杞红素的化学结构图(c72h116o4;cas号:144-67-2);
图2为本发明实施例1中枸杞红素提取物的高效液相色谱图(图中*为枸杞红素)。(其中,t=31min时标注*的峰为枸杞红素色谱峰)
具体实施方式
下面通过具体的实施方案叙述本发明。除非特别说明,本发明中所用的技术手段均为本领域技术人员所公知的方法。另外,实施方案应理解为说明性的,而非限制本发明的范围,本发明的实质和范围仅由权利要求书所限定。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对这些实施方案中的物料成分和用量进行的各种改变或改动也属于本发明的保护范围。以下结合具体实施例对本发明进行进一步说明。
实施例1枸杞红素的提取
1)将1kg干枸杞粉碎,与水(即溶剂a)按质量体积比1:20混合,35℃,搅拌提取1.5小时,经过滤,得到提取液和滤渣;
其中,枸杞粉碎为初步粗粉碎。
2)将所述步骤(1)的滤渣冷冻干燥后再次粉碎,将得到的粉碎滤渣与提取溶剂b按质量体积比1:20混合,55℃,搅拌萃取1小时,过滤,得到提取液和滤渣,将所述滤渣按照所述步骤2)方法再次循环重复提取,直至提取液无色,合并提取液,经浓缩,得到浓缩提取液;其中,提取溶剂b为正己烷:乙醇=2.6:1。
其中,滤渣粉碎的粒度为0.01-0.3mm。
3)向所述步骤2)中的浓缩提取液加入固体吸附剂,30℃,搅拌2小时,静置分离,收集富集枸杞红素的固体吸附剂;用洗脱溶剂将所述固体吸附剂冲洗至ph为中性;
其中,固体吸附剂为:c30修饰的二氧化硅,加入量为枸杞原料质量的0.1倍。
其中,洗脱溶剂为乙醇,洗脱溶剂的加入量为:固体吸附剂质量:洗脱溶剂体积比为1:10。
4)向所述步骤3)获得的固体吸附剂中加入萃取溶剂即三氯甲烷,缓慢震荡3小时,静置分离,除去固体吸附剂,将所得溶剂浓缩干燥得到枸杞红素;其中萃取溶剂三氯甲烷与洗脱溶剂的体积比为1:1。
所得溶剂浓缩干燥得到枸杞红素粗提取物总量为72克,通过液相分析测定,其中枸杞红素含量约为1.93g,枸杞红素的提取率约为74.51%,枸杞红素纯度约为2.68%。
所述枸杞红素提取率=(所得溶剂干燥浓缩得到的枸杞红素/枸杞子中枸杞红素的含量)×100%
枸杞红素纯度=(所得溶剂干燥浓缩得到的枸杞红素/所得溶剂干燥浓缩得到的枸杞红素粗提取物总量)×100%。
实施例1、2、3、4所用到的枸杞原料相同,经测定枸杞原料中的枸杞红素含量通过hplc检测得到,实施例中,使用的枸杞原料中枸杞红素含量为2.59±0.051mg/g。
参照附图2为本发明实施例1中枸杞红素提取物的高效液相色谱图。
枸杞红素的测定:使用高效液相色谱法(highperformanceliquidchromatography,hplc)进行检验,针对于枸杞中枸杞红素的hplc检测方法,依据枸杞红素的结构查阅文献,并且根据枸杞红素标准品在450nm处存在最大吸收,确定了检测波长,使用枸杞红素标准品,建立标准曲线,并且应用于实验中的枸杞红素样品。枸杞红素液相测定方法来源于文章inbarajbs,luh,hungcf,etal.determinationofcarotenoidsandtheirestersinfruitsoflyciumbarbarumlinnaeusbyhplc–dad–apci–ms[j].journalofpharmaceutical&biomedicalanalysis,2008,47(4-5):812-818.
以下实施例2、3、4中枸杞红素提取率和枸杞红素纯度的测定方法与计算方式同实施例1.
实施例2枸杞红素的提取
1)将1kg干枸杞粉碎,与水(即溶剂a)按质量体积比1:25混合,30℃,搅拌提取2小时,经过滤,得到提取液和滤渣;其中枸杞粉碎为初步粗粉碎,所用粉碎装置为:jyl-d050料理机,产品转速为:18000转/分,功率为:250w(九阳股份有限公司)。
2)将所述步骤(1)的滤渣冷冻干燥后再次粉碎,将得到的粉碎滤渣与提取溶剂b按质量体积比1:25混合,50℃,搅拌萃取1小时,过滤,得到提取液和滤渣,将所述滤渣按照所述步骤2)方法再次循环重复提取,直至提取液无色,合并提取液,经浓缩,得到浓缩提取液;
其中,滤渣粉碎的粒度为0.01-0.3mm。
所述步骤2)中,滤渣粉碎中所用粉碎装置可为:高速万能粉碎机,转速为24000rpm(天津市泰斯特仪器有限公司)。
其中,提取溶剂b为正己烷:乙醇=3:1。
3)向所述步骤2)中的浓缩提取液加入固体吸附剂,30℃,搅拌2小时,静置分离,收集富集枸杞红素的固体吸附剂;用洗脱溶剂将所述固体吸附剂冲洗至ph为中性;
其中,固体吸附剂为:c30修饰的二氧化硅,固体吸附剂的加入量为枸杞原料质量的0.15倍。
其中,洗脱溶剂为:丙二醇,洗脱溶剂的加入量为:固体吸附剂质量:洗脱溶剂体积1:2。
4)向所述步骤3)获得的固体吸附剂中加入萃取溶剂缓慢震荡2小时,静置分离,除去固体吸附剂,将所得溶剂浓缩干燥得到枸杞红素。
其中,所述萃取溶剂为:三氯甲烷。
其中萃取溶剂三氯甲烷与洗脱溶剂的体积比为1:1。
所得溶剂浓缩干燥得到枸杞红素粗提取物总量为65克,通过液相分析测定,其中枸杞红素含量为1.97g,枸杞红素的提取率为76.06%,枸杞红素纯度为2.59%。
所得溶剂浓缩干燥得到枸杞红素粗提取物总量为72克,通过液相分析测定,其中枸杞红素含量约为1.93g,枸杞红素的提取率约为76.1%,枸杞红素纯度约为3.03%。
实施例3枸杞红素的提取
1)将干燥的枸杞子粉碎,取枸杞粉1kg,加入10l水(即溶剂a),30℃搅拌提取1小时,提取结束后静置沉淀过滤分离,得到提取液和滤渣;其中枸杞粉碎为初步粗粉碎。
2)将步骤1)得到的滤渣冷冻干燥后再次粉碎,得到滤渣400g,加入5升提取溶剂b,45℃搅拌萃取0.5小时,过滤;滤渣按照上述方法再次提取两次,直至提取液无色,合并几次提取液,蒸发浓缩,得到浓缩提取液;
其中,滤渣粉碎的粒度为0.01-0.3mm。
其中,提取溶剂b组成为正己烷:乙醇=5:1
3)向步骤2)浓缩提取液加入0.2kg的c30固体吸附剂,缓慢搅拌0.5小时,静置分离,得到富集枸杞红素的固体吸附剂;用30℃的洗脱溶剂甲醇溶液将富含枸杞红素的固体吸附剂冲洗至ph为中性;
其中,洗脱溶剂甲醇溶液的加入量为:固体吸附剂质量:洗脱溶剂体积=1:10。
4)向所述步骤3)获得的固体吸附剂中加入萃取溶剂二氯甲烷,缓慢震荡2小时,静置分离,除去固体吸附剂,所得溶剂浓缩干燥得到枸杞红素粗提取物总量为56克,通过液相分析测定,其中枸杞红素含量约为1.79g,枸杞红素的提取率约为69%,枸杞红素纯度约为3.19%。
实施例4枸杞红素的提取
1)将干燥的枸杞子粉碎,取枸杞粉1kg,加入100l水(即溶剂a),30℃搅拌提取10小时,提取结束后静置沉淀过滤分离,得到提取液和滤渣;
所述步骤1)中,枸杞粉碎为初步粗粉碎。
2)将步骤1)得到的滤渣冷冻干燥后再次粉碎,得到滤渣400g,加入50升正己烷(即溶剂b),50℃搅拌萃取6小时,过滤;滤渣按照上述方法再次提取两次,直至提取液无色,合并几次提取液,蒸发浓缩,得到浓缩提取液;
优选地,所述步骤2)中,滤渣粉碎的粒度为0.01-0.3mm。
3)提取步骤2)得到的浓缩液,先其中加入4kg的c8固体吸附剂,缓慢搅拌1小时,静置分离,得到富集枸杞红素的固体吸附剂;用40℃的洗脱溶剂甲醇溶液将富含枸杞红素的固体吸附剂冲洗至ph为中性;
固体吸附剂与洗脱溶剂的质量体积比为1:15(m/v)。
4)向所述步骤3)获得的固体吸附剂中加入萃取溶剂缓慢震荡1-5小时,静置分离,除去固体吸附剂,所得溶剂浓缩干燥得到枸杞红素粗提取物总量为82克,通过液相分析测定,其中枸杞红素含量约为1.5g,枸杞红素的提取率约为58%,枸杞红素纯度约为1.83%。
- 还没有人留言评论。精彩留言会获得点赞!