一种与中枢神经衰老相关的乙酰化修饰CNP蛋白标记分子及其应用的制作方法
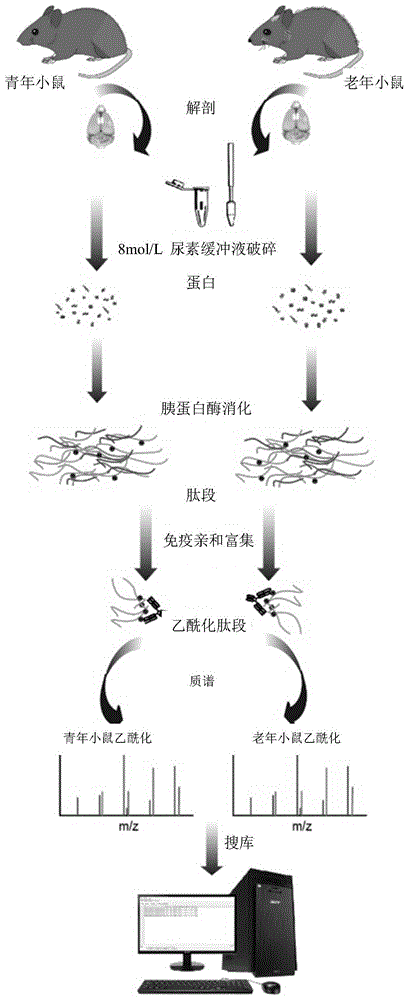
本发明属于分子诊断医学
技术领域:
,涉及一种与中枢神经衰老相关的乙酰化修饰cnp蛋白标记分子及其应用。
背景技术:
:衰老主要表现为个体生化和生理功能的随着年龄的减退,是癌症、肥胖和2型糖尿病等疾病的主要危险因素。随着社会卫生保健服务设施和系统的改善,儿童和孕产妇死亡率的降低,以及生活方式和生活水平的改善和提高等因素,目前人类的平均预期寿命已超过60岁。寿命的延长极大地影响了人口的结构,预计从2000年到2050年,全球60岁及以上的人口数量将从6.05亿增加到20亿(worldhealthorganization,“lifeexpectancyincreasedby5yearssince2000,buthealthinequalitiespersist,”http://www.who.int/mediacentre/news/releases/2016/healthinequalities-persist/en/.)。人口老龄化的增加将对社会和经济活动产生深远的影响。虽然我们无法抑制衰老的进程,但尽早发现衰老的发生并通过一定的干预或治疗以延缓衰老,将有助于降低衰老相关疾病的发病风险,提高老年的生活质量,并减少家庭和社会的负担。对于衰老的研究,目前一个亟需解决的问题是寻找可对衰老进行定量分析的标志物(burkle,grune,gonos,&bohr,2015),这也是评价抗衰老治疗效果所必需的。一般认为哺乳动物的衰老具有以下9个特征:基因组不稳定、端粒的损耗、表观遗传的变化、蛋白质稳定性的下降、对营养感知的失调、线粒体功能的障碍、细胞衰老、干细胞衰竭和细胞间通讯的改变(lópez-otín,blasco,partridge,serrano,&kroemer,2013)。目前发现的可以反映细胞衰老的标志物包括:组蛋白h2a.x(ser139)的磷酸化(也称为γ-h2a.x,dna损伤标志)、p16ink4a的表达的增加、laminb1表达的丧失、溶酶体内容物增加和溶酶体活性改变等。此外,衰老细胞的特征还有广泛的染色质重构,最显著的是衰老相关异染色质簇集(sahf)的形成(freund,laberge,demaria,&campisi,2012;lapak&burd,2014;nacarelli,liu,&zhang,2017;rogakou,boon,redon,&bonner,1999)。组织水平是衰老多数以代谢物的总体水平来确定,如总同型半胱氨酸(thcy),总胆固醇,极低、低、高密度脂蛋白密度脂蛋白,甘油三酯等(arnesenetal.,1995;cullen,2000;expertpanelondetection&treatmentofhighbloodcholesterolin,2001;grundyetal.,2004;manolioetal.,1992;verhoefetal.,1996)。部分中枢神经系统标志性蛋白也可以作为衰老标志物,比如β-淀粉样蛋白42(aβ42),总tau蛋白,磷酸化tau蛋白以及f-异前列烷(f2-iso)(blennow,vanmechelen,&hampel,2001;galaskoetal.,1998;kim,jung,paeng,kim,&chung,2004;poitouetal.,2005)等。蛋白质是生命活动的物质基础,蛋白质一级结构和折叠后高级结构的理化性质是蛋白质活性和稳定性的基础。蛋白质翻译后修饰(ptm)是通过依赖酶或不依赖酶的方式将特定的化学基团结合到氨基酸侧链,进而影响到蛋白质结构和功能。酶促的ptms包括磷酸化、糖基化、乙酰化、甲基化、sumoylation、棕榈酰化、生物素化、泛素化、硝化、氯化和氧化/还原。而非酶ptms包括糖基化、亚硝基化、氧化/还原、乙酰化和琥珀化(witze,old,resing,&ahn,2007)。人们很早就注意到衰老过程中蛋白质翻译后修饰的变化,发现随着年龄的增加,酶异常形式的积累与蛋白质的翻译后修饰,以及随着年龄的增加降解这些修饰的酶的逐渐丢失有关(stadtman,1988)。近年的研究也提示蛋白质翻译后修饰的变化以及一些共价修饰蛋白质的积累是生物衰老的标志(vanhoorenetal.,2015)。2015年欧洲科学家完成的“mark-age”项目中首次全面探讨了血清蛋白质的酶依赖和非酶依赖的翻译后糖基化修饰与衰老的关系(burkleetal.,2015)。除了糖基化,蛋白质的泛素化,甲基化和乙酰化修饰也可能与衰老相关(santos&lindner,2017)。因此对ptm修饰位点的准确分析将为早期诊断,预后,以及检测治疗的效果提供可能的标志物。技术实现要素:本发明的首要目的在于提供一种与中枢神经衰老相关的乙酰化修饰cnp蛋白标记分子。本发明的另一目的在于提供上述与中枢神经衰老相关的乙酰化修饰cnp蛋白标记分子的应用。为实现上述目的,本发明通过下述技术方案实现:一种与中枢神经衰老相关的乙酰化修饰cnp蛋白标记分子,是第177位赖氨酸和第401位赖氨酸经乙酰化修饰的cnp蛋白。所述的cnp蛋白的氨基酸序列如下:mntsftrkshtflpklffrkmsssgakekpelqfpflqdedtvatlhecktlfilrglpgsgkstlarlilekyhdgtkmvsadaykiipgsradfseaykrldedlagycrrdirvlvlekdflplyfgwfltkkssetlrkagqvfleelgnhkafkkelrhfisgdepkeklelvsyfgkrppgvlhcttkfcdygkaagaeeyaqqevvkrsygkafklsisalfvtpktagaqvvltdqelqlwpsdldkpsaseglppgsrahvtlgcaadvqpvqtgldlldilqqvkggsqg所述的与中枢神经衰老相关的乙酰化修饰cnp蛋白标记分子在细胞、组织、器官或个体衰老程度检测中的应用;优选包括如下步骤:(1)动物细胞或组织蛋白的提取、纯化和定量;(2)对纯化的蛋白进行酶解;(3)特异性抗体对乙酰化修饰肽段富集;(4)基于液相色谱质谱联用技术定量分析细胞或组织蛋白的乙酰化修饰;(5)通过定量分析结果评估细胞、组织、器官或个体的衰老程度。步骤(1)中所述的动物为哺乳动物。所述的哺乳动物包括鼠、人、猴和猩猩等。所述的鼠包括小鼠和大鼠。所述的小鼠优选为c57bl/6小鼠。所述的猴优选为食蟹猴。所述的猩猩优选为苏门答腊猩猩。步骤(1)中所述的组织优选为脑组织。步骤(1)中所述的定量的方法优选为bradford法。步骤(2)中所述的酶解优选采用fasp酶解方法实现。步骤(3)中所述的特异性抗体优选为抗乙酰赖氨酸抗体。步骤(3)中所述的富集优选通过免疫亲和沉淀实现。步骤(4)中所述的定量分析过程优选包括如下步骤:1)将富集的乙酰化修饰肽段重悬,进行分离;2)接着进行质谱鉴定,得到质谱原始数据;3)质谱原始数据通过maxquant软件进行搜库,从而获得肽段信息列表。步骤1)中所述的分离优选通过easynanolc1000系统进行。所述的分离条件优选如下:以a液和b液作为流动相,通过c18柱子(75μm×15cm,3μm)以500nl每分钟进行分离,分离梯度为:2分钟内1%b到3%b,接下来的8分钟内3%b到8%b,接下来的45分钟内8%b到20%b,接下来的12分钟内20%b到30%b,接下来的1分钟内30%b到90%b,然后稳定90%b7分钟;a液为0.1%(v/v)甲酸-乙腈(溶剂为乙腈,溶质为甲酸),b液为0.1%(v/v)甲酸-水(溶剂为水,溶质为甲酸),a液和b液总和为体积百分比100%。步骤2)中所述的质谱鉴定优选使用orbitrapfusionlumos质谱仪。步骤2)中所述的质谱鉴定的条件优选以dda的方式进行质谱鉴定。步骤3)中所述的搜库的参数如下:样本类型为standard,multiplicity为1;蛋白质消化酶为:trypsin;固定修饰:carbamidomethyl(c);可变修饰为acetyl(k),deamidation(n),deamidation(nq);最小肽段长度为6;肽段和蛋白的错配率(fdr)阈值都小于0.01;用于蛋白质定量肽段的可变修饰为oxidation(m),acetyl(proteinn-term),肽段为unique。步骤(5)中所述的评估的标准优选如下:所述的与中枢神经衰老相关的乙酰化修饰cnp蛋白标记分子的总乙酰化修饰上调程度和衰老程度呈正相关,即第177位赖氨酸和第401位赖氨酸经乙酰化修饰上调程度和衰老程度呈正相关。所述的与中枢神经衰老相关的乙酰化修饰cnp蛋白标记分子在制备预测衰老相关的退行性疾病的试剂盒中的应用。在所述的应用中,是通过确定生物样本中所述的标记分子的分子乙酰化修饰程度,来判断生物样本的衰老程度。所述的cnp蛋白标记分子的分子乙酰化修饰程度的确定,可以通过用于确定样本中相关分子表达水平以及蛋白质乙酰化水平的方法或设备实现。所述的与中枢神经衰老相关的乙酰化修饰cnp蛋白标记分子在制备预防和/或治疗衰老相关的退行性疾病的药物中的应用。该应用是将所述的与中枢神经衰老相关的乙酰化修饰cnp蛋白标记分子作为药物靶点进行应用。本发明相对于现有技术具有如下的优点及效果:本发明提供了一种衰老相关的生物标志物及检测方法,以cnp(2',3'-环状核苷酸3'-磷酸二酯酶)在衰老的小鼠脑中k177和k401位点的乙酰化修饰上调,作为细胞或者个体衰老检测的标志物。本发明为今后探索衰老的过程、衰老相关疾病的发生及抗衰老的研究提供一个有效的研究方法以及研究方向。附图说明图1为本发明的技术路线图。图2为质谱鉴定到的cnpk177和k401所在肽段lk(ac)pglek和gk(ac)pvpihgsr的二级谱图;其中,a为k177在样本y3肽段二级谱图;b为k177在样本o3中检测到的二级谱图;c为k401在y3样本检测到的二级谱图。图3为质谱鉴定结果中cnpk177和k401在不同组小鼠脑中乙酰化修饰的相对定量结果图;其中,a为相对定量结果;b为相应统计结果柱状图。图4为质谱鉴定到的cnpk177所在肽段lk(ac)pglek在每个样本中的离子流图以及峰面积统计结果图;其中,a为肽段lk(ac)pglek在每个样本中的离子流图;b为肽段lk(ac)pglek在每个样本中的对应的峰面积;c为b图统计结果柱状图。图5为质谱鉴定到的cnpk401所在肽段gk(ac)pvpihgsr在每个样本中的离子流图以及峰面积统计结果图;其中,a为肽段gk(ac)pvpihgsr在每个样本中的离子流图;b为肽段gk(ac)pvpihgsr在每个样本中的对应的峰面积;c为b图统计结果柱状图。图6为质谱鉴定到的cnp非乙酰化肽段ggsqgeavgelpr在每个样本中的离子流图以及峰面积统计结果图;其中,a为肽段ggsqgeavgelpr在每个样本中的离子流图;b为肽段ggsqgeavgelpr在每个样本中的对应的峰面积;c为b图统计结果柱状图。图7为不同组小鼠coip验证结果图;其中,a为免疫共沉淀及westernblot验证结果图;b为a图统计结果柱状图。具体实施方式下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。本发明的技术路线如图1所示。本发明实施例中涉及的试剂、配制方法如下:1mol/ltrishclph8.0溶液:12.11gtrisbase(tris-碱)溶于纯水,用浓盐酸调ph至8.0,超纯水定容至100毫升。4%水合氯醛:称取0.4g水合氯醛,用蒸馏水溶解,再用蒸馏水稀释到10毫升。8mol/l尿素缓冲液:称取48.048g尿素颗粒,加入5毫升浓度为1mol/l的trishcl(ph8.0)溶液,超纯水定容至100毫升。1mol/l二硫苏糖醇(dtt)溶液:称取二硫苏糖醇15.42g,加超纯水稀释成100ml,分成小份贮存于-20℃。1mol/l碘乙酰胺(iaa)溶液:称0.185giaa于1ml浓度为8mol/l尿素缓冲液中,至完全溶解。50mmol/lnh4hco3:称取2g碳酸氢铵,加超纯水定容至50ml。1×pbs:称取8gnacl、0.2gkcl、1.44gna2hpo4和0.24gkh2po4,溶于800ml蒸馏水中,用hcl调节溶液的ph值至7.4,最后加蒸馏水定容至1l即可。0.05%pbst:吸取0.5ml吐温-20,加1×pbs缓冲液定容至1l即可。1%乙腈,0.1%三氟乙酸溶液(v/v):在超纯水中按体积比添加乙腈和三氟乙酸后摇匀,终体积500ml。40%乙腈,0.1%三氟乙酸溶液(v/v):在超纯水中按体积比添加乙腈和三氟乙酸后摇匀,终体积500ml。netn缓冲液:50mmtris、1mmedta、100mmnacl、0.5%nonidetp-40(乙基苯基聚乙二醇),ph8.0。etn缓冲液:100mmnacl、1mmedta、50mmtris,ph8.0。实施例1质谱鉴定前样本准备1.c57bl/6小鼠脑蛋白提取1)c57bl/6小鼠(广州中医药大学实验动物中心)分组,包括三组青年小鼠组(y1组、y2组、y3组,鼠龄2个月)和三组老年小鼠组(o1组、o2组、o3组,鼠龄16个月);每组小鼠6只。2)每只小鼠按0.1ml/kg给予4%水合氯醛腹腔注射进行麻醉,解剖腹腔,暴露出心脏后,1×pbs缓冲液心脏灌流,脑组织解剖并称重;3)将脑组织置于8mol/l尿素缓冲液中(脑组织的终浓度为20mg/ml),玻璃匀浆器匀浆,得到脑组织匀浆液;4)将脑组织匀浆液超声裂解:功率30w,破碎10s,间隔10s,5个循环,得到脑组织裂解液;5)将脑组织裂解液于13000g离心30min,离心2次;取两次上清,混合;6)利用bradford法定量蛋白浓度(bradford蛋白浓度测定试剂盒购于碧云天,产品编号p0006;具体操作步骤按照说明书进行)。2.fasp酶解1)每组青年、老年小鼠分别取脑蛋白量2mg,加8mol/l尿素缓冲液至2ml(即调至脑蛋白浓度为1.0mg/ml),得到蛋白悬液;2)将蛋白悬液加入10kd4ml超滤管(millipore超滤离心管4ml/10kdultra-4,2mg脑蛋白量/管)中,超滤管套于15ml离心管中,4000g、24℃离心至管内上室(超滤管为上室)液体少于100μl;3)加1mol/ldtt溶液到上室,至dtt终浓度约为20mmol/l,震荡混匀,37℃空气浴1.5h,4000g、24℃离心至管内上室液体少于100μl;4)倒掉超滤管内下室液体,加浓度为1mol/l的iaa溶液到上室,至iaa终浓度约为0.1mol/l,震荡混匀,常温避光20min,离心,条件同上,至剩余液体小于50μl;5)上室蛋白用50mmol/lnh4hco3清洗,并置换溶液为50mmol/lnh4hco3后,按1:100的比例加入胰酶,即每管在2ml(原蛋白相同体积)50mmol/lnh4hco3中加入20μg胰酶;下室也加1ml50mmol/lnh4hco3;37℃,孵育16h后,换新的收集管收集离心后的液体,即为总肽段混合物,将肽段用冻干机抽干;6)肽段脱盐:将得到的干燥肽段溶解于相a(1%乙腈,0.1%三氟乙酸的溶液),上样到平衡好的4.6mmc18分析柱(agilent1200hplc)。1ml/min的相a冲洗10分钟以去除样本中的盐分和其他杂质,随后用1ml/min相b(40%乙腈,0.1%三氟乙酸溶液)洗脱5分钟并收集洗脱峰,收集后的洗脱液经冻干得到纯化后的肽段,用于下一步的免疫亲和沉淀。3.免疫亲和沉淀富集乙酰化肽段1)用移液枪吸取30μl抗体包被好的琼脂糖珠(泛乙酰化抗体偶联树脂,pananti-acetyllysineantibodyconjugatedagarosebeads,ptmbio,ptm-104)置于小滤管中并套在ep管上,用预冷的1×pbs缓冲液洗琼脂糖珠,然后500g离心15s,重复三次;2)将抽干的肽段用netn缓冲液溶解并加入洗好的琼脂糖珠中,滤管下面用塞子堵上,并用封口膜封好盖子,固定在旋转混合器上,4℃,旋转混匀过夜;3)第二天将孵育好的琼脂糖珠取出冰箱,取一干净ep管,去掉滤管下面的塞子,将液体离心到ep管中;在滤管中加入0.5mlnetn缓冲液,上下颠倒混匀,500g,离心15s,洗两次;在滤管中加入0.5mletn缓冲液,上下颠倒混匀,离心条件同上,洗两次;在滤管中加入0.5ml去离子水或超纯水,按上述步骤洗两次;在滤管中加入100μl洗脱缓冲液(elutionbuffer),上下颠倒1min,500g,离心15s,再重复两次,总共收集体积为300μl;4)将收集的液体抽干,并保存于-20℃,得到乙酰化肽段。实施例2lc-ms/ms鉴定及数据搜库1.lc-ms/ms鉴定1)富集后的肽段均不分级直接进行nanolc-ms/ms分析,以0.1%甲酸-乙腈(a)和0.1%甲酸-水(b)作为流动相,每个样品的肽段用质谱流动相a液重悬,通过easynanolc1000系统(sanjose,thermofisher),在c18柱子(75μm×15cm,3μm)以500nl每分钟进行分离;流通液线性梯度如表1所示:表1lc-ms/ms洗脱条件时间/min流速(nl/min)a%(v/v)b%(v/v)0:005009912:0050097310:0050092855:00500802067:00500703068:00500109075:0050010902)肽段使用orbitrapfusionlumos(bremen,thermofisher)质谱仪,以dda的方式进行质谱鉴定:扫描周期为3s,ms1母离子扫描范围为m/z350-1550,子离子扫描范围:从100m/z开始。其他参数设置如下:ms1和ms2分辨率分别设置为120k和30k;采用自动增益控制(agc),ms1和ms2分别为1e6和1e5;离子筛选窗口为四极杆,1.6m/z;碎裂模式:hcd,归一化碰撞能(nce)为32;动态排除时间为20s。质谱鉴定到的cnp第177和第401位赖氨酸所在肽段lk(ac)pglek和gk(ac)pvpihgsr的二级图谱如图2所示。肽段碎裂为不同b,y离子对后经质谱检测到不同质荷比的离子,符合该肽段的氨基酸组成的理论质量。2.质谱结果搜库质谱原始数据通过maxquant(1.6.3.3版本)软件对各组处理进行搜库,蛋白质序列数据库来自uniprotmusmusculus(小鼠),包含10090种蛋白质序列,搜库参数参照maxquant使用说明设置为:1)样本类型为standard,multiplicity为1;2)蛋白质消化酶为:trypsin;3)固定修饰:carbamidomethyl(c);4)可变修饰为acetyl(k),deamidation(n),deamidation(nq);5)最小肽段长度为6;6)肽段和蛋白的错配率(fdr)阈值都小于0.01;7)用于蛋白质定量的修饰肽段参数为oxidation(m),acetyl(proteinn-term),用于定量的肽段为unique,该结果作为蛋白质表达量的变化。实施例3cnp乙酰化水平增加的质谱结果maxquant搜库结果表格中,acetyl(k)sites.txt表格中每个位点强度值通过每个样本间总离子流强度进行校正,校正后的强度值作为每个样本中乙酰化位点的定量。同样的,proteingroups.txt表格中的每个蛋白强度值通过每个样本间总离子流强度进行校正,校正后的强度值作为每个样本中cnp蛋白表达量的定量值。使用graphpadprism软件统计cnp乙酰化位点强度差异倍数,以及蛋白表达差异倍数,t-tests检验相应p-value。同时,通过非乙酰化蛋白质的丰度变化校正乙酰化修饰的变化,以消除蛋白质表达量变化引起的乙酰化修饰的改变,结果如图3所示。乙酰化k177和k401所在肽段o比y比值分别为2.19和3.19(p<0.05),经蛋白丰度校正后k177和k401乙酰化修饰的o比y比值分别为2.57和3.7(p<0.05和p<0.01)。为了进一步分析cnp蛋白乙酰化k177和k401在o和y中表达的变化,采用xcalibur软件(thermoscientific)直接找出原始数据中cnpk177和k401乙酰化肽段的提取离子流图。图4和图5分别显示cnpk177和k401乙酰化的肽段在每个样本中的峰面积图,峰面积统计,以及柱状图,结果表明k177的乙酰化在o中修饰相对于y中是增加的(p<0.0001)。图6为cnp中的非乙酰化肽段ggsqgeavgelpr在每个样本中的峰图,相对y样本,非乙酰化肽段在o中是显著下调的(p<0.05)。实施例4免疫共沉淀(coip)验证质谱结果分别准备老年(o)和青年(y)小鼠脑蛋白样本160μg,用移液枪分别吸取20μl抗体包被好的琼脂糖珠(panptmantibodyconjugatedagarosebeads,lysineacetylation,ptmbio,ptm-104),pbs洗涤3次,加入样本蛋白后共同4℃旋转孵育过夜。第二天从冰箱取出,800g离心5分钟,弃上清,沉淀用0.05%pbst洗涤5次后,0.2%甲酸洗脱目的蛋白,离心后取上清,真空抽干后加入2×上样缓冲液沸水浴5分钟,使用抗cnp的一抗(cellsignalingtechnology,5664s)和小鼠igg的hrp二抗(cst,7076s)作westernblot分析。结果如图7所示,通过input的cnp分别校正o组和y组泛乙酰化抗体富集过的cnp条,结果显示cnp的乙酰化显著上调。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。序列表<110>暨南大学<120>一种与中枢神经衰老相关的乙酰化修饰cnp蛋白标记分子及其应用<160>1<170>siposequencelisting1.0<210>1<211>420<212>prt<213>小鼠(musmusculus)<220><223>cnp蛋白的氨基酸序列<400>1metasnthrserphethrarglysserhisthrpheleuprolysleu151015phephearglysmetserserserglyalalysglulysprogluleu202530glnphepropheleuglnaspgluaspthrvalalathrleuhisglu354045cyslysthrleupheileleuargglyleuproglyserglylysser505560thrleualaargleuileleuglulystyrhisaspglythrlysmet65707580valseralaaspalatyrlysileileproglyserargalaaspphe859095serglualatyrlysargleuaspgluaspleualaglytyrcysarg100105110argaspileargvalleuvalleuaspaspthrasnhisgluargglu115120125argleuaspglnleupheglumetalaaspglntyrglntyrglnval130135140valleuvalgluprolysthralatrpargleuaspcysalaglnleu145150155160lysglulysasnglntrpglnleuseralaaspaspleulyslysleu165170175lysproglyleuglulysasppheleuproleutyrpheglytrpphe180185190leuthrlyslyssersergluthrleuarglysalaglyglnvalphe195200205leuglugluleuglyasnhislysalaphelyslysgluleuarghis210215220pheileserglyaspgluprolysglulysleugluleuvalsertyr225230235240pheglylysargproproglyvalleuhiscysthrthrlysphecys245250255asptyrglylysalaalaglyalagluglutyralaglnglngluval260265270vallysargsertyrglylysalaphelysleuserileseralaleu275280285phevalthrprolysthralaglyalaglnvalvalleuthraspgln290295300gluleuglnleutrpproseraspleuasplysproseralaserglu305310315320glyleuproproglyserargalahisvalthrleuglycysalaala325330335aspvalglnprovalglnthrglyleuaspleuleuaspileleugln340345350glnvallysglyglyserglnglyglualavalglygluleuproarg355360365glylysleutyrserleuglylysglyargtrpmetleuserleuthr370375380lyslysmetgluvallysalailephethrglytyrtyrglylysgly385390395400lysprovalproilehisglyserarglysglyglyalametglnile405410415cysthrileile420当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1