一种具有高保湿功效的谷物源多糖的加工方法及其应用与流程
[0001]
本发明涉及一种具有高保湿功效的谷物源多糖的加工方法及其应用,属于天然产物深加工技术领域。
背景技术:
[0002]
天然保湿剂是指从天然材料中提取的具有吸湿保湿和营养双重性能且符合保湿剂要求的一类潜在材料。天然保湿剂的种类很多,按照来源分为多糖类和氨基酸类保湿剂。其中氨基酸天然保湿剂括蚕丝蛋白、水解胶原蛋白、植物蛋白、大豆蛋白等,此类保湿剂包含生物体所需的营养成分,但是来源成本较高。天然多糖类物质因其天然性、营养性、无毒性、无刺激性被广泛应用于保湿类材料的开发,因为多糖分子中的羟基、羧基和其他极性基团可与水分子形成氢键而结合大量的水分,而且,多糖分子链还相互交织成网状,加之与水的氢键结合,起到很强的保水作用,同时还具有良好的成膜性能,在物体表面形成一层均匀的薄膜,减少表面水分蒸发。
[0003]
当前,透明质酸、海藻酸钠、甲壳素、肝素等传统保湿剂已在食品、化妆及医药领域得到广泛应用,然而其生产过程中提取和纯化过程较为复杂,且这些产品吸湿性能显著保湿性能一般,因而,开发研究性能优异的多糖类保湿剂是材料学、食品科学、化妆品学、皮肤医学等领域的热门课题。从天然谷物物质中提取的具有营养和保湿双重性能的天然保湿剂符合保湿剂的发展趋势。鉴于来源和类型的差异影响了多糖的溶解性和可萃取性,因此,对于分离和提纯的过程提出了不同的要求。
[0004]
基于上述原因,提供一种具有高保湿功效的谷物源多糖加工方法及其应用对天然保湿材料发展具有重要意义。
技术实现要素:
[0005]
为了应对上述问题,本发明提供了一种基于谷物多糖的保湿剂及其加工方法和应用,本发明的加工方法避免了有机试剂的污染,具有适应工业化生产的特点。
[0006]
本发明的第一个目的是提供一种具有高保湿功效的谷物源多糖加工方法,所述方法包括如下步骤:
[0007]
(1)取适量的谷物颗粒于0-4℃粉碎,按1:5-1:7(w/v,g/ml)于水中均质,后离心处理并收集上清液,调节所得上清液ph至4.5-5.0并置于80-100℃加热处理20-60min,离心并收集上清液;
[0008]
(2)将步骤(1)所得上清液采用双膜连续分级,即先后通过截留孔径为0.1-0.5μm和10-30nm的滤膜进行纯化,收集第二级滤膜截留液,醇沉干燥处理;
[0009]
(3)将步骤(2)干燥后所得粉末溶于磷酸盐缓冲液,添加100-500u/g底物的表面切稀糖酶后在30-60℃反应0.1-4h,继续调节体系ph至7-12,添加占反应底物质量0.1-10%的电荷改性试剂反应2-12h,干燥即得谷物源多糖。
[0010]
在本发明的一种实施方式中,步骤(1)中所述的谷物包括玉米、水稻、高粱、大麦、
荞麦中任一种或上述的组合。
[0011]
在本发明的一种实施方式中,步骤(1)中,粉碎至80-120目。
[0012]
在本发明的一种实施方式中,所述均质压力为20-100mpa处理0.1-3h。
[0013]
在本发明的一种实施方式中,步骤(2)中所述双膜纯化分级为微滤膜和超滤膜串联系统。
[0014]
在本发明的一种实施方式中,所述滤膜包括醋酸纤维膜、聚氟乙烯膜、聚丙烯膜、聚砜膜等中的任一种,所述滤膜的形状包括平膜、卷膜、管状膜及中空纤维膜等中的任一种。
[0015]
在本发明的一种实施方式中,步骤(2)中,所述醇沉处理选用无水乙醇,添加量为3-10倍截留液的体积。
[0016]
在本发明的一种实施方式中,所述磷酸盐缓冲液的ph为5.0-7.0。
[0017]
在本发明的一种实施方式中,步骤(3)中,所述表面切稀糖酶包括α-淀粉酶、糖化酶、β-淀粉酶、普鲁兰酶、新普鲁兰酶、麦芽糖淀粉酶等中的任一种或上述的组合。
[0018]
在本发明的一种实施方式中,所述电荷修饰剂包括乙酸酐、琥珀酸酯、磷酸盐、氯乙酸、苯磺酰氯、三甲基氯化铵及上述物质的衍生物中的一种或多种。
[0019]
本发明的第二个目的是提供上述加工方法制备得到的谷物源多糖。
[0020]
在本发明的一种实施方式中,所述谷物源多糖的绝对分子量为1.0
×
10
7-2.5
×
107g/mol,多分散系数小于1.02,分散分子密度1200-1600g
·
mol-1
·
nm-3
,表面带电荷大小为-10至-30.0mv。
[0021]
本发明的第三个目的是提供上述谷物源多糖在高保湿材料中的应用。
[0022]
本发明的第四个目的是提供包含上述谷物源多糖的化妆品、食品或医药。
[0023]
与现有技术相比,本发明具有以下优点:
[0024]
1.本发明方法所使用的原料来源广泛,提取方法对环境友好,安全可靠,可精准控制谷物源多糖颗粒尺寸大小,且加工过程成本较低,适合工业化生产。
[0025]
2.本发明通过特异性糖酶和电荷修饰制备特定粒度分布的多糖粒子,同时在其表面引入官能基团,可以促进生物活性分子间的相互作用,从而拓宽应用范围。
[0026]
3.本发明所得到的多糖为植物性纳米粒子,具有良好的生物相容性,无皮肤刺激性,其保湿率能力优于传统保湿剂透明质酸(ha),锁水保湿功能,7天相对水保留率高于68%,且生产成本较低。此外,本发明制备得到的多糖纳米颗粒可以吸附其他活性分子,促进其他活性分子在水相中的溶解度和渗透性,在保湿配方中可以起到良好的协同作用。
附图说明
[0027]
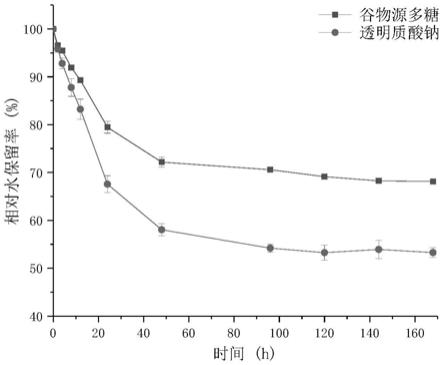
图1为本发明实施例1制备得到的谷物源多糖和透明质酸的在相对湿度(rh)43%环境中的保湿变化图。
具体实施方式
[0028]
下面结合实施例和附图,对本发明作进一步的详细说明,本发明的实施方式及其说明仅用于解释本发明,但不限定对本发明的范围。
[0029]
本发明根据以下方法对谷物源多糖的理化性质进行测定:
[0030]
分子量测定:称取多糖粉末配置成0.2%的溶液后向高效凝胶排阻色谱系统(hpsec)进样,其中以0.1mol/l的nano3溶液为流动相,流速设为0.6ml/min;多角度激光散射检测器中光源波长λ设定为632.8nm;多糖的折光指数增量d
n
/d
c
=0.138,并利用astra软件对色谱图中的单个色谱峰计算得到重均分子量m
w
,数均分子量m
n
及旋转半径r
z
,多分散系数分及散分子密度的计算如下:
[0031]
多分散系数=m
w
/m
n
;
[0032]
分散分子密度=m
w
/r
z3
。
[0033]
表面电位:称取多糖粉末配置成0.1%溶液,超声20min后取1ml加入电位池中。在室温条件下利用zeta电位/粒径仪测定颗粒表面的电位。
[0034]
多糖的相对水保留率测定:称取多糖粉末配置成1%溶液,在室温下放置于相对湿度(rh)43%的环境下持续干燥,在不同的时间间隔下取样称重,相对水保留率计算公式如下:
[0035]
相对水保留率%=(m
2-m0)/(m
1-m0)
×
100;
[0036]
式中其中m0是多糖的质量,m1是溶液的质量,m2是样品脱水一定时间后的质量。
[0037]
实施例1
[0038]
称取100g玉米粒于4℃低温粉碎至80目,溶于0.5l去离子水中进行均质(20mpa,1h)、离心处理,调节所得上清液ph至4.9并置于100℃加热处理30min,离心收集上清液;将上述步骤所得上清液采用双膜连续分级,先后通过截留尺寸为0.15um和20nm的滤膜进行纯化,收集第二级截留液,添加3倍体积乙醇,沉淀后干燥处理;取所得粉末溶于ph 6.0的磷酸盐缓冲液并配置成质量分数10%的溶液,添加200u/g底物的β-淀粉酶后在60℃反应2h,继续调节体系ph至11,添加底物质量百分比3%电荷改性试剂氯乙酸反应4h后,干燥即得粒径可控的玉米源多糖。
[0039]
通过上述检测方法测得玉米源多糖的绝对分子量1.89
×
107g/mol,多分散系数为1.01,分散分子密度为1381g
·
mol-1
·
nm-3
,表面zeta电位为-14.8mv。
[0040]
控制室温(25℃)和相对湿度43%(饱和碳酸钾溶液)的条件下,模拟干燥环境中此实施例制备得到的谷物源多糖的保湿能力,对照样品为市售透明质酸钠(化妆品级)。将上述样品干燥后分别配制成质量分数1%的水溶液,分别移取300mg于干燥的称量瓶中,涂抹均匀后敞口放置于相对湿度43%(饱和碳酸钾溶液)的干燥器中,于不同时间段取样称量,计算相对水保留率,每个样品作3组平行。
[0041]
如图1所示,本发明制备得到玉米源多糖在放置7天后,相对水保留率75%,明显高于透明质酸的55%。也就是说本发明制备得到的谷物源多糖的保湿率能力优于传统保湿剂透明质酸(ha),是一种优良的同时具有良好的生物相容性的保湿剂,可以用于日化用品以及食品和医药领域。
[0042]
实施例2
[0043]
称取100g玉米粒于4℃低温粉碎至120目,溶于0.5l去离子水中进行均质(100mpa,0.2h)、离心处理,调节所得上清液ph至4.9并置于100℃加热处理30min,离心收集上清液;将上述步骤所得上清液采用双膜连续分级,先后通过截留尺寸为0.2um和30nm的滤膜进行纯化,收集第二级截留液,添加6倍体积乙醇,沉淀后干燥处理;取所得粉末溶于ph 6.0的磷酸盐缓冲液并配置成质量分数10%的溶液,添加400u/g底物的β-淀粉酶后在60℃反应2h,
继续调节体系ph至11,添加质量百分比3%电荷改性试剂氯乙酸反应4h后干燥即得粒径可控的玉米源多糖。
[0044]
通过上述检测方法测得玉米源多糖的绝对分子量1.64
×
107g/mol,多分散系数为1.01,分散分子密度为1248g
·
mol-1
·
nm-3
,表面zeta电位为-12.2mv。
[0045]
按照实施例1的保湿能力的方法,发现,本实施例制备得到的玉米源多糖在放置7天后,相对水保留率79%。
[0046]
实施例3
[0047]
称取100g玉米粒于4℃低温粉碎至100目,溶于0.5l去离子水中进行均质(80mpa,1h)、离心处理,调节所得上清液ph至4.9并置于100℃加热处理30min,离心收集上清液;将上述步骤所得上清液采用双膜连续分级,先后通过截留尺寸为0.15um和20nm的滤膜进行纯化,收集第二级截留液,添加5倍体积乙醇,沉淀后醇沉干燥处理;取所得粉末溶于ph6.0的磷酸盐缓冲液并配置成质量分数10%的溶液,添加400u/g底物的β-淀粉酶后在60℃反应2h,继续调节体系ph至11,添加质量百分比5%电荷改性试剂氯乙酸反应4h后醇沉干燥即得粒径可控的玉米源多糖。
[0048]
通过上述检测方法测得玉米源多糖的绝对分子量1.71
×
107g/mol,多分散系数为1.01,分散分子密度为1394g
·
mol-1
·
nm-3
,表面zeta电位为-17.9mv。
[0049]
按照实施例1的保湿能力的方法,发现,本实施例制备得到的玉米源多糖在放置7天后,相对水保留率70%。
[0050]
实施例4
[0051]
称取100g水稻粒于4℃低温粉碎至80目,溶于0.6l去离子水中进行均质(20mpa,1h)、离心处理,调节所得上清液ph至4.6并置于80℃加热处理60min,离心收集上清液;将上述步骤所得上清液采用双膜连续分级,先后通过截留尺寸为0.15um和20nm的滤膜进行纯化,收集第二级截留液,添加3倍体积乙醇,沉淀后干燥处理;取所得粉末溶于ph 5.0的磷酸盐缓冲液并配置成质量分数10%的溶液,添加500u/g底物的新普鲁兰酶后在50℃反应4h,继续调节体系ph至8,添加质量百分比10%电荷改性试剂乙酸酐反应8h后干燥即得粒径可控的水稻源多糖。
[0052]
通过上述检测方法测得水稻源多糖的绝对分子量1.42
×
107g/mol,多分散系数为1.00,分散分子密度为1250g
·
mol-1
·
nm-3
,表面zeta电位为-27.6mv。
[0053]
按照实施例1的保湿能力的方法,发现,本实施例制备得到的水稻源多糖在放置7天后,相对水保留率79%。
[0054]
实施例5
[0055]
称取100g大麦粒于4℃低温粉碎至80目,溶于0.6l去离子水中进行均质(20mpa,1h)、离心处理,调节所得上清液ph至5.0并置于90℃加热处理30min,离心收集上清液;将上述步骤所得上清液采用双膜连续分级,先后通过截留尺寸为0.15um和20nm的滤膜进行纯化,收集第二级截留液,添加3倍体积乙醇,沉淀后干燥处理;取所得粉末溶于ph 7.0的磷酸盐缓冲液并配置成质量分数10%的溶液,添加200u/g底物的α-淀粉酶后在40℃反应3h,继续调节体系ph至8,添加质量百分比8%电荷改性试剂琥珀酸酯反应2h后,醇沉干燥即得粒径可控的大麦源多糖。
[0056]
通过上述检测方法测得大麦源多糖的绝对分子量1.61
×
107g/mol,多分散系数为
1.01,分散分子密度为1479g
·
mol-1
·
nm-3
,表面zeta电位为-20.5mv。
[0057]
按照实施例1的保湿能力的方法,发现,本实施例制备得到的大麦源多糖在放置7天后,相对水保留率71%。
[0058]
实施例6
[0059]
称取100g高粱粒于4℃低温粉碎至80目,溶于0.5l去离子水中进行均质(20mpa,1h)、离心处理,调节所得上清液ph至4.5并置于100℃加热处理30min,离心收集上清液;将上述步骤所得上清液采用双膜连续分级,先后通过截留尺寸为0.15um和20nm的滤膜进行纯化,收集第二级截留液,添加3倍体积乙醇,沉淀后干燥处理;取所得粉末溶于ph 7.0的磷酸盐缓冲液并配置成质量分数10%的溶液,添加200u/g底物的麦芽糖淀粉酶后在60℃反应2h,继续调节体系ph至8,添加质量百分比3%电荷改性试剂三甲基氯化铵反应4h后,醇沉干燥即得粒径可控的高粱源多糖。
[0060]
通过上述检测方法测得高粱源多糖的绝对分子量1.29
×
107g/mol,多分散系数为1.00,分散分子密度为1310g
·
mol-1
·
nm-3
,表面zeta电位为-16.4mv。
[0061]
按照实施例1的保湿能力的方法,发现,本实施例制备得到的高粱源多糖在放置7天后,相对水保留率78%。
[0062]
对比例1
[0063]
当实施例1中不添加电荷改性试剂、在其他条件不改变时获得玉米源多糖,经过测定其绝对分子量1.73
×
107g/mol,多分散系数为1.02,分散分子密度为1466g
·
mol-1
·
nm-3
,表面zeta电位为-3.2mv,7天后的相对水保留率22%。
[0064]
对比例2
[0065]
当实施例1中不采用表面切稀糖酶处理、在其他条件不改变时获得玉米源多糖,通过测定其绝对分子量2.49
×
107g/mol,多分散系数为1.03,分散分子密度为1592g
·
mol-1
·
nm-3
,表面zeta电位为-19.1mv,7天后的相对水保留率43%。
[0066]
对比例3
[0067]
当实施例1中不采用双膜连续分级处理、在其他条件不改变时获得玉米源多糖,通过测定其绝对分子量2.76
×
107g/mol,多分散系数为1.16,分散分子密度为1768g
·
mol-1
·
nm-3
,表面zeta电位为-13.1mv,7天后的相对水保留率37%。
[0068]
对比例4
[0069]
参照实施例1,将β-淀粉酶用量200u/g底物分别替换为20u/g底物、1000u/g底物,制得相应的玉米源多糖。所得玉米源多糖产品的性能结果见表1。
[0070]
表1不同表面切稀糖酶用量所得玉米源多糖结果
[0071]
β-淀粉酶用量(u/g底物)7天后的相对水保留率2042%100038%
[0072]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1