2-(烷基氨基甲酰基)肼-1-羧酸烷基酯或其相应的尿唑盐的制备的制作方法
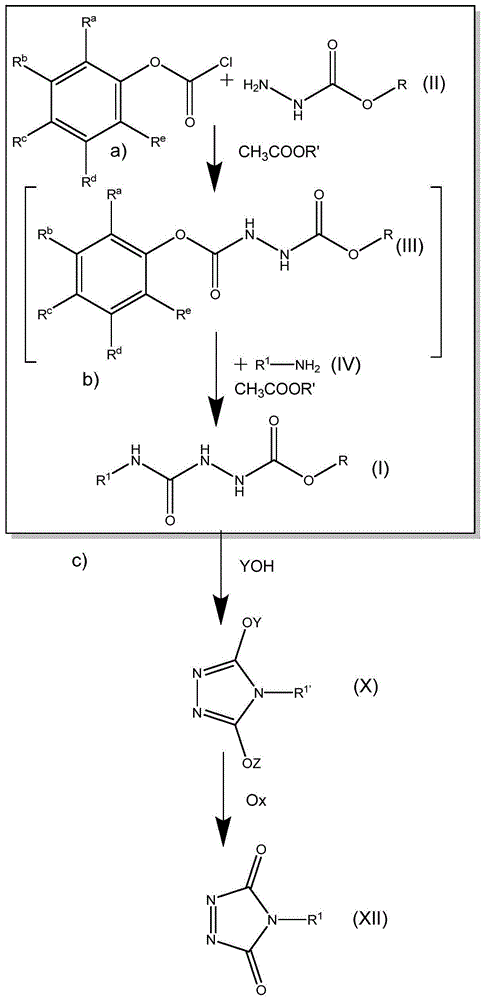
本发明涉及2-(烷基氨基甲酰基)肼-1-羧酸烷基酯或其相应的衍生物烷基-4h-1,2,4-三唑-3,5-二醇盐类化合物(尿唑盐类化合物)的制备。
背景技术:
:1,2,4-三唑啉-3,5-二酮类化合物或尿唑类化合物,分别可以通过不同的路线合成。breton等人的tetrahedronletters55(2014),4661-4663一方面公开了1,2,4-三唑啉-3,5-二酮类化合物或尿唑类化合物的反应途径,其包含氨基脲类化合物的环化,氨基脲类化合物是由肼基甲酸乙酯和异氰酸烷基酯类化合物合成的。另一方面,公开了替代性的反应途径。这个反应途径包括氨基脲类化合物的环化,其中氨基脲类化合物是由芳基肼-1,2-二羧酸乙酯在乙腈中合成的,其中芳基肼-1,2-二羧酸乙酯是由肼基甲酸乙酯和氯甲酸芳基酯在二氯甲烷中制备的。对于第一种选择,所提出的程序是不利的,因为异氰酸烷基酯类化合物是剧毒化合物。在第二种选择中,非常不利的是,从肼基甲酸乙酯开始到氨基脲的合成使用两种不同的溶剂,而且需要分离中间产物(肼-1,2-二羧酸乙基芳基酯类化合物(ethylarylhydrazine-1,2-dicarboxylates))。分离和使用不同的溶剂增加了劳动成本、时间成本和后处理成本。特别地,在使用不同的溶剂时,由于发生额外的分离过程,产生额外的成本,例如用于储罐、溶剂回收,并且所需产品的损失增加。技术实现要素:因此,本发明要解决的问题是提供一种新的、高效的、精益的分别合成氨基脲类化合物或尿唑盐类化合物或尿唑类化合物或1,2,4-三唑啉-3,5-二酮类化合物的方法。令人惊奇地,这个问题可以通过根据权利要求1中的方法解决,其中在步骤a)和步骤b)中使用相同的溶剂进行一锅反应,而不分离作为中间体形成的肼-1,2-二羧酸烷基芳基酯(alkylarylhydrazine-1,2-dicarboxylate)。还发现,相应的1,2,4-三唑啉-3,5-二酮类化合物可以直接从相应的尿唑盐类化合物合成。这允许生产方法中的效率进一步提高。本发明的进一步方面是进一步独立权利要求的主题。特别优选的实施例是从属权利要求的主题。附图简要说明图1示意性地显示了与本发明有关的各反应。具体实施方式在第一方面,本发明涉及在一锅反应中制造式(i)的化合物的方法,包括步骤a)a)将式(ii)的肼羧酸烷基酯与氯甲酸芳基酯反应,形成式(iii)的中间产物肼-1,2-二羧酸1-烷基2-芳基酯(1-alkyl2-arylhydrazine-1,2-dicarboxylate)随后进行步骤b)b)将式(iii)的中间产物肼-1,2-二羧酸1-烷基2-芳基酯与式(iv)的烷基胺反应,产生式(i)的化合物r1-nh2(iv)其特征在于步骤a)和步骤b)的反应在式ch3coor'的乙酸烷基酯溶剂中进行;并且没有分离式(iii)的中间产物肼-1,2-二羧酸1-烷基2-芳基酯;并且其中r和r'和r1彼此独立地代表甲基基团或乙基基团或丙基基团或丁基基团;并且其中ra、rb、rc、rd和re彼此独立地代表h或c1-4烷基基团。为清楚起见,本文中使用的一些术语定义如下:在本文中,"cx-y-烷基"基团是包括x至y个碳原子的烷基基团,即例如,c1-3-烷基基团是包括1至3个碳原子的烷基基团。该烷基基团可以是直链的或支链的。例如-ch(ch3)-ch2-ch3被认为是c4-烷基基团。因此,"丙基"可以是"正丙基"或"异丙基"。类似地,"丁基"可以是"正丁基"或"异丁基"或"仲丁基"或"叔丁基"。本文中的术语"彼此独立地"是指,在取代基、部分(moieties)或基团的上下文中,指定的取代基、部分或基团可以在同一分子中以不同的含义同时出现。在若干式中对符号或基团存在相同标记的情况下,在本文中,在一个特定式中对所述基团或符号的定义也适用于包含相同的所述标记的其他式。表述"制造方法"是"制备方法"或"制备工艺"的同义词,并且可以相互交换使用。在若干式中对符号或基团存在相同标记的情况下,在本文中,在一个特定式中对所述基团或符号的定义也适用于包含相同的所述标记的其他式。本发明的一个关键因素是,该方法是一锅式反应。已经令人惊奇地发现,这种包括步骤a)和步骤b)的反应在式ch3coor'的乙酸烷基酯溶剂中非常有效地进行,这允许整个方法可以作为一锅反应来实现,即没有必要分离式(iii)的中间产物,相应地对步骤a)和步骤b)来说所需的溶剂改变也是没有必要的。因此,所提出的制造方法不仅在经济方面,而且在生态方面都呈现显著的优势。所提出的解决方案的产率仍然显著地高。步骤a)在步骤a)中,式(ii)的肼羧酸烷基酯与氯甲酸芳基酯反应,形成式(iii)的中间产物肼-1,2-二羧酸1-烷基2-芳基酯。优选的是,ra、rb、rc、rd和re代表h或甲基或乙基,更优选h或甲基。优选的是,取代基ra、rb、rc、rd和re中不超过两个取代基代表c1-4-烷基基团。ra、rb、rc、rd和re的优选组合是:-ra=甲基或乙基,优选地甲基,rb=rc=rd=re=h-rb=甲基或乙基,优选地甲基,ra=rc=rd=re=h-rc=甲基或乙基,优选地甲基,且ra=rb=rd=re=h-ra=re=甲基或乙基,优选地甲基,rb=rc=rd=h-rb=rd=甲基或乙基,优选地甲基,ra=rc=re=h-ra=rb=rc=rd=re=h。在最优选的实施方式中,所有的取代基ra、rb、rc、rd和re都代表h,即优选的氯甲酸芳基酯是氯甲酸苯酯。氯甲酸苯酯可从不同供应商处商购获得。式(ii)的肼羧酸烷基酯(也称肼基甲酸烷基酯)包含取代基r。r代表甲基基团或乙基基团或丙基基团或丁基基团。在一个实施方式中,r优选地代表乙基基团或丙基基团或丁基基团,更优选地代表甲基基团、正丙基基团、异丙基基团、正丁基基团或异丁基基团或仲丁基基团。在另一个优选的实施方式中,r优选地代表乙基基团或丙基基团或丁基基团,最优选地代表乙基基团。式(ii)的肼羧酸烷基酯可从不同的供应商处商购获得。如上所述,反应步骤在溶剂为式ch3coor'的乙酸烷基酯中进行。由于r'代表甲基基团或乙基基团或异丙基基团或丁基基团,因此该溶剂选自乙酸甲酯、乙酸乙酯、乙酸正丙酯、乙酸异丙酯、乙酸正丁酯、乙酸异丁酯、乙酸仲丁酯和乙酸叔丁酯组成的组。这类溶剂与其他溶剂(例如乙腈或二氯甲烷)相比在生态毒理学上和工作安全性上非常有利。优选地,r'代表乙基基团或丙基基团或丁基基团,更优选地丁基基团或异丙基基团,甚至更优选地正丁基或异丙基基团。最优选地,r'代表正丁基基团。因此,优选的溶剂是乙酸正丁酯。式(ii)的肼羧酸烷基酯与氯甲酸芳基酯的摩尔比优选地在1.1:1和1:1.1的范围内,更优选地为1:1。优选的是,首先将肼羧酸烷基酯溶于式ch3coor'的乙酸烷基酯中,然后加入氯甲酸芳基酯。优选的是,缓慢地加入氯甲酸芳基酯,优选地在搅拌下加入。优选的是,步骤a)在碱的存在下进行。所述碱优选地在加入氯甲酸芳基酯之前加入到肼羧酸烷基酯中。优选地,所述碱是碱金属碳酸盐或碱土金属碳酸盐或碱金属碳酸氢盐或碱土金属碳酸氢盐,或乙酸的盐(乙酸钾),或脂族叔胺或脂环胺或含n的杂芳族化合物,如吡啶或吡咯或甲基吡啶或嘧啶。优选的脂族叔胺或脂环胺是三乙胺、三丙胺、三异丙胺、三丁胺或n,n-二异丙基乙胺。优选地,所述碱为碳酸钠或吡啶,特别地是吡啶。碱的量优选地选择为使其至少为氯甲酸芳基酯的摩尔量。更优选地,所述碱的量相对于氯甲酸芳基酯的摩尔量至少过量10%。作为步骤a)的结果,形成了式(iii)的中间产物肼-1,2-二羧酸1-烷基2-芳基酯。所述中间体在原则上是可以被分离的,但由于在本发明中这不是必要的,所以反应直接继续进行反应步骤b)。步骤b)在步骤b)中,将步骤a)中形成式(iii)的中间产物肼-1,2-二羧酸1-烷基2-芳基酯与式(iv)的烷基胺反应,产生式(i)的化合物。式(iv)的伯胺包含取代基r1。r1代表甲基基团或乙基基团或丙基基团或丁基基团。r1优选地代表甲基基团或乙基基团或丙基基团,优选地甲基基团或乙基基团或异丙基基团。式(iv)的伯胺与式(iii)的中间产物肼-1,2-二羧酸1-烷基2-芳基酯的摩尔比优选地在2.5:1和1:1之间,更优选在1.5:1和1:1之间的范围内。通常将式(iv)的烷基胺缓慢加入,优选地在搅拌下加入。反应步骤a)和反应步骤b)均在同一溶剂中进行,该溶剂为如上所述的式ch3coor'的乙酸烷基酯。反应步骤a)和反应步骤b)优选地在同一反应容器中进行。此外,步骤a)和步骤b)优选地在0℃和50℃之间的范围内,特别是在5℃和40℃之间的范围内的温度下进行。甚至更优选的是,步骤a)在5℃和30℃之间的范围内,最优选在5℃和25℃之间的范围内的温度下进行。甚至更优选的是,步骤b)在5℃和35℃之间的范围内,最优选在10℃和30℃之间的范围内的温度下进行。此外优选的是,步骤a)和/或步骤b)在环境压力下进行。进一步优选的是,r与r'不同,和/或r与r1不同。最优选的是,所有的取代基r、r'和r1彼此不同。优选的实施方式采用以下的r、r'和r1r的组合:-r=乙基,r1=甲基,r'=正丁基;-r=乙基,r1=甲基,r'=异丙基;-r=乙基,r1=乙基,r'=正丁基;-r=乙基,r1=乙基,r'=异丙基;-r=乙基,r1=异丙基,r'=正丁基;-r=乙基,r1=异丙基,r'=异丙基。式(i)的化合物是2-(烷基氨基甲酰基)肼-1-羧酸烷基酯(也称为氨基脲)。式(i)的化合物在进一步的反应中可以容易地转变形成式(x)的化合物。因此,在另一个方面,本发明还涉及制造式(x)的化合物的方法,包括步骤c)c)在yoh碱的存在下对式(i)的化合物进行环化,产生式(x)的化合物;其中y代表碱金属,z代表h或y;并且其中r和r1彼此独立地代表甲基基团或乙基基团或异丙基基团或丁基基团。式(x)的化合物是烷基尿唑盐。环化反应非常高效。当然,式(i)的化合物优选地如上所详述制备。优选的是,y为碱金属,优选地为k或na。优选地,y是na。步骤c)的反应优选地在有机溶剂(s)存在下进行,特别地是在乙醇的存在下。优选的是,有机溶剂是无水的。更优选地,步骤c)的反应在升高的温度下进行,特别地是在所述溶剂的回流温度下进行。在反应期间,式(x)的化合物通常是沉淀的,并且可以容易地过滤掉。yoh碱与式(i)的化合物的摩尔比优选地至少为1,通常至少为1.2。当将此比率从1显著增加时,二盐的量(即式(x),其中z°=y)显著增加。已经发现,式(x)的化合物可以被直接氧化成式(xii)的化合物(=4-烷基-1,2,4-三唑啉-3,5-二酮)。因此,在另一个方面,本发明涉及通过氧化剂(ox)直接氧化式(x)的化合物来制造式(xii)的化合物的方法。式(x)的化合物可以被直接氧化成式(xii)的化合物。在本文中,"直接"意思是指式(x)的化合物不需要先转化为相应的式(xi)的烷基尿唑类化合物(=4-烷基-1,2,4-三唑啉-3,5-二酮)。非常有利的是,盐可以被氧化剂(ox)直接氧化成式(xii)的化合物。式(xii)的化合物可作为亲双烯体用于diels-alder反应。图1示意性地显示了与本发明有关的各反应。在第一方面,示出了制造式(i)的化合物的方法,包含在溶剂ch3coor'中的反应步骤a)和反应步骤b),没有分离式(iii)的中间体。在另一个方面,示出了制造式(x)的化合物的方法,包括在yoh碱存在下的环化步骤c)。在另一个方面,示出了通过氧化式(x)的化合物制造式(xii)的化合物的方法。式(iii-a)的化合物和式(x-a)的化合物是新颖的化合物。因此,在另一个方面,本发明还涉及式(iii-a)的化合物,它是式(iii)的化合物的一种具体实施方式,其中r”代表ch3或ch2ch2ch3或ch(ch3)2或ch2ch2ch2ch3或ch2ch(ch3)2或ch(ch3)ch2ch3,并且其中ra、rb、rc、rd和re彼此独立地代表h或c1-4-烷基基团。在一个更进一步的方面,本发明还涉及式(x-a)的化合物,它是式(x)的化合物的一种具体实施方式,其中r1'代表甲基基团或乙基基团或丙基基团,优选地是甲基基团或乙基基团或异丙基基团,而且y代表碱金属,z代表h或y。式(iii-a)的化合物和(x-a)的化合物特别适合用于上文详细讨论的方法。实施例通过以下实验来进一步说明本发明。实施例a1.2-(甲基氨基甲酰基)肼-1-羧酸乙酯(式(i),r1=甲基,r=乙基),(r'=异丙基)的合成步骤a):肼-1,2-二羧酸1-乙基2-芳基酯(式(iii),r=乙基)的形成在500毫升圆底烧瓶中加入64.4克(0.61摩尔,1.0当量)肼基甲酸乙酯和156克乙酸异丙酯。溶解后加入76.4克(0.72摩尔,1.2当量)na2co3。将悬浮液冷却至10℃,然后在45分钟内加入96.1克(0.61摩尔,1.0当量)氯甲酸苯酯,将反应温度保持在10℃至20℃之间。加入后,形成co2。在25℃下继续搅拌2小时,直到转化率达到99%。加入600克水,搅拌15分钟后,排出下层水相。经鉴定,该产物为肼-1,2-二羧酸1-乙基-2-苯基酯。步骤b):2-(甲基氨基甲酰基)肼-1-羧酸乙酯(式(i),r1=甲基,r=乙基)的形成在没有任何分离肼-1,2-二羧酸1-乙基-2-苯基酯的情况下,向上述步骤a)制备的91.5克(0.97摩尔,1.6当量)肼-1,2-二羧酸1-乙基-2-苯基酯的有机相中,加入33%w/w在乙醇中的甲胺,将反应温度保持在低于25℃。约30分钟后,混合物变成淡黄色的悬浮液。在25℃下继续搅拌5小时,直到转化率达到99%。蒸馏出200克过量的甲胺、乙醇和乙酸异丙酯(40℃,75毫巴)。将反应混合物冷却至10℃,并将产物过滤。用冷的乙酸异丙酯(3次,每次26克)洗涤滤饼后,将产物干燥(80℃,1毫巴),得到78.0克2-(甲基氨基甲酰基)肼-1-羧酸乙酯(99%w/w,79%产率)。实施例a2-a32-(烷基氨基甲酰基)肼-1-羧酸乙酯(式(i),r=乙基)的合成在实施例a2-a3中,已按实施例a1中所述的相同方式在一锅反应中制备相应的式(i)的化合物。物质a2和a3已经确定。实施例r1r'a2乙基异丙基a3异丙基异丙基实施例a42-(甲基氨基甲酰基)肼-1-羧酸乙酯(式(i),r1=甲基,r=乙基)在乙酸正丁酯中的合成在实施例a4中,2-(甲基氨基甲酰基)肼-1-羧酸乙酯在如实施例a1中的一锅反应中制备,其中步骤a)和步骤b)中均使用乙酸正丁酯作为相应的溶剂。实施例r'a4正丁基发现,实施例a4中制备的2-(甲基氨基甲酰基)肼-1-羧酸乙酯与实施例a1中制备的相同。实施例b15-羟基-4-甲基-4h-1,2,4-三唑-3-油酸钠(甲基尿唑单钠盐)的合成(式(x),r1=甲基,y=na,z=h)步骤c):在250毫升圆底烧瓶中加入9.0克(0.23摩尔,1.2当量)固体naoh和103克无水甲醇。溶解后,加入30.0克(0.19摩尔,1.0当量)如实施例a1中所制备的2-(甲基氨基甲酰基)肼-1-羧酸乙酯,并且再次加入16克甲醇。将反应混合物回流3.5小时,直到转化率达到99%。将淡黄色的悬浮液冷却至5℃,并过滤产物。用冷甲醇(2次,每次24克)洗涤滤饼后,将产物干燥(40℃,1毫巴),得到21.9克甲基尿唑单钠盐(98.5%w/w,83%收率),已通过nmr表征:1h-nmr(300mhz,d2o):δ(ppm)=3.01(s,3h)13c-nmr(75mhz,d2o):δ(ppm)=24.9,157.7。实施例b2-b35-羟基-4-烷基-4h-1,2,4-三唑-3-油酸钠(烷基尿唑单钠盐)(式(x),y=na,z=h)的合成在实施例b2-b3中,以如实施例a2-a3中所制备的2-(烷基氨基甲酰基)肼-1-羧酸乙酯类化合物为基础,已按实施例b1中所述的相同方式制备相应的式(x)的化合物。这些物质已通过nmr鉴定和表征。实施例r1b2乙基b3异丙基表征b2:1h-nmr(300mhz,d2o):δ(ppm)=1.17(t,3h,j=7.25hz),3.50(q,2h,j=7.25hz)13c-nmr(75mhz,d2o):δ(ppm)=13.3,33.8,156.5。b3:1h-nmr(300mhz,d2o):δ(ppm)=1.40(d,6h,j=6.99hz),4.16(h,1h,j=6.99hz)13c-nmr(75mhz,d2o):δ(ppm)=19.3,43.5,156.5。实施例c2-c3直接氧化合成4-烷基-3h-1,2,4-三唑-3,5(4h)-二酮(=4-烷基-1,2,4-三唑啉-3,5-二酮)将5-羟基-4-甲基-4h-1,2,4-三唑-3-油酸钠(275毫克,1.70毫摩尔)(b1)悬浮在乙酸乙酯(3.9毫升)中。缓慢加入hcl的乙酸乙酯溶液(3.8毫升,3.8毫摩尔,1m)。在10分钟内滴加1,3,5-三氯-1,3,5-三嗪烷-2,4,6-三酮(125毫克,0.54毫摩尔)的乙酸乙酯(1.7毫升)溶液中。白色悬浮液立即变成粉红色,并搅拌30分钟。将悬浮液过滤,并用乙酸乙酯(2.5毫升)洗涤滤饼。在烧瓶中,在氩气下,将5-羟基-4-乙基-4h-1,2,4-三唑-3-油酸钠(1.25克,6.76毫摩尔)(b2)悬浮在乙酸乙酯(26.1毫升)中,并缓慢加入hcl的乙酸乙酯溶液(7毫升,7毫摩尔,1m)。在10分钟内滴加1,3,5-三氯-1,3,5-三嗪烷-2,4,6-三酮(0.61克,2.37毫摩尔)的乙酸乙酯(1.7毫升)溶液。白色悬浮液立即变成粉红色,并搅拌30分钟。在烧瓶中,在氩气下,将5-羟基-4-异丙基-4h-1,2,4-三唑-3-油酸钠(1.58克,6.63毫摩尔)(b3)悬浮在乙酸乙酯(26.1毫升)中,并缓慢加入hcl的乙酸乙酯溶液(7毫升,7毫摩尔,1m)。在10分钟内滴加1,3,5-三氯-1,3,5-三嗪烷-2,4,6-三酮(0.60克,2.32毫摩尔)的乙酸乙酯(1.7毫升)溶液。白色悬浮液立即变成粉红色,并搅拌30分钟。定量地进行氧化,并且通过nmr和ms鉴定产物(c1、c2和c3)。表1.直接氧化式(x)的化合物为相应的式(xii)的化合物。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1