一种抗新型冠状病毒药物筛选与评价模型的建立方法及应用
1.本发明涉及生物医药技术领域,尤其涉及一种抗新型冠状病毒药物筛选与评价模型的建立方法及应用。
背景技术:
2.新冠肺炎是由新型冠状病毒(sars
‑
cov
‑
2)感染引起的传染性疾病,自2019年以来全球蔓延愈演愈烈,至今尚无经临床验证的特效治疗药物批准上市。研发安全有效的抗sars
‑
cov
‑
2创新药物需求十分迫切,但缺乏可靠的活性筛选急需的针对病毒感染特异机制的细胞模型。
3.目前,常用的抗sars
‑
cov
‑
2药物的体外筛选及评价方法,主要是通过建立病毒体外感染细胞体系来评价药物的抗病毒作用,即通过分离sars
‑
cov
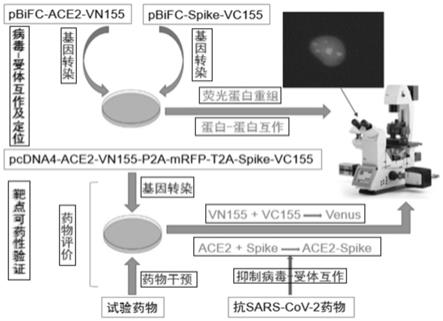
‑
2活病毒,在体外感染培养的vero
‑
e6细胞来实现。首先,培养vero
‑
e6细胞,分离sars
‑
cov
‑
2,采用病毒稀释液吸附细胞,观察细胞病变,计算病毒半数感染剂量(tcid
50
)。然后采用相应剂量(tcid
50
)的病毒感染细胞,再加入最大无毒浓度的试验药物进行干预。由于sars
‑
cov
‑
2感染vero
‑
e6细胞后可形成空斑病变,最后通过计算药物对病毒的半数抑制浓度(ic
50
)和治疗指数(ti),来评价药物的抗sars
‑
cov
‑
2作用。而鉴于sars
‑
cov
‑
2极强的传染能力,出于对研究人员的保护,国家规定使用sars
‑
cov
‑
2活病毒,必须在高级别生物安全实验室(p3实验室)进行,但p3实验室建设和运行成本极高,而绝大多数医疗和研究单位都没有p3实验室,无法开展涉及sars
‑
cov
‑
2活病毒分离、培养和保存等相关研究工作,给直接采用活病毒感染细胞开展药物活性筛选带来极大障碍和风险。因此,建立适于普通实验室的抗sars
‑
cov
‑
2药物筛选细胞模型意义重大。
4.虽然有关sars
‑
cov
‑
2假病毒开展抗sars
‑
cov
‑
2的研究已有报道,但假病毒的感染和复制过程不能完全体现活病毒的特性,故利用假病毒系统进行药物筛选更易出现假阳性,经假病毒筛选后的活性化合物仍需使用活病毒确证。鉴于假病毒技术仍存在诸多不足,针对sars
‑
cov
‑
2感染的关键分子机制建立新的体外筛选模型仍十分必要。
5.在sars
‑
cov
‑
2跨膜进入宿主细胞,以及在宿主细胞内转录翻译、新病毒体组装、释放过程中的关键蛋白和环节,理论上均可作为抗sars
‑
cov
‑
2药物作用的靶点,但阻止病毒进入宿主细胞的环节是抗病毒最优质的作用靶点。阻断sars
‑
cov
‑
2通过内吞作用进入宿主细胞的过程所涉及的药物靶点主要有来自宿主的ace2受体以及来自sars cov
‑
2的spike蛋白。针对sars
‑
cov
‑
2进入宿主细胞所必须的spike蛋白与ace2受体蛋白的相互作用,建立病毒与宿主细胞相互作用的评价模型用于抗sars
‑
cov
‑
2药物筛选与验证,对加快抗sars
‑
cov
‑
2新药研发的进程具有重大意义。
技术实现要素:
6.鉴于上述现有技术中存在的缺陷,本发明基于新型冠状病毒(sars
‑
cov
‑
2)spike蛋白与宿主细胞ace2受体相互作用是病毒感染细胞的关键环节和抗sars
‑
cov
‑
2药物的关
键靶点,利用荧光蛋白重组特性,建立了适于普通实验室开展的抗sars
‑
cov
‑
2药物筛选与评价的新模型,因此,本发明的目的是提出一种抗新型冠状病毒药物筛选与评价模型的建立方法及应用,解决直接采用活病毒感染细胞开展药物活性筛选带来障碍和风险的问题。
7.为了实现上述目的,本发明采用了如下技术方案:
8.一种抗新型冠状病毒药物筛选与评价模型的建立方法,以新型冠状病毒spike蛋白与ace2受体相互作用为靶点构建的体外药物筛选与评价模型。
9.进一步的,所用的载体构建方法为双分子荧光互补技术。
10.进一步的,将新型冠状病毒的spike蛋白基因,人ace2基因,以及荧光蛋白venus的两个非荧光互补片段构建在单一载体或不同载体上转染细胞。
11.进一步的,1)采用pcdna4
‑
to质粒,利用2a多肽的自我切割特性,并以mrfp作为表达对照,将人ace2基因、新型冠状病毒的spike蛋白基因,以及荧光蛋白venus的两个非荧光互补片段vn155和vc155,构建在单一载体上,构建载体pcdna
‑
ace2
‑
vn155
‑
p2a
‑
mrfp
‑
t2a
‑
spike
‑
vc155,基因序列如seq id no.1所示;
12.2)培养的vero
‑
e6细胞贴壁后,将构建的野生型和突变型载体分别转染细胞,根据待测药物的性质及作用机制采用转染前预防给药或转染后药物干预的给药方式处理细胞,同时设立空载体对照、溶剂对照和未处理细胞对照;
13.3)处理后不同时间,分别用荧光显微镜分析各组细胞的荧光信号强度及蛋白相互作用的亚细胞定位;
14.4)完成荧光信号强度及蛋白相互作用的亚细胞定位分析后,收集转染细胞检测ace2和spike的基因和蛋白表达水平,分析药物干预对转染细胞ace2和spike表达的影响。
15.进一步的,用rt
‑
pcr法检测ace2和spike mrna表达水平;用western blotting法检测ace2和spike蛋白表达水平。
16.上述任意一种抗新型冠状病毒药物筛选与评价模型的建立方法,在抗新型冠状病毒药物筛选与评价中的应用。
17.本发明的突出效果为:
18.本发明是基于荧光蛋白venus的两个非荧光互补片段vn155和vc155重新组合形成荧光蛋白发出荧光信号,并利用2a多肽自我切割特性实现多基因同时表达,来检测新型冠状病毒spike蛋白与ace2受体的结合效应,可用于能切断新型冠状病毒吸附并感染人体细胞的抗sars
‑
cov
‑
2药物的筛选与临床前药效评价。本发明具有简单、快速、微量、直观的优点,结果重现性好,特异性强、灵敏度高,干扰因素少,不易出现假阳性和假阴性,适用于抗sars
‑
cov
‑
2新药研发。
附图说明
19.图1为本发明的新型冠状病毒(sars
‑
cov
‑
2)spike蛋白与宿主细胞ace2受体相互作用及荧光蛋白重组原理图;
20.图2为本发明实施例的方法流程图。
具体实施方式
21.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完
整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
22.实施例:
23.主要材料:
24.1、vero
‑
e6细胞、感受态细胞dh5a。
25.2、dmem培养基(gibco)、pcdna4
‑
to质粒、dna提取试剂盒(omega)、pcr纯化试剂盒(vazyme)、plasmid maxi kit(omega)、dntps、高保真pfu聚合酶、2000转染试剂(sigma)、t7连接酶(thermo fisher)、rnase(invitrogen)、核酸参考marker(thermo fisher)、蛋白marker(amresco);hindiii、bamhⅰ、xbai、nehⅰ内切酶(invitrogen
tm
);过硫酸铵(aps)(sigma)、四甲基乙二胺(temed)(sigma)、β
‑
巯基乙醇(gibco)、ace2和spike表达检测试剂等。
26.3、仪器:
27.1)倒置荧光显微镜。
28.2)其它常规分子生物学研究设备。
29.本实施例的操作流程如图2所示,包括:
30.一、验证sars
‑
cov
‑
2的spike蛋白与人ace2受体的结合作用
31.1、vero
‑
e6细胞培养:
32.采用含10%的胎牛血清的dmem培养基,在含5%二氧化碳的37℃下的培养箱中培养,待细胞长成单层后即可应用。
33.2、pcdna
‑
ace2
‑
vn155
‑
p2a
‑
mrfp
‑
t2a
‑
spike
‑
vc155载体构建:
34.采用pcdna4
‑
to质粒,利用2a多肽的自我切割特性,并以mrfp作为表达对照,将人ace2基因、spike基因,以及荧光蛋白venus的两个非荧光互补片段vn155和vc155,构建在同时表达多个基因的单一载体上,即pcdna
‑
ace2
‑
vn155
‑
p2a
‑
mrfp
‑
t2a
‑
spike
‑
vc155(基因序列如seq id no.1所示)。同时,在该载体基础上,构建表达spike蛋白突变体基因的载体转染vero
‑
e6细胞作为阴性对照。
35.3、spike蛋白与ace2受体互作的验证:
36.培养在96孔板里的vero
‑
e6细胞贴壁后,将构建的野生型和突变型载体分别转染细胞,同时设立空载体对照和未处理细胞对照。转染24和48小时后,分别用荧光显微镜及其软件分析各组细胞的荧光强度和位置。通过观察荧光的强度及位置,可以了解并验证人ace2受体与新冠病毒spike蛋白的互作情况及其亚细胞定位。
37.4、结果判定:
38.如图1所示,若ace2受体与spike蛋白发生相互作用,则引起荧光蛋白venus的两个非荧光互补片段vn155和vc155重新组合形成荧光蛋白,并发出通过荧光显微镜可以检测到的荧光。通过显微镜观察到荧光,可以证明ace2受体与spike蛋白间发生了相互作用;通过观察细胞里荧光出现的位置(如细胞核、细胞质、细胞膜),可以判断细胞中ace2受体表达的区域,从而实现亚细胞定位。
39.二、抗sars
‑
cov
‑
2药物活性筛选及评价方法
40.1、vero
‑
e6细胞培养:
41.采用含10%的胎牛血清的dmem培养基,在含5%二氧化碳的37℃下的培养箱中培养,待细胞长成单层后即可应用。
42.2、pcdna
‑
ace2
‑
vn155
‑
p2a
‑
mrfp
‑
t2a
‑
spike
‑
vc155载体构建:
43.采用pcdna4
‑
to质粒,利用2a多肽的自我切割特性,并以mrfp作为表达对照,将人ace2基因、spike基因,以及荧光蛋白venus的两个非荧光互补片段vn155和vc155,构建在同时表达多个基因的单一载体上,即pcdna
‑
ace2
‑
vn155
‑
p2a
‑
mrfp
‑
t2a
‑
spike
‑
vc155(基因序列如seq id no.1所示)。同时,在该载体基础上,构建表达spike蛋白突变体基因的载体转染vero
‑
e6细胞作为阴性对照。
44.3、抗sars
‑
cov
‑
2药物活性筛选:
45.1)根据待测药物的性质及作用机制可采用不同的给药方式(a)或(b):
46.(a)转染前预防给药:当dmem培养基中的vero
‑
e6细胞贴壁后,先用不同浓度试验药物预处理细胞24小时,然后将构建的野生型和突变型载体分别转染细胞,同时设立空载体对照、溶剂对照和未处理细胞对照。转染24、48和72小时后,分别用荧光显微镜及其相关软件分析各组细胞的荧光信号强度及亚细胞位置。
47.(b)转染后药物干预:当dmem培养基中的vero
‑
e6细胞贴壁后,将构建的野生型和突变型载体分别转染细胞,转染后用不同浓度试验药物处理细胞24小时。药物处理后24、48和72小时,分别用荧光显微镜及其相关软件分析各组细胞的荧光信号强度及亚细胞位置。同时设立空载体对照、溶剂对照和未处理细胞对照。
48.2)完成荧光信号强度及蛋白互作的亚细胞定位分析后,收集转染细胞用rt
‑
pcr法检测ace2和spike mrna表达水平;用western blotting法检测ace2和spike蛋白表达水平,分析试验药物干预对转染细胞ace2和spike表达的影响。
49.4、结果判定:
50.由于试验药物对细胞的处理会影响ace2与spike蛋白互作,通过检测荧光的有无、强度及位置,可了解试验药物对ace2与spike蛋白结合的干预情况。结合ace2和spike的基因和蛋白表达水平,综合评价试验药物的抗sars
‑
cov
‑
2活性。
51.以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1