一次性检测多基因的五色FISH探针系统及方法与流程
文档序号:27492898发布日期:2021-11-22 15:07阅读:2217来源:国知局
导航: X技术> 最新专利>有机化合物处理,合成应用技术
一次性检测多基因的五色fish探针系统及方法
技术领域
1.本发明属于生物技术领域,具体涉及一次性检测多基因的五色fish探针系统及方法。
背景技术:
2.肺癌高居我国恶性肿瘤病死率的首位,肺癌从组织病理学上可以分为小细胞肺癌(small cell lung cancer,sclc)和非小细胞肺癌(non
‑
small cell lung cancer,nsclc)两大类,其中非小细胞肺癌约占肺癌总病例的85%。在我国肺癌患者5年的生存率仅为13%。nsclc尤其是肺腺癌如果未能行高灵敏度的基因变异检测,将丧失精准靶向治疗的机会,严重影响患者的生存期以及生活质量。
3.目前,化疗和放疗仍然是nsclc治疗的主要手段之一。在过去的几十年里,虽然科学家们不断地探索nsclc化疗方案和放疗技术,但取得的成果仍不能令人满意,疗效未能明显提高,且会出现一些比较严重的不良反应,如恶心、呕吐等胃肠道反应,骨髓抑制以及放射性肺炎等,影响患者的生活质量,甚至导致治疗的中断。传统的细胞毒性化学药物可比作是“杀敌一千,自损八百”,因而许多患者对此是谈之色变。
4.近年来,随着分子生物学技术的发展,肺癌特异性分子靶向治疗已经成为新的重要治疗方式之一。所谓靶向治疗,是指在精准分子诊断的基础上,利用肺癌细胞和正常细胞之间存在的差异,通过基因或分子的选择,有针对性地抑制恶性肿瘤细胞生长和增殖,达到治疗目的,同时又几乎不影响正常细胞。由于分子靶向药物特异性作用于肿瘤的特定位点,能够有选择性地杀死肿瘤细胞,副作用小,极大地改善了nsclc患者的生存和预后。
5.研究表明,约50%nsclc的发生是由于一系列的驱动基因所致。目前研究较为成熟且应用于临床的主要有两个作用点,一个是血管内皮生长因子受体(vascular endothelial growth factor receptor,vegfr),另一个为表皮生长因子受体(epidermal growth factor receptor,egfr)。随着分子遗传学研究以及分子检测技术的飞速发展,人们慢慢认识到越来越多的新的nsclc相关驱动基因,包括:热点基因间变性淋巴瘤激酶(anaplastic lymphoma kinase,alk)、ros1、间质表皮转化因子(cellular
‑
mesenchymal to epithelial transition factor,c
‑
met)和ret等。
6.alk基因最初是在间变性t细胞淋巴瘤和炎性成纤维细胞瘤中被发现。2007年,emla
‑
alk融合基因首次被发现存在于部分nsclc中,并被证实是nsclc发生发展过程中独立而又关键的分子靶点,在nsclc中的发生率约为5%。eml4和alk两个基因分别位于人类2号染色体的p21和p23带,相隔约12mb。eml4基因位于2p21区(chr2:42,308,141
‑
42,471,339),基因长度为163kb。alk基因位于2p23区(chr2:29,327,291
‑
30,056,128),基因长度为728kb。这两个基因片段的倒位融合,即inv(2)(p21p23)能够使得组织表达新的eml4
‑
alk融合蛋白。融合后的eml4启动子位于alk酪氨酸激酶的上游,从而使融合基因活化,表达eml4
‑
alk融合蛋白。通过eml4胞外结构形成的二聚体使alk受体持续磷酸化,进而持续激活下游的细胞信号通路。
7.ros1是一种跨膜的受体酪氨酸激酶基因,ros1融合首先发现于恶性胶质瘤中,其融合突变发生于6号染色体q22区。ros1融合包含一个完整的酪氨酸激酶区域,其融合突变会导致细胞下游信号通路的激活,从而影响细胞的生长、增殖和分化。研究显示,ros1染色体的重排可以激活ros1激酶活性,约有1
‑
2%的nsclc患者携带重组基因。
8.met即原癌基因c
‑
met,原癌基因c
‑
met被认为是继egfr基因突变和alk基因融合之后,nsclc又一个重要的驱动基因。原癌基因c
‑
met位于人类7号染色体长臂(7q31),编码的met广泛表达于肺、肝、肾、胎盘、消化道等多种人类上皮组织,属ii型酪氨酸激酶受体。met与其配体肝细胞生长因子(hepatocyte growth factor,hgf)结合,引起受体酪氨酸磷酸化并通过pi3k和akt、stat3或者ras和mapk激活下游信号通路。在人类实体瘤和血液恶性肿瘤中,包括胃癌、头颈癌、肝癌、卵巢癌、nsclc和甲状腺癌,这条信号通路是最常发生异常的信号通路之一。
9.ret(ret proto
‑
oncogene)即ret原癌基因,它由6615个腺嘌呤、8233个胞嘧啶、8744个鸟嘌呤、6815个胸腺嘧啶组成。ret原癌基因位于10号常染色体长臂(l0qll.2),全长60kb,包含21个外显子,编码1100个氨基酸的酪氨酸激酶受体超家族ret蛋白。最近的研究表明:ret原癌基因能与多种基因发生融合,从而逃脱受体结合配体的调控,进行自我磷酸化、自动传导信号,引发肿瘤生成。nsclc的ret重排的频率为1%左右。
10.目前,针对alk、ros1、met和ret重排或扩增,均有成熟的靶向药物可以应用,可改善上述驱动基因nsclc患者的预后。例如,以crizotinib(克唑替尼,pfizer)为代表的药物是针对eml4
‑
alk基因融合突变开发的小分子靶向药物,通过抑制alk酪氨酸激酶区域的活性,阻断其下游异常信号通路,从而抑制肿瘤细胞的生长。临床研究表明crizotinib对eml4
‑
alk融合突变患者的有效率可达60%以上,而对野生型的患者几乎没有疗效。再例如,vandetanib(凡德他尼)、pralsetinib和selpercatinib等靶向药物能抑制ret基因在内的多种受体酪氨酸激酶的活性,杀伤携带ret融合基因的细胞。
11.检测alk、ros1、ret和met重排或扩增状态是指导靶向药物用药的前提。因此,通过高灵敏的检测方法检测融合基因,对于提高nsclc尤其肺腺癌患者的生存率,延长生存期,提高生活质量有着重要意义。
12.目前,临床上用于检测基因重排、融合等突变类型的金标准是荧光原位杂交技术(fluorescence in situ hybridization,fish)。fish是在20世纪80年代末在放射性原位杂交技术的基础上发展起来的一种非放射性分子细胞遗传技术。利用特定核酸经荧光素标记后作为探针,与靶dna进行杂交后,再通过荧光显微镜直接以单个细胞为观察对象进行计数,可以在36小时内实现对待测染色体片段的定性、定量和定位分析。
13.虽然fish专业性强,但将fish技术用于检测多个nsclc驱动基因仍然面临以下问题:首先,由于fish是在细胞层面上进行病理学的分析,而通常大多数nsclc确诊时已处于晚期,其基因检测标本大多为肺穿刺活检标本,肺穿刺石蜡组织标本经过几轮切片如常规he、免疫组化、egfr突变等检测,所剩活检组织往往较少,往往不能满足逐个筛查的需要;其次,目前大多常规的fish每次只能检测一个基因的融合或扩增,检测通量低,对于多个热点基因,只能运用fish技术连续、逐一检测每个驱动基因,会导致工作效率低下,等待检测结果时间长;最后,由于fish检测价格相对较高,目前采取的分次检测多个融合基因,对于患者来说存在一定的经济压力。
14.例如,目前,ros1基因、alk基因、ret基因和met基因,是分别的4支探针,当前市场上的这四个基因的每支探针的颜色均为双色(红/绿或者橙/绿),至少需要4张石蜡包埋切片为样本,做4次试验,耗费4次试剂,分别在荧光显微镜下判读。考虑到检测费用高和/或可取样本量少的情况,患者就会失去检测四个基因异常的机会,从而错失对应的治疗方法。目前临床上尚无能够同时、一次性完成对alk、ros1、ret和met这4个热点基因进行检测的试剂盒。
技术实现要素:
15.有鉴于此,本发明的目的在于提供一次性检测多基因的五色fish探针系统及方法,在一张标本切片上同时检测非小细胞肺癌的alk、rosl、ret和met基因,大大缩短了检测的时间,提高了肺癌基因检测的灵敏度和准确率,从而实现指导肺癌临床治疗方案制定及化疗预后。
16.本发明的目的可以通过以下技术方案来实现:
17.本发明的第一方面,在于提供一次性检测多融合基因的五色fish探针系统,包含:
18.标记第一荧光素的第一探针,其与alk基因断裂点5’端杂交;
19.标记第二荧光素的第二探针,其与alk基因断裂点3’端杂交;
20.标记第三荧光素的第三探针,其与alk基因断裂点5’端和3’端杂交;
21.标记第一荧光素的第四探针,其与ros1基因断裂点5’端杂交;
22.标记第二荧光素的第五探针,其与ros1基因断裂点3’端杂交;
23.标记第三荧光素的第六探针,其与ret基因断裂点5’端杂交;
24.标记第四荧光素的第七探针,其与ret基因断裂点3’端杂交;
25.标记第五荧光素的第八探针,其与ret基因断裂点5’端和3’端杂交;
26.标记第三荧光素的第九探针,其与met基因杂交;
27.标记第四荧光素的第十探针,其与7号染色体着丝粒杂交;
28.其中,第一荧光素、第二荧光素、第三荧光素、第四荧光素、第五荧光素为不同颜色的荧光素。
29.在本发明的一些具体实例中,第一荧光素为绿色荧光素,第二荧光素为橙色荧光素,第三荧光素为蓝色荧光素,第四荧光素为红色荧光素,第五荧光素为金色荧光素。
30.此时,一次性检测多融合基因的五色fish探针系统,包含:
31.标记绿色荧光素的第一探针,其与alk基因断裂点5’端杂交;
32.标记橙色荧光素的第二探针,其与alk基因断裂点3’端杂交;
33.标记蓝色荧光素的第三探针,其分别与alk基因断裂点5’端和3’端杂交;
34.标记绿色荧光素的第四探针,其与ros1基因断裂点5’端杂交;
35.标记橙色荧光素的第五探针,其与ros1基因断裂点3’端杂交;
36.标记蓝色荧光素的第六探针,其与ret基因断裂点5’端杂交;
37.标记红色荧光素的第七探针,其与ret基因断裂点3’端杂交;
38.标记金色荧光素的第八探针,其分别与ret基因断裂点5’端和3’端杂交;
39.标记蓝色荧光素的第九探针,其与met基因杂交;
40.标记红色荧光素的第十探针,其与7号染色体着丝粒杂交。
41.在本发明的一些具体实例中,
42.第一探针位于chr2:29,563,514
‑
29,926,884;
43.第二探针位于chr2:29,135,420
‑
29,365,842;
44.第三探针位于chr2:28,933,548
‑
30,336,478;
45.第四探针位于chr6:117,110,256
‑
117,598,544;
46.第五探针位于chr6:117,658,624
‑
117,821,562;
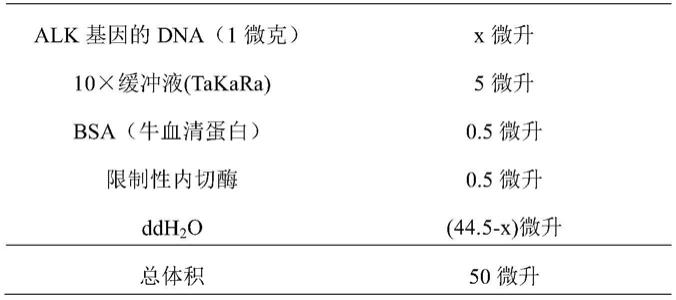
47.第六探针位于chr10:43,258,465
‑
43,526,541;
48.第七探针位于chr10:43,625,984
‑
44,026,625;
49.第八探针位于chr10:43,090,623
‑
44,352,264;
50.第九探针位于chr7:116,054,223
‑
116,568,442;
51.第十探针位于chr7:7p11.1
‑
q11.1。
52.本发明的第二方面,在于提供制备上述一次性检测多融合基因的五色fish探针系统的方法:
53.所述的第一~第九探针通过以下步骤制得:利用携带有检测基因的bac菌种,获得所述检测基因的克隆后,大量提取所述检测基因的dna;根据设计的杂交位点,选定限制性内切酶对所述检测基因的dna进行两次酶切,得到所述检测基因的小片段dna探针;再采用缺口平移的方法将选定的荧光素标记连接到所述检测基因的小片段dna探针上,纯化得到所述检测基因的探针;所述检测基因为alk、ros1、ret或met基因;
54.所述的第十探针通过以下步骤制得:以7号染色体着丝粒位于chr7:7p11.1
‑
q11.1的序列为模板,采用聚合酶链技术进行pcr扩增反应得到pcr产物;采用缺口平移的方法将选定的荧光素标记连接到所述pcr产物上,纯化后得到第十探针。
55.在本发明的一些具体实例中,携带有alk基因的bac菌种,编号为rp11
‑
701p18;携带有ros1基因的bac菌种,编号为rp11
‑
323o17;携带有ret基因的bac菌种,编号为rp11
‑
242a16;携带有met基因的bac菌种,编号为rp11
‑
114o6。
56.本发明的第三方面,在于提供一次性检测多融合基因的五色fish试剂盒,其包括上述的五色fish探针系统。
57.在本发明的一些具体实例中,一次性检测多融合基因的五色fish试剂盒,还包括:预处理液、蛋白酶液、洗涤液和dapi/抗荧光衰减封片剂。
58.本发明的第四方面,在于提供利用上述五色fish探针系统或五色fish试剂盒一次性检测多融合基因的方法,包括以下步骤:
59.(1)将待测样本固定在玻片上进行预处理切片;
60.(2)将上述的五色fish探针系统加至所述待测样本切片的待杂交区域,共变性后,封片杂交;杂交完成后,洗涤玻片;对杂交区域细胞核进行复染,封片;
61.(3)使用具有匹配滤光块的荧光显微镜对玻片杂交区域进行观察,并对结果进行判断,以确定所述待测样本中alk、ros1、ret和met基因是否存在异常。
62.所述待测样本为肺癌(例如非小细胞肺癌,尤其是非小细胞肺癌晚期)患者手术/穿刺组织的石蜡包埋切片。
63.在本发明的一些具体实例中,第一荧光素为绿色荧光素,第二荧光素为橙色荧光素,第三荧光素为蓝色荧光素,第四荧光素为红色荧光素,第五荧光素为金色荧光素。
64.在本发明的一些具体实例中,采取以下原则对结果进行判断:
65.先使用第一/第二荧光素双通道滤光片的荧光显微镜进行观察:
66.当观察到的信号均为第一/第二荧光素信号融合,则表明alk/ros1基因均无分离;
67.当观察到分离的第一荧光素和第二荧光素信号,则使用第三荧光素单通道滤光片的荧光显微镜进行观察,观察分离的第一荧光素和第二荧光素信号是否伴随第三荧光素信号:如果分离的第一荧光素和第二荧光素信号伴随第三荧光素信号,则代表alk基因分离;如果分离的第一荧光素和第二荧光素信号并无第三荧光素信号伴随,则代表ros1基因分离;如果同时既观察到分离的第一荧光素和第二荧光素信号伴随第三荧光素信号,又观察到分离的第一荧光素和第二荧光素信号无第三荧光素信号伴随,则代表alk基因和ros1基因均发生分离;
68.使用第五荧光素/第四荧光素/第三荧光素单通道滤光片的荧光显微镜进行观察:
69.当出现信号为2个第五荧光素/第四荧光素/第三荧光素融合,表示ret基因正常;
70.当出现1个第五荧光素/第四荧光素/第三荧光素融合、1个第五荧光素/第三荧光素融合、1个第五荧光素/第四荧光素融合,表示ret基因分离;
71.无第五荧光素伴随的第四荧光素、第三荧光素信号为met信号,可直接进行计数:当出现的荧光信号组合为2个第四荧光素2个第三荧光素,表示met基因正常;当出现的荧光信号组合中第三荧光素信号数增多,表示met基因扩增。
72.在本发明的一些具体实例中,采取以下原则对结果进行判断:
73.先使用橙绿双通道滤光片的荧光显微镜进行观察:
74.当观察到的信号均为橙绿信号融合,则表明alk/ros1基因均无分离;
75.当观察到分离的橙、绿信号,则使用蓝色单通道滤光片的荧光显微镜进行观察,观察分离的橙、绿信号是否伴随蓝色信号:如果分离的橙、绿信号伴随蓝色信号,则代表alk基因分离;如果分离的橙、绿信号并无蓝色信号伴随,则代表ros1基因分离;如果同时既观察到分离的橙、绿信号伴随蓝色信号,又观察到分离的橙、绿信号无蓝色信号伴随,则代表alk基因和ros1基因均发生分离;
76.使用金/红/蓝单通道滤光片的荧光显微镜进行观察:
77.当出现2个金/红/蓝融合信号,表示ret基因正常;
78.当出现1个金/红/蓝融合,1个金/蓝融合,1个金/红融合,表示ret基因分离;
79.无金色伴随的红、蓝信号为met信号,可直接进行计数:当出现的荧光信号组合为2红2蓝,表示met基因正常;当出现的荧光信号组合中蓝色信号数增多,表示met基因扩增。
80.本发明中,设计了一种能同时检测alk基因分离、ros1基因分离、ret基因分离和met基因扩增的五色fish探针。通过五色fish探针系统的巧妙设计,结合荧光显微镜在镜下的观察,通过不同荧光素颜色的组合,对各基因的异常情况作出判读,通过一次实验和一个探针系统,可以同时完成4个肺癌基因异常的检测。
81.与现有技术相比较,本发明的五色fish探针系统以及检测方法具有以下有益的技术效果:
82.本发明的探针系统设计巧妙,实现了在一张标本切片上单次fish同时检测非小细胞肺癌的alk、rosl、ret、met四个基因的状态,快速确定晚期nsclc患者是否存在上述融合基因,节省了标本和试剂,大大缩短了检测的时间。
83.本发明对alk、rosl、ret和met四个基因的联合检测,提高了预后预测的灵敏度和准确性,并根据检测结果选择相对应的分子靶向药物,能够更可靠地指导肺癌临床治疗方案制定,从而改善预后。
附图说明
84.图1a~图1d分别为本发明的五色fish探针系统中ret、met、alk、rosl基因标记示意图(非按比例)。
85.图2为利用本发明五色fish探针系统进行检测的镜检结果判读规则示意图。
86.图3为将本发明的五色fish探针系统与人外周血培养细胞(中期染色体)杂交后经荧光显微镜镜检得到的图像。
具体实施方式
87.下面结合附图和具体实施例对本发明的实施方案进行详细描述。应理解,这些实施例仅用于说明本发明,而不应视为限定本发明的范围。
88.下列实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市场购得的常规产品。以下实施例中摩尔浓度单位采用的是领域内惯用书写方式:m,mm或μm,分别代表mol/l,mmol/l或μmol/l。
89.实施例1探针的制备
90.①
第一探针的制备
91.(1)将携带有alk基因的bac菌种(rp11
‑
701p18)(美国invitrogen公司)接种于新鲜的含抗生素的lb营养琼脂平板,置于37℃过夜培养;次日,用10微升白色枪头挑取生长状态良好的单克隆菌种至液体培养基(2ml含抗生素的lb培养基)中,37℃振荡培养6~8h(274rpm);将2ml菌液转移至200ml的液体lb培养基,37℃摇床(274rpm),过夜培养;按照qiagen公司质粒大量提取试剂盒的操作说明,进行dna大量提取和纯化,得到alk基因的dna。
92.(2)针对alk基因断裂点上游(5’端),选择限制性内切酶hindiii对alk基因的dna进行酶切,获得大片段dna:
93.将酶切反应体系(见下表1,表1中限制性内切酶为hindiii)的各成分混匀,37℃水浴反应1h,加入10微升50mm的edta终止反应,混匀,沉淀;吸取上清丢弃,加入100微升体积浓度为70%的乙醇,4℃混匀,离心15min;小心吸取上清丢弃,干燥沉淀,得到大片段(第一)dna。
94.表1酶切反应体系
[0095][0096]
(3)选择限制性内切酶ecor1对步骤(2)得到的大片段dna进行随机酶切,形成小片段dna(第一)探针:
[0097]
将下表2所示的随机酶切反应体系(表2中限制性内切酶为ecor1)的各成分混匀,37℃水浴反应1h,加入10微升50mm的edta终止反应,混匀,沉淀;吸取上清丢弃,加入100微升体积浓度为70%的乙醇,4℃混匀,离心15min;小心吸取上清丢弃,干燥沉淀,得到小片段dna探针,放置于4℃保存,等连接反应备用。小片段dna(第一)探针序列位于chr2:29,563,514
‑
29,926,884。
[0098]
表2随机酶切反应体系
[0099][0100]
(4)荧光素标记连接反应
[0101]
采用切口平移法对步骤(3)得到的小片段dna(第一)探针进行荧光素标记:
[0102]
取避光的ep管,按照下表3所示的连接反应体系(表3中荧光素datp/dye为绿色荧光素—异硫氰酸荧光素)加液:先加水,再加体系中其它组分,最后加入dnase(10纳克/微升)和dna聚合酶(10单位/微升,酶始终放在冰盒或冰上),混匀,孵育过夜。次日,70℃水浴10min中止反应。
[0103]
表3连接反应体系
[0104][0105]
(5)dna(探针)纯化
[0106]
按照qiagen公司的dna纯化试剂盒的操作步骤,纯化并回收步骤(4)得到的标记好荧光素的dna片段(或者说与荧光素连接好的dna片段),在
‑
20℃避光保存,作为第一探针备用。
[0107]
使用紫外分光光度计测定第一探针的纯度和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0108]
使用凝胶电泳判断第一探针的长度:取其中2μl第一探针进行2%琼脂糖凝胶电泳检查,以观察所标记第一探针的大小。第一探针的大小≤500bp。
[0109]
②
第二探针的制备
[0110]
采用与第一探针的制备基本相同的方法,制备第二探针,区别仅在于以下步骤:
[0111]
(2)针对alk基因断裂点下游(3’端),限制性内切酶选用bamhi酶,对alk基因的dna进行酶切,获得大片段(第二)dna:
[0112]
(3)小片段dna(第二)探针序列位于以下区域chr2:29,135,420
‑
29,365,842。
[0113]
(4)表3所示的连接反应体系中,荧光素为橙色荧光素(罗丹明)。
[0114]
使用紫外分光光度计测定第二探针的纯度和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0115]
使用凝胶电泳判断第二探针的长度:取其中2μl第二探针进行2%琼脂糖凝胶电泳检查,以观察所标记第二探针的大小。第二探针的大小为≤500bp。
[0116]
③
第三探针的制备
[0117]
采用与第一探针的制备基本相同的方法,制备第三探针,区别仅在于以下步骤:
[0118]
(2)针对alk基因断裂点上游(5’端)和alk基因断裂点下游(3’端),限制性内切酶选用ncoi酶,对alk基因的dna进行酶切,获得大片段(第三)dna。
[0119]
(3)小片段dna(第三)探针序列位于以下区域chr2:28,933,548
‑
30,336,478
[0120]
(4)表3所示的连接反应体系中,荧光素为蓝色荧光素(deac琥珀酰亚胺酯)
[0121]
使用紫外分光光度计测定第三探针的纯度和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0122]
使用凝胶电泳判断第三探针的长度:取其中2μl第三探针进行2%琼脂糖凝胶电泳检查,以观察所标记第三探针的大小。第三探针的大小为≤500bp,标记效果佳。
[0123]
④
第四探针的制备
[0124]
采用与第一探针的制备基本相同的方法,制备第四探针,区别仅在于以下步骤:
[0125]
(1)bac菌种为携带有ros1基因的bac菌种(rp11
‑
323o17)(美国invitrogen公司),得到的dna为ros1基因的dna。
[0126]
(2)针对ros1基因断裂点上游(5’端),限制性内切酶选用hindiii酶,对ros1基因的dna进行酶切,获得大片段(第四)dna。
[0127]
(3)小片段dna(第四)探针序列位于以下区域chr6:117,110,256
‑
117,598,544。
[0128]
(4)表3所示的连接反应体系中,荧光素为绿色荧光素(异硫氰酸荧光素)。
[0129]
使用紫外分光光度计测定第四探针的纯度和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0130]
使用凝胶电泳判断第四探针的长度:取其中2μl第四探针进行2%琼脂糖凝胶电泳检查,以观察所标记第四探针的大小。第四探针的大小为≤500bp。
[0131]
⑤
第五探针的制备
[0132]
采用与第一探针的制备基本相同的方法,制备第五探针,区别仅在于以下步骤:
[0133]
(1)bac菌种为携带有ros1基因的bac菌种(rp11
‑
323o17)(美国invitrogen公司),得到的dna为ros1基因的dna。
[0134]
(2)针对ros1基因断裂点下游(3’端),限制性内切酶采用bamhi酶,对ros1基因的dna进行酶切,获得大片段(第五)dna。
[0135]
(3)小片段dna(第五)探针序列位于以下区域chr6:117,658,624
‑
117,821,562
[0136]
(4)表3所示的连接反应体系中,荧光素为橙色荧光素(罗丹明)。
[0137]
使用紫外分光光度计测定第五探针的纯度和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0138]
使用凝胶电泳判断第五探针的长度:取其中2μl第五探针进行2%琼脂糖凝胶电泳检查,以观察所标记第五探针的大小。第五探针的大小为≤500bp。
[0139]
⑥
第六探针的制备
[0140]
采用与第一探针的制备基本相同的方法,制备第六探针,区别仅在于以下步骤:
[0141]
(1)bac菌种为携带有ret基因的bac菌种(rp11
‑
242a16)(美国invitrogen公司),得到的dna为ret基因的dna。
[0142]
(2)针对ret基因断裂点上游(5’端),限制性内切酶采用hindiii酶,对ret基因的dna进行酶切,获得大片段(第六)dna:
[0143]
(3)小片段dna(第六)探针序列位于以下区域chr10:43,258,465
‑
43,526,541
[0144]
(4)表3所示的连接反应体系中,荧光素为蓝色荧光素(deac琥珀酰亚胺酯)
[0145]
使用紫外分光光度计测定第六探针的纯度和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0146]
使用凝胶电泳判断第六探针的长度:取其中2μl第六探针进行2%琼脂糖凝胶电泳检查,以观察所标记第六探针的大小。第六探针的大小为≤500bp。
[0147]
⑦
第七探针的制备
[0148]
采用与第一探针的制备基本相同的方法,制备第七探针,区别仅在于以下步骤:
[0149]
(1)bac菌种为携带有ret基因的bac菌种(rp11
‑
242a16)(美国invitrogen公司),得到的dna为ret基因的dna。
[0150]
(2)针对ret基因断裂点下游(3’端),选择bamhi酶对ret基因的dna进行酶切,获得大片段(第七)dna。
[0151]
(3)小片段dna(第七)探针序列位于以下区域chr10:43,625,984
‑
44,026,625。
[0152]
(4)表3所示的连接反应体系中,荧光素为红色荧光素(得州红(texasred))
[0153]
使用紫外分光光度计测定第七探针的纯度和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0154]
使用凝胶电泳判断第七探针的长度:取其中2μl第七探针进行2%琼脂糖凝胶电泳检查,以观察所标记第七探针的大小。第七探针的大小为≤500bp。
[0155]
⑧
第八探针的制备
[0156]
采用与第一探针的制备基本相同的方法,制备第八探针,区别仅在于以下步骤:
[0157]
(1)bac菌种为携带有ret基因的bac菌种(rp11
‑
242a16)(美国invitrogen公司),得到的dna为ret基因的dna。
[0158]
(2)针对ret基因断裂点上游(5’端)和ret基因断裂点下游(3’端),选择ncoi酶对ret基因的dna进行酶切,获得大片段(第八)dna。
[0159]
(3)小片段dna(第八)探针序列位于以下区域chr10:43,090,623
‑
44,352,264。
[0160]
(4)表3所示的连接反应体系中,荧光素为金色荧光素(罗丹明6g)。
[0161]
使用紫外分光光度计测定第八探针的纯度和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0162]
使用凝胶电泳判断第八探针的长度:取其中2μl第八探针进行2%琼脂糖凝胶电泳检查,以观察所标记第八探针的大小。第八探针的大小为≤500bp。
[0163]
⑨
第九探针的制备
[0164]
采用与第一探针的制备基本相同的方法,制备第九探针,区别仅在于以下步骤:
[0165]
(1)bac菌种为带有met基因的bac菌种(rp11
‑
114o6)(美国invitrogen公司),得到的dna为met基因的dna。
[0166]
(2)限制性内切酶采用bamhi酶,对met基因的dna进行酶切,获得大片段(第九)dna:
[0167]
(3)小片段dna(第九)探针序列位于以下区域chr7:116,054,223
‑
116,568,442
[0168]
(4)表3所示的连接反应体系中,荧光素为蓝色荧光素(deac琥珀酰亚胺酯)。
[0169]
使用紫外分光光度计测定第九探针的纯度和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0170]
使用凝胶电泳判断第九探针的长度:取其中2μl第九探针进行2%琼脂糖凝胶电泳检查,以观察所标记第九探针的大小。第九探针的大小为≤500bp。
[0171]
⑩
第十探针的制备
[0172]
(1)以7号染色体着丝粒(chr7:7p11.1
‑
q11.1)(str)序列(由上海生工生物工程有限公司合成)为模板,采用聚合酶链技术进行pcr扩增反应得到。
[0173]
pcr扩增程序:(1)95℃,3min;(2)95℃,10s
─
58℃,30s
─
72℃,30s,循环40次;(3)72℃,5min。
[0174]
pcr扩增引物如下:
[0175]
上游引物f:5'gggaaatatcttcaaataaaaaccaga 3'
[0176]
下游引物r:5'tttctactgttggcatcaaatcgc 3'
[0177]
(2)将pcr产物与荧光素标记连接:采用切口平移法,具体为:取避光的ep管,按照下表4所示的连接反应体系加液:先加水,再加体系中其它组分,最后加入dnase(10纳克/微升)和dna聚合酶(10单位/微升,酶始终放在冰盒或冰上),混匀,孵育过夜。次日,70℃水浴10min中止反应。
[0178]
表4连接反应体系
[0179][0180]
datp/dye荧光素为红色荧光素(得州红(texasred))。
[0181]
(3)dna(探针)纯化
[0182]
按照qiagen公司的dna纯化试剂盒的操作步骤,纯化并回收标记好荧光素的dna片段(或者说与荧光素连接好的dna片段),在
‑
20℃避光保存,作为第十探针备用(第十探针序列位于以下区域chr7:7p11.1
‑
q11.1)。
[0183]
使用紫外分光光度计测定第十探针的纯度和浓度。纯度满足以下要求:od260nm/od280nm介于1.7
‑
2.0之间,浓度>30ng/μl。
[0184]
使用凝胶电泳判断第十探针的长度:取其中2μl第十探针进行2%琼脂糖凝胶电泳检查,以观察所标记第十探针的大小。第十探针的大小为≤500bp。
[0185]
各探针序列的探针区域的位置示意图(非按比例)如图1a~图1d所示。
[0186]
图1a中,ret:蓝色荧光素、红色荧光素分别标记ret基因断裂点(10q11)两端(5’端、3’端);金色荧光素标记ret基因断裂点5’端和3’端。
[0187]
图1b中,met:蓝色荧光素标记met基因,红色荧光素标记7号染色体着丝粒。
[0188]
图1c中,alk:绿色荧光素、橙色荧光素分别标记于alk基因断裂点(2p23)两端(5’端、3’端);蓝色荧光素标记alk基因断裂点5’端和3’端。
[0189]
图1d中,ros1:绿色荧光素、橙色荧光素分别标记ros1基因断裂点(6q22)两端(5’端、3’端)。
[0190]
实施例2探针系统的制备
[0191]
用甲酰胺缓冲液(每2ml甲酰胺缓冲液中,360微升5m nacl,40微升1mtris
‑
hcl,1ml甲酰胺,2微升10%(w/v)sds(十二烷基硫酸钠),598微升无菌水,ph7.4)对上述得到的各探针分别进行稀释,得到不同浓度的各个探针,并将同一基因的探针归入一个组合中,具体如下:
[0192]
alk探针组合,包括第一、第二和第三探针(alk绿/橙/蓝),其浓度分别为:分别为
5ng/ul、3ng/ul、20ng/ul;
[0193]
ros1探针组合,包括第四和第五探针(ros1绿/橙),其浓度分别为:5ng/ul、20ng/ul;
[0194]
ret探针组合,包括第六、第七、第八探针(ret蓝/红/金),其浓度分别为:5ng/ul、3ng/ul、20ng/ul;
[0195]
met探针组合,包括第九、第十探针(met蓝/红),其浓度分别为:20ng/ul、5ng/ul;
[0196]
将上述alk探针组合、ros1探针组合、ret探针组合、met探针组合按照体积比为1:1:1:1混合,得到五色fish探针系统。
[0197]
实施例3探针系统的杂交反应(利用实施例2的探针系统对样本进行检测)
[0198]
3.1样本的预处理
[0199]
①
将待测样本切片70℃10分钟。
[0200]
②
二甲苯(xylene)脱蜡,10分钟,二次。
[0201]
③
100%乙醇,100%乙醇,90%乙醇,70%乙醇中分别孵化切片5分钟。
[0202]
④
蒸馏水或去离子水洗2分钟,2次。
[0203]
⑤
切片在预热到98℃的预处理液中孵育15分钟。
[0204]
⑥
立即把切片转入蒸馏水或去离子水中洗2分钟,2次。
[0205]
⑦
在组织/细胞区域滴加蛋白酶液,并在37℃恒温恒湿箱孵化约10分钟。
[0206]
⑧
洗涤缓冲液中5分钟,蒸馏水或去离子水1分钟。
[0207]
⑨
脱水:经70%,90%,100%乙醇溶液中依次脱水各1分钟,空气干燥切片。
[0208]
3.2变性与杂交(第一天)
[0209]
①
用移液器吸取10μl的上述实施例2制备所得的五色fish探针系统,加入至切片待杂交区域。
[0210]
②
样本盖上盖玻片(22mm
×
22mm);橡胶胶水封片。
[0211]
③
75℃变性10分钟。
[0212]
④
37℃杂交过夜(>14h)。
[0213]
3.3杂交后洗涤(第二天)
[0214]
①
仔细除去胶水带。
[0215]
②
在置于染色缸内的室温洗涤缓冲液中洗涤1~3分钟,使盖玻片脱落。
[0216]
③
用洗涤缓冲液37℃洗涤切片5分钟,2次。
[0217]
④
置于70%,90%,100%乙醇溶液中洗涤切片各1分钟。避光风干,备用。
[0218]
3.4复染
[0219]
用移液器吸取30μl的dapi/抗荧光衰减封片剂到切片组织上,避免气泡,盖上盖玻片(24mm
×
60mm),避光孵育15分钟。
[0220]
3.5观察与保存
[0221]
使用具有匹配滤光块的荧光显微镜对玻片杂交区域进行观察,并采集图像:低倍镜下观察整张切片,初步判断检测质量;然后于油镜下通过特异通道滤光片观察信号,随机计数至少2个不同区域的50个癌细胞核中的信号,并进行信号计数。
[0222]
其中,荧光显微镜采用奥林巴斯bx53型荧光显微镜,滤光块荧光素如下:绿色fitc荧光素(激发波长503nm,发射波长528nm),橙色5
‑
carboxyl
‑
x
‑
rhodamine荧光素(激发波长
548nm,发射波长573nm),蓝色aqua荧光素(激发波长418nm,发射波长467nm),红色texasred荧光素(激发波长580nm,发射波长599nm),金色carboxyrhodamine 6g荧光素(激发波长525nm,发射波长551nm)。
[0223]
3.6结果判读:
[0224]
先使用橙绿双通道滤光片的荧光显微镜进行观察:
[0225]
当观察到的信号均为橙绿信号融合,则表明alk/ros1基因均无分离;当观察到分离的橙、绿信号,则使用蓝色单通道滤光片的荧光显微镜进行观察,观察分离的橙、绿信号是否伴随蓝色信号:如果分离的橙、绿信号伴随蓝色信号,则代表alk基因分离;如果分离的橙、绿信号并无蓝色信号伴随,则代表ros1基因分离;如果同时既观察到分离的橙、绿信号伴随蓝色信号,又观察到分离的橙、绿信号无蓝色信号伴随,则代表alk基因和ros1基因均发生分离。
[0226]
使用单通道滤光片(金/红/蓝)的荧光显微镜进行观察:
[0227]
当出现信号为2个金/红/蓝融合,表示ret基因正常;当出现1个金/红/蓝融合、1个金蓝、1个金红,表示ret基因分离;
[0228]
无金色伴随的红、蓝信号为met信号,可直接进行计数。当出现的荧光信号组合为2红2蓝,表示met基因正常;当出现的荧光信号组合为蓝色信号数增多,表示met基因扩增。
[0229]
上述判断规则如图2所示。
[0230]
图2中,标记a为绿色荧光信号,标记b为橙色荧光信号,标记c为蓝色荧光信号,标记d为红色荧光信号,标记e为金色荧光信号。
[0231]
实施例4探针系统的验证
[0232]
采用常规方法对所制备的探针进行验证,即采用正常人外周血培养单个核细胞(正常二倍体细胞)对上述实施例2制得的五色探针系统进行验证,以评估灵敏度和特异性,具体为:使用密度梯度离心法用ficoll液提取正常人外周血单个核细胞,按实施例3的方法制片、杂交。实验结果在正常二倍体细胞中,各基因拷贝数应为2。人外周血培养细胞(中期染色体)杂交图如图3所示。
[0233]
由图3可见各基因(alk、ros1、ret、met基因)分别杂交于对应的染色体位点,从而验证了各基因杂交位点正确,且无非特异性杂交。
[0234]
当前,使用商业化探针检测上述四个基因(alk、ros1、ret和met基因),需要用到四支探针在四张标本切片上进行四次fish测试,本发明的探针系统只需要使用一张标本切片、单次fish测试即可达到同样的效果,节省了标本和试剂,大大缩短了检测的时间。
[0235]
由此可见,本发明的目的已经完整并有效的予以实现。本发明的功能及结构原理已在实施例中予以展示和说明,在不背离所述原理的情况下,实施方式可作任意修改。所以,本发明包括了基于权利要求精神及权利要求范围的所有变形实施方式。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:卢红阳;张谷;樊滢
- 技术所有人:浙江省肿瘤医院
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....