一种重组非洲猪瘟病毒多表位融合蛋白、制备及其应用
1.本发明属于生物技术制药领域,具体涉及一种重组非洲猪瘟病毒多表位融合蛋白、制备及其应用。
背景技术:
2.非洲猪瘟(african swine fever, asf)是由非洲猪瘟病毒(african swine fever virus, asfv)引起的一种猪的急性烈性传染病,死亡率可达100%,目前尚无商品化的疫苗。世界动物卫生组织(world organization for animal health, oie)将其列为必须通报的动物疫病,我国将其列为重点防御的一类动物传染病。
3.由于asfv基因组庞大,编码蛋白众多,病毒结构复杂,至今还没有安全、有效的疫苗用于疫情防控。asf疫苗以往的研究经验表明:灭活疫苗诱导产生较高水平的体液免疫应答,却不能提供免疫保护;(2)asf减毒活疫苗接种后虽然能够提供针对同源或异源毒株的免疫保护,但接种的动物易出现不良反应,而且存在毒力返强的风险。(3)一些asfv抗原亚单位能够诱导产生中和抗体,提供部分免疫保护,该疫苗突出的优点是安全性高,易于鉴别诊断,这为开发安全有效的asf疫苗提供了可能。随着对asfv适应性免疫应答、保护性抗原的不断发掘及新型佐剂研究的深入,设计诱导保护性抗体和特异性细胞免疫的有效的asf亚单位疫苗成为研究的热点领域之一。
4.p72是asfv的重要结构蛋白,是构成病毒粒子衣壳的主要成分,由基因b646l编码,分子量大小为73.2 kda。p72能够诱导产生中和抗体能抑制asfv感染宿主细胞。研究表明,这些中和抗体是由p72上一些重要的抗原表位诱导的。另一种值得关注的结构蛋白是pe248r,研究表明,pe248r作为重要是重要的内囊膜蛋白,是诱导产生保护性免疫应答的潜在抗原。
技术实现要素:
5.为了开发安全有效的asf疫苗,本发明将asfv结构蛋白p72的4个抗原表位与pe248r的n段氨基酸序列通过连接肽(linker)串联,获得重组多抗原表位融合蛋白,命名为重组蛋白ppe,含重组蛋白ppe的疫苗在接种小鼠后能诱导产生高水平的抗p72和抗pe248r igg抗体和特异性细胞免疫,且诱导产生的抗体在体外显著抑制asfv感染宿主细胞,提示重组蛋白ppe可用于asf亚单位疫苗的制备。
6.本发明采用的具体方案如下:本发明的目的一是提供一种重组多表位融合蛋白,所述重组多表位融合蛋白由asfv结构蛋白p72的4个抗原表位和pe248r的n段氨基酸序列通过连接肽(linker)融合而成,具有以下通式:p72抗原表位1-(linker)
n-p72抗原表位2-(linker)
n-p72抗原表位3-(linker)
n-p72抗原表位4-(linker)
n-pe248r的n段氨基酸序列;其中,所述p72抗原表位1的氨基酸序列如seq id no:3所示,所述p72抗原表位2的氨基酸序列如seq id no:4所示,所述p72抗原表位3的氨基酸序列如seq id no:5所示,所
述p72抗原表位4的氨基酸序列如seq id no:6所示;所述连接肽序列为ggggs,n为1、2、3或4。
7.作为对上述融合蛋白的进一步优化,所述连接肽序列为ggggs,n为3。
8.作为对上述融合蛋白的进一步优化,所述asfv结构蛋白pe248r的n段的氨基酸序列为seq id no:7所示。
9.作为对上述方案的进一步优化,所述重组多抗原表位融合蛋白的氨基酸序列如seq id no:2所示。优选地,编码所述重组蛋白的核苷酸序列为seq id no:1。
10.本发明的目的二是提供了一种表达载体,所述表达载体由骨架质粒可修饰地连接编码上述融合蛋白的核苷酸序列形成;优选地,骨架质粒为pet-30a(+)。
11.本发明的目的三是提供上述重组蛋白的制备方法,所述制备方法包括以下步骤:(1) 载体构建:构建上述的表达载体;(2) 转化及阳性克隆的筛选:将步骤(1)中的表达载体转化至宿主菌,经诱导和sds-page鉴定得到能够表达目的蛋白的菌株;(3) 诱导表达:将步骤(2)中的阳性菌株转接生长到一定浓度时加入iptg进行诱导表达;(4) 蛋白纯化:收集步骤(3)中的菌体,经超声破碎、包涵体洗涤及溶解、ni螯合亲和层析纯化和透析复性得到目的蛋白;(5)重组蛋白的鉴定:采用sds-page和western blotting 对(4)中获得的重组蛋白进行鉴定。
12.本发明的目的四是提供上述重组蛋白在asf疫苗制备中的应用。
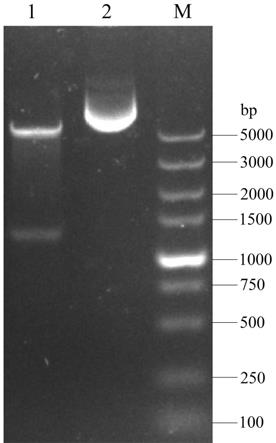
13.本发明的目的五是提供一种asf亚单位疫苗,包含上述的融合蛋白。优选地,将所述融合蛋白与isa 206佐剂配伍后所得的asf亚单位疫苗效果更佳。
14.由于采用了上述技术方案,本发明具有如下的优点:1、ppe表达质粒可以在原核表达系统(大肠杆菌)中诱导表达,而且具有表达量高、易于纯化的优点;2、选择pet载体系列时,重组蛋白ppe以融合蛋白形式表达;重组蛋白的c端含有一个分子量仅为0.84 kda的6
×
his标签,对融合蛋白的功能没有影响,而且使得纯化步骤简单,经一步纯化得到的重组蛋白ppe的纯度在90%以上;3、重组蛋白ppe能够在接种动物体内诱导产生高水平的特异性抗体和细胞免疫。
15.4、利用本发明制备的重组蛋白ppe可通过皮下(肌肉)注射途径进行免疫接种,激发机体产生高滴度igg抗体。经中和试验证实,所述重组蛋白制备的疫苗诱导产生的抗体在体外能够抑制asfv感染宿主细胞,具有作为asf亚单位疫苗的应用的价值。
附图说明
16.图1为本发明实施列中重组表达载体pet-30a(+)-ppe双酶切鉴定结果。泳道1:pet-30a(+)-ppe ndei-xhoi双酶切,泳道2:pet-30a(+)-ppe;泳道m: dna分子量标准(marker);图2为本发明实施列中重组蛋白ppe诱导表达及纯化的sds-page检测结果。泳道1:阳性菌株诱导前;泳道2:蛋白分子量标准(marker);泳道3:阳性菌株诱导后;泳道4:菌体破
碎后沉淀;泳道5:包涵体溶解;泳道6:纯化的ppe;图3为本发明实施列中利用6*his单克隆抗体(a)和asfv阳性血清(b)对重组蛋白ppe进行鉴定的western blotting结果。泳道1:牛血清白蛋白;泳道2:纯化的ppe;泳道m:蛋白分子量标准(marker);图4本发明实施列中首次免疫小鼠后不同时间点血清中p72特异性igg的动态消长;图5本发明实施列中首次免疫小鼠后不同时间点血清中pe248r特异性igg的动态消长;图6为本发明实施列中首次免疫小鼠后28天脾脏淋巴细胞经抗原刺激后分泌的细胞因子水平;图7为本发明实施列中首次免疫小鼠后28天脾淋巴细胞经抗原刺激后淋巴细胞增殖水平;图8为本发明实施列中asfv与首次免疫小鼠后28天的血清孵育后培养的asfv基因组拷贝数(a)及病毒中和率(b)。
具体实施方式
17.本发明将asfv结构蛋白p72中4个抗原表位的编码基因与pe248r的n段氨基酸序列的编码基因串联形成多抗原表位融合dna序列,经原核表达、纯化获得的重组多抗原表位融合蛋白(命名为重组蛋白ppe),含重组蛋白ppe的疫苗在接小鼠后能诱导产生高水平的抗p72和抗pe248r igg抗体和特异性细胞免疫,且诱导产生的抗体在体外显著抑制asfv感染宿主细胞,提示重组蛋白ppe可用于asf亚单位疫苗的制备。
18.为了更好的理解本发明的内容,下面结合具体实施方法对本发明内容作进一步说明,但发明的保护内容不局限于以下实施例。
19.重组质粒的构建与鉴定将the immune epitope database (iedb) 数据库中已验证的4个asfv p72表位(表位id :141844、141941、141989、142069),通过(ggggs)3柔性linker依次串联,将串联后的p72表位通过(ggggs)3柔性linker再与asfv-sy18结构蛋白pe248r (蛋白id:ayw34102.1)的n段氨基酸序列(met1-lys198)串联得到asfv多表位抗原融合蛋白ppe的氨基酸序列,将该序列按照大肠杆菌的密码子偏好转换为核苷酸序列,并在其5'端和3'端分别引入特异性酶切位点ndei和xhoi,委托南京金斯瑞生物科技有限公司合成并克隆至pet-30a(+)表达载体上,获得重组质粒pet-30a(+)-ppe。将该重组质粒转化dh5α,挑取阳性克隆接种于卡那抗性lb培养基中,37 ℃振荡培养过夜。根据说明书的步骤,采用快速质粒小提试剂盒提取阳性克隆的质粒。通过ndei和xhoi进行酶切,37 ℃水浴1.5 小时。体系如下:重组质粒5
ꢀµ
l、ndei酶 1
ꢀµ
l、xhoi酶 1
µ
l、10
×
cutsmart buffer 1
ꢀµ
l、ddh2o 2
ꢀµ
l。将上述酶切反应体系中各加入2.5
ꢀµ
l 5
×
loading buffer,经1.0%琼脂糖凝胶130 v电泳25 分钟后,uv扫描仪观察酶切的结果。
20.实验结果如图1所示:重组质粒pet-30a(+)-ppe酶切前大小在5000 bp以上,与预期相符。经ndei和xhoi双酶切后,重组质粒pet-30a(+)-ppe被切成2个片段,大片段约5200 bp为表达载体pet-30a(+)部分,小片段约1400 bp,为插入编码ppe的片段,说明pet-30a
(+)-ppe重组质粒构建成功,重组质粒的测序结果进一步证实了该结论。
21.重组蛋白ppe的诱导表达及纯化将鉴定阳性的重组质粒pet-30a(+)-ppe转化大肠杆菌bl21(de3) 感受态细胞,挑取阳性克隆接种于5 ml卡那抗性lb培养基中,37 ℃ 220 rpm培养。待菌液的od
600
达到0.6-0.8时,留取1 ml菌液转至灭菌ep管中作为扩大培养的菌种,将剩余4 ml菌液平均分成2份,一份加入1 mm iptg进行诱导,另一份作为对照,37 ℃ 220 rpm培养4 小时,分别收集菌体进行sds-page检测(如图2),结果显示以iptg诱导的菌体在48 kda处有明显的条带,与重组蛋白ppe预期大小相符。将留取的1 ml菌液扩繁后按1:100接种到1 l卡那抗性的lb培养基中,37 ℃ 220 rpm培养。待菌液的od
600
达到0.6-0.8时加入1 mm iptg进行诱导,37 ℃ 220 rpm继续培养4 小时。8000 rpm离心7 分钟收集菌体,加入50 ml 结合缓冲液(300 mm nacl, 20 mm nah2po4, 5 mm咪唑; ph 8.0)重悬菌体,将菌体超声裂解40 分钟,经10000 rpm离心25 分钟分别收集包涵体和上清,并进行sds-page电泳检测,结果显示重组蛋白ppe为包涵体表达。将包涵体在含8 m尿素的结合缓冲液中溶解,10000 rpm离心25分钟收集的上清与ni-excel亲和介质在4 ℃条件下结合2 小时,用20 ml洗涤缓冲液(8 m尿素,300 mm nacl, 20 mm nah2po4, 20 mm咪唑; ph 8.0)淋洗,最后用20 ml洗脱缓冲液(8 m尿素,300 mm nacl, 20 mm nah2po4, 500 mm咪唑; ph 8.0)对结合的重组蛋白进行洗脱。洗脱的重组蛋白依次在含8 m,6 m,4 m,2 m,0 m的透析液 (20 mm nah2po4, 300 mm nacl, 2 mm β-巯基乙醇, 0.4%精氨酸, 10%甘油, ph 7.5)中进行复性,收集复性的重组蛋白,取部分产物进行sds-page检测,结果显示:复性的重组蛋白分子量为48 kda,与重组质粒转化的阳性菌株诱导表达的蛋白大小一致,如图2。
22.重组蛋白ppe的浓度测定及western blotting鉴定采用bradford法对重组蛋白ppe的浓度进行测定,取200 ng重组蛋白ppe与5
×
上样缓冲液混合后煮沸10分钟,进行sds-page(80 v 30 分钟,120v 1 小时10分钟),然后电转印于硝酸纤维素膜(pvdf)上,并用5%脱脂奶粉在室温条件下封闭2 小时。一抗孵育:将封闭好的pvdf膜分别与鼠抗6
×
his单克隆抗体(1:5000倍稀释)和asfv阳性猪血清(1:300倍稀释)在4度条件下孵育过夜,并用1
×
pbst洗涤6次。二抗孵育:将过氧化物酶标记的羊抗鼠igg(1:5000倍稀释)和羊抗猪igg(1:5000倍稀释)分别加入对应的pvdf膜中,室温孵育1 小时,并用1
×
pbst洗涤6次。显色:按说明书配制ecl发光液,均匀铺至pvdf膜上,显色后,用无离子水终止反应,多功能成像仪采集图像。
23.western blotting结果如图3所示,重组蛋白ppe不仅能被鼠抗6
×
his单克隆抗体识别,且与asfv阳性血清反应性良好,提示该重组多抗原表位融合蛋白具有潜在的应用价值。
24.疫苗制备及小鼠免疫方案将复性的重组蛋白ppe稀释为200
ꢀµ
g/ml,平均分成2份,其中1份与等体积的isa 206混合后充分乳化,制成水/油/水剂型的疫苗;另一份与等体积 pbs混匀制成无佐剂疫苗。同时设置isa 206佐剂与等体积pbs混合作为阴性对照,pbs作为空白对照。将20只6-8周龄spf级雌性balb/c小鼠随机分为4组(5只/每组),将制备好的疫苗以皮下多点免疫的方式,按照下表中的免疫分组以及免疫剂量,初免14天后加强免疫1次。
25.特异性igg检测首次免疫前及免疫后7、14、21和28天,对所有免疫的balb/c小鼠进行尾静脉采血,4000 rpm离心10分钟分离血清,用建立的p72和pe248r间接elisa对免疫血清进行检测。具体操作如下:将纯化的重组p72和pe248r(单独表达并纯化)用包被缓冲液(碳酸盐缓冲液,ph 9.6)分别稀释为1
ꢀµ
g/ml,每孔100 μl,4 ℃过夜;弃掉包被液,加入含5%脱脂奶粉的pbst封闭(200 μl/孔),37℃孵育2小时;弃掉封闭液,用1
×
pbst洗板5次,加入1:100稀释的免疫小鼠血清,100
ꢀµ
l/孔,37℃孵育1小时;弃掉液体,用1
×
pbst洗板5次,加入1∶10000 稀释的hrp标记的羊抗小鼠igg,100
ꢀµ
l/孔,37℃孵育1小时;弃掉液体,用1
×
pbst洗板5次,加入tmb底物显色液,100 μl/孔,37 ℃避光10~15min;加入2 m h2so4终止反应(100 μl/孔),测定450nm处的od值。
26.结果及分析:如图4和图5所示,佐剂免疫组和pbs组在免疫期间均未检测到针对p72和pe248r的特异性抗体,组间无统计学差异(p》0.05)。重组蛋白ppe单独免疫组和重组蛋白ppe+ isa 206免疫组,首次免疫后7天,均能检测到针对p72和pe248r的特异性igg抗体,与首次免疫相比,加强免疫后抗体水平均明显升高,且重组蛋白ppe+isa 206组的抗p72和抗pe248r特异性igg抗体水平显著高于重组蛋白ppe单独免疫组(p 《 0.001)。结果说明,重组蛋白ppe具有良好的免疫原性,且与isa 206配伍后免疫效果更优。
27.淋巴细胞分泌细胞因子水平测定首次免疫后28 天,从每组随机选取3只小鼠脱臼处死,用75%酒精浸泡约5分钟;于超净台中无菌取出脾脏并浸润于rpmi-1640培养基中,用5ml注射器活塞轻轻研磨制成脾细胞悬液;1500rpm离心5分钟弃上清,向细胞沉淀中加入2ml红细胞裂解液重悬,室温裂解3分钟;随后加入10ml pbs终止反应,1500rpm离心5分钟收集细胞并用pbs洗涤2次;收集的脾细胞用含10% fbs的rpmi-1640培养基重悬,并调整细胞密度至1
×
106/ml;然后接种12孔板,每孔1ml,加入终浓度为5μg/ml的纯化重组蛋白p72和pe248r,37 ℃ 5% co2培养72小时,收集上清,采用小鼠细胞子检测试剂盒检测上清中il-2,ifn-γ和tnf-α的含量。
28.如图6所示,重组蛋白ppe+isa 206免疫组和重组蛋白ppe单独免疫组的脾淋巴细胞经体外刺激后,均分泌il-2,ifn-γ和tnf-α,但ppe+isa 206免疫组显著高于重组蛋白ppe单独免疫组(p 《 0.001);与实验组相比,单独佐剂免疫组和pbs对照组的脾淋巴细胞,体外刺激后il-2,ifn-γ和tnf-α的含量均在处于低水平。实验结果证明:重组蛋白ppe与isa 206配伍试制的疫苗免疫后能够显著活化免疫细胞,提高细胞因子的分泌水平。
29.1.7淋巴细胞增殖实验脾细胞分离如2.6所述,将分离的脾细胞调整为5
×
105/ml,接种96孔板(100
ꢀµ
l/孔),然后加入终浓度为2.5 μg/ml的p72和pe248r重组蛋白,同时设立rpmi-1640培养基对照、正常细胞对照和cona阳性对照。37 ℃ 5% co2培养72小时后,每孔加入10
ꢀµ
l cck8反应液,37 ℃ 5% co2孵育3.5 小时后,检测od
450nm
,计算刺激指数si=(实验组od
450-空白对照
od
450
) /(阴性对照od
450-空白对照od
450
)。
30.如图7所示,重组蛋白ppe+isa 206免疫组脾淋巴细胞,经体外抗原刺激后淋巴细胞的增殖水平(百分比)最高,淋巴细胞刺激指数的平均值大于3,明显高于其他三组(p 《 0.001)。重组蛋白ppe单独免疫组则显著高于佐剂免疫组(p 《 0.01)和pbs组(p 《 0.05)。实验结果证明:重组蛋白ppe与isa 206佐剂配伍诱导细胞免疫应答的水平显著优于无佐剂组,提示通过与佐剂配伍可显著提升重组蛋白的细胞免疫应答能力。
31.血清中和实验用首次免疫前和免疫后28天的血清进行中和试验,具体操作如下:将血清分别用灭菌的pbs进行1:5稀释,并用0.22 μm的针头滤器过滤除菌,56℃水浴灭活30分钟。将asfv-cn/sc/2019(moi=0.01,中国农业科学院兰州兽医研究所 bsl-3实验室保存)与灭活的小鼠血清混合后,37℃过夜。将过夜的病毒混合物接种pam单层中,每孔200
ꢀµ
l(24孔板),37 ℃孵育1小时,每隔10分钟轻轻摇动1次。将病毒血清混合液弃掉,用无菌pbs清洗3遍,随后加入500
ꢀµ
l含5 % fbs的rpmi-1640,37 ℃ 5 % co2培养48小时。收集培养细胞,采用病毒基因组提取试剂盒分别提取各孔asfv基因组,qpcr试剂盒扩增asfv基因,根据ct值和建立的标准曲线计算各样品中asfv基因组的拷贝数,确定病毒中和率:病毒中和率(%)=100-100*免疫血清孵育后asfv拷贝数/免疫前血清孵育后asfv基因组的拷贝数。
32.如图8a所示,与免疫前血清相比,重组蛋白ppe单独免疫组和重组蛋白ppe+isa206组免疫血清能显著降低asfv基因组的拷贝数(p 《 0.001),根据asfv基因组拷贝数计算出这两种免疫血清在体外对asfv的平均抑制率分别为71.5%和78.4%(图8b)。佐剂免疫组和pbs对照组的asfv的基因组拷贝数与免疫前血清无显著性差异(p 》 0.05),即血清中无中和抗体。重组蛋白ppe单独免疫组和重组蛋白ppe+isa 206组血清在体外都能显著抑制asfv感染pam,但重组蛋白ppe+isa 206组的病毒抑制率显著高于重组蛋白ppe单独免疫组(p 《 0.01)。说明本发明构建的重组蛋白ppe诱导asfv中和抗体,与isa206佐剂配伍进一步提高asfv中和抗体水平,提示重组蛋白ppe是一种非常重要的免疫保护重组蛋白形式。
33.需要说明的是,以上所述的实施方案应理解为说明性的,而非限制本发明的保护范围,本发明的保护范围以权利要求书为准。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对本发明作出的一些非本质的改进和调整仍属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1