一种曲妥珠单抗心脏毒性诊断试剂盒及治疗药物
1.本发明涉及生物医药技术领域,具体涉及一种用于曲妥珠单抗心脏毒性诊断的生物标记物以及egfr抑制剂在制备治疗ptx3相关疾病或损伤的药物中的应用。
背景技术:
2.曲妥珠单抗是靶向人表皮生长因子受体2(human epidermal growthfactor receptor 2,her2)的人源化单克隆抗体,其可用于治疗her2阳性的乳腺癌以及转移性胃癌。随着临床广泛应用,曲妥珠单抗被证实具有显著的心脏毒性风险,且被美国fda标记为黑框警告。曲妥珠单抗可引起左心室功能不全、心律失常、高血压与心力衰竭等心肌病,主要特征为左心室射血分数的降低。文献报道显示4.2%-13.1%的患者会出现左心室射血分数的降低,1.0%-3.8%的患者会最终发展为充血性心力衰竭(chavez-macgregor m,et al.trastuzumab-related cardiotoxicity among older patients with breast cancer.j clin oncol 2013,31(33):4222-4228;florido r,et al.cardiotoxicity from human epidermal growth factor receptor-2(her2)targeted therapies.j am heart assoc 2017,6(9):1-14.),严重影响患者生存质量,极大地限制其临床安全长期应用。
3.目前曲妥珠单抗诱发心脏毒性的分子机制远未阐明,临床缺乏有效防治手段,主要采取心脏影像学检查手段定期监测左室射血分数实现心脏毒性早期检测。如何治疗曲妥珠单抗的心脏毒性仍然是其临床应用中面临的重大难题,开发心脏毒性治疗药物对曲妥珠单抗的临床安全有效广泛应用具有十分重要的意义。
4.专利文献cn 104334189 a公开组合两种her2抗体对患者施用帕妥珠单抗、曲妥珠单抗来治疗her2阳性癌症,而不增加心脏毒性。
5.五聚素3(pentraxin 3,ptx3)是一种分泌型模式识别受体,可通过识别外来抗原和自身变性抗原,激活固有免疫反应,在微生物感染、哮喘、急性肺损伤、动脉粥样硬化、肾炎等多种炎症性疾病以及心肌梗死、心力衰竭等疾病中发挥重要的作用,且ptx水平与这些疾病或器官损伤的严重程度、死亡率相关。基于此,五聚素3可作为相关疾病或损伤的潜在治疗靶点,但目前尚无抑制ptx3表达或分泌的药物。
6.人表皮生长因子受体(human epidermal growth factor receptor,egfr)抑制剂是用于治疗egfr突变肿瘤的小分子激酶抑制剂。有研究报道显示,egfr抑制剂对心肌肥厚等存在一定保护作用,但目前尚无egfr抑制剂治疗ptx3相关疾病或损伤的报道。
技术实现要素:
7.本发明的目的在于提供一种与曲妥珠单抗诱发心脏毒性副作用相关因子,以此作为曲妥珠单抗心脏毒性诊断的生物标记物以及治疗靶点。
8.为实现上述目的,本发明采用如下技术方案:
9.本发明提供了五聚素3(ptx3)作为生物标记物在制备曲妥珠单抗心脏毒性诊断试剂盒中的应用,所述生物标记物为氨基酸序列如seq id no.1所示的ptx3蛋白或核苷酸序
列如seq id no.2所示的ptx3 mrna。
10.本发明研究发现,曲妥珠单抗可上调血管内皮细胞的ptx3基因的转录水平,诱导其释放ptx3蛋白,曲妥珠单抗作用后的血管内皮细胞的培养基与ptx3重组蛋白可降低人诱导多能干细胞分化的心肌细胞(ipsc-cms)或人心肌细胞系ccc-heh-2的收缩力,提示血管内皮细胞释放的ptx3是曲妥珠单抗诱发心脏毒性的关键因子,ptx3可能是曲妥珠单抗诱发心脏毒性的潜在靶点。因此,可将ptx3蛋白或ptx3 mrna作为曲妥珠单抗心脏毒性诊断的生物标记物,可用于临床判断曲妥珠单抗诱发心脏毒性副作用的检测。
11.所述试剂盒中包含用于检测所述生物标记物的试剂,具体的,当ptx3蛋白作为生物标记物时,所述试剂盒包含:抗ptx3抗体;当ptx3mrna作为生物标记物时,所述试剂盒包含引物对,所述引物对为:前引物:5
’‑
aacaaactggttgctgaagcc-3’;后引物:5
’‑
atgtgacctgtggccatctc-3’。
12.本发明还提供了五聚素3作为生物标记物在筛选治疗曲妥珠单抗心脏毒性副作用药物中的应用,所述生物标记物为氨基酸序列如seq id no.1所示的ptx3蛋白或核苷酸序列如seq id no.2所示的ptx3 mrna。
13.具体的,利用细胞或动物模型筛选靶向抑制ptx3释放或转录的药物,通过测定ptx3蛋白表达水平或ptx3 mrna转录水平来评判待测药物活性。
14.本发明的另一个目的是提供人表皮生长因子受体(egfr)抑制剂在制备治疗ptx3相关疾病或损伤的药物中的应用。
15.本发明经研究证明,敲低血管内皮细胞中的egfr基因可显著抑制ptx3的转录与分泌,采用egf激活egfr信号可促进ptx3的转录与分泌,提示egfr可作为调控ptx3的关键靶点。进一步地,本发明经研究证明,egfr抑制剂可显著降低血管内皮细胞中ptx3的转录水平、抑制其分泌,可用于治疗ptx3相关疾病或损伤。
16.进一步的,所述ptx3相关疾病或损伤为ptx3上调表达引起的心血管疾病。
17.进一步的,所述ptx3相关疾病或损伤为曲妥珠单抗诱发的心脏毒性反应。所述人表皮生长因子受体抑制剂通过与曲妥珠单抗联合用药可逆转曲妥珠单抗诱导的ptx3转录与分泌。
18.所述人表皮生长因子受体抑制剂包括但不局限于吉非替尼、azd3759或其药学上可接受的盐。
19.所述吉非替尼的化学名为n-(3-氯-4-氟苯基)-7-甲氧基-6-(3-吗啉-4-丙氧基)喹唑啉-4-胺,分子式为c
22h24
clfn4o3,分子量为446.90。联合用药时,吉非替尼的使用剂量为0.15-0.60μm。
20.所述azd3759的化学名为(2r)-2,4-二甲基-1-哌嗪羧酸4-[(3-氯-2-氟苯基)氨基]-7-甲氧基-6-喹唑啉基酯,分子式为c
22h23
clfn5o3,分子量为459.90。联合用药时,azd3759的使用剂量为2.5-10μm。
[0021]
进一步的,所述药物还包括药学上可接受的辅料。
[0022]
所述药物的制剂形式可以为口服固体制剂、口服液体制剂、注射液、冻干粉针剂、大输液剂型、贴剂、软膏剂、凝胶剂、软胶囊剂或栓剂。
[0023]
本发明还提供了抗肿瘤联合用药物组合物,包括人表皮生长因子受体抑制剂作为活性成分的第一制剂,以及曲妥珠单抗作为活性成分的第二制剂。所述药物组合物可应用
于制备治疗乳腺癌、胃癌的药物。
[0024]
本发明具备的有益效果:
[0025]
(1)针对曲妥珠单抗引发的心脏毒性,提供了一种诊断生物标记物ptx3,可用于临床曲妥珠单抗心脏毒性的检测以及毒性治疗药物的筛查,为曲妥珠单抗心脏毒性的检测与治疗药物发现提供有效策略;ptx3可在血清中检测到,可快速诊断心脏毒性是否发生。
[0026]
(2)本发明首次公开egfr是调控ptx3转录与分泌的关键靶点,egfr抑制剂可阻断血管内皮细胞ptx3的转录与分泌,可用于治疗ptx3相关疾病或损伤。
[0027]
(3)egfr抑制剂的用药浓度均低于临床剂量下的平均血药浓度,安全性高,临床可行性高。
附图说明
[0028]
图1为曲妥珠单抗对心肌细胞存活的直接影响,其中(a)为曲妥珠单抗作用于ccc-heh-2细胞系;(b)为曲妥珠单抗为作用于ipsc-cms模型。
[0029]
图2为曲妥珠单抗对心肌细胞收缩力的直接影响,其中(a)为曲妥珠单抗作用于ccc-heh-2细胞时细胞平表面积变化;(b)和(c)分别为曲妥珠单抗作用于ipsc-cms模型时细胞收缩幅度与搏动频率。
[0030]
图3为曲妥珠单抗血管内皮细胞条件培养基对心肌细胞存活影响,其中(a)为操作示意图;(b)为条件培养基作用于ccc-heh-2细胞系;(c)为条件培养基作用于ipsc-cms模型。
[0031]
图4为曲妥珠单抗血管内皮细胞条件培养基对心肌细胞收缩力的影响,其中(a)为条件培养基作用于ccc-heh-2细胞时细胞平表面积变化;(b)和(c)分别为条件培养基作用于ipsc-cms模型时细胞收缩幅度与搏动频率。
[0032]
图5为曲妥珠单抗上调血管内皮细胞中ptx3基因的转录水平。
[0033]
图6为曲妥珠单抗诱导血管内皮细胞释放ptx3情况,其中(a)为给予150μg/ml曲妥珠单抗作用24h前后细胞释放ptx3情况;(b)为不同浓度梯度的曲妥珠单抗作用下胞内胞外释放ptx3情况。
[0034]
图7为ptx3重组蛋白对心肌细胞收缩力的影响,其中(a)为ptx3作用于ccc-heh-2细胞系细胞平表面积变化;(b)为ptx3作用于ipsc-cms模型时细胞搏动幅度。
[0035]
图8为敲低egfr基因抑制ptx3的转录(a)与曲妥珠单抗诱导的ptx3的分泌(b)。采用shrna序列构建敲低egfr基因的突变huvec细胞株。其中nc为无意序列,作为阴性对照;#1和#2分别为2种egfr shrna序列敲低egfr基因后的突变株。
[0036]
图9为egfr激活促进ptx3的转录(a)与分泌(b)。
[0037]
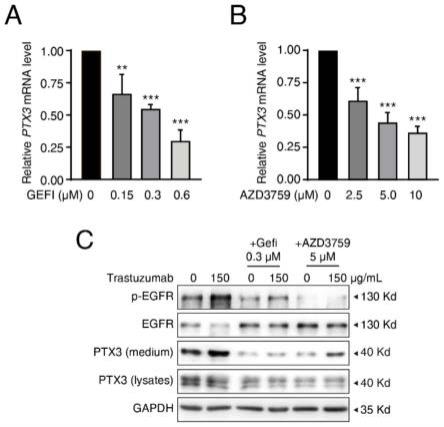
图10为egfr抑制剂抑制ptx3的转录与曲妥珠单抗诱导的ptx3的分泌,其中(a)和(b)分别为吉非替尼和azd3759直接作用后huvec细胞ptx3的mrna水平;(c)为0.3μm的吉非替尼或5μm的azd3759和/或与曲妥珠单抗作用于huvec细胞后ptx3的分泌情况。
具体实施方式
[0038]
下面结合具体实施例对本发明做进一步说明。以下实施例仅用于说明本发明,不用来限制本发明的适用范围。在不背离本发明精神和本质的情况下,对本发明方法、步骤或
条件所做的修改或替换,均属于本发明的范围。
[0039]
下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
[0040]
ccc-heh-2细胞系(广州吉妮欧生物科技有限公司);ipsc-cms模型(南京艾尔普再生医学科技有限公司);huvec细胞(广州吉妮欧生物科技有限公司);曲妥珠单抗(罗氏公司,由浙江大学医学院附属第一医院提供,cas号:180288-69-1);阿霉素(selleck公司,cas号:23214-92-8);地高辛(selleck公司,cas号:20830-75-5);ptx3重组蛋白(r&d systems公司),抗体(p-egfr(y1068)、egfr购自cell signalingtechnology公司;ptx3、gapdh购自santa cruz biotechnology公司);egf(上海昊海生物科技股份有限公司);ptx3试剂盒(elisa)(上海酶联生物科技有限公司);
[0041]
吉非替尼,化学名为n-(3-氯-4-氟苯基)-7-甲氧基-6-(3-吗啉-4-丙氧基)喹唑啉-4-胺,分子式为c
22h24
clfn4o3,分子量为446.90,结构式如下:
[0042]
azd3759,化学名为(2r)-2,4-二甲基-1-哌嗪羧酸4-[(3-氯-2-氟苯基)氨基]-7-甲氧基-6-喹唑啉基酯,分子式为c
22h23
clfn5o3,分子量为459.90,结构式如下:
[0043]
实施例1.曲妥珠单抗对心肌细胞的直接影响
[0044]
1、利用人胚胎心肌组织来源的ccc-heh-2细胞系考察曲妥珠单抗对心肌细胞存活的直接影响。
[0045]
曲妥珠单抗应用于临床时达到的平均血药浓度为150μg/ml,根据血药浓度设置了一系列浓度梯度(37.5、75、150与300μg/ml),将曲妥珠单抗作用于ccc-heh-2细胞72h后,利用srb法检测细胞存活情况。
[0046]
如图1a所示,曲妥珠单抗不明显影响ccc-heh-2细胞的存活。
[0047]
2、采用具有自主搏动性的ipsc-cms模型,取150μg/ml的曲妥珠单抗处理ipsc-cms,并同时设置阳性对照阿霉素(adriamycin,adr)组,设置时间点(0、0.5、1、2、3、6、9、12与24h),实时考察细胞的存活率。将每个时间点采集到的信息与对照孔进行归一化处理。
[0048]
从图1b的结果可以发现,adr处理下6h开始细胞存活率就出现明显下调,至24h时达到63.34
±
8.12%(p=0.02),与此同时曲妥珠单抗组相比的存活率为95.43
±
2.21%,进一步证明曲妥珠单抗不直接影响心肌细胞的存活。
[0049]
3、在体外水平构建了地高辛(digoxin)诱导的细胞收缩力检测模型,利用地高辛促进细胞收缩使平表面积减小进而在多种刺激条件下考察收缩能力的变化情况。
[0050]
在检测前先用150μg/ml曲妥珠单抗处理24h,再给予地高辛刺激观察1h,每20min拍摄一张照片。根据同一视野下的细胞的平表面积进行计算比较。
[0051]
从图2a结果可以看出,对照组或曲妥珠单抗组在给予地高辛后均可降低细胞的平表面积,在60min时与0min相比均发生了形态缩小,说明曲妥珠单抗处理下并不会影响地高辛给予后的细胞收缩,即曲妥珠单抗直接作用于心肌细胞后不影响其在刺激条件下的收缩力。
[0052]
4、进一步检测药物对ipsc-cms收缩力的影响,与adr不同的是,曲妥珠单抗在24h内不影响ipsc-cms的搏动频率与幅度(图2b、c)。adr组心肌细胞从12h起搏动频率明显下调,并在18h时细胞出现停跳的现象,这与adr直接杀伤ipsc-cms相关。这些结果共同提示,曲妥珠单抗并不影响心肌细胞的收缩力。
[0053]
实施例2.曲妥珠单抗通过血管内皮细胞间接降低心肌细胞收缩力
[0054]
1、在体外构建了血管内皮细胞条件培养基模型(图3a),以曲妥珠单抗处理huvec细胞24h后,取上清培养液用于培养心肌细胞,随后进行相应的检测。
[0055]
srb结果发现,经不同浓度(37.5、75、150与300μg/ml)曲妥珠单抗条件培养基(tra-medium)处理后的ccc-heh-2细胞的存活率分别为对照条件培养基(ctrl-medium)的104.35
±
12.98%、107.21
±
4.93%、107.59
±
7.84%和103.97
±
15.60%(图3b)。
[0056]
同样地,150μg/mltra-medium处理后的ipsc-cms细胞的存活率与对照细胞无明显差别(图3c)。
[0057]
这些结果提示,曲妥珠单抗血管内皮细胞条件培养基不会明显影响心肌细胞的存活率。
[0058]
2、进一步地,通过地高辛促细胞收缩模型考察了条件培养基对心肌细胞的收缩力的影响。
[0059]
如图4a的结果所示,60min时,ctrl-medium+digoxin组平均表面积相对值为79.24
±
15.97%(与ctrl-medium组相比,p=0.0053),而tra-medium+digoxin组平表面积相对值为100.19
±
7.84%(与tra-medium组相比,p=0.99),说明tra-medium处理会显著影响由地高辛本身所引起的细胞平表面积的减少。
[0060]
图4b、c的结果显示,150μg/ml tra-medium处理后的ipsc-cms细胞的搏动频率和幅度显著降低。
[0061]
这些结果共同说明,曲妥珠单抗血管内皮细胞条件培养基会影响心肌细胞收缩力,提示曲妥珠单抗可能通过影响血管内皮细胞从而引起心脏毒性作用。
[0062]
实施例3.血管内皮细胞释放的ptx3调控心肌细胞收缩力
[0063]
1、对曲妥珠单抗条件培养基进行富集浓缩,并通过lc-ms/ms对浓缩后的蛋白进行检测,鉴定出ptx3这一潜在关键因子。首先考察了曲妥珠单抗对ptx3基因转录水平的影响。
[0064]
在huvec细胞上给予不同浓度梯度的曲妥珠单抗(0、75、150与300μg/ml)作用12h后,通过rt-pcr检测ptx3的mrna水平。
[0065]
前引物:5
’‑
aacaaactggttgctgaagcc-3’;
[0066]
后引物:5
’‑
atgtgacctgtggccatctc-3’。
[0067]
如图5所示,75、150与300μg/ml曲妥珠单抗作用下,ptx3的mrna水平分别升高至对照的1.34
±
0.10倍(p=0.0401)、1.47
±
0.17(p=0.0059)倍和1.61
±
0.28(p=0.0007)倍,
说明曲妥珠单抗可上调ptx3基因的转录水平。
[0068]
2、进一步,在huvec细胞上给予150μg/ml曲妥珠单抗作用24h,收集上清进行elisa的检测。从图6a的结果可以看出,在曲妥珠单抗作用下,ptx3的水平由10.91
±
1.39ng/ml增加到16.67
±
2.34ng/ml(p=0.031)。
[0069]
随后在huvec细胞上给予不同浓度梯度的曲妥珠单抗(0、37.5、75、150与300μg/ml)作用24h后,收集上清经甲醇-氯仿沉淀富集蛋白后,通过western blot验证ptx3的释放情况。如图6b的western blot的结果显示,在曲妥珠单抗作用下胞内ptx3水平基本没有发生变化,而胞外ptx3的水平相对于对照组明显增加。
[0070]
这些结果共同证明曲妥珠单抗可诱导血管内皮细胞释放ptx3。
[0071]
3、通过地高辛促细胞收缩模型考察了ptx3对心肌细胞的收缩力的影响。
[0072]
如图7a的结果所示,在地高辛诱导细胞收缩模型上可以观察到40ng/ml ptx3作用细胞24h后,可明显抑制由地高辛所引起的细胞平表面积的降低(p=0.0003)。
[0073]
进一步在ipsc-cms上考察了ptx3对心肌细胞搏动频率和幅度的影响。给予ipsc-cms 40ng/ml ptx3后,按时间点(0、0.5、1、2、3、6、9、12、18、24、30、36、42与48h)检测细胞的搏动幅度。
[0074]
从图7b的结果可以看出搏动幅度在ptx3作用6小时后开始出现下调,从24h开始明显降低,24h开始的时间点对应的相对收缩力分别为0.80
±
0.07(p=0.010)、0.81
±
0.10(p=0.035)、0.77
±
0.07(p=0.0082)、0.80
±
0.04(p=0.0016)和0.78
±
0.06(p=0.0053)。
[0075]
以上结果共同说明ptx3可直接降低心肌细胞的收缩力,其可作为曲妥珠单抗心脏毒性诊断的生物标记物和治疗靶点。
[0076]
实施例4.egfr调控ptx3的转录与分泌
[0077]
1、采用两对靶向egfr的shrna序列敲低huvec细胞中的egfr基因考察egfr对ptx3转录与分泌的影响。
[0078]
如图8a的结果显示,敲低egfr基因后曲妥珠单抗组的ptx3的mrna水平由nc-曲妥珠单抗组的1.72
±
0.19倍降低至0.61
±
0.05倍(p=0.0000)和0.74
±
0.23倍(p=0.0001),提示敲低egfr基因可逆转曲妥珠单抗所升高的ptx3的mrna水平。
[0079]
随后,本发明考察了egfr基因敲低对曲妥珠单抗诱导的ptx3的分泌的影响。如图8b所示,敲低egfr基因可明显降低egfr的表达水平,逆转曲妥珠单抗诱导的ptx3的分泌。
[0080]
以上结果提示,egfr参与调控ptx3的转录与分泌。
[0081]
2、进一步采用egf激活egfr信号通路,考察egfr对ptx3转录与分泌的影响。
[0082]
如图9a的结果显示,10、20和40μg/ml的egf作用后ptx3的mrna水平分别升高至对照的1.56
±
0.04倍(p=0.0005)、1.77
±
0.09倍(p=0.0000)和2.11
±
0.19倍(p=0.0000),提示egfr激活可显著增加ptx3基因的mrna水平。
[0083]
如图9b所示,10、20和40μg/ml的egf作用后egfr的磷酸化水平明显增加,并且分泌型ptx3的水平明显增加。
[0084]
以上结果进一步证明信号通路参与调控ptx3的转录与分泌。
[0085]
3、考察了egfr抑制剂吉非替尼(gfei)和azd3759对ptx3转录与分泌的影响。
[0086]
如图10a的结果显示,0.15、0.3和0.6μm的吉非替尼直接作用后huvec细胞中ptx3的mrna水平分别降低至对照的0.67
±
0.15倍(p=0.0039)、0.55
±
0.03倍(p=0006)和0.30
±
0.08倍(p=0.0000)。
[0087]
如图10b的结果显示,2.5、5和10μm的azd3759直接作用后huvec细胞中ptx3的mrna水平分别降低至对照的0.61
±
0.10倍(p=0.0003)、0.44
±
0.08倍(p=0.0000)和0.37
±
0.05倍(p=0.0000)。提示egfr抑制剂可显著降低ptx3的mrna水平。
[0088]
如图10c所示,将0.3μm的吉非替尼或5μm的azd3759与150μg/ml曲妥珠单抗分别或同时作用于huvec细胞,二者均可明显逆转正常情况下的ptx3分泌或曲妥珠单抗诱导的ptx3的分泌。
[0089]
以上结果进一步证明egfr信号通路参与调控ptx3的转录与分泌,egfr抑制剂可用于抑制ptx3的转录与分泌,可用于ptx3相关疾病的治疗。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1