本申请是2015年2月9日提交的、名称为“ReagentCartridgeandMethodsforDetectionofCells(用于细胞检测的试剂盒和方法)”的美国专利申请序列号14/617,631的连续案且要求其优先权,该申请是2014年9月3日提交的、名称为“ReagentCartridgeandMethodsforDetectionofCells(用于细胞检测的试剂盒和方法)”的美国专利申请序列号14/476,392的部分连续案,该申请要求如下美国临时专利申请序列号的优先权和权益:2014年4月24日提交的、名称为“ReagentCartridgeforDetectionofCells(用于细胞检测的试剂盒)”的美国临时专利申请序列号61/983,765;2014年2月12提交的、名称为“SystemsandMethodsforPackagingNucleicAcidMoleculesintoNon-ReplicativeTransductionParticlesandTheirUseasCellularReporters(用于将核酸分子包装到非复制型转导颗粒中的系统和方法及其作为细胞报告体的用途)”的美国临时专利申请序列号61/939,126;和2013年10月29日提交的、名称为“TranscriptDetectionSystemsandMethods(转录检测系统和方法)”的美国临时专利申请序列号61/897,040,这些文献中的每一个的全部内容均通过引用并入本文中。2015年2月9日提交的、名称为“ReagentCartridgeandMethodsforDetectionofCells(用于细胞检测的试剂盒和方法)”的美国专利申请序列号14/617,631还要求如下美国临时专利申请序列号的优先权和权益:2014年4月24日提交的、名称为“ReagentCartridgeforDetectionofCells(用于细胞检测的试剂盒)”的美国临时专利申请序列号61/983,765;和2014年2月12日提交的、名称为“SystemsandMethodsforPackagingNucleicAcidMoleculesintoNon-ReplicativeTransductionParticlesandTheirUseasCellularReporters(用于将核酸分子包装到非复制型转导颗粒中的系统和方法及其作为细胞报告体的用途)”的美国临时专利申请序列号61/939,126,这些文献中的每一个的全部内容均通过引用并入本文中。本申请还要求2014年4月24日提交的、名称为“ReagentCartridgeforDetectionofCells(用于细胞检测的试剂盒)”的美国临时专利申请序列号61/983,765的优先权及其权益,该文献的全部内容通过引用并入本文中。
背景技术:
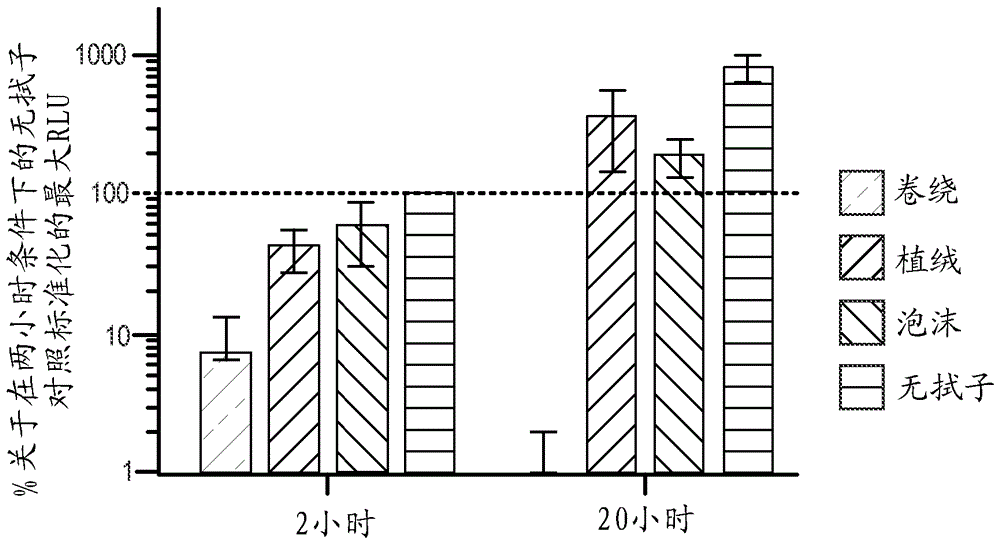
:本文中所述的实施例涉及用于使用改造的转导颗粒进行细胞检测的系统和方法。更具体地,本文中所述的实施例还涉及容器和仪器,在其内能够在集成的、封闭的系统中利用简易(walkaway)功能对细菌进行检测。细菌(尤其是耐药菌株)的检测是在诊断细菌感染和限制细菌感染的传播中的重要步骤。例如,MRSA是通过在美国很大一部分人口携带的常见金黄色葡萄球菌的耐药变体。MRSA的大部分感染发生在医院中,且可具有高死亡率(在美国每年大约19,000人死于MRSA感染)。因此,存在对导致感染的细菌菌株(包括其表型和/或基因型以及其他分子目标),诸如MRSA,进行有效、准确且快速识别的需要。特别重要的是能够从各种不同的样本(例如,人类样本、环境样本、植物样本、兽医样本、食物样本等等)中识别细菌表型和/或基因型和其他分子目标,以便能够以及时的方式开始适当的治疗和控制方案。用于识别细菌的一个已知方法包括细菌培养。培养是高度敏感的,但是常常需要18个小时或更长时间才能产生结果,且因此不适于快速诊断或用于有效筛选目的。已知的培养方法常常使用要求受过高级培训的人员进行化验的系统来进行,并且因此不适于在各种不同的环境中使用。已知的培养方法还易于受到污染,这可能导致假阳性和/或细菌的错误识别。而且,已知的培养方法针对各种菌种的识别采用专门定制的培养方案,因此测试广泛的细菌系列对象(panel)能够迅速提高成本。直接细菌免疫检测(即,使用抗体抗原反应的检测)是用于细菌检测的另一种方法。已知的免疫检测方法相比培养能够更快速且以更低成本产生结果,但是常常受限于用于所感兴趣的细菌菌株的选择性抗体的可用性,且可用的抗体易于发生交叉反应。这些已知的方法相比培养还更不敏感,因此常常仍然存在细菌扩增的需要,这会延长化验时间。用于检测细菌细胞的其他已知方法包括提取和分析诸如DNA或RNA的核酸。用于从样本提取核酸的已知方法常常包括几个严格的样本制备步骤,其需要昂贵且专门的装备。尤其,这样的步骤包括1)通过添加蛋白酶移除在含有细菌或细胞的样本内的蛋白质;2)分解剩余的总样本(bulksample)以暴露其中含有的核酸(也称为细胞裂解);3)从样本沉淀核酸;4)洗涤和/或以其他方式制备核酸用于进一步分析;5)分析核酸以识别物种。在制备样本之后,已知分析方法能够包括聚合酶链反应(PCR)、基因序列测定、基因指纹图谱、荧光、免疫测定、电化学免疫测定、基因芯片、任何其他合适的技术或其组合。已经发现PCR的广泛商业用途,但是常常需要涉及昂贵试剂和测试设备的多个步骤。涉及PCR的许多已知方法不适于台式测试(例如,其要求相对熟练的人员)。而且,已知PCR方法采用热循环和/或升高的温度,这会增加分析的成本、时间和/或复杂度。此外,因为基于核酸扩增的技术不测量细菌对于抗生素的反应,所以这样的技术不适于抗生素敏感性测试。最后,因为核酸扩增方法裂解样本细胞,所以这样的方法不能区分活细胞和死细胞。用于细胞识别的一些已知系统和方法包括使用噬菌体来识别和/或检测某些细菌。在一些已知方法中,用报告分子标记的噬菌体能够用于以特定细菌菌株为目标和感染特定细菌菌株。在感染之后,噬菌体能够经历裂解循环(即,破坏细胞壁以杀死目标细菌)和/或溶原循环(即,在没有杀死细菌的情况下噬菌体连同细菌一起复制),之后是检测扩增的子代噬菌体。依赖于噬菌体检测的这样的已知方法常常包括限制性或复杂的步骤。例如,用于识别的一些已知的基于噬菌体检测的方法依赖于噬菌体复制(在此期间,细菌能够被裂解),且通常要求用于促进该过程的细胞培养。一些已知的基于噬菌体检测的方法要求使用仔细地计量的和/或pH受控的试剂从样本中移除或“解除结合”特异性结合的噬菌体。而且,一些已知的基于噬菌体检测的方法依赖于仔细计量所添加的噬菌体的量和/或包括打开或关闭反应室以添加/移除试剂,这会导致试剂的污染和/或过早混合,从而导致不正确的结果并且使得化验本质上是复杂的。一些已知的基于噬菌体的系统和方法能够导致试剂到封闭系统中的非期望和/或不一致输送。例如,一些已知系统和方法输送试剂到样本中,以促进能光学地检测到的反应。这样的试剂的不一致和/或不准确的输送能够导致与光检测相关联的非期望变化性,潜在地错误读数等等。一些已知系统采用密封的试剂容器或“泡罩包装”,以隔离试剂和样本直到期望输送试剂为止。为了促进试剂从泡罩包装输送,一些已知系统包括机构,诸如滚动件,以排出试剂(参见例如,W02005/085855,图31)。其他已知系统包括多个穿刺件以促进泡罩包装的破裂(参见例如,W02007/115378,图16)。然而,过多“死体积”(在致动之后在泡罩包装内能够包含试剂的体积)能够导致不一致的输送时间和/或量。而且,在输送试剂时,已知系统的输送机构能够产生非期望效果(例如,过多的飞溅或不完全的混合)。因此,许多已知系统不适应与闪光发光反应(flashluminescencereaction)相关联的试剂的输送。除了关于使用基于噬菌体的方法的上述缺点之外,已知方法不采用自动设备或测试设备,以实现“简易”噬菌体识别系统。例如,许多已知系统不适应封闭系统处理和/或信号的测量,该信号由某些报告分子(诸如例如,闪光发光反应)产生。因此,已知系统和方法需要熟练的人员和对样本进行精通处理,这能够增加假阳性或阴性的可能性。因此,存在对于改进的器械和方法的需要,所述器械和方法用于对临床样本中的菌种进行快速、有成本效益且容易的检测和识别。尤其,在这样的系统内存在对于改进的破裂结构和输送路径的需要。此外,存在对于改进的器械和方法的需要,所述器械和方法用于临床样本从收集点到测试位置的有效储存和转移。技术实现要素:在本文中描述了用于使用改造的载体(包括病毒载体)和/或转导颗粒检测和/或识别目标细胞(例如,细菌)的系统和方法。在一些实施例中,器械包括壳体和致动器。限定能够接收试剂容器的试剂体积的壳体能够能移除地联接到反应室。壳体包括穿刺件,其限定与试剂体积流体连通的转移路径。在壳体联接到反应室时,壳体的输送部分限定在转移路径和反应室之间的输送路径。致动器具有安置在试剂体积内的柱塞部分。能够操纵致动器的接合部分以在试剂体积内移动柱塞部分,以使试剂容器变形。穿刺件能够刺穿试剂容器的易破部分,以将试剂从试剂容器经由转移路径和/或输送路径传送到反应室中。附图说明图1-3是根据实施例分别处于第一构造、第二构造和第三构造的容器组件的示意图。图4是沿着图1中的线X-X截取的、在图1-3中示出的容器组件的一部分的横截面视图。图5是根据实施例的容器组件的示意图。图6和图7是根据实施例分别处于第一构造和第二构造的容器组件的示意图。图8是在图6和图7中示出的容器组件的一部分的顶视图。图9是响应于所施加的力变形的在图6和图7中示出的容器组件的一部分的示意图。图10和图11分别示出根据实施例的容器组件4700的透视图和分解视图。图12是在图10和图11中示出的容器组件的壳体的俯视透视图。图13是在图10和图11中示出的容器组件的壳体的横截面视图。图14是在图13中标记为区域Z的壳体的部分的放大视图。图15是在图10和图11中示出的容器组件的试剂容器的横截面视图。图16是在图10和图11中示出的容器组件的致动器的横截面视图。图17和图18是相应地处于第一构造和第二构造的图10和图11中示出的容器组件的横截面视图。图19是在图18中标记为区域Z的容器组件的部分的放大视图。图20是根据实施例,包括在图10和图11中示出的容器组件的试剂盒。图21是根据实施例的方法的示意性流程图解。图22是根据实施例的方法的流程图。图23是根据实施例的方法的流程图。图24是根据实施例的壳体组件的横截面视图。图25A-25C分别是根据实施例的壳体组件的侧视图、前视图和底视图。图26和图27是根据实施例的壳体组件的前视图。图28是测试程序的示意图以及人造丝卷绕拭子(Rayonwoundswab)与尼龙泡沫拭子比较的测试结果。图29是比较卷绕拭子、植绒拭子和泡沫的测试程序的示意图。图30A和图30B是示出通过在图29中指出的测试得到的结果的柱状图。图31是通过比较底物的各种不同注射速度的测试得到的结果的柱状图。具体实施方式在本文中描述了用于使用改造的载体(包括病毒载体)和/或转导颗粒检测和/或识别目标细胞(例如,细菌)的系统和方法。在一些实施例中,器械包括壳体和致动器。限定能够接收试剂容器的试剂体积的壳体能够能移除地联接到反应室(例如,其能够包含包括目标细胞的样本)。试剂容器能够安置在试剂体积内,且能够包含任何合适的试剂或物质。例如,试剂容器能够包含一种或多种转导颗粒、配制成与样本中的一种或多种报告分子反应以增强信号的产生或以其他方式增加信号或其他化验组分的试剂、十三醛、营养物、抗生素、裂解试剂、消毒试剂等等。壳体包括穿刺件,其限定与试剂体积流体连通的转移路径。在壳体联接到反应室时,壳体的输送部分限定在转移路径和反应室之间的输送路径。在一些实施例中,输送路径的至少一部分能够至少部分地环绕穿刺件。致动器具有安置在试剂体积内的柱塞部分。能够操纵致动器的接合部分以在试剂体积内移动柱塞部分,以使试剂容器变形。穿刺件能刺穿试剂容器的易破部分,以将试剂从试剂容器经由转移路径和/或输送路径传送到反应室中。在一些实施例中,器械包括壳体、试剂容器、致动器和锁定构件。壳体能够能移除地联接到反应室(例如,其能够包含目标细胞)。壳体限定试剂体积且包括限定输送路径的输送部分。在壳体联接到反应室时,输送路径将试剂体积置放成与反应室流体连通。输送部分具有与输送路径流体连通的穿刺件。试剂容器安置在壳体的试剂体积内且能够包含任何合适的试剂或物质。例如,试剂容器能够包含一种或多种转导颗粒、配制成与样本中的一种或多种报告分子反应以增强信号的产生或以其他方式增加信号或其他化验组分的试剂、十三醛、营养物、抗生素、裂解试剂、消毒试剂等等。试剂容器具有易破部分和环绕易破部分的裙部。致动器包括安置在试剂体积内的柱塞部分。能够操纵致动器以在试剂体积内移动柱塞部分,以使试剂容器从第一构造变形到第二构造。穿刺件被构造成在试剂容器处于第二构造时刺穿试剂容器的易破部分,以将试剂从试剂容器经由输送路径传送到反应室中。在试剂容器处于第二构造时,锁定构件能够维持裙部与壳体的输送部分的肩部接触,以维持在裙部和肩部之间的基本上流体密闭的密封。在一些实施例中,器械包括壳体、试剂容器和致动器。壳体能够能移除地联接到反应室(例如,其能够包含目标细胞)。壳体包括输送部分,其限定输送路径且包括与输送路径流体连通的穿刺件。在壳体联接到反应室时,输送路径将试剂体积置放成与反应室流体连通。试剂容器安置在壳体的试剂体积内且能够包含任何合适的试剂或物质。例如,试剂容器能够包含一种或多种转导颗粒、配制成与样本中的一种或多种报告分子反应以增强信号的产生或以其他方式增加信号或其他化验组分的试剂、十三醛、营养物、抗生素、裂解试剂、消毒试剂等等。试剂容器包括接触部分、易破部分和环绕易破部分的裙部。致动器具有安置在试剂体积内的柱塞部分。柱塞部分能够对应于试剂容器的接触部分或穿刺件中的一个或多个。能够操纵致动器以在试剂体积内移动柱塞部分,使得柱塞部分接合试剂容器的接触部分,以使试剂容器从第一构造变形到第二构造。穿刺件被构造成在试剂容器处于第二构造时刺穿试剂容器的易破部分,以将试剂从试剂容器经由输送路径传送到反应室中。在一些实施例中,方法包括将样本安置在反应室中。反应室被包装以包含试剂(例如,液体或干燥成分,诸如药片),其被配制成与样本混合以形成化验培养基。与细胞表型相关联的一种或多种转导颗粒与反应室中的样本混合。一种或多种转导颗粒被改造成包括核酸分子,其被配制成导致细胞表型产生一种或多种报告分子。试剂被配制成在细胞表型的一部分中抑制一种或多种报告分子的产生。试剂能够包括任何合适的物质。例如,试剂能够包括抗生素和/或着色剂。接收与试剂相关联的第一信号。第一信号能够与试剂的任何合适的特性相关联,诸如试剂的颜色,且能够因此用于指示和/或确认试剂的存在。在第一信号指示存在试剂时维持样本和一种或多种转导颗粒,以在细胞表型存在于样本中时表达一种或多种报告分子。接收与一种或多种报告分子的量相关联的第二信号。在一些实施例中,配制成与一种或多种报告分子反应的物质能够安置到样本中,以生成或增强第二信号。在一些实施例中,方法包括接收包含拭子和运送培养基的容器。拭子包括轴和由非-卷绕材料构造的收集部分。运送培养基包括从收集部分释放的样本。收集部分能够从非卷绕结构的任何合适材料构造和/或包括非卷绕结构的任何合适材料。例如,收集部分能够从泡沫材料构造和/或包括泡沫材料。将运送培养基和样本转移到反应室中。运送培养基在反应室中与一种或多种转导颗粒(其与目标细胞相关联)混合。一种或多种转导颗粒被改造成包括核酸分子,其被配制成导致目标细胞产生一种或多种报告分子。一种或多种报告分子能够包括任何合适的物质。例如,一种或多种报告分子能够包括细菌荧光素酶、真核荧光素酶、荧光蛋白质、适用于比色法检测的酶、适用于免疫检测的蛋白质、适用于免疫检测的肽、和/或用作适体或显示酶活性的核酸。运送培养基和一种或多种转导颗粒的混合物在至少20摄氏度的温度维持大约八小时或更短的时段,以在目标细胞存在于样本中时表达一种或多种报告分子。能够接收与一种或多种报告分子的量相关联的信号。在其他实施例中,收集部分可直接地添加到或安置在反应室内。在这样的实施例中,收集部分可在整个化验中保持在反应室中,或者其可以在收集部分上的样本释放到反应室中之后从反应室中移除。如本文中所述的,术语“基因”、“DNA”和“核甘酸”意指目标细菌或载体的基因序列的整体或一部分。如本文中所述的,术语“质粒”意指包含在载体内的改造的基因、序列和/或分子,其包括调控元件、与目标基因同源的核酸序列、及各种报告构建体,用于导致活细胞内的报告分子的表达和/或在目标细胞内何时存在细胞内分子。“转导颗粒”指的是能够将非病毒核酸分子输送到细胞中的病毒。病毒能够是噬菌体、腺病毒等。“非复制型转导颗粒”指的是能够将非病毒核酸分子输送到细胞中的病毒,但是不将其自身复制的病毒基因组包装到转导颗粒中。病毒能够是噬菌体、腺病毒等。如在本文中使用的,“报告核酸分子”指的是包括DNA或RNA分子的核甘酸序列。报告核酸分子能够是天然存在的或者人造或合成的分子。在一些实施例中,报告核酸分子对于宿主细胞是外源的,且能够作为外源核酸分子(诸如质粒或载体)的部分被引入到宿主细胞中。在某些实施例中,报告核酸分子能够与细胞中的目标基因互补。在其他实施例中,报告核酸分子包括报告基因,其编码报告分子(例如,报告酶、蛋白质)。在一些实施例中,报告核酸分子被称为“报告构建体”或“核酸报告构建体”。如在本文中使用的,“报告分子”或“报告体”指的是赋予生物体能检测或能选择性表型的分子(例如,核酸或蛋白质)。能检测的表型能够是例如比色的、荧光的或发光的。报告分子能够从如下表达:编码调节发光反应的酶(luxA、luxB、luxAB、luc、rue、nluc)的报告基因、编码调节比色反应的酶(lacZ、HRP)的基因、编码荧光蛋白质(GFP、eGFP、YFP、RFP、CFP、BFP、mCherry、近红外荧光蛋白质)的基因、编码亲和肽(组氨酸标签、3X-FLAG)的核酸分子、及编码可选择性标记(ampC、tet(M)、氯霉素乙酰转移酶(CAT)、erm)的基因。报告分子能够用作用于将核酸分子或外源序列(质粒)成功摄取到细胞中的标记。如本文中所述,报告分子还能够用来指示目标基因、目标核酸分子、目标细胞内分子或细胞的存在。替代地,报告分子能够是报告核酸分子其本身,诸如适体或核酶。在一些实施例中,报告核酸分子操作地连结到启动子。在其他方面,基于启动子在特定细胞(例如,特定物种)中而不是在其他细胞中的活性,能够选择或设计启动子成有助于报告系统的反应和交叉反应。在某些方面中,报告核酸分子包括复制源。在其他方面,基于复制源在特定细胞(例如,特定物种)中而不是在其他细胞中的活性,当目标细胞内的报告核酸分子的复制有助于报告信号产生或报告信号产生需要报告核酸分子的复制时,复制源的选择能够类似地有助于报告系统的反应和交叉反应。在一些实施例中,报告核酸分子形成复制子,其能够在病毒复制期间作为多联DNA包装到子代病毒中。如在本文中使用的,单数形式“一”、“一个”和“所述”包括复数个指示物,除非上下文中另有明确指示。因此,例如,术语“构件”预期意指单个构件或构件的组合,“材料”预期意指一种或多种材料,或者其组合。如在本文中使用的,涉及其多个部件或部分的术语预期指的是其第一部件或第一部分,和/或其第二部件或第二部分,除非上下文中另有明确指示。因此,例如,术语“穿刺件”预期指的是“第一穿刺件”和/或“第二穿刺件”。如在本文中使用的,术语“大约”和“近似”通常意指所陈述的值加10%或者减10%。例如,大约0.5将包括0.45和0.55,大约10将包括9到11,大约1000将包括900到1100。术语“流体密闭”被理解为包含气密密封(即,气体不能透过的密封)以及液体不能透过的密封二者。在结合“流体密闭的”、“气体不能透过的”和/或“液体不能透过的”使用时,术语“基本上”预期传达:虽然期望完全流体不能透过,但是由于制造公差或其他实际考虑(诸如例如施加到密封和/或在流体内的压力),甚至在“基本上流体密闭的”密封中也能够出现一些最低限度的泄漏。因此,“基本上流体密闭的”密封包括下述密封,在该密封被维持在恒定位置且处于小于大约5psig、小于大约10psig、小于大约20psig、小于大约30psig、小于大约50psig、小于大约75psig、小于大约100psig及在其之间的所有值的流体压力时,该密封防止流体(包括气体、液体和/或浆液)传递通过其。类似地,“基本上液体密闭的”密封包括下述密封,在该密封维持在恒定位置处且暴露于小于大约5psig、小于大约10psig、小于大约20psig、小于大约30psig、小于大约50psig、小于大约75psig、小于大约100psig及在其之间的所有值的流体压力时,该密封防止液体(例如,液体药剂)传递通过其。图1-3示出根据实施例的处于第一构造(图1)、第二构造(图2)和第三构造(图3)的容器组件1700。容器组件1700能够与在本文中以及在名称为“SystemsandMethodsforDetectionofCellsusingEngineeredTransductionParticles(用于使用改造的转导颗粒进行细胞检测的系统和方法)”的美国专利申请号13/802,461(“‘461申请”)中描述的仪器中的任一者和/或部件中的任一者一起使用且通过其操纵,所述文献的全部内容通过引用并入本文中。以该方式,根据在本文中或在‘461申请中描述的方法中的任一者,容器组件1700和本文中所述的容器组件中的任一者能够用于检测和/或识别样本内的目标细胞(例如,细菌)。例如,在一些实施例中,容器组件1700能够用于将试剂安置和/或混合到样本中,同时维持在容器和外部区域之间的流体隔离。以该方式,细胞识别的方法能够在封闭系统和/或均相化验中进行。类似地陈述,在一些实施例中,容器组件1700在不涉及从容器组件1700移除内容物、在容器组件1700内分离内容物、在容器组件1700内洗涤内容物和/或在容器组件1700内冲洗内容物的细胞识别和/或检测的方法中使用。容器组件1700包括壳体1741、致动器1750和反应室1732。壳体1741能移除地联接到反应室1732。例如,在一些实施例中,壳体1741能够螺纹联接到反应室1732。在其他实施例中,壳体1741和反应室1732能够形成过盈配合,以将壳体1741联接到反应室1732。壳体1741限定构造成接收试剂容器1780的试剂体积1742。壳体1741包括穿刺件1792和输送部分1770。在一些实施例中,壳体1741、输送部分1770和/或穿刺件1792能够整体地构造。在其他实施例中,壳体1741、输送部分1770和/或穿刺件1792能够单独地形成且然后结合在一起。穿刺件1792被构造成刺穿(例如,破裂)试剂容器1780的易破部分1788,以将试剂从试剂容器1780传送到反应室1732中。如在图1-3中所示,穿刺件1792包括终止于构造成刺穿试剂容器1780的单个尖端中的结构。而且,穿刺件1792的该结构限定与试剂体积1742流体连通的转移路径1793。如在图4中所示,在一些实施例中,包括转移路径1793导致在穿刺件1792中不连续的横截面形状(在单个尖端之下或在其“下游”示出了横截面视图)。因此,如在本文中更详细地描述的,在穿刺件1792刺穿试剂容器1780时,转移路径1793提供试剂容器1780中的内容物能够通过其流动的路径。如图所示,路径1793不平行于试剂容器1780的易破部分1788。尤其,路径1793基本上垂直于试剂容器1780的易破部分1788。以另一种方式来说,路径1793与致动器1750的运动方向(参见箭头AA)对准和/或平行。而且,转移路径1793的布置和/或穿刺件1792的横截面形状能够限制可能由于刺穿导致的堵塞或阻塞,以及在致动之后的“死体积”,因此提供试剂容器1780中的内容物的更加能重复的输送。尽管示出为包括单个尖端,但是在其他实施例中,穿刺件能够包括锐利边缘(例如,线性边缘)和/或构造成刺穿试剂容器的突出部系列。在这样的实施例中,例如,支撑或限定突出部的系列中的每一个的结构能够限定转移路径(类似于转移路径1793)。尽管示出为平行于易破部分1788的基本上线性路径,但是在其他实施例中,转移路径1793能够具有任何合适的形状、方向和/或构造,诸如例如螺旋形、逐渐变细形状等等。尽管转移路径1793的横截面形状在图4中示出为弯曲的和/或半圆形的,但是在其他实施例中,转移路径1793的横截面形状能够具有任何合适的形状。而且,转移路径1793的形状和/或大小能够变化(例如,根据距穿刺末端的距离)。尽管穿刺件1792示出为包括单个转移路径1793,但是在其他实施例中,穿刺件能够限定任何合适数目的转移路径。输送部分1770被构造成促进将内容物从试剂容器1780和/或试剂体积1742输送到反应室1732中。因此,如图所示,输送部分1770能够提供任何合适的路径和/或机构,用于将安置在试剂容器1780和/或试剂体积1742中的转导颗粒和/或试剂输送到反应室1732中。尤其,输送部分1770限定在转移路径1793和反应室1732之间的输送路径1771。输送路径1771能够具有任何合适的大小和/或形状,且能够适应通过其的任何期望的流动速率。例如,在一些实施例中,转移路径1793和/或输送路径1771能够适应任何合适的流动速率,例如,1ml/秒、2ml/秒、3ml/sec、4ml/秒、5ml/秒。致动器1750具有安置在试剂体积1742内的柱塞部分1754和接合部分1752。致动器1750的接合部分1752被构造成被操纵以在试剂体积1742内移动柱塞部分1754以使试剂容器1780变形。以该方式,柱塞部分1754的运动能够推动试剂容器1780的易破部分1788抵靠穿刺件1792以刺穿和/或破裂易破部分1788。致动器1750的柱塞部分1754和壳体1741的一部分能够共同地限定密封,以将试剂体积1742与壳体1741外的体积流体地和/或光学地隔离。试剂容器1780能够完全地或部分地填充有任何合适的试剂或物质。例如,试剂容器1780能够包含转导颗粒,其包括改造的核酸,其被配制成导致目标细胞(例如,细菌)产生一种或多种报告分子。在一些实施例中,试剂容器1780能够包含一种或多种转导颗粒,其被改造成不能复制(例如,裂解性复制、溶原复制)。例如,在一些实施例中,试剂容器1780能够包含在本文中以及在如下文献中描述的转导颗粒中的任一者:2014年4月24日提交的、名称为“ReagentCartridgeforDetectionofCells(用于细胞检测的试剂盒)”的美国临时申请号61/983,765;2013年3月13日提交的、名称为“Non-ReplicativeTransductionParticlesandTransductionParticle-BasedReporterSystems(非复制型转导颗粒和基于转导颗粒的报告系统)”的美国临时申请号61/779,177;2014年2月12日提交的、名称为“SystemsandMethodsforPackagingNucleicAcidMoleculesintoNon-ReplicativeTransductionParticlesandTheirUseasCellularReporters(用于将核酸分子包装到非复制型转导颗粒中的系统和方法及其作为细胞报告体的用途)”的美国临时申请号61/939,126;以及2013年10月29日提交的、名称为“TranscriptDetectionSystemsandMethods(转录检测系统和方法)”的美国临时申请号61/897,040,和2014年3月13日提交的、名称为“Non-ReplicativeTransductionParticlesandTransductionParticle-BasedReporterSystems(非复制型转导颗粒和基于转导颗粒的报告系统)”的国际专利申请号PCT/US2014/026536,这些文献中的每一个的全部内容均通过引用并入本文中。在一些实施例中,试剂容器能够包含试剂,其被配制成与一种或多种报告分子反应以生成和/或增强信号的产生。对于另一示例,试剂容器1780能够包括底物,诸如十三醛,其能够与报告分子(例如,荧光素酶)相互作用,以例如经由发光反应产生能测量的信号。对于又另一示例,在一些实施例中,试剂容器1780能够包括营养物、抗生素(例如,β-内酰胺、超广谱β-内酰胺、氨基糖甙类、安沙霉素类、碳头孢烯类、碳青霉烯类,任一代头孢菌素、糖肽类、林可酰胺类、脂肽类、大环内酯类、单菌胺类、硝基呋喃类、恶唑烷酮类、青霉素类、多肽、喹诺酮类、氟喹诺酮类、磺酰胺类、四环素类、分枝杆菌抗生素、氯霉素、莫匹罗星)、裂解试剂、消毒试剂、着色剂等等。试剂容器1780能够被成形和确定大小成基本上安置在试剂体积1742内。试剂容器1780能够由对于包含在其中的物质(例如,转导颗粒、底物、抗生素、缓冲剂、表面活性剂或能够与检测化验一起使用的任何其他试剂)和外部环境基本上不能渗透和/或基本上呈化学惰性的材料构造。试剂容器1780的至少一部分(例如,易破部分1788)能够由具有特定温度特性的材料(例如,聚合物薄膜,诸如任何形式的聚丙烯)构造,使得在特定温度以上维持期望的性能和完整性。例如,在一些情形中,可能期望在冷藏条件下储存包含试剂和/或底物的试剂容器1780。在一些实施例中,试剂容器1780的一部分能够由双向拉伸聚丙烯(BOP)构造。在一些实施例中,试剂容器1780的一部分能够由铝构造。在一些实施例中,试剂容器1780的一部分能够由聚氯乙烯(PVC)、乙烯-乙烯醇(EVOH)、聚乙烯(PE)和/或聚三氟氯乙烯(PCTFE或PTFCE)构造。反应室1732被构造成包含样本和/或其他试剂,且能够由任何合适材料形成,例如,玻璃、塑料(例如,聚丙烯)、丙烯酸等。在一些实施例中,反应室1732能够由轻质、刚性和/或惰性的材料形成。反应室1732的至少一部分(例如,远端端部部分)能够至少部分地是透明的,以允许观察、光学接近和/或检测反应室1732的内体积。在一些实施例中,反应室1732的远端端部部分能够被抛光以促进光通过其的最佳透射。尽管示出为被成形为带有圆形底部的筒体,但是在其他实施例中,反应室1732能够具有任何其他合适的形状,例如,正方形、矩形、卵形、多边形、椭圆形、锥形等。例如,在一些实施例中,反应室1732能够具有基本上平坦的底部。在一些实施例中,反应室1732能够具有12mm的直径和75mm的高度。在一些实施例中,容器组件1700能够设有呈液体和/或干燥形式的一种或多种溶液/试剂(例如,细菌营养物溶液、缓冲剂、表面活性剂、转导颗粒、着色剂和/或抗生素),其预置在反应室1732内。在一些情形中,反应室1732能够包含任何合适的试剂和/或物质。例如,在一些实施例中,反应室1732能够包含一种或多种转导颗粒、配制成与样本中的一种或多种报告分子反应以生成和/或增强信号的产生的试剂、营养物、抗生素、裂解试剂、消毒试剂、着色剂等等。如在图1中所示,容器组件1700处于第一构造。在第一构造中,致动器1750定位成使得安置在壳体1741内的试剂容器1780基本上没有变形。类似地陈述,致动器1750定位成使得其不导致穿刺件1792刺穿试剂容器1780。因此,在处于第一构造时,容器组件1700处于“就绪”状态。在一些实施例中,容器组件1700能够包括安全机构(未示出),以防止和/或限制致动器1750相对于壳体1741的运动直到操作者需要为止。为了致动容器组件1700,对致动器1750的接合部分1752施加力,因此导致致动器1750如通过图2中的箭头AA所示的运动。如在图2中所示,容器组件1700处于第二(或“中间”)构造。在第二构造中,致动器1750定位成使得试剂容器1780部分地变形。类似地陈述,致动器1750定位成使得所述力的至少一部分转移到试剂容器1780。因此,试剂容器1780的至少一部分开始变形。在一些情形中,在第二构造中,穿刺件1792能够至少部分地刺穿试剂容器1780的一部分(例如,易破部分1788),因此使试剂容器1780的内体积置放成与转移路径1793和/或输送路径1771流体连通。如在图3中所示,容器组件1700处于第三(或“配置”)构造。在第三构造中,致动器1750定位成使得试剂容器1780显著变形。类似地陈述,致动器1750定位成使得所述力的至少一部分转移到试剂容器1780。在这样的构造中,穿刺件1792已经刺穿试剂容器1780(例如,易破部分1788),使得试剂容器中的内容物已经基本上离开试剂容器1780且经由转移路径1793进入输送部分1770和/或反应室1732,如通过箭头BB所示。在使用中,操纵致动器1750(例如,接合部分1752)以在壳体1741内移动柱塞部分1754,使得柱塞部分1754接合试剂容器1780的接触部分(在图1-3中未指示),以使试剂容器1780从第一构造部分地变形到第二构造。在柱塞部分1754接合试剂容器1780的接触部分时,穿刺件1792刺穿试剂容器1780的一部分(例如,易破部分1788),以将试剂从试剂容器1780至少部分到经由转移路径1793传送到反应体积1742、输送部分1770、和/或反应室1732中。从第二构造到第三构造,操纵致动器1750以在壳体1741内移动柱塞部分1754,使得柱塞部分1754接合试剂容器1780的接触部分,以使试剂容器1780从第二构造变形到第三构造。在试剂容器1780从第二构造变形到第三构造时,基本上全部其内容物(例如,试剂)被从试剂容器1780传送到反应体积1742、输送部分1770、和/或反应室1732中,使得在试剂容器1780中的“死体积”是有限的。以该方式,能够获得内容物从试剂容器1780到反应室1732的基本上能重复的输送。例如,在一些实施例中,第一试剂容器在第一时间的变形和第二试剂容器在第二时间(在第一时间之后)的变形能够基本上类似,因此允许在第一时间和第二时间从试剂容器1780转移基本上全部的内容物。而且,该布置能够限制可能由于试剂容器1780的刺穿导致的堵塞或阻塞,因此提供试剂容器1780中的内容物的更加能重复的输送。图5示出根据实施例的容器组件2700。容器组件2700能与在本文中以及在‘461申请中描述的仪器中的任一者和/或部件中的任一者一起使用并通过其操纵,‘461申请的全部内容通过引用并入本文中。以该方式,根据在本文中或在‘461申请中描述的方法中的任一者,容器组件2700和本文中所述的容器组件中的任一者能够用于检测和/或识别样本内的目标细胞(例如,细菌)。例如,在一些实施例中,容器组件2700能够用于将试剂安置和/或混合到样本中,同时维持在容器和外部区域之间的流体隔离。以该方式,细胞识别的方法能够在封闭系统和/或均相化验中进行。类似地陈述,在一些实施例中,容器组件2700在不涉及从容器组件2700移除内容物、在容器组件2700内分离内容物、在容器组件2700内洗涤内容物和/或在容器组件2700内冲洗内容物的细胞识别和/或检测的方法中使用。容器组件2700包括壳体2741、反应室2732、试剂容器2780、致动器2750和锁定构件2772。壳体2741能移除地联接到反应室2732。例如,在一些实施例中,壳体2741能够螺纹联接到反应室2732。在其他实施例中,壳体2741和反应室2732能够形成过盈配合,以将壳体2741联接到反应室2732。壳体2741限定试剂体积2742且包括输送部分2770。输送部分2770包括穿刺件2792。在一些实施例中,壳体2741、输送部分2770、和/或穿刺件2792能够整体地构造。在其他实施例中,壳体2741、输送部分2770、和/或穿刺件2792能够单独地形成且然后结合在一起。输送部分2770被构造成促进内容物从试剂容器2780和/或试剂体积2742输送到反应室2732中。因此,如图所示,输送部分2770能够提供任何合适的路径和/或机构,用于将安置在试剂容器2780和/或试剂体积2742中的内容物输送到反应室2732内。尤其,输送部分2770限定在试剂体积2742和反应室2732之间的输送路径2771。输送路径2771能够具有任何合适的大小和/或形状,且能够适应通过其的任何期望的流动速率。例如,在一些实施例中,输送路径2771能够适应任何合适的流动速率,例如,1ml/秒、2ml/秒、3ml/sec、4ml/秒、5ml/秒。而且,输送路径2771的形状和/或大小能够变化。尽管输送部分2770被示出为包括单个输送路径2771,但是在其他实施例中,输送部分能够限定任何合适数目的输送路径。而且,输送部分2770(以及本文中所述的输送部分中的任一者)能够包括任何合适的特征,诸如输送路径2771、表面几何形状、表面覆层等等。例如,如图所示,输送部分2770包括凹入表面2774。以该方式,输送部分2770能够促进内容物从试剂容器2780和/或试剂体积2742到反应室2732中的输送。例如,试剂容器2780中的内容物能够沿着输送部分2770的凹入表面转移(例如,至少部分地基于重力)且经由输送路径2771传递到反应室2732中。然而,在其他实施例中,输送部分2770不需要具有凹入表面。输送部分2770的穿刺件2792被构造成刺穿(例如,破裂)试剂容器2780的易破部分2788,以将试剂从试剂容器2780传送到反应室2732中。因此,穿刺件2792能够包括任何尖端、锐利边缘和/或突出部系列,其被构造成刺穿试剂容器2780。在一些实施例中,穿刺件的布置和/或形状能够限制可由刺穿导致的堵塞和/或阻塞,因此提供试剂容器2780中的内容物的更加能重复的输送。例如,在一些实施例中,穿刺件2792能够限定一个或多个转移路径,类似于本文中示出和描述的那些(例如,在图1-3中)。因此,穿刺件2792与输送部分2770的输送路径2771流体连通。以该方式,且如在本文中更详细地描述的,穿刺件能够促进试剂容器2780中的内容物到反应室2732的转移。试剂容器2780能够完全地或部分地填充有任何合适的试剂或物质。例如,试剂容器2780能够包含转导颗粒,其包括改造的核酸,其被配制成导致目标细胞(例如,细菌)产生一种或多种报告分子。在一些实施例中,试剂容器2780能够包含一种或多种转导颗粒,其被改造成不能复制(例如,裂解性复制、溶原复制)。例如,在一些实施例中,试剂容器2780能够包含在本文中以及在如下文献中描述的转导颗粒中的任一者:2014年4月24日提交的、名称为“ReagentCartridgeforDetectionofCells(用于细胞检测的试剂盒)”的美国临时申请号61/983,765;2013年3月13日提交的、名称为“Non-ReplicativeTransductionParticlesandTransductionParticle-BasedReporterSystems(非复制型转导颗粒和基于转导颗粒的报告系统)”的美国临时申请号61/779,177;2014年2月12日提交的、名称为“SystemsandMethodsforPackagingNucleicAcidMoleculesintoNon-ReplicativeTransductionParticlesandTheirUseasCellularReporters(用于将核酸分子包装到非复制型转导颗粒中的系统和方法及其作为细胞报告体的用途)”的美国临时申请号61/939,126;以及2013年10月29日提交的、名称为“TranscriptDetectionSystemsandMethods(转录检测系统和方法)”的美国临时申请号61/897,040,和2014年3月13日提交的、名称为“Non-ReplicativeTransductionParticlesandTransductionParticle-BasedReporterSystems(非复制型转导颗粒和基于转导颗粒的报告系统)”的国际专利申请号PCT/US2014/026536,这些文献中的每一个的全部内容均通过引用并入本文中。在一些实施例中,试剂容器2780能够包含试剂,其被配制成与一种或多种报告分子反应以增强信号的产生。对于另一示例,试剂容器2780能够包括底物,诸如十三醛,其能够与报告分子(例如,荧光素酶)相互作用,以例如经由发光反应产生能测量的信号。对于又另一示例,在一些实施例中,试剂容器2780能够包括营养物、抗生素(例如,β-内酰胺、超广谱β-内酰胺、氨基糖甙类、安沙霉素类、碳头孢烯类、碳青霉烯类,任一代头孢菌素、糖肽类、林可酰胺类、脂肽类、大环内酯类、单菌胺类、硝基呋喃类、恶唑烷酮类、青霉素类、多肽、喹诺酮类、氟喹诺酮类、磺酰胺类、四环素类、分枝杆菌抗生素、氯霉素、莫匹罗星)、裂解试剂、消毒试剂、着色剂等等。试剂容器2780能够被成形和确定大小成基本上安置在试剂体积2742内。试剂容器2780能够由对于包含在其中的物质(例如,转导颗粒、底物、抗生素、缓冲剂、表面活性剂或能够与检测化验一起使用的任何其他试剂)基本上不能渗透/或基本上呈化学惰性的材料构造。试剂容器2780的至少一部分(例如,易破部分2788)能够由具有特定温度特性的材料(例如,聚合物薄膜,诸如任何形式的聚丙烯)构造,使得在特定温度以上维持期望的性能和完整性。例如,在一些情形中,可能期望在冷藏条件下储存包含试剂和/或底物的试剂容器2780。在一些实施例中,试剂容器2780的一部分能够由双向拉伸聚丙烯(BOP)构造。在一些实施例中,试剂容器2780的一部分能够由铝构造。在一些实施例中,试剂容器2780的一部分能够由聚氯乙烯(PVC)、乙烯-乙烯醇(EVOH)、聚乙烯(PE)和/或聚三氟氯乙烯(PCTFE或PTFCE)构造。试剂容器2780具有裙部2781和易破部分2788。裙部2781环绕易破部分2788的至少一部分。如图所示,裙部2781安置在锁定构件2772和壳体2741的输送部分2770的肩部部分2775之间。以该方式,且如在本文中进一步详细讨论的,裙部2781能够至少部分地通过锁定构件2772固定(例如,抓住、握住、保持、挤压、过盈配合等)。因此,裙部2781能够提供固定功能,使得试剂容器2780的位置能够在使用期间基本上维持不变。裙部2781能够是任何合适的大小和/或形状,且能够包括任何合适的表面设计(例如,平滑的、粗糙的等等)。例如,在一些实施例中,裙部2781能够被确定大小和/或成形为对应于锁定构件2772的一部分。致动器2750具有安置在试剂体积2742内的柱塞部分2754和接合部分2752。致动器2750的接合部分2752被构造成被操纵以在试剂体积2742内移动柱塞部分2754,以使试剂容器2780从第一构造变形到第二构造(第二构造在图5中未示出)。以该方式,柱塞部分2754的运动能够推动试剂容器2780的易破部分2788抵靠穿刺件2792以刺穿和/或破裂易破部分2788。因此,如在本文中更详细地描述的,在穿刺件2792刺穿试剂容器2780时,输送路径2771提供试剂容器2780中的内容物能够通过其流动的路径(例如,在处于第二构造时)。致动器2750的柱塞部分2754和壳体2741的一部分能够共同地限定密封,以将试剂体积2742与壳体2741外的体积流体地和/或光学地隔离。如上所述,锁定构件2772被构造成维持试剂容器2780的裙部2781的至少一部分与壳体2741的输送部分2770(例如,输送部分2770的肩部2775)相接触。而且,肩部2775和裙部2781的部分能够形成基本上流体密闭的密封,因此在使用期间减少和/或消除试剂在试剂容器2780内的回流。以该方式,通过维持裙部2781相对于输送部分2770的位置,锁定构件2772能够促进维持在输送部分2770的肩部2775和裙部2781之间的基本上流体密闭的密封。此外,锁定构件2772能够限制试剂容器2780相对于输送部分的运动。尤其,锁定构件2772能够限制在试剂容器2780从第一构造变形到第二构造时的运动。以该方式,在使用中,锁定构件2772能够限制和/或防止试剂容器2780的非期望运动,因此提供内容物从试剂容器2780到反应室2732的基本上能重复的输送。类似地陈述,在处于第一构造和/或第二构造时,试剂容器2780能够被保持在优选位置中(例如,稳定的位置)。锁定构件2772能够是任何合适的大小和/或形状。例如,在一些实施例中,锁定构件2772能够被确定大小和/或成形为对应于(例如,通过形状、大小、表面设计、质地等)试剂容器2780的裙部2781的一部分。以该方式,锁定构件2772和裙部2781能够协作起作用,以将试剂容器2780基本上维持在相对于输送部分2770的期望位置中。图6和图7示出根据实施例的处于第一构造(图6)和第二构造(图7)的容器组件3700。容器组件3700能够与在本文中以及在‘461申请中描述的仪器中的任一者和/或部件中的任一者一起使用并通过其操纵,‘461申请的全部内容通过引用并入本文中。以该方式,根据在本文中或在‘461申请中描述的方法中的任一者,容器组件3700和本文中所述的容器组件中的任一者能够用于检测和/或识别样本内的目标细胞(例如,细菌)。例如,在一些实施例中,容器组件3700能够用于将试剂安置和/或混合到样本中,同时维持在容器和外部区域之间的流体隔离。以该方式,细胞识别的方法能够在封闭系统和/或均相化验中进行。类似地陈述,在一些实施例中,容器组件3700在不涉及从容器组件3700移除内容物、在容器组件3700内分离内容物、在容器组件3700内洗涤内容物和/或在容器组件3700内冲洗内容物的细胞识别和/或检测的方法中使用。容器组件3700包括壳体3741、反应室3732、试剂容器3780和致动器3750。壳体3741能移除地联接到反应室3732。例如,在一些实施例中,壳体3741能够螺纹联接到反应室3732。在其他实施例中,壳体3741和反应室3732能够形成过盈配合,以将壳体3741联接到反应室3732。壳体3741限定试剂体积3742且包括输送部分3770。输送部分3770包括穿刺件3792。在一些实施例中,壳体3741、输送部分3770、和/或穿刺件3792能够整体地构造。在其他实施例中,壳体3741、输送部分3770、和/或穿刺件3792能够单独地形成且然后结合在一起。输送部分3770被构造成促进内容物从试剂容器3780和/或试剂体积3742到反应室3732中的输送。因此,如图所示,输送部分3770能够提供任何合适的路径和/或机构,用于将安置在试剂容器3780和/或试剂体积3742中的内容物输送到反应室3732中。例如,试剂容器3780中的内容物能够沿着输送部分3770的一个或多个表面转移(例如,至少部分地通过重力、通过致动器3750施加的力、表面张力等被推进)且转移到反应室3732中。尤其,输送部分3770限定在试剂体积3742和反应室3732之间的输送路径3771。输送路径3771能够具有任何合适的大小和/或形状,且能够适应通过其的任何期望的流动速率。例如,在一些实施例中,输送路径3771能够适应任何合适的流动速率,例如,1ml/秒、2ml/秒、3ml/sec、4ml/秒、5ml/秒。而且,输送路径3771的形状和/或大小能够变化。尽管输送部分3770被示出为包括单个输送路径3771,但是在其他实施例中,输送部分能够限定任何合适数目的输送路径。输送部分3770的穿刺件3792被构造成刺穿(例如,破裂)试剂容器3780的易破部分3788,以将试剂从试剂容器3780传送到反应室3732中。因此,穿刺件3792能够包括任何尖端、锐利边缘和/或突出部系列,其被构造成刺穿试剂容器3780。穿刺件的布置和/或形状能够限制可由刺穿导致的堵塞和/或阻塞,因此提供试剂容器3780中的内容物的更加能重复的输送。穿刺件3792能够将试剂容器3780置放成与输送部分3770的输送路径3771流体连通。以该方式,且如在本文中更详细地描述的,穿刺件能够促进试剂容器3780中的内容物到反应室3732的转移。试剂容器3780能够完全地或部分地填充有任何合适的试剂或物质。例如,试剂容器3780能够包含转导颗粒,其包括改造的核酸,其被配制成导致目标细胞(例如,细菌)产生一种或多种报告分子。在一些实施例中,试剂容器3780能够包含一种或多种转导颗粒,其被改造成不能复制(例如,裂解性复制、溶原复制)。例如,在一些实施例中,试剂容器3780能够包含在本文中以及在如下文献中描述的转导颗粒中的任一者:2014年4月24日提交的、名称为“ReagentCartridgeforDetectionofCells(用于细胞检测的试剂盒)”的美国临时申请号61/983,765;2013年3月13日提交的、名称为“Non-ReplicativeTransductionParticlesandTransductionParticle-BasedReporterSystems(非复制型转导颗粒和基于转导颗粒的报告系统)”的美国临时申请号61/779,177;2014年2月12日提交的、名称为“SystemsandMethodsforPackagingNucleicAcidMoleculesintoNon-ReplicativeTransductionParticlesandTheirUseasCellularReporters(用于将核酸分子包装到非复制型转导颗粒中的系统和方法及其作为细胞报告体的用途)”的美国临时申请号61/939,126;以及2013年10月29日提交的、名称为“TranscriptDetectionSystemsandMethods(转录检测系统和方法)”的美国临时申请号61/897,040,和2014年3月13日提交的、名称为“Non-ReplicativeTransductionParticlesandTransductionParticle-BasedReporterSystems(非复制型转导颗粒和基于转导颗粒的报告系统)”的国际专利申请号PCT/US2014/026536,这些文献中的每一个的全部内容均通过引用并入本文中。在一些实施例中,试剂容器能够包含试剂,其被配制成与一种或多种报告分子反应以增强信号的产生。对于另一示例,试剂容器3780能够包括底物,诸如十三醛,其能够与报告分子(例如,荧光素酶)相互作用,以例如经由发光反应产生能测量的信号。对于又另一示例,在一些实施例中,试剂容器3780能够包括营养物、抗生素(例如,β-内酰胺、超广谱β-内酰胺、氨基糖甙类、安沙霉素类、碳头孢烯类、碳青霉烯类,任一代头孢菌素、糖肽类、林可酰胺类、脂肽类、大环内酯类、单菌胺类、硝基呋喃类、恶唑烷酮类、青霉素类、多肽、喹诺酮类、氟喹诺酮类、磺酰胺类、四环素类、分枝杆菌抗生素、氯霉素、莫匹罗星)、裂解试剂、消毒试剂、着色剂等等。试剂容器3780能够被成形和确定大小成基本上安置在试剂体积3742内。试剂容器3780能够由对于包含在其中的物质(例如,转导颗粒、底物、抗生素、缓冲剂、表面活性剂或能与检测化验一起使用的任何其他试剂)基本上不能渗透/或基本上呈化学惰性的材料构造。试剂容器3780的至少一部分(例如,易破部分3788)能够由具有特定温度特性的材料(例如,聚合物薄膜,诸如任何形式的聚丙烯)构造,使得在特定温度以上维持期望的性能和完整性。例如,在一些情形中,可能期望在冷藏条件下储存包含试剂和/或底物的试剂容器3780。在一些实施例中,试剂容器3780的一部分能够由双向拉伸聚丙烯(BOP)构造。在一些实施例中,试剂容器3780的一部分能够由铝构造。在一些实施例中,试剂容器3780的一部分能够由聚氯乙烯(PVC)、乙烯-乙烯醇(EVOH)、聚乙烯(PE)和/或聚三氟氯乙烯(PCTFE或PTFCE)构造。试剂容器3780具有裙部3781、接触部分3782和易破部分3788。裙部3781环绕易破部分3788的至少一部分。裙部3781能够是任何合适的大小和/或形状,且能够包括任何合适的表面设计(例如,平滑的、粗糙的等等)。在一些实施例中,裙部3781和输送部分3771能够形成基本上流体密闭的密封以在使用期间最小化死体积。如下文中描述的,试剂容器3780的接触部分3782被构造成接触致动器3750的柱塞部分3754。接触部分能够是任何合适的大小和/或形状。例如,在一些实施例中,接触部分3782能够被确定大小和/或成形为对应于致动器3750。在其他实施例中,接触部分3782能够包括一个或多个应力集中耸立物、穿孔等等,以促进接触部分3782和/或试剂容器3780以期望的方式变形。例如,在一些实施例中,接触部分3782能够包括几何特征和/或材料性能,用以促进试剂容器3780在特定方向上和/或以特定方式的变形以最小化使用期间的死体积。例如,如在图9中所示,在一些实施例中,接触部分3782、裙部3781和/或易破部分3788能够共同地被构造成使得在向接触部分3782施加力(如通过箭头EE所示)时,易破部分3788将朝外鼓起以产生凸起形状。在一些实施例中,壳体3741的输送部分3770能够包括凹入表面(在图6-9中未示出),其在使用期间对应于易破部分的变形的或“鼓起的”形状。以该方式,试剂容器3780的变形部分能够被配合地接收在壳体的输送部分3770内以最小化死体积,从而促进试剂等等的能重复输送。如在图8中所示,在一些实施例中,接触部分3782能够是环形环。以该方式,接触部分3782能够被构造成横跨通过环形环限定的区域基本上一致地与致动器3750的柱塞部分3754配合,从而导致死体积的最小化和试剂容器3780中的内容物到反应室3732的能重复传送。尽管示出为具有恒定宽度,但是在其他实施例中,环形环能够是任何合适的大小或形状(例如,圆形的、卵形、矩形等)。例如,在一些实施例中,环形环能够具有变化的尺寸(例如,变化的环宽度)。以该方式,接触部分3782和柱塞部分3754能够协作起作用以适当地配合,从而导致试剂容器3780中的内容物从试剂容器3780的能重复输送。致动器3750具有安置在试剂体积3742内的柱塞部分3754和接合部分3752。致动器3750的接合部分3752被构造成被操纵以在试剂体积3742内移动柱塞部分3754,以使试剂容器3780从第一构造(图6)变形到第二构造(图7)。类似地陈述,响应于致动器3750的接合部分3752的操纵,柱塞部分3754能够接合试剂容器3780的接触部分3782,以使试剂容器3780从第一构造变形到第二构造。以该方式,柱塞部分3754的运动能够推动试剂容器3780的易破部分3788抵靠穿刺件3792以刺穿和/或破裂易破部分3788。因此,如在本文中更详细地描述的,在穿刺件3792刺穿试剂容器3780时,输送路径3771提供试剂容器3780中的内容物能够通过其流动的路径(例如,在处于第二构造时)。在一些实施例中,致动器3750的柱塞部分3754和壳体3741的一部分能够共同地限定密封,以使试剂体积3742与壳体3741外的体积流体地和/或光学地隔离。而且,柱塞部分3754能够是任何合适的大小和/或形状。例如,柱塞部分3754能够被成形和/或确定大小成对应于试剂容器3780的接触部分3782和/或对应于穿刺件3792。进一步关于该示例,如图所示,柱塞部分3754具有弯曲形状,其被构造成配合地接合试剂容器3780的接触部分3782的弯曲形状。以该方式,柱塞部分3754、接触部分3782、和/或穿刺件3792能够配合在一起和/或协作起作用以限制死体积(例如,在输送部分3770内的死体积)。最小化死体积允许试剂容器3780中的内容物到反应室3732的能重复传送,以及试剂容器3780的能重复刺穿(例如,能重复泡罩破裂)。如在图6中所示,容器组件3700处于第一构造。在第一构造中,致动器3750定位成使得安置在壳体3741内的试剂容器3780基本上没有变形。类似地陈述,致动器3750定位成使得其不导致穿刺件3752刺穿试剂容器3780。因此,在处于第一构造时,容器组件3700处于“就绪”状态。在一些实施例中,容器组件3700能够包括安全机构(未示出),以防止和/或限制致动器3750相对于壳体3741的运动直到操作者期望为止。为了致动容器组件3700,向致动器3750的接合部分3752施加力,因此导致致动器3750如通过图6中的箭头CC所示的运动。如在图7中所示,容器组件3700处于第二构造。在第二构造中,致动器3750定位成使得试剂容器3780显著变形。类似地陈述,致动器3750定位成使得力的至少一部分被转移到试剂容器3780。在这样的构造中,穿刺件3792已经刺穿试剂容器3780(例如,易破部分3788),使得试剂容器中的内容物已经基本上离开试剂容器3780且进入输送部分3770和/或反应室3732,如通过箭头DD所示。在使用中,操纵致动器3750(例如,接合部分3752)以在壳体3741内移动柱塞部分3754,使得柱塞部分3754接合试剂容器3780的接触部分,以使试剂容器3780从第一构造部分地变形到第二构造。在柱塞部分3754接合试剂容器3780时,穿刺件3792刺穿试剂容器3780的一部分(例如,易破部分3788),以将试剂从试剂容器3780传送到反应体积3742、输送部分3770、和/或反应室3732中。从第一构造到第二构造,操纵致动器3750以在壳体3741内移动柱塞部分3754,使得柱塞部分3754接合试剂容器3780的接触部分,以使试剂容器3780变形。在试剂容器3780变形时,其内容物(例如,试剂)基本上全部从试剂容器3780传送到反应体积3742、输送部分3770、和/或反应室3732中,使得在试剂容器3780中的“死体积”是有限的。以该方式,能够获得内容物从试剂容器3780到反应室3732的基本上能重复的输送。例如,在一些实施例中,第一试剂容器在第一时间的变形和第二试剂容器在第二时间(在第一时间之后)的变形能够基本上类似,因此允许在第一时间和第二时间从试剂容器3780转移基本上全部的内容物。而且,该布置能够限制可由试剂容器3780的刺穿导致的堵塞或阻塞,因此提供试剂容器3780中的内容物的更加能重复的输送。尽管容器组件1700、2700和3700被示出为包括仅一个试剂容器,但是在其他实施例中,壳体和/或容器组件能够包括任何合适数目的试剂容器。例如,图10和图11根据实施例分别示出容器组件4700的透视图和容器组件4700的分解视图。容器组件4700能够与在本文中以及在名称为“SystemsandMethodsforDetectionofCellsusingEngineeredTransductionParticles(用于使用改造的转导颗粒进行细胞检测的系统和方法)”的美国专利申请号13/802,461中描述的仪器中的任一者和/或部件中的任一者一起使用并且通过其操纵,该文献的全部内容通过引用并入本文中。以该方式,根据在本文中或在‘461申请中描述的方法中的任一者,容器组件4700和本文中所述的容器组件中的任一者能够用于检测和/或识别样本内的目标细胞(例如,细菌)。例如,在一些实施例中,容器组件4700能够用于将试剂安置和/或混合到样本中,同时维持在容器和外部区域之间的流体隔离。以该方式,细胞识别的方法能够在封闭系统和/或均相化验中进行。类似地陈述,在一些实施例中,容器组件4700在不涉及从容器组件4700移除内容物、在容器组件4700内分离内容物、在容器组件4700内洗涤内容物和/或在容器组件4700内冲洗内容物的细胞识别和/或检测的方法中使用。容器组件4700包括壳体4741、第一致动器4750、第二致动器4760和反应室4732。壳体4741、第一致动器4750、第一试剂容器4780、第二致动器4760和第二试剂容器4790的组件能够被称为“帽组件”或“试剂组件”。壳体4741(和/或帽组件)能移除地联接到反应室4732。例如,如在图10中所示,壳体4741能够螺纹联接到反应室4732的近端部分。在其他实施例中,壳体4741和反应室4732能够形成过盈配合,以将壳体4741联接到反应室4732。因此,壳体4741(或帽组件)能够与反应室4732单独地储存和/或与其间隔开。以该方式,用户然后能够根据在本文中(和在‘461申请中,该文献地全部内容通过引用并入本文中)所述的方法将样本安置到反应室4732中,且然后能够将壳体4741(或帽组件)组装到反应室4732(或者“管”)及完成用于细胞识别的步骤,如本文中所述的。壳体4741限定构造成接收第一试剂容器4780的第一试剂体积4742和构造成接收第二试剂容器4790的第二试剂体积4744。壳体4741包括第一穿刺件4792、第二穿刺件4794、第一输送部分4770、及第二输送部分4772。在一些实施例中,壳体4741、第一输送部分4770、第二输送部分4772、第一穿刺件4792、和/或第二穿刺件4794能够整体地构造。在其他实施例中,壳体4741、第一输送部分4770、第二输送部分4772、第一穿刺件4792、和/或第二穿刺件4794能够单独地形成且然后结合在一起。图12-14相应地示出壳体4741的内部部分的视图、沿着图12中的线X-X截取的横截面侧视图、和在图13中示出的横截面侧视图的详细视图。如图所示,壳体4741限定构造成接收第一试剂容器4780(未示出)的第一试剂体积4742和构造成接收第二试剂容器4790(未示出)的第二试剂体积4744。此外,如图所示,第一输送部分4770限定与第一穿刺件4792流体连通的第一输送路径4771。类似地,第二输送部分4772限定与第二穿刺件4794流体连通的第二输送路径4773。第一穿刺件4792和/或第二穿刺件4794相应地被构造成刺穿(例如,破裂)试剂容器4780的第一易破部分4788(在图12中未示出)和试剂容器4790的第二易破部分(在图12中未示出),以将试剂从试剂容器4780和/或试剂容器4790传送到反应室4732中。因此,穿刺件4792和穿刺件4794包括尖端、锐利边缘和/或突出部,如图所示,以相应地刺穿试剂容器4780和试剂容器4790。而且,第一穿刺件4792限定与第一试剂体积4742流体连通的第一系列转移路径4793,并且第二穿刺件4794限定与第二试剂体积4744流体连通的第二系列转移路径4795。尤其,第一系列转移路径4793和第二系列转移路径4795中的每一个均包括围绕相应穿刺件的中心点以近似90度间隔间隔开的四个通道。因此,如图所示,包括第一系列转移路径4793和/或第二系列转移路径4795相应地在第一穿刺件4792和第二穿刺件4794中产生不连续的横截面形状。在第一穿刺件4792刺穿第一试剂容器4780时,第一系列转移路径4793提供试剂容器4780中的内容物能够通过其流动的路径。类似地,在第二穿刺件4794刺穿第二试剂容器4790时,第二系列转移路径4795提供试剂容器4790中的内容物能够通过其流动的路径。而且,第一系列转移路径4793、第二系列转移路径4795的布置、第一穿刺件4792的横截面形状、和/或第二穿刺件4794的横截面形状能够限制可由刺穿导致的堵塞或阻塞,因此提供第一试剂容器4780和/或第二试剂容器4790中的内容物的更加能重复的输送。如图所示,穿刺件4792和/或穿刺件4794相应地沿着试剂体积4742和试剂体积4744的轴向中心线安置和/或与其对准。类似地陈述,穿刺件4792和穿刺件4794相应地相对于试剂容器4780和试剂容器4790居中。这样的构造促进内容物从试剂容器4780和/或试剂容器4790能重复的、基本上完全的输送,如本文中所述的。然而在其他实施例中,穿刺件4792和/或穿刺件4794能够相应地从试剂体积4742和试剂体积4744的轴向中心线偏置。在这样的实施例中,例如,偏置能够基于第一输送部分4770、第二输送部分4772、和/或反应室4732的形状、大小、斜率和/或构造。例如,在一些实施例中,穿刺件4792能够朝着壳体4741的侧部分侧向偏置。类似地,在一些实施例中,穿刺件4794能够朝着壳体4741的侧部分侧向偏置。以该方式,能够促进试剂容器4780和/或试剂容器4790中的内容物相对靠近侧壁部分4734流动,因此防止内容物的飞溅和/或湍流。因此,在这样的实施例中,穿刺件4792和/或穿刺件4794的偏置能够提供内容物相应地从试剂容器4780和试剂容器4790的有效的、期望的和/或完全的输送。尽管第一系列转移路径4793和第二系列转移路径4795的横截面形状在图12中示出为弯曲的和/或半圆形,但是在其他实施例中,第一系列转移路径4793和/或第二系列转移路径4795能够具有任何合适的形状和构造,诸如例如,螺旋形、逐渐变细形状等等。而且,尽管第一系列转移路径4793和/或第二系列转移路径4795的形状和/或大小在图13中被示出为具有竖直定向和恒定直径(横截面面积、流动面积),但是在其他实施例中,第一系列转移路径4793和/或第二系列转移路径4795能够具有任何合适的定向、构造和大小。例如,在一些实施例中,第一系列转移路径4793和/或第二系列转移路径4795能够具有变化的横截面(或流动)面积(例如,随着距穿刺件末端的距离而变)和/或非-竖直定向(例如,倾斜的)。以该方式,第一系列转移路径4793和/或第二系列转移路径4795能够被构造成促进流动通过其的物质的受控和/或期望的流动速率。而且,尽管第一系列转移路径4793和第二系列转移路径4795各自在图12中被示出为限定四个通道,但是在其他实施例中,转移路径能够限定任何合适数目的转移通道。图13和图14相应地示出在图12中示出的壳体4741的横截面视图和近视横截面视图。如图所示,第一输送路径4771与第一系列转移路径4793、第一试剂体积4742和反应室4732流体连通。类似地,第二输送路径4773与第二系列转移路径4795、第二试剂体积4744和反应室4732流体连通。因此,第一系列转移路径4793和第二系列转移路径4795被构造成将反应室4732置放成相应地与第一输送路径4771和第二输送路径4773,以及相应地与试剂体积4742和试剂体积4744流体连通。以该方式,试剂容器4780中的内容物能够从试剂容器4780经由试剂体积4742、第一系列转移路径4793、和/或第一输送路径4771传送到反应室4732。类似地,试剂容器4790中的内容物能够从试剂容器4790经由试剂体积4744、第二系列转移路径4795、和/或第二输送路径4773传送到反应室4732。而且,尽管壳体4741被示出为具有第一系列转移路径4793和第二系列转移路径4795,但是在其他实施例中,壳体4741能够具有(或限定)任何合适数目的转移路径和/或转移路径系列。尽管未示出,但是在一些实施例中,第一系列转移路径4793(或其一部分)和第二系列转移路径4795(或其一部分)能够彼此流体连通。例如,在一些实施例中,第一系列转移路径4793和第二系列转移路径4795能够经由转移集管路径(未示出)彼此流体连通,其中,转移集管路径与反应室4732流体连通。在这样的实施例中,例如,在到达反应室4732或其一部分之前,第一试剂容器4780中的内容物能够与第二试剂容器4790中的内容物连通(例如,混合)。在一些实施例中,这样的布置能够促进来自试剂容器4780和/或试剂容器4790的内容物的混合和/或最小化充气、喷溅(overspray)和/或非期望湍流。参考图11和图16-18,第一致动器4750具有安置在第一试剂体积4742内的第一柱塞部分4754和第一接合部分4752。第二致动器4760(在图16中未示出)具有安置在第二试剂体积4744内的第二柱塞部分4756和第二接合部分4753。尽管出于容易解释的原因,在本文中参考致动器4750描述在图16中示出的致动器,但是应当理解,参考第一致动器4750描述的任何特征也能够,或替代地应用到第二致动器4760,且反之亦然。第一致动器4750的第一接合部分4752被构造成被操纵以在第一试剂体积4742内移动第一柱塞部分4754,以使第一试剂容器4780变形。第二致动器4760的第二接合部分4753被构造成被操纵以在第二试剂体积4744内移动第二柱塞部分4756,以使第二试剂容器4790变形。以该方式,柱塞部分4754的运动能够推动第一试剂容器4780的易破部分4788抵靠穿刺件4792以刺穿和/或破裂易破部分4788。类似地,柱塞部分4756的运动能够推动第二试剂容器4790的易破部分4789抵靠穿刺件4794以刺穿和/或破裂易破部分4789。致动器4750的柱塞部分4754和壳体4741的一部分能够共同地限定密封,以将试剂体积4742与壳体4741外的体积流体地和/或光学地隔离。类似地,致动器4760的柱塞部分4756和壳体4741的一部分能够共同地限定密封,以将试剂体积4744与壳体4741外的体积流体地和/或光学地隔离。而且,尽管在图16中示出的柱塞部分4754具有用于接触试剂容器4780的基本上平面的表面,但是在其他实施例中,柱塞部分4754能够是任何合适的形状、大小和/或构造。例如,在一些实施例中,柱塞部分4754能够对应于(例如,共用类似的形状、协作起作用)试剂容器4780(例如,试剂容器的接触部分)和/或穿刺件4792。例如,在一些实施例中,柱塞部分4754能够是弯曲的(例如,凹入),以便与试剂容器4780的弯曲(例如,凹入)部分配合。以该方式,柱塞部分4754和试剂容器4780能够共同地和/或协作地起作用以限制死体积。而且,这样的协作(例如,配合)能够促进试剂容器4780中的内容物的能重复输送。类似地,在一些实施例中,例如,柱塞部分4754能够是弯曲的,以便与穿刺件4792的弯曲部分配合。以该方式,柱塞部分4754和穿刺件4792能够共同地和/或协作地起作用以限制死体积。而且,这样的协作(例如,配合)能够促进试剂容器4780中的内容物的能重复输送。如在图15中所示,试剂容器4780具有侧壁4786和易破部分4788,其一起限定内体积。如本文中所述的,内体积能够完全地或部分地填充有试剂和/或物质。此外,试剂容器4780具有裙部4781(被称为“第一裙部”)、接触部分4782(被称为“第一接触部分”)和易破部分4788(被称为“第一易破部分”)。裙部4781环绕易破部分4788的至少一部分。在一些实施例中,侧壁4786也能够是易破的。试剂容器4790具有裙部4791(被称为“第二裙部”)、接触部分4792(被称为“第二接触部分”)、和易破部分4789(被称为“第二易破部分”)。第二裙部4791环绕第二易破部分4789的至少一部分。应当注意,尽管出于容易解释的原因,参考试剂容器4780描述在图15中示出的试剂容器,但是参考试剂容器4780描述的任何特征也能够或替代地应用到试剂容器4790,且反之亦然。第一裙部4781和/或第二裙部4791能够是任何合适的大小和/或形状,且能够包括任何合适的表面设计(例如、平滑的、粗糙的等等)。例如,在一些实施例中,第一裙部4781和/或第二裙部4791能够被确定大小和/或成形为对应于壳体4741的一部分。试剂容器4780的第一接触部分4782和/或试剂容器4790的第二接触部分4792能够是任何合适的大小和/或形状。例如,在一些实施例中,第一接触部分4782和/或第二接触部分4792能够被确定大小和/或成形为相应地对应于第一致动器4750和/或第二致动器4760。例如,在这样的实施例中,第一接触部分4782和/或第二接触部分4792能够包括凹入部分,且第一致动器4750和/或第二致动器4760能够相应地被确定大小和/或成形为对应于第一接触部分4782的凹入部分和/或第二接触部分4792的凹入部分。以该方式,试剂容器4780和/或试剂容器4790能够被构造成促进其相应内容物(例如,试剂、物质等)的基本上完全的分配,和/或在刺穿试剂容器4780和/或试剂容器4790时促进用于内容物从试剂容器4780和/或试剂容器4790行进的优选路径。试剂容器4780被成形和确定大小以基本上安置在第一试剂体积4742内。试剂容器4790被成形和确定大小以基本上安置在第一试剂体积4744内。如在图17和图18中最佳图示的,试剂容器4780能够通过在第一裙部4781和壳体4741的一部分之间的过盈配合维持在期望位置中。类似地,试剂容器4790能够通过在第二裙部4791和壳体4741的一部分之间的过盈配合维持在期望位置中。以该方式,在使用期间能够基本上维持试剂容器4780和/或试剂容器4790相对于壳体4741的期望位置。尽管容器组件4700未被示出为包括锁定构件,但是在一些实施例中,容器组件4700能够包括类似于上文中参考图5示出和描述的锁定构件2772的锁定构件。在这样的实施例中,试剂容器4780能够通过锁定构件(未示出)并且通过在第一裙部4781和壳体4741的一部分和/或锁定构件的一部分之间的过盈配合维持在期望位置中。类似地,在这样的实施例中,试剂容器4790能够通过锁定构件(未示出)并且通过在第二裙部4791和壳体4741的一部分和/或锁定构件的一部分之间的过盈配合维持在期望位置中。试剂容器4780和/或试剂容器4790能够具有任何合适的大小和/或体积。例如,在一些实施例中,在处于展开构造时,试剂容器4780和/或试剂容器4790能够具有大约400μL的内体积。在这样的实施例中,试剂容器4780和/或试剂容器4790能够最初包含大约300μL到大约350μL(及更具体地,大约325μL)的本文中所述的任何试剂。因此,在试剂容器4780和/或试剂容器4790处于其相应展开构造时,其具有大约百分之75到大约百分之88的填充百分比。试剂容器4780和/或试剂容器4790被构造成,连同其相应柱塞和壳体的部分,使得在处于其相应的收缩构造时,分配的体积是大约250μL到大约300μL(及更具体地,大约285μL)。类似地陈述,在试剂容器4780和/或试剂容器4790处于其相应收缩构造时,其具有在大约百分之76和大约百分之92之间的分配百分比。第一试剂容器4780和第二试剂容器4790能够完全地或部分地填充有任何合适的试剂或物质。在一些实施例中,第一试剂容器4780和第二试剂容器4790能够包括相同内容物(例如,相同试剂)。在其他实施例中,第一试剂容器4780和第二试剂容器4790能够包括不一样的内容物(例如,第一试剂容器4780包含第一试剂,且第二试剂容器包含与第一试剂不同的的第二试剂)。在一些实施例中,例如,试剂容器4780和/或试剂容器4790能够包含转导颗粒,其包括改造的核酸,其被配制成导致目标细胞(例如,细菌)产生一种或多种报告分子。在一些实施例中,试剂容器4780和/或试剂容器4790能够包含一种或多种转导颗粒,其被改造成不能复制(例如,裂解性复制、溶原复制)。例如,在一些实施例中,试剂容器4780和/或试剂容器4790能够包含在本文中以及在如下文献中描述的转导颗粒中的任一者:2014年4月24日提交的、名称为“ReagentCartridgeforDetectionofCells(用于细胞检测的试剂盒)”的美国临时申请号61/983,765;2013年3月13日提交的、名称为“Non-ReplicativeTransductionParticlesandTransductionParticle-BasedReporterSystems(非复制型转导颗粒和基于转导颗粒的报告系统)”的美国临时申请号61/779,177;2014年2月12日提交的、名称为“SystemsandMethodsforPackagingNucleicAcidMoleculesintoNon-ReplicativeTransductionParticlesandTheirUseasCellularReporters(用于将核酸分子包装到非复制型转导颗粒中的系统和方法及其作为细胞报告体的用途)”的美国临时申请号61/939,126;以及2013年10月29日提交的、名称为“TranscriptDetectionSystemsandMethods(转录检测系统和方法)”的美国临时申请号61/897,040,和2014年3月13日提交的、名称为“Non-ReplicativeTransductionParticlesandTransductionParticle-BasedReporterSystems(非复制型转导颗粒和基于转导颗粒的报告系统)”的国际专利申请号PCT/US2014/026536,这些文献中的每一个的全部内容均通过引用并入本文中。在一些实施例中,试剂容器4780和/或试剂容器4790能够包含试剂,其被配制成与一种或多种报告分子反应以生成和/或增强信号的产生。对于另一示例,试剂容器4780和/或试剂容器4790能够包括荧光素酶底物,诸如十三醛,其能够与报告分子(例如,荧光素酶)相互作用,以例如经由发光反应产生能测量的信号。对于又另一示例,在一些实施例中,试剂容器4780和/或试剂容器4790能够包括营养物、抗生素(例如,β-内酰胺、超广谱β-内酰胺、氨基糖甙类、安沙霉素类、碳头孢烯类、碳青霉烯类,任一代头孢菌素、糖肽类、林可酰胺类、脂肽类、大环内酯类、单菌胺类、硝基呋喃类、恶唑烷酮类、青霉素类、多肽、喹诺酮类、氟喹诺酮类、磺酰胺类、四环素类、分枝杆菌抗生素、氯霉素、莫匹罗星)、裂解试剂、消毒试剂、着色剂等等。试剂容器4780和/或试剂容器4790能够由具有任何合适的尺寸的任何合适的材料构造。试剂容器4780和/或试剂容器4790的侧壁的厚度能够例如在大约0.010英寸和0.020英寸之间。而且,试剂容器4780和/或试剂容器4790能够由对于包含在其中的(多种)物质(例如,转导颗粒、底物、抗生素、缓冲剂、表面活性剂或能够与检测化验一起使用的任何其他试剂)基本上不能渗透/或基本上呈化学惰性的材料构造。试剂容器4780的至少一部分(例如,易破部分4788)和/或试剂容器4790的至少一部分(例如,易破部分4789)能够由具有特定温度特性的材料(例如,聚合物薄膜,诸如任何形式的聚丙烯)构造,使得在特定温度以上维持期望的性能和完整性。例如,在一些情形中,可能期望在冷藏条件下储存包含试剂和/或底物的试剂容器4780和/或试剂容器4790。在一些实施例中,试剂容器4780的一部分和/或试剂容器4790的一部分能够由双向拉伸聚丙烯(BOP)构造。在一些实施例中,试剂容器4780的一部分和/或试剂容器4790的一部分能够由铝构造。在一些实施例中,试剂容器4780的一部分和/或试剂容器4790的一部分能够由下述材料构造:聚氯乙烯(PVC)、乙烯-乙烯醇(EVOH)、聚乙烯(PE)、聚三氟氯乙烯(PCTFE或PTFCE)、医药级共聚物、环烯烃共聚物膜、泰克妮、COCP12P、PCTFE膜层压、和/或泰克妮VA10200。例如,在一些实施例中,试剂容器4780和/或试剂容器4790能够由PVC构造,使得在侧壁的内表面上具有聚乙烯EVOH的层压件。以该方式,层压件能够起着氧气屏障的作用,以保存包含在试剂容器4780和/或试剂容器4790内的试剂。在一些实施例中,外表面能够包括PCTFE覆层,用以起湿气屏障的作用。在一些实施例中,易破部分4788和/或易破部分4789被焊接密封到侧壁。而且,在一些实施例中,易破部分4788和/或易破部分4789能够没有覆层以提供用于能重复操作的充分“能刺穿性”或者最小破裂强度。在其他实施例中,易破部分4788和/或易破部分4789能够包括漆覆层。反应室4732能够能移除地联接到壳体4741。如图所示,反应室4732螺纹联接到壳体4741。然而,在其他实施例中,反应室4732能够形成过盈配合,以将反应室联接4732联接到壳体4741。反应室4732包括侧壁部分4734和远端部分(包括底部表面)4736,且能够是用于以允许监视、识别和/或检测样本内的目标细胞(例如,细菌)的方式包含临床样本(例如,患者样本)的任何合适的室。在一些实施例中,反应室4732的至少一部分,诸如远端部分4736,能够是基本上透明的,例如,以允许观察和/或光学监视包含在其中的内容物。在一些实施例中,反应室4732的一部分(例如,远端部分)能够是基本上透明的,同时反应室4732的剩余部分能够是基本上不透明的。以该方式,反应室4732能够被构造成使光传播通过反应室4732的基本上透明部分,但是在反应室4732的基本上不透明部分处阻止光。在一些实施例中,反应室4732的侧壁部分4734能够包括覆层,以允许光最佳透射通过反应室4732的远端部分4736。在一些实施例中,覆层能够是构造成阻止和/或反射光的任何合适材料,例如标签。尤其,在一些实施例中,标签能够是白色标签以反射光。而且,在一些实施例中,反应室4732的远端部分4736能够被抛光,以促进光通过其的最佳透射。图17和图18相应地示出处于第一构造(图17)和第二构造(图18)的容器组件4700的横截面侧视图。如图所示,反应室4732的远端部分4736包括基本上平坦的底部表面。平坦的底部表面促进光通过其基本上一致地递送。具体地,在使用中,光能够通过远端部分4736基本上一致地传输到检测器。类似地陈述,该布置允许通过检测器(例如,在本文中和在‘461申请中所述的任何检测器)对容器组件4732进行“底部读取”。而且,在使用中,在远端部分4736处的这样的基本上平坦表面能够导致容器组件4700被一致地置放成更靠近仪器中的光学检测窗口和/或与其接触。以该方式,这样的构造能够最小化在信号产生和信号检测之间的信号路径的距离,和/或最小化在信号路径中的不匹配的介电介质(dialecticmedium)之间的界面,这两者都能够对到达传感器的信号的损失(例如,由于光散射和/或光折射)有贡献。而且,在一些实施例中,例如,平坦表面能够被构造成接触光学检测窗口。此外,如在图17和图18中所示,反应室4732的侧壁部分4734逐渐变细。类似地陈述,侧壁部分4734的表面不平行于通过反应室4732限定的纵向中心线。逐渐变细构造促进内容物从试剂容器4780和/或试剂容器4790沿着侧壁部分4734流动。因此,能够限制内容物的湍流、飞溅、气泡的产生、充气等等,且相比样本包含这样的气泡、充气等等的情况,随后的光学读数能够更加准确。尤其,第一输送路径4771的离开部分和第二输送路径4773的离开部分各自限定离开轴线(分别是轴线EE和轴线FF),其与反应室4732的侧壁部分4734相交,如在图17中所示。因此,在使用中,来自试剂容器4780和/或试剂容器4790的内容物能够相应地从第一输送路径4771和/或第二输送路径4773沿着其相应离开轴线流动到侧壁部分4734。而且,如图所示,每个离开轴线(即,轴线EE和轴线FF)和侧壁部分4734的相交在预期填充线4738(或者名义填充线)之上发生,因此在内容物从试剂容器4780和/或试剂容器4790运动到反应室4732时,防止和/或限制内容物的飞溅、湍流等等。尽管反应室4732的侧壁部分4734被示出为逐渐变细,使得每个离开轴线均在反应室4732的上半部分处截断侧壁部分4734,但是在其他实施例中,侧壁部分4734能够以任何合适的度数逐渐变细(或成角度)。在一些实施例中,侧壁部分4734能够以大约一度逐渐变细(相对于纵向中心线)。在其他实施例中,侧壁部分4734能够以小于5度逐渐变细(相对于纵向中心线)。类似地,尽管名义填充线4738被图示为定位在反应室4736的中间部分附近,但是在其他实施例中,名义填充线能够定位在任何合适的水平(例如,随着与侧壁部分4734和/或任一离开轴线相关联的角度而变)。反应室4732能够由任何合适材料构造,例如,玻璃、塑料(例如,聚丙烯)、丙烯酸等。在一些实施例中,反应室4732能够是伽马(gamma)能消毒的。在一些实施例中,反应室4732能够是市售的容器,例如,离心管、Eppendorf®管、玻璃小瓶、平底小瓶/管、圆底小瓶/管、或任何其他合适的容器。如在图17中所示,容器组件4700处于第一构造。在第一构造中,第一致动器4750和第二致动器4760定位成使得安置在壳体4741内的试剂容器4780和试剂容器4790基本上未变形。类似地陈述,第一致动器4750和第二致动器4760定位成使得其不导致穿刺件4752和穿刺件4794相应地刺穿试剂容器4780和试剂容器4790。因此,在处于第一构造时,容器组件4700处于“就绪”状态。在一些实施例中,容器组件4700能够包括安全机构(未示出),以防止和/或限制第一致动器4750和/或第二致动器4760相对于壳体4741的运动直到操作者期望为止。为了致动容器组件4700,向第一致动器4750的接合部分4752施加力,并且向致动器4760的接合部分4753施加力,因此导致第一致动器4750和第二致动器4760如通过图17中相应地箭头GG和HH所示的运动。能够通过任何合适的仪器施加力,诸如在‘461申请中示出和描述的那些仪器。根据期望的化验,能够基本上同时或在不同时间施加力。更具体地,操纵第一致动器4750(例如,在第一接合部分4752处)以在壳体4741内移动第一柱塞部分4754,使得第一柱塞部分4754接合试剂容器4780的接触部分4782,以使试剂容器4780从第一构造部分地变形到第二构造。在第一柱塞部分4754接合试剂容器4780时,第一穿刺件4792刺穿试剂容器4780的一部分(例如,易破部分4788),以将试剂从试剂容器4780传送到第一试剂体积4742、第一输送部分4770和/或反应室4732中。类似地,操纵第二致动器4760(例如,在第二接合部分4753处)以在壳体4741内移动第二柱塞部分4756,使得第二柱塞部分4756接合试剂容器4790的第二接触部分4784,以使试剂容器4790从第一构造部分地变形到第二构造。在第二柱塞部分4756接合试剂容器4790时,第二穿刺件4794刺穿试剂容器4790的一部分(例如,易破部分4789),以将试剂从试剂容器4790传送到第二试剂体积4744、第二输送部分4772和/或反应室4732中。如在图18中以及更详细地在图19中所示,容器组件4700处于第二构造。在第二构造中,第一致动器4750和第二致动器4760定位成使得,试剂容器4780和试剂容器4790显著变形和/或收缩。类似地陈述,第一致动器4750和第二致动器4760定位成使得相应力的至少部分相应地转移到第一试剂容器4780和第二试剂容器4790。在这样的构造中,如图所示,第一穿刺件4792已经刺穿试剂容器4780,使得试剂容器4780中的内容物的期望量已经基本上离开试剂容器4780,且进入第一输送部分4770和/或反应室4732,如通过箭头II所示。类似地,第二穿刺件4794已经刺穿试剂容器4790,使得试剂容器4790中的内容物的期望量已经基本上离开试剂容器4790,且进入第二输送部分4772和/或反应室4732,如通过箭头JJ所示。在试剂容器4780和/或试剂容器4790变形时,其内容物的期望量以使得“死体积”是有限的和/或基本上被消除的方式传送到反应室4732中。如在本文中使用的,“死体积”是从试剂容器4780和/或试剂容器4790分配的,但是不传送到反应室4732中的试剂的体积。死体积能够包括,例如,输送路径和转移路径的体积。在一些实施例中,试剂容器4780和/或试剂容器4790能够被构造成在致动组件4700时限制其中的死体积。例如,在一些实施例中,接触部分4782和/或接触部分4784能够被构造成,连同相应地致动器4750和致动器4760的对应接合部分,以减小死体积的受控方式变形。以该方式,试剂容器4780和/或试剂容器4790能够被构造成促进一致和/或能重复地分配其内容物(例如,试剂)。在一些实施例中,帽组件(即,试剂容器4780和/或试剂容器4790连同其相应的柱塞和壳体的部分)被构造成使得“死体积”在大约30μL和大约50μL之间。在一些实施例中,帽组件被构造成使得“死体积”为大约40μL±9μL。通过限制死体积的部分-到-部分(part-to-part)的变化,能够改进试剂输送的准确度,并且因此化验的准确度。在一些实施例中,例如,帽组件被构造成使得分配体积为大约285μL,其中变化系数为大约百分之三。如本文中所述的,在一些实施例中,容器组件(例如,容器组件4700或本文中所述的任何其他容器组件)能够包含患者样本,其潜在地包含待使用在本文中以及在‘461申请中所述的方法、仪器和/或部件中的任一者检测的细胞(例如,细菌),‘461申请的全部内容通过引用并入本文中。样本能够是人类样本(例如,鼻拭子、粘膜拭子、唾液样本、血液样本、尿样、粪便样本、组织活检、骨髓和/或脑脊液)、兽医样本、食物样本、植物样本和/或环境样本。在一些实施例中,样本能够是天然的、生的或以其他方式基本上未处理的样本。在一些实施例中,试剂盒能够被提供和/或用于执行这样的方法。例如,图20示出根据实施例的试剂盒4000。如图所示,试剂盒4000包括运送容器组件4010、转移构件4030和容器组件4700。尽管示出为包括容器组件4700,但是在其他实施例中,试剂盒能够包括如在本文中示出和描述的容器组件和/或帽组件中的任一者。运送容器组件4010(也被称为“收集组件”)包括样本收集器4020、运送帽4012和运送室4014。运送帽4012能移除地联接到运送室4014以形成基本上流体密闭的密封。例如,在一些实施例中,运送帽4012能够螺纹联接到运送室4014。在其他实施例中,运送帽4012和运送室4014能够形成过盈配合、压配合、卡扣配合、和/或任何其他合适的配合,以将运送帽4012联接到运送室4014。运送室4014能够是任何合适的大小和/或形状,且能够由任何合适材料构造。运送室4014限定样本能够被安置在其内的运送体积4016。在一些实施例中,运送室4014能够在运送体积4016内包括运送培养基、溶液和/或试剂(在图20中未指示)。运送培养基能够包括,例如,细菌的营养培养基、生物体选择性培养基、缓冲剂、表面活性剂或任何其他组分以便于患者样本(例如,目标细菌)的生长和/或优化其健康、在目标细菌内报告分子的产生、细菌的检测等等。在一些实施例中,运送培养基能够包括,例如,使得细菌能够生长和繁殖的细菌营养物和/或生长培养基(例如,天然培养基、确定成分的培养基、鉴别培养基、基本培养基、选择性培养基等)、维持pH的缓冲剂(例如,Amies、PBS、HEPES、TRIS、TAPSO、N-二甘氨酸、MES、MOPS、两性离子缓冲剂、PIPES、SSC、琥珀酸等),和/或表面活性剂(例如,吐温20、吐温80、TritonX、X-114、CHAPS、DOC、NP-40CTAB、SDS等)。在一些实施例中,运送培养基或运送成分能够预置在内体积4016中,或者其能够在样本传送到容器中之后添加。在一些实施例中,运送培养基能够预置在运送室4014中,但是能够选择性地维持与样本隔离,例如,在运送室4014内的单独的隔室(未示出)中。例如,在一些实施例中,运送培养基能够储存在运送帽4012中,使得溶液能够按照需求和/或在封闭-系统环境中连通到患者样本。在一些实施例中,运送培养基、试剂和/或成分能够被定制以增强生长、缩短停滞期、维持和/或攻击特别的目标细胞,例如,细菌。在一些实施例中,对于特定目标细胞和/或样本能够采用特定形式的溶液。例如,溶液的第一制备物能够被定制用于包含MRSA的鼻拭子样本,溶液的第二制备物能够被定制用于包含大肠杆菌的尿样,溶液的第三制备物能够被定制用于包含芽孢杆菌的粪便样本等等。样本收集器4020包括轴部分4022和收集部分4024。轴部分4022被构造成联接(例如,能移除或基本上永久地)到运送帽4012。例如,在一些实施例中,在样本收集器4020已经用于收集患者样本之后,样本收集器4020的轴部分4022能够能移除地联接到运送帽4012。在其他实施例中,例如,轴部分4022能够保持联接到运送帽4012,同时样本收集器4020用于收集患者样本。以该方式,在一些实施例中,用户能够使用运送帽操作样本收集器,而在其他实施例中,用户能够使用轴部分4022操作样本收集器。样本收集器4020能够具有用于收集患者样本的任何合适的构造和材料。例如,在一些实施例中,样本收集器4020能够是拭子(例如,卷绕拭子、植绒拭子、泡沫拭子等)。而且,在一些实施例中,样本收集器4020(以及更具体地,收集部分4024)能够被构造成将患者样本的至少一部分释放到运送培养基中。以该方式,如本文中所述的,样本收集器4020能够将患者样本释放到运送室4014中,用于之后转移到容器组件4700中。因此,在一些实施例中,样本收集器4020被构造成最大化样本收集效率和将所收集的样本释放到容器组件4700和/或反应室4732中的效率,和/或由配制成最大化样本收集效率和将所收集的样本释放到容器组件4700和/或反应室4732中的效率的材料构造。如通过在本文中提供的示例支持的,在一些情形中,已经确定,当拭子在化验培养基中运送(例如,经由运送室4014,利用化验微球和帽4012)时,在MRSA筛选化验中,泡沫拭子相比卷绕和/或植绒拭子表现更好。在又其他情形中,已经确定,在拭子连同样本在运送室4014内运送时,泡沫和/或植绒拭子表现相对类似,且二者都比卷绕拭子更好。在一些情形中,已经确定,卷绕拭子(例如,卷绕人造丝拭子)和/或涤纶拭子,尽管传统上在各种取样方法中使用,但是在释放患者样本(例如,细菌)以进行化验方面是不良的。在其他情形中,已经确定,在释放患者样本方面植绒拭子比传统拭子(例如,卷绕拭子)表现得更好,但是在一些情形中,在化验中表现得不好。这样不良的表现,在一些情形中,能够通过执行某些运送方法缓和。这样的运送方法能够包括将患者样本从患者拭子转移到反应室(例如,反应室4732),而不将患者拭子置放在运送室4014中(例如,经由转移工具转移患者样本)。以该方式,在一些情形中,已经确定植绒拭子能够在化验中表现良好。在另外的情形中,已经确定泡沫拭子,尽管通常不在细菌化验中使用,但是像植绒拭子一样地释放细菌且在化验中表现良好。转移工具4030能够是用于将运送培养基和/或样本从运送室4014转移到反应室(例如,反应室4732)的任何合适的工具。例如,在一些实施例中,转移工具4030能够是移液管。在其他实施例中,例如,转移工具4030能够是拭子。在又另外的实施例中,例如,转移工具4030能够是注射器。转移工具4030能够是任何合适的大小和形状,且能够由任何合适材料构造。图21是流程图解,其示出用于使用本文中示出和描述的试剂盒4000或任何其他设备收集、运送和测试患者样本的方法4200。如在4210处所示,患者样本使用样本收集器4020从患者(例如,经由患者的鼻孔)收集。在4220处,样本收集器4020被置放到运送容器组件4010内,使得患者样本被安置在运送室4014的运送体积4016内。尤其,样本收集器4020被置放在运送体积4016内,使得收集部分4024被安置在运送室4014内的任何运送培养基内。运送帽4012然后联接到运送室401,从而将样本收集器4020留在运送室4014内。以该方式,患者样本能够从样本收集器4020(例如,从收集部分2024)传送到运送室4014的运送培养基和/或运送体积4016。在一些实施例中,操作4210和4220能够发生在收集位置处,诸如例如护士站。在4230处,患者样本(例如,其潜在地包括目标细菌)的至少一部分和运送培养基能够从运送容器组件4010和/或样本收集器4020经由转移工具4030(例如,移液管)传送到反应室(例如,室4732)中。在一些情形中,运送帽4012首先与运送室4014分离。因此,转移工具4030能够接近安置在运送室4014内的患者样本的至少一部分。以该方式,目标细菌从经由转移工具4030转移到容器组件4700的反应室4732中。尽管示出为容器组件4700,但是能够使用任何合适的容器组件(例如,容器组件1700、2700、3700等)。在4250处,包含目标细胞的容器组件4700被安置在检测仪器(例如,在本文中以及在‘461申请中所述的任何仪器,该‘461申请的全部内容通过引用并入本文中)内。容器组件4700然后经受在本文中以及在‘461申请中所述的检测方法。在一些实施例中,方法能够涉及使用一种样本收集器,其被配制成最大化样本收集效率和/或将所收集的样本释放到容器组件中的效率。例如,图22是根据实施例的方法200的流程图。如在图22中所示,方法200包括在205处,接收包含拭子和运送培养基的容器。拭子能够类似于本文中所述的样本收集器,且包括具有由非卷绕材料构造的收集部分的轴。在一些实施例中,收集部分能够由静电组装或以其他方式聚集的材料(即,植绒拭子)或泡沫材料(诸如开室有泡沫顶端的拭子)构造。运送培养基包括从收集部分释放的样本。在210处,将运送培养基和样本转移到反应室中。反应室能够是本文中所述的任何反应室,诸如反应室4732。运送培养基和样本能够经由任何合适的机构,诸如经由转移构件4030(例如,移液管)转移。在215处,运送培养基和与目标细胞相关联的一种或多种转导颗粒在反应室中混合。转导颗粒能够是本文中所述的任何转导颗粒,且被改造成包括核酸分子,其被配制成导致目标细胞产生一种或多种报告分子。在一些实施例中,一种或多种转导颗粒能够是非复制型的。在一些实施例中,一种或多种转导颗粒能够没有所述一种或多种报告分子中的报告分子。在又另外的实施例中,来自一种或多种报告分子中的报告分子能够包括细菌荧光素酶、真核荧光素酶、荧光蛋白质、适用于比色法检测的酶、适用于免疫检测的蛋白质、适用于免疫检测的肽或起着适体的作用或表现出酶活性的核酸中的一者或多者。转导颗粒能够通过任何合适的机构被添加到反应室内和/或在反应室内被混合。在一些实施例中,转导颗粒能够被包括在如本文中所述的壳体4741(或帽组件)内的试剂容器4780和/或试剂容器4790中。在这样的实施例中,通过将力施加到致动器(例如,致动器4750和/或致动器4760),转导颗粒能够被添加到反应室(例如,室4732)内和/或在反应室内被混合,这因此导致转导颗粒如本文中所述的从试剂容器传送到反应室中。在一些实施例中,能够传送转导颗粒,使得在帽组件内的死体积在大约30μL和大约50μL之间。在一些实施例中,能够传送转导颗粒,使得“死体积”为大约40μL±9μL。在一些实施例中,能够传送转导颗粒,使得分配体积为大约285μL,其中,变化系数为大约百分之三。通过限制死体积和/或死体积的部分-到-部分的变化,能够改进输送的准确度,并且因此改进化验的准确度。在一些实施例中,转导颗粒能够以减少在其中生成的湍流的方式传送到反应室中。例如,在一些实施例中,能够传送转导颗粒,使得其冲击和/或接触如本文中所述的反应室的侧壁。在其他实施例中,转导颗粒能够以促进混合和/或减少湍流的速度和/或流动速率传送。例如,在一些实施例中,转导颗粒的混合包括通过以在大约63mm每秒和大约81mm每秒之间的速率线性地移动致动器(例如,致动器4750)来将转导颗粒传送到反应室中。在一些实施例中,转导颗粒的混合包括通过以大约72mm每秒的速率线性地移动致动器(例如,致动器4750)来将转导颗粒传送到反应室中。在一些实施例中,反应室能够包含配制成与运送培养基混合的试剂(例如,如本文中所述的,呈包括药片形式的干燥形式、和/或包括抗生素)。抗生素能够被选择和/或配制成杀死其他非目标细菌菌株,例如,非-耐药菌株,以便仅耐药菌株存活。以该方式,所产生的报告分子必然通过剩余的、目标细菌菌株产生。在一些实施例中,抗生素/抗生素系列能够被预置在反应室中(例如,在运送培养基中,以冻干和/或低压冻干形式或任何其他合适的形式)。在其他实施例中,抗生素/抗生素系列能够被安置在单独的隔室中(例如,在试剂容器中,诸如试剂容器4790),且能够按照需求或在预定时间传送到样本溶液中。在220处,当样本中存在目标细胞时,将运送培养基和一种或多种转导颗粒的混合物在至少20摄氏度的温度下维持大约八小时或更短的时段,以表达一种或多种报告分子。在一些实施例中,混合物能够被维持在大约37摄氏度大约四小时。在又其他实施例中,混合物能够被维持大约三小时或更短,或大约2小时或更短。在又其他实施例中,混合物能够被维持且处于任何合适的温度,例如在大约20摄氏度和大约37摄氏度的范围之间。在225处,接收与一种或多种报告分子的量相关联的信号。信号能够是通过特定报告分子产生的任何合适的信号,诸如例如,通过闪光发光反应产生的光学信号。在一些实施例中,信号与样本内的报告分子的量有关。在一些实施例中,信号的幅值独立于转导颗粒的高于预定量的量。类似地陈述,在一些实施例中,信号的强度基本上独立于转导颗粒的量。尽管试剂盒4000包括运送容器组件4010、转移工具4030和容器组件4700,但是在其他实施例中,试剂盒能够包括额外部件和/或没有任何这样的部件。例如,在一些实施例中,试剂盒能够没有转移工具。在一些实施例中,试剂盒能够没有转移工具和运送室。在这样的实施例中,例如,试剂盒能够包括运送帽(例如,运送帽4012)、样本收集器(例如,样本收集器4020)和容器组件(例如,容器组件4700或本文中所述的任何其他容器组件)。以该方式,利用样本收集器收集的且安置在样本收集器上的患者样本能够被置放在反应室(例如,反应室4732或本文中所述的任何其他反应室)内。在这样的实施例中,例如,运送帽能够能移除地联接到反应室。以该方式,运送帽能够从反应室移除,且反应室能够能移除地联接到壳体(例如,壳体4741或本文中所述的任何其他壳体或帽组件)。在又另外的实施例中,试剂盒能够包括运送帽(例如,运送帽4012)、样本收集器(例如,样本收集器4020)和反应室(例如,反应室4732或本文中所述的任何其他反应室)。尽管图21示出包括运送容器组件4010和单独的反应室的方法,但是在其他实施例中,在没有首先转移到运送容器的情况下,患者样本能够从样本收集器4020直接地传送到反应室(例如,反应室4732)。在这样的实施例中,在不使用转移工具4030的情况下,患者样本能够从样本收集器4020直接地传送到反应室4732。在这样的实施例中,患者样本能够在收集位置处经由样本收集器4020收集(例如,类似于上文中所述的操作4210)。接下来,样本收集器4020能够被传送到反应室4732,或本文中公开的任何其他反应室。以该方式,患者样本从患者被传送到反应室4732。一旦患者样本和/或样本收集器4020的至少一部分被安置在反应室4732内,运送帽4012能够能移除地联接到反应室4732。因此,患者样本能够通过运送帽4012、反应室4732和/或样本收集器4020共同地包含和/或保护。以该方式,患者样本能够被储存、和/或从收集位置安全地转移到测试和/或检测位置。在期望时(例如,在用于目标细胞检测的准备中),运送帽4012能够从反应室4732移除,且壳体4741(或帽组件)或本文中所述的任何其他壳体能够能移除地联接到反应室4732以完成化验。在一些实施例中,运送室4014和/或反应室4732能够包含试剂或其他成分,其被配制成与样本混合以形成化验培养基或溶液。这样的试剂能够被包括在运送培养基内和/或是运送培养基的一部分,或替代地能够是单独的成分。例如,在一些实施例中,运送室4014和/或反应室4732能够包括低压冻干药片,其与运送培养基分离地被维持,且与样本混合以形成化验培养基。例如,在一些实施例中,运送室4014和/或反应室4732能够包含抗生素(例如,头孢西丁、苯唑西林、头孢替坦、阿莫西林、青霉素、红霉素、阿奇霉素、头孢菌素、碳青霉烯类、氨基糖苷类、磺酰胺类、喹诺酮类、恶唑烷酮类等)。包含抗生素能够例如,在本文中示出和描述的类型的细菌细胞生存能力和/或敏感性化验中,杀死或以其他方式防止来自源于所有易受药物影响的细菌的报告分子的信号的生成和/或表达。抗生素能够被选择和/或配制成杀死其他非目标细菌菌株,例如,非-耐药菌株,以便仅耐药菌株存活。以该方式,所产生的报告分子必然通过剩余的、目标细菌菌株产生。在一些实施例中,抗生素/抗生素系列能够被预置在容器中(例如,在溶液中,以冻干和/或低压冻干形式或任何其他合适的形式)。在其他实施例中,抗生素/抗生素系列能够被安置在单独的隔室中(例如,在容器组件的主体或帽中),且能够按照需求或在预定时间传送到样本溶液中。在一些实施例中,连同安置在其中的任何试剂,反应室能够包括着色剂(例如,染料)。这样的染料能够例如用作“过程控制”,以确保容器中的内容物(例如,试剂)在样本被置放在其中之前不被破坏和/或排空。以该方式,如果在使用期间,仪器感测到在样本混合物中的颜色,则能够发送信号以指示和/或确认干燥试剂物质实际上在容器内。如果没有识别和/或检测到颜色,例如,仪器能够发送错误信号,指示:在测试期间,期望的试剂事实上不在容器内。尤其,图23是根据实施例的方法100的流程图。如在图23中所示,在105处,方法100包括将样本安置到反应室(本文中所述的反应室中的任一者,例如,反应室4732)中。反应室被包装成包含试剂(例如,干燥试剂、低压冻干试剂),其被配制成与样本混合以形成化验培养基。在一些实施例中,试剂可以是小球形式。在其他实施例中,试剂能够在管中干燥(例如,粘附到反应室4732的内表面)。而且,在一些实施例中,试剂能够包括抗生素和着色剂。在这样的实施例中,如本文中所述的,抗生素能够被配制成抑制在细胞表型的部分中产生一种或多种报告分子。在其他实施例中,试剂能够包括配制成抑制能检测信号的传递和/或传送的物质。在110处,在反应室中的样本与一种或多种转导颗粒(与细胞表型相关联)混合。转导颗粒能够被包含在试剂容器4780和/或试剂容器4790中,且能够如本文中所述的被引入到样本中。一种或多种转导颗粒被改造成包括核酸分子,其被配制成导致细胞表型产生一种或多种报告分子,其能够生成和/或产生能检测信号。在一些实施例中,能检测信号能够是通过闪光发光反应产生的光学信号。在一些实施例中,转导颗粒能够被改造成不能进行裂解和/或溶原复制。在一些实施例中,一种或多种转导颗粒能够源于噬菌体。试剂被配制成通过抑制产生信号的成分的产生或通过抑制信号的传送和/或传输来抑制能检测信号。在一些实施例中,例如,试剂被配制成抑制在细胞表型的至少一部分中产生一种或多种报告分子。转导颗粒能够通过任何合适的机构被添加到反应室内和/或在反应室内被混合。在一些实施例中,转导颗粒能够被包括在如本文中所述的壳体4741(或帽组件)内的试剂容器4780和/或试剂容器4790中。在这样的实施例中,通过将力施加到致动器(例如,致动器4750和/或致动器4760),转导颗粒能够被添加到反应室(例如,室4732)内和/或在反应室(例如,室4732)内被混合,这因此导致转导颗粒从试剂容器传送到反应容器中,如本文中所述的。在一些实施例中,能够传送转导颗粒,使得在帽组件内的死体积在大约30μL和大约50μL之间。在一些实施例中,能够传送转导颗粒,使得“死体积”为大约40μL±9μL。在一些实施例中,能够传送转导颗粒,使得分配体积为大约285μL,其中变化系数为大约百分之三。通过限制死体积和/或死体积的部分-到-部分的变化,能够改进输送的准确度,并且因此改进化验的准确度。在一些实施例中,转导颗粒能够以减少在其中生成的湍流的方式传送到反应室中。例如,在一些实施例中,能够传送转导颗粒,使得其冲击和/或接触如本文中所述的反应室的侧壁。在其他实施例中,转导颗粒能够以促进混合和/或减少湍流的速度和/或流动速率传送。例如,在一些实施例中,转导颗粒的混合包括通过以在大约63mm每秒和大约81mm每秒之间的速率线性地移动致动器(例如,致动器4750)来将转导颗粒传送到反应室中。在一些实施例中,转导颗粒的混合包括通过以大约72mm每秒的速率线性地移动致动器(例如,致动器4750)来将转导颗粒传送到反应室中。在115处,接收与试剂相关联的第一信号。在一些实施例中,第一信号能够是与包括在试剂内的着色剂相关联的光学信号。在一些实施例中,第一信号能够与在反应室内的化验培养基的体积相关联。以该方式,第一信号能够指示试剂的存在。在120处,当第一信号指示存在试剂时,维持样本和一种或多种转导颗粒,以在细胞表型存在于样本中时,表达一种或多种报告分子。在125处,接收与一种或多种报告分子的量相关联的第二信号。第二信号是能检测信号,且能够是通过特定报告分子产生的任何合适的信号,诸如例如,通过闪光发光反应产生的光学信号。在一些实施例中,第二信号与样本内的报告分子的量相关联。在一些实施例中,第二信号的幅值独立于超过预定量的转导颗粒的量。类似地陈述,在一些实施例中,第二信号的强度基本上独立于转导颗粒的量。而且,在一些实施例中,细胞表型的部分能够包括细菌表型,其对个别的抗生素或与另一抗生素组合的抗生素有抗性。抗生素能够包括如下中的一种或多种:β-内酰胺、超广谱β-内酰胺、氨基糖甙类、安沙霉素类、碳头孢烯类、碳青霉烯类、任一代头孢菌素类、糖肽、林可酰胺类、脂肽、大环内酯类、单菌胺类、硝基呋喃类、恶唑烷酮类、青霉素类、多肽、喹诺酮类、氟喹诺酮类、磺酰胺类、四环素类、分枝杆菌抗生素、氯霉素、或莫匹罗星。在一些实施例中,细胞表型的部分能够包括对头孢西丁、万古霉素、替考拉丁、氨苄青霉素/舒巴坦、环丙沙星、美罗培南、头孢他啶、头孢曲松、哌拉西林/他唑巴坦或庆大霉素中的一种或多种有抗性的细菌表型。在一些实施例中,方法100能够包括将物质安置到样本中。物质被配制成与一种或多种报告分子反应以增强第二信号。例如,在一些实施例中,报告分子能够是荧光素酶,且方法100能够采用上文中所述的帽组件和/或壳体4741。在这样的实施例中,试剂容器4780和/或试剂容器4790能够包含醛试剂,其被配制成引发、发起和/或催化能通过信号的产生检测到的发光反应。在一些实施例中,试剂能够包括6-碳醛(己醛)、13-碳醛(十三醛)和/或14-碳醛(十四醛),包括在其之间所有不同的碳链长度的醛。在一些实施例,组件4700能被构造成在额外试剂被安置到样本中之前,维持额外试剂与样本流体隔离。以该方式,能够控制额外试剂输送到样本中的时间。在一些实施例中,系统能够包括机构(例如,用于将力施加到致动器4750和/或致动器4760的机构),用于在任何合适的时间和/或以任何合适的方式添加额外试剂以诱导能检测的信号。例如,如在本文中更详细地描述的,在一些实施例中,系统和/或测试容器能够包括机构,用于以预定速度(或流动速率)将额外试剂传送到样本中以促进期望水平的混合。例如,在一些实施例中,能够传送试剂和/或底物使得其冲击和/或接触如本文中所述的反应室的侧壁。在其他实施例中,能够以促进混合和/或减少湍流的速度和/或流动速率传送试剂和/或底物。荧光素酶反应的步骤包括首先在荧光素酶和核黄素单核苷酸之间形成复合体。在缺乏合适的醛(即,底物)的情况下,该复合体不能在发光反应中继续。荧光素酶反应在添加醛时继续并发光,且理想地,优选的是所有复合的荧光素酶都被引发以同时发射光子。这将导致在短的时间段内发射大流量的光子,即,能够容易地检测到一道闪光。然而如通过在本文中呈现的测试结果所支持的,如果试剂和/或底物以太高的速率被传送到反应室中,则所检测到的光的量将减少和/或重复检测到的光的量将表现出增加的变化性,从而导致与光检测相关联的变化系数增大。性能的这种降低被认为与在溶液中的飞溅和/或气泡形成(其在试剂和/或底物以高速传送时能够发生)相关。因此,试剂和/或底物的混合能够被控制以产生期望的光输出性能。例如,在一些实施例中,试剂和/或底物的混合包括通过以在大约63mm每秒和大约81mm每秒之间的速率线性地移动致动器(例如,致动器4760)来将试剂和/或底物传送到反应室中。在一些实施例中,试剂和/或底物的混合包括通过以大约72mm每秒的速率线性地移动致动器(例如,致动器4760)来将试剂和/或底物传送到反应室中。在一些实施例中,MRSA报告化验能够使用如本文中所述的任何合适的系统和方法开发和/或执行。在这样的实施例中,非复制型转导颗粒从专门针对金黄色葡萄球菌的噬菌体开发,且在组成型启动子的控制下并入细菌荧光素酶基因luxAB。在该转导颗粒将报告系统引入到金黄色葡萄球菌中时,组成型启动子能够表达luxAB,其适用于报告活金黄色葡萄球菌的存在。如果另外,还在混合转导颗粒与金黄色葡萄球菌细胞之前或同时地添加抗生素头孢西丁或类似抗生素,则如果细胞不包含和表达mecA基因,在化验中将不表达任何luxAB,因此指示不存在MRSA。然而如果,细胞包含并表达mecA基因,则在化验中将表达luxAB,因此指示细胞是MRSA(即,对头孢西丁的抑制作用有抗性)。尽管容器组件4700被示出为包括在壳体4741和反应室4732之间的螺纹联接,但是在其他实施例中,壳体能够经由压配合联接到反应室。例如,图24示出根据实施例的容器组件5700的侧面、局部横截面视图。容器组件5700能够与在本文中以及在名称为“SystemsandMethodsforDetectionofCellsusingEngineeredTransductionParticles(用于使用改造的转导颗粒进行细胞检测的系统和方法)”的美国专利申请号13/802,461中描述的仪器中的任一者和/或部件中的任一者一起使用且通过其操纵,该文献的全部内容通过引用并入本文中。以该方式,容器组件5700和本文中所述的容器组件中的任一者根据在本文中或在‘461申请中描述的方法中的任一者能够用于检测和/或识别样本内的目标细胞(例如,细菌)。例如,在一些实施例中,容器组件5700能够用于将试剂安置和/或混合到样本中,同时维持在容器和外部区域之间的流体隔离。以该方式,细胞识别的方法能够在封闭系统和/或均相化验中执行。类似地陈述,在一些实施例中,容器组件5700在不涉及从容器组件5700移除内容物、在容器组件5700内分离内容物、在容器组件5700内洗涤内容物和/或在容器组件5700内冲洗内容物的细胞识别和/或检测的方法中使用。容器组件5700包括壳体5741、第一致动器(未示出)、第二致动器5760和反应室(未示出)。壳体5741能够能移除地联接到反应室。例如,如在图24中所示,壳体5741能够经由压配合部分5743联接到反应室的近端部分。因此,壳体5741(以及安置在其中的部件)能够与反应室5732分离地和/或间隔开的储存。以该方式,用户然后能够根据在本文中(和在‘461申请中,该文献的全部内容通过引用并入本文中)所述的方法将样本安置到反应室中,且然后能将壳体5741(或“帽组件”)组装到反应室(或者“管”)且完成用于细胞识别的步骤,如本文中所述的。壳体5741限定构造成接收第一试剂容器(未指示)的第一试剂体积(未指示)和构造成接收第二试剂容器5790的第二试剂体积5744。壳体5741包括第一穿刺件5792、第二穿刺件5794、第一输送路径5771和第二输送路径5773。第一穿刺件5792、第二穿刺件5794、第一输送路径5771和第二输送路径5773类似于上文中所述的壳体4741中的对应结构,且因此不再详细描述。压配合部分5743包括凹部或槽,反应室的一部分能够固定地安置在其中(即,形成压配合或过盈配合)。在一些实施例中,压配合部分5743能够包括密封构件(例如,O型环等)以在壳体5741联接到反应室时限定基本上流体密闭的密封。如图所示,第二致动器5760是基本上实心,且具有基本上类似于第二试剂体积5744的宽度的宽度。以该方式,能够限制在第二试剂体积5744(和/或第一试剂体积,未指示)内的非期望“死空间”。在使用中,容器组件5700能够相对于壳体4741和/或帽组件以类似于上述方式的方式致动。尤其,第二致动器5760能够在第二试剂体积5760内操纵,以将试剂从第二试剂体积5760传送到反应室。尽管试剂容器(例如,试剂容器4780、试剂容器4790、试剂容器5780、试剂容器5790)已经在安置在壳体(例如,壳体4741)内时被描述和图示为在彼此侧向的位置中,但是在其他实施例中,试剂容器能以任何合适的方式或构造,诸如例如,以竖直构造安置在壳体内。例如,图25A-C、及图26和图27示出根据实施例的壳体6741(和“帽组件”)。尤其,图25A-C在横截面侧视图中(图25A)、在横截面前视图中(图25B)以及在底视图中(图25C)示出壳体6741。图26和图27在横截面前视图中(图26)和前视图(图27)中示出壳体6741(没有试剂容器)。如图所示,壳体6741限定试剂体积6742(图25B),其被构造成接收第一试剂容器6780和第二试剂容器6790。如在图26中所示,壳体6741包括第一破裂构件6798和第二破裂构件6799。第一破裂构件6798和第二破裂构件6799相应地包括第一穿刺件6792和第二穿刺件6794。破裂构件6798和破裂构件6799各自至少部分地限定输送路径6771。输送路径6771将试剂体积6742置放成与反应室(未示出)流体连通。此外,如图所示,输送路径6771将第一破裂构件6798和第二破裂构件6799置放成彼此流体连通。以该方式,在到达反应室(未示出)或其一部分之前,试剂容器6780中的内容物能够与试剂容器6790中的内容物连通(例如,混合)。这样的布置,在一些实施例中,能够促进来自试剂容器6780和/或试剂容器6790的内容物的混合和/或最小化充气、喷溅和/或非期望湍流。尽管示出为流体连通的,但是在其他实施例中,第一破裂构件6798和第二破裂构件6799能够维持彼此流体隔离。例如,在一些实施例中,第一破裂构件6798能够部分地限定第一输送路径(未示出),且第二破裂构件6799能够部分地限定第二输送路径(未示出),使得第二输送路径与第一输送路径不同和/或与第一输送路径流体隔离。试剂容器6780和试剂容器6790的破裂能够至少部分地通过任何合适的装置发起和/或导致。例如,在一些实施例中,能够操纵壳体6741,使得壳体6741的内部部分内的压力被改变,从而导致试剂容器6780和/或试剂容器6790相应地被推进抵靠第一破裂构件6798和第二破裂构件6799。以该方式,第一破裂构件6798的穿刺件6792和/或第二破裂构件6799的穿刺件能够相应地破裂第一试剂容器6780和第二试剂容器6790。例如,在一些实施例中,壳体6741能够包括一个或多个致动器(类似于致动器4750)。虽然已经在上文中描述了各种实施例,但是应当理解其仅以举例而不是限制的方式呈现。在上文中所述的方法和/或示意图指示某些事件和/或流程图谱以特定次序发生的情况下,可修改某些事件和/或流程图谱的次序。额外地,在可能时,某些事件可在并行过程中同时执行,以及顺序地执行。虽然已经具体地示出和描述了实施例,但是将理解,可对形式和细节做出各种改变。尽管穿刺件(例如,穿刺件1792)在本文中被描述为相对于壳体(例如,壳体1741)基本上静止(例如,固定),但是在其他实施例中,穿刺件能够相对于壳体运动(例如,能滑动、能旋转等)。在使用中,任何合适的容器组件(例如,容器组件1700、2700、3700、4700、5700等)能够经由任何合适的方法接收患者样本(例如,细菌)。例如,在一些实施例中,容器组件能够被提供在试剂盒内,试剂盒包括额外部件,例如,用于收集患者样本的拭子。在这样的实施例中,样本能够经由拭子输送到测试容器。在其他实施例中,样本能够从运送容器输送到容器组件(例如,经由移液管、注射器等)。尽管试剂容器4780和试剂容器4790被示出和描述为具有特定形状和构造,但是本文中所述的试剂容器(或泡罩包装)中的任一者能够由任何合适材料,例如PVC,和/或由不同材料(例如,医药级共聚物、环烯烃共聚物膜、泰克妮COCP12P、PCTFE薄膜层压件、泰克妮VA10200)的组合构造。在一些实施例中,本文中所述的试剂容器或泡罩包装能够由与包括γ辐照的生物负载减少的方法相容的材料构造。而且,本文中所述的泡罩包装中的任一者能够是任何合适的大小或形状。例如,在一些实施例中,泡罩包装能够包括线性部分(例如,泡罩包装的裙部、平坦表面)和非线性部分(例如,圆形表面)。在这样的实施例中,泡罩包装能够被构造成限制在其中的死体积(例如,空的空间、空隙、空腔、没有试剂的区域等)。在一些实施例中,代替或额外于线性部分,泡罩包装能够包括凹入部分。以该方式,在该部分破裂时(例如,箔开始凸出),能够在凹入部分的表面和刺穿构件之间建立高效和/或充分的接触。因此,泡罩包装中的内容物的分配能够被最大化和/或能够实现死体积减少。本文中所述的试剂容器和/或泡罩包装中的任一者(例如,试剂容器4780和/或试剂容器4790)能够包含预定量的任何合适的试剂(例如,化验试剂、抗生素试剂、转导颗粒、底物试剂等)。能够以任何适当方式测量预定量,例如,通过比浓度的体积。而且,试剂容器和/或泡罩包装中的任一者能够包括在本文中以及在如下文献中描述的转导颗粒中的任一者:2014年4月24日提交的、名称为“ReagentCartridgeforDetectionofCells(用于细胞检测的试剂盒)”的美国临时申请号61/983,765;2013年3月13日提交的、名称为“Non-ReplicativeTransductionParticlesandTransductionParticle-BasedReporterSystems(非复制型转导颗粒和基于转导颗粒的报告系统)”的美国临时申请号61/779,177;2014年2月12日提交的、名称为“SystemsandMethodsforPackagingNucleicAcidMoleculesintoNon-ReplicativeTransductionParticlesandTheirUseasCellularReporters(用于将核酸分子包装到非复制型转导颗粒中的系统和方法及其作为细胞报告体的用途)”的美国临时申请号61/939,126;以及2013年10月29日提交的、名称为“TranscriptDetectionSystemsandMethods(转录检测系统和方法)”的美国临时申请号61/897,040,和2014年3月13日提交的、名称为“Non-ReplicativeTransductionParticlesandTransductionParticle-BasedReporterSystems(非复制型转导颗粒和基于转导颗粒的报告系统)”的国际专利申请号PCT/US2014/026536,这些文献中的每一个的全部内容均通过引用并入本文中。尽管容器组件、系统和方法在本文中描述为用于使用非复制型转导颗粒检测和/或识别目标细胞,在其他实施例中,本文中所述的容器组件和系统中的任一者能够结合任何合适的试剂使用以检测目标细菌。例如,在一些实施例中,本文中所述的组件和系统能够结合有复制能力的转导颗粒(诸如例如传统的噬菌体报告体)使用。例如,在一些实施例中,壳体或“帽组件”(例如,壳体4741)包含两个试剂体积(例如,体积4742和4744)和/或两个试剂容器(例如,试剂容器4780和4790)。第一试剂体积和/或试剂容器包含改造的荧光素酶-报告噬菌体,诸如例如由Promega公司生产的Nanoluc®荧光素酶。第二试剂体积和/或第二试剂容器包含底物,诸如furimazine。在一些实施例中,底物能够被配制以与包含在第一试剂体积内的荧光素酶-报告噬菌体(例如,Nanoluc®)的特定相容。在使用中,在样本被添加到反应室且帽组件联接到其之后,方法包括将第一试剂体积中的内容物添加到反应室。样本和第一试剂(例如,报告噬菌体,诸如Nanoluc®报告噬菌体)在预定温度或预定温度之上被维持预定时间段(例如,培育样本)。如果样本包含细菌(其是报告噬菌体被设计针对的目标),那么报告噬菌体导致活目标细菌在培育期期间表达荧光素酶。在培育期之后,第二试剂体积中的内容物被添加到反应室,从而提供底物(即,复立玛津(furimazine)),其能够与任何表达的荧光素酶反应且生成发光信号,因此指示在样本中存在目标细菌。在该化验(和本文中所述的化验中的任一者)期间产生的光输出能够使用任何合适的仪器检测,诸如在‘461申请中描述的仪器。在一些实施例中,方法包括使用荧光素酶报告噬菌体以识别耐抗生素细菌的存在。例如,在一些实施例中,反应室(例如,反应室4732)能够包括抗生素,例如,作为干燥试剂。能够使用本文中所述的任何类型的抗生素。壳体或“帽组件”(例如,壳体4741)被构造成能移除地联接到反应室,且包含两个试剂体积(例如,体积4742和4744)和/或两个试剂容器(例如,试剂容器4780和4790)。第一试剂体积和/或试剂容器包含任何合适的报告噬菌体。第二试剂体积和/或第二试剂容器包含底物,诸如荧光素。在使用中,在样本被添加到反应室且帽组件联接到其之后,方法包括将第一试剂体积中的内容物添加到反应室。样本和第一试剂(例如,报告噬菌体)在预定温度或预定温度之上被维持预定时间段(例如,培育样本)。以该方式,在样本内存在的对抗生素有抗性的任何细菌能够繁殖和表达荧光素酶。相反,在样本内对抗生素敏感的那些细菌不繁殖和/或不表达荧光素酶,和/或以其他方式不能成功地介导发光反应。在培育期之后,第二试剂体积中的内容物被添加到反应室,从而提供底物,其能够与任何表达的荧光素酶反应以生成发光信号,因此指示在样本中存在目标细菌。在该化验(和本文中所述的化验中的任一者)期间产生的光输出能够使用任何合适的仪器检测,诸如在‘461申请中描述的仪器。在其他实施例中,荧光素酶报告化验能够采用细菌的荧光素酶基因luxAB作为第一试剂,且其底物,诸如癸醛的醛作为,第二试剂。在又其他实施例中,荧光素酶报告化验能够采用包括基因luxCDEAB的细菌的荧光素酶基因操纵子,因此由于操纵子包含使目标细菌能够产生醛的基因,所以消除了对于添加底物(例如,醛)的需要。在这样的实施例中,帽组件仅需要限定一个试剂体积或包括一个试剂容器。如本文中所述的,这样的方法能够结合抗生素和/或抗菌化合物使用。尽管容器组件、系统和方法在本文中描述为用于检测和/或识别目标细胞,诸如细菌,但是在其他实施例中,本文中所述的容器组件、系统和方法中的任一者能够结合任何合适的均相化验使用。而且,尽管容器组件、系统和方法在本文中被描述为用于检测和/或识别目标细胞,诸如细菌,但是在其他实施例中,本文中所述的容器组件、系统和方法中的任一者能够结合并入了“能切换信号(switchablesignal)”(即,实现均相化验的报告系统,其中,能够在不需要洗涤或分离步骤的情况下生成和检测特定信号)的任何化验使用。类似地陈述,本文中所述的容器组件、系统和方法中的任一者能够结合任何合适的化验使用,其中,不产生信号除非或直到与分析物发生反应为止和/或其中,在样本中不存在任何量的报告体直到是使得产生报告体的条件为止。而且,尽管“能切换”报告分子在本文中被描述为能够从编码介导发光反应的酶的报告基因被表达的分子,但是在其他实施例中,能切换报告体能够通过直接添加分子被介导,其在例如通过结合到目标分析物介导的构象改变时‘打开’以产生信号,诸如例如,能切换适体,其被设计用于检测由命名为Spinach的RNA构成的S-腺苷甲硫胺酸,和荧光团3,5-二氟-4-羟基苯亚甲基咪唑啉酮(DFHBI),其被设计为包括结合到S-腺苷甲硫氨酸的传感元件,其在构象改变时导致允许荧光团激活,如在“FluorescenceimagingofcellularmetaboliteswithRNA,Science,2012年3月,第335卷,第6073期,9,第1194页”中描述的。在又其他实施例中,能切换报告体包括在与分析物反应之前表现出第一信号且在与分析物反应之后表现出第二(不同)信号的任何事物。在一些实施例中,本文中所述的容器组件和系统能够在卫生化验中使用,以通过检测在样本内三磷酸腺苷(ATP)的存在来确定活的(或之前活的)生物体的存在。在这样的实施例中,未知卫生样本被添加到反应室(例如,反应室4732)。方法进一步包括将壳体或“帽组件”(例如,壳体4741)被附接到反应室。如上所述,壳体包含两个试剂体积(例如,体积4742和4744)和/或两个试剂容器(例如,试剂容器4780和4790)。第一试剂体积和/或试剂容器包含营养培养基,其被配制成使得在样本中存在的任何生物体将保持代谢活跃。营养培养基能够类似于和/或包含本文中所述的运送培养基的营养物或成分中的任一者。第二试剂体积和/或第二试剂容器包含制剂,其包括真核荧光素酶、荧光素和裂解试剂。如下文中描述的,在ATP存在时,产生光输出(即,经由发光反应),其能够使用任何合适的仪器检测,诸如在‘461申请中描述的仪器。在使用中,在样本被添加到反应室且帽组件联接到其之后,方法包括将第一试剂体积中的内容物添加到反应室,以为样本中的任何生物体提供营养物,以保持代谢活跃。在一些实施例中,能够培育样本一时间段以允许样本中的任何生物体生长。这样的培育能够使用在‘461申请中描述的仪器中的任一者执行任何合适的时间并且在任何合适的温度下。第二试剂体积中的内容物能够然后被添加到反应室。裂解试剂(被包括在第二试剂室内)被配制成释放通过可在样本内存在的活生物体产生的三磷酸腺苷。如果样本包含任何活生物体,则荧光素酶和荧光素将与提取的三磷酸腺苷一起反应,从而导致发光反应,并且因此指示在反应中活生物体的存在。在其他实施例中,执行卫生化验的方法不需要包括添加营养培养基,如上文中指示的。因此,在一些实施例中,帽组件能够包括仅单个试剂体积、致动器和/或试剂容器。在这样的实施例中,方法能够包括在没有培育步骤的情况下直接从样本报告活生物体的存在。在其他实施例中,执行卫生化验的方法能够包括使用本文中所述类型的帽组件输送各种不同的成分。以该方式,在化验中使用的某些成分能够与其他成分分离地和/或间隔开的储存。例如,采用本文中所述的帽组件的这样的方法能够便于裂解(或提取)试剂的分离储存,其能够限制裂解剂将消极地影响荧光素酶和/或荧光素的性能的可能性。例如,在一些实施例中,荧光素和/或荧光素酶能够被并入到干燥试剂中并且置放到反应室中。该布置还适应使用液体形式不稳定的荧光素和/或荧光素酶制剂。例如,在一些实施例中,荧光素能够作为干燥试剂被包括在反应室内,(帽组件的)第一试剂体积能够包括裂解试剂,且(帽组件的)第二试剂体积能够包括真核荧光素酶。在使用中,裂解试剂相比荧光素酶能够在不同的时间被添加,因此允许在添加荧光素酶之前的受控的裂解期。在其他实施例中,荧光素酶能够作为干燥试剂被包括在反应室内,(帽组件的)第一试剂体积能够包括裂解试剂,且(帽组件的)第二试剂体积能够包括荧光素。在又其他实施例中,荧光素酶和荧光素两者都能够作为干燥试剂被包括在反应室内,且(帽组件的)试剂体积能够包括裂解试剂。在一些实施例中,执行卫生化验的方法能够包括将样本暴露于抗菌化合物。抗菌化合物能够包括任何物质,诸如例如,抗生素,其被配制和/或选择成杀死非目标生物体(例如,细菌菌株等等)。以该方式,方法能够用于指示在反应中对抗菌化合物不敏感或有抗性的活生物体的存在。在这样的实施例中,抗菌化合物能够例如以干燥形式被包括在反应室内。因此,在一些实施例中,方法包括将未知卫生样本添加到包含抗菌化合物的反应室。壳体或“帽组件”(例如,壳体4741)被附接到反应室。如上所述,壳体包含两个试剂体积(例如,体积4742和4744)和/或两个试剂容器(例如,试剂容器4780和4790)。第一试剂体积和/或试剂容器包含营养培养基,其被配制成使得在样本中存在的任何生物体将保持代谢活跃。营养培养基能够类似于和/或包含本文中所述的运送培养基的营养物或成分中的任一者。第二试剂体积和/或试剂容器包含制剂,其包括真核荧光素酶、荧光素和裂解试剂。如下文中描述的,在ATP存在时,产生光输出(即,经由发光反应),其能够使用任何合适的仪器检测,诸如在‘461申请中描述的仪器。在将样本添加到反应室和帽组件联接到其之后,第一试剂体积中的内容物能够被添加到反应室,以为样本中的任何生物体(其对抗菌化合物有抗性)提供营养物以保持代谢活跃。在一些实施例中,样本能够被培育一定时间以允许样本中对抗菌化合物有抗性的任何生物体生长。这样的培育能够使用在‘461申请中描述的仪器中的任一者执行任何合适的时间并且在任何合适的温度下。第二试剂体积中的内容物能够然后被添加到反应室。(包括在第二试剂室内的)裂解试剂被配制成释放通过可能存在于样本内的活生物体(即,对抗菌化合物不敏感或有抗性的那些生物体)产生的三磷酸腺苷。如果样本包含任何活生物体,则荧光素酶和荧光素将与提取的三磷酸腺苷一起反应,从而导致发光反应,并且因此指示在反应中存在这样的活生物体。在一些实施例中,本文中所述的容器组件和系统能够用于检测某些酶在样本中的存在。以该方式,能够确定在样本内存在的任何生物体的功能和/或特征。例如,在一些实施例中,方法包括确定酰胺酶的存在,酰胺酶能够表明对某些抗生素有抗性的细菌。在这样的实施例中,反应室(例如,反应室4732)能够包括笼状荧光素酶底物(例如,以干燥形式),诸如例如,笼状D-荧光素分子,诸如在“HequanYao等,ABioluminogenicSubstrateforInVivoImagingofBeta-LactamaseActivity,AngewandteChemieInternationalEdition,2007年8月,第46卷,第7031-7034页”中描述的那些β-内酰胺-d-荧光素(Bluco)。笼状荧光素酶底物作为荧光素酶底物能够被设计为和/或改造成具有有限的反应性或者没有反应性,除非酰胺酶首先与笼状荧光素酶底物反应,使得其释放底物。壳体或“帽组件”(例如,壳体4741)被构造成能移除地联接到反应室。壳体包含两个试剂体积(例如,体积4742和4744)和/或两个试剂容器(例如,试剂容器4780和4790)。第一试剂体积和/或试剂容器包含细胞裂解试剂。第二试剂体积和/或第二试剂容器包含诸如海肾荧光素酶的生物发光分子。在样本被添加到反应室且帽组件联接到其之后,方法包括将第一试剂体积中的内容物添加到反应室。以该方式,可存在于样本中的任何细胞被裂解。如果样本包含表达酰胺的目标细胞,则细胞的这样的裂解释放酰胺和其他细胞内分子。方法然后包括将第二试剂体积中的内容物添加到反应室。如果存在酰胺,则其能够解放笼状荧光素且允许解放的荧光素酶底物与荧光素酶(从第二试剂体积添加,例如,海肾荧光素酶)反应,因此产生发光信号,其表明在样本中存在酰胺酶。在该化验(和本文中所述的化验中的任一者)期间产生的光输出能够使用任何合适的仪器检测,诸如在‘461申请中描述的仪器。在其他实施例中,笼状荧光素酶底物能够被包括在容器组件的任何合适的部分(或体积)中,和/或能够在方法的任何合适的交接处被添加。例如,在一些实施例中,帽组件的第一试剂体积能够包括非复制型转导颗粒,其被设计为表达在目标细胞中的海肾荧光素酶。第二试剂体积能够包括笼状荧光素酶底物,其被设计为作为荧光素酶底物具有有限的反应性或没有反应性,除非酰胺酶首先与笼状荧光素酶底物反应,使得其解放底物。在样本被添加到反应室且帽组件联接到其之后,方法包括将第一试剂体积中的内容物添加到反应室。所得到的溶液然后在预定温度或预定温度之上被维持一时间段(即,培育溶液)。以该方式,如果样本包含目标细胞,则非复制型转导颗粒能够导致目标细胞表达海肾荧光素酶。方法然后包括将第二试剂体积中的内容物添加到反应室。如果目标细菌产生酰胺,则酰胺能够释放笼状荧光素酶底物且允许释放的荧光素酶底物与荧光素酶反应,因此产生发光信号,其表明在样本中存在酰胺酶。在该化验(和本文中所述的化验中的任一者)期间产生的光输出能够使用任何合适的仪器检测,诸如在‘461申请中描述的仪器。尽管方法被示出和描述为确定酰胺酶的存在,但是在其他实施例中,方法和系统能够用于确定任何合适的酶的存在。例如,在一些实施例中,方法包括确定碳青霉烯酶的存在。在这样的实施例中,反应室(例如,反应室4732)能够包括干燥碳青霉烯底物,诸如碳青霉烯或头霉素。壳体或“帽组件”(例如,壳体4741)被构造成能移除地联接到反应室。壳体包含两个试剂体积(例如,体积4742和4744)和/或两个试剂容器(例如,试剂容器4780和4790)。第一试剂体积和/或试剂容器包含细胞裂解试剂。第二试剂体积和/或第二试剂容器包含试剂,其包含pH指示剂,其被配制成使得在被添加到样本时,在反应混合物的pH被包括在6.4和8.4之间时,反应将改变颜色。在样本被添加到反应室且帽组件联接到其之后,方法包括将第一试剂体积中的内容物添加到反应室。以该方式,可能存在于样本中的任何细胞被裂解。如果样本包含表达碳青霉烯的目标细胞,则细胞的这样的裂解释放碳青霉烯和其他细胞内分子。方法然后包括将第二试剂体积中的内容物添加到反应室。如果存在碳青霉烯,则其与碳青霉烯底物反应且经由pH指示剂导致颜色改变,其中,颜色改变指示在样本中存在产生碳青霉烯的细菌。在该化验(以及本文中所述的化验中的任一者)期间产生的颜色改变能够使用任何合适的仪器检验,诸如在‘461申请中描述的仪器。在一些实施例中,本文中所述的容器组件和系统能够在DNA序列化验中使用。在这样的实施例中,反应室(例如,反应室4732)包含干燥适体分子和干燥荧光团的成分。干燥适体分子被配制、改造和/或设计为结合到DNA的目标序列。干燥荧光团(也称为染料)被设计为优选地在结合到复合体时发荧光,该复合体通过适体到目标DNA序列的结合形成。壳体或“帽组件”(例如,壳体4741)能移除地联接到反应室。如上所述,壳体包含两个试剂体积(例如,体积4742和4744)和/或两个试剂容器(例如,试剂容器4780和4790)。第一试剂体积和/或试剂容器包含缓冲溶液,其被设计为产生和/或促进对于适体/目标DNA/荧光团结合有利的条件。第二试剂体积和/或第二试剂容器包含制剂,其包含寡核苷酸,其被设计为结合到目标DNA分子且置换(例如,排挤掉)可能已经结合到目标DNA分子的适体。在使用中,在样本被添加到反应室且帽组件联接到其之后,方法包括将第一试剂体积中的内容物添加到反应室。因为第一试剂的添加产生对于适体/目标DNA/荧光团结合有利的条件,所以如果样本包含目标DNA,则结合将发生,且能够检测到来自复合的荧光团的荧光信号。以该方式,适体分子能够被认为是“能切换”适体。在时间段已经过去之后,第二试剂体积中的内容物能够被添加到反应室。如果在添加从第二试剂体积引入的寡核苷酸之后消除了荧光信号,那么如果信号的丢失是由于通过寡核苷酸从目标DNA置换了适体(且因此从现在未复合的适体置换荧光团)。这种信号的丢失用于确认初始荧光信号具体是由于适体到目标DNA的复合。在该化验(和本文中所述的化验中的任一者)期间产生的光输出能够使用任何合适的仪器检测,诸如在‘461申请中描述的仪器。在一些实施例中,DNA序列检测系统和方法能够包括在活细胞内检测DNA。例如,在一些实施例中,上文中所述的方法能够被修改,使得反应室(例如,反应室4732)包含干燥荧光团,其被配制和/或改造成使得在包含活细胞的样本被添加到反应室时其能够进入活细胞。而且,荧光团还被设计为优选地在结合到通过适体到目标DNA序列的结合形成的复合体时发荧光。结合本方法使用的壳体或“帽组件”(例如,壳体4741)包含两个试剂体积(例如,体积4742和4744)和/或两个试剂容器(例如,试剂容器4780和4790)。第一试剂体积和/或试剂容器包含脂质体和适体。适体能够类似于上文中所述的那些,且被配制、改造和/或设计为结合到DNA的目标序列。脂质体能够将适体直接携带到活细胞中,或者能够携带设计为在活细胞内表达适体的DNA序列。第二试剂体积和/或第二试剂容器包含裂解试剂,以在活细胞内释放分子,且寡核苷酸被设计为从目标DNA序列置换适体(类似于上文中所述的)。在使用中,在样本被添加到反应室且帽组件联接到其之后,第一试剂体积中的内容物能够被添加到反应室。在将适体输送到反应室中之后,适体经由包含在第一试剂体积中的脂质体输送到细胞中。在其他实施例中,能够使用任何其他合适的机构以将适体运送到细胞中。而且,在一些实施例中,脂质体能将适体直接地携带和/或运送到活细胞中,然而在其他实施例中,脂质体能携带和/或运送设计为在活细胞内表达适体的DNA序列。在适体在活细胞内之后,其能够与目标DNA序列复合,从而允许复合体结合荧光团并且产生荧光信号,其表明适体结合到目标DNA序列。在一定时间段之后,第二试剂体积中的内容物能够被添加到反应室。裂解试剂的添加将分子释放在活细胞内,且寡核苷酸能够因此从目标DNA序列置换适体。因此,如果在添加从第二试剂体积引入的寡核苷酸之后荧光信号消除,那么信号的丢失是由于通过寡核苷酸从目标DNA置换了适体(且因此从现在未复合的适体置换荧光团)。这用于确认初始荧光信号具体是由于适体到目标DNA的复合。在该化验(和本文中所述的化验中的任一者)期间产生的光输出能够使用任何合适的仪器检测,诸如在‘461申请中描述的仪器。在一些实施例中,本文中所述的容器组件和系统能够在化验中用于确定样本的转录活性。在这样的实施例中,样本能够被安置在反应室(例如,反应室4732)内。壳体或“帽组件”(例如,壳体4741)能移除地联接到反应室。壳体包含两个试剂体积(例如,体积4742和4744)和/或两个试剂容器(例如,试剂容器4780和4790)。第一试剂体积和/或试剂容器包含脂质体,其携带分子信标,其被设计成在信标已经结合到目标RNA转录序列时发荧光。第二试剂体积和/或第二试剂容器包含制剂,其包含裂解试剂和寡核苷酸,其被设计为优选地结合到目标RNA序列且置换结合的分子信标(例如,“排挤掉“信标)。在样本被添加到反应室且帽组件联接到其之后,方法包括将第一试剂体积中的内容物添加到反应室。所添加的脂质体能够将分子信标输送到可能存在于样本内的活细胞中。如果样本包含转录目标RNA的细菌的活细胞,则分子信标能结合到目标RNA序列并且产生荧光信号。荧光信号能够使用任何合适的仪器检测,诸如在‘461申请中描述的仪器。第二试剂体积中的内容物然后被添加到反应室。裂解试剂的添加释放分子在活细胞内,且寡核苷酸能因此从目标RNA序列置换分子信标。因此,如果在添加从第二试剂体积引入的寡核苷酸之后荧光信号消除,那么信号的丢失是由于通过寡核苷酸从目标RNA置换了分子信标(且因此重新猝灭被置换的分子信标)。这用于确认初始荧光信号是由于分子信标到目标RNA的复合。在该化验(和本文中所述的化验中的任一者)期间所产生的光输出和/或光输出的改变能够使用任何合适的仪器检测,诸如在‘461申请中描述的仪器。在又其他实施例中,本文中所述的帽组件、容器和方法不需要用于确定细胞的存在或生物活性。例如,在一些实施例中,本文中所述的容器组件和系统能够在滴定化验中用于确定例如样本的pH。在这样的实施例中,未知pH的样本被添加到反应室(例如,反应室4732),其包含诸如溴百里酚蓝的干燥pH指示染料。壳体或“帽组件”(例如,壳体4741)被附接到反应室。如上所述,壳体包含两个试剂体积(例如,体积4742和4744)和/或两个试剂容器(例如,试剂容器4780和4790)。试剂体积和/或容器中的一个包含已知浓度的盐酸,并且另一个试剂体积和/或容器包含已知浓度的氢氧化钠。在使用中,在添加样本之后,在反应室中的溶液的颜色能够被确定(例如,使用任何合适的仪器,诸如在‘461申请中描述的仪器,其能够包含能够确定样本颜色的光电检测器)。如果样本pH是中性的(6<pH<7.6),则在室内的溶液(即,在室内干燥试剂和样本的溶液)是绿色的。然而如果样本pH>7.6,则溶液是蓝色的。在仪器检测到样本颜色为蓝色时,在第一试剂体积中的试剂(即,已知浓度的盐酸)能够被添加到反应室。第一试剂的添加能以任何合适的速率和/或以任何合适的量执行。例如,在一些实施例中,能该添加预定量的第一试剂(HCl)。如果反应从蓝色变成黄色,则样本包含至少等于第一试剂体积中的盐酸的浓度的氢氧根离子的量。因此,在仪器检测到颜色改变时(例如,从蓝色到黄色),能产生指示pH和/或离子浓度的输出。如果pH<6,则反应是黄色的,且在第二试剂体积中的试剂(即,已知浓度的氢氧化钠)能够被添加到反应室。如果反应从黄色变成蓝色,则样本可包含至少等于第二试剂体积中的氢氧化钠的浓度的氢离子的量。因此,在仪器检测到颜色改变时(例如,从黄色到蓝色),能产生指示pH和/或离子浓度的输出。在又其他实施例中,本文中所述的试剂体积或试剂容器中的任一者能够包含任何合适的试剂,以便于在其中使用用于任何合适的化验。例如,在一些实施例中,试剂体积或试剂容器能够包括各种不同的染料或指示剂。这样的染料能够包括,例如,薄膜染料、亲脂性染剂(例如,“尼罗红”或9-二乙基氨基-5-苯并[a]吩噁嗪酮(9-diethylamino-5-benzo[a]phenoxazinone))、亲脂性阳离子吲哚菁(indocarbocyanine)染料(例如,“DiI”或(2Z)-2-[(E)-3-(3,3-二甲基-l-十八烷基吲哚-l-鎓-2-基)-2-亚丙烯基]-3,3-二甲基-l-十八烷基吲哚((2Z)-2-[(E)-3-(3,3-dimethyl-l-octadecylindol-l-ium-2-yl)prop-2-enylidene]-3,3-dimethyl-l-octadecylindole);高氯酸盐)和/或渗透细胞的染料,其能够用于确定细胞生存能力(例如,CalceinAM,其由生命科技生产)。尽管各种实施例已经被描述为具有具体特征和/或部件的组合,但是其他实施例可能具有来自如上文所述的实施例中的任一者的任何特征和/或部件的组合。例如,在一些实施例中,上文中所述的帽组件的致动器4750和/或致动器4760能够包括凹入接合特征,诸如上文中关于致动器3750所述的接合部分3754。收集工具的分析上文中所述的方法200包括将安置在运送容器(例如,运送室4014)的内部区域内的内容物(例如,运送培养基)转移到反应室(例如,反应室4732)。转移运送培养基包括将患者样本(例如,使用收集工具(诸如拭子)收集的)从运送室转移到反应室。在一些实施例中,转移内容物能够包括将从收集工具释放到运送培养基中的目标细菌经由转移工具(例如,移液管)传送到反应室。因此,在一些实施例中,方法能采用如下收集工具,其有效地用于(1)收集样本(例如,从患者的鼻腔)和(2)释放所收集的样本到运送室、容器组件和/或反应室中二者。尤其,方法能采用如下收集工具,其适用于在其中样本能够包括非常低水平的目标细菌(即,“低负载”)和/或采用有限的培育时间的这类方法。以该方式,检测目标细胞的方法甚至在可用于检测的目标细胞的量有限时也能是有效的。例如,具有由卷绕材料(诸如卷绕人造丝或涤纶)构造的收集部分的收集工具可为患者提供舒适和/或有效的样本收集,但是可能不将足够量的所收集的样本释放到运送培养基和/或运送室中以在本文中所述的方法中是有效的。参见,例如,“ComparisonofRayonandDacronSwabsinAmiesMediumforBordetellapertussisTransport”,J.StephenThompson等,ASM99届全体大会,1999年5月;“WhyFlockedSwabsareSuperiortoFiberWrappedSwabsandFoamSwabsandHowTheyCanImproveInfectiousDiseaseDiagnosis”,CopanInnovation,意大利布,雷西亚,在线检索于[http://www.mls.be/nieuwsbrieven/css/Why-Flocked-Swabs-are-Superior-to-Fiber-and-Foam.pdf](“CopanInnovation”)。而且,具有由泡沫材料构造的收集部分的收集工具被认为已经具有不良的吸收性能,且因此通常不在细菌化验中使用。参见CopanInnovation。因此,进行测试以评估收集工具(以及更具体地收集部分或“拭子”的构造)以确定用于本文中所述的化验和方法的适当收集工具。第一测试涉及在使用人造丝卷绕拭子(美国BD公司拭子BD-220115)、尼龙泡沫拭子(普瑞登拭子25-15061PF)的细胞转移和细胞的直接转移期间细胞回收的比较。测试过程的示意图和测试结果在图28中示出。如图所示,使用泡沫拭子释放到溶液中的细胞量是使用卷绕拭子释放的细胞量的近似七倍。事实上,泡沫拭子的释放或转移效率与将细胞直接转移(例如,经由移液管)到溶液中的效率相当。因此,尽管卷绕拭子可提供更好的液体吸收(例如,用于在收集样本中使用),但是卷绕拭子的释放或转移性能不如泡沫拭子的性能。第二测试涉及比较与包含经由卷绕拭子、“植绒”拭子和泡沫拭子转移的目标细胞的溶液相关联的信号输出(即,相对光单位,或RLU)。以该方式,通过比较信号输出,第二测试与本文中所述的检测的方法紧密地相关。如在图29中所示,第二测试包括将拭子置放到包含一定量的目标细胞的已知样本中。每个拭子然后均被置放到包含一定量的运送培养基的容器中。以该方式,容器以类似于本文中所述的运送室中的任一者的方式起作用。额外于所述三种不同的拭子,测试还包括“对照”测试,其中,样本的一部分被直接转移到容器中。每个容器均在受控条件下被维持预定时间或“培育”期。测试包括两个小时的培育期和20小时的培育期。在培育期完成之后,受控量的运送培养基被转移到用于手动化验的化验板。试剂(即,底物)被添加到化验板以与多个报告分子反应以增强发光信号。然后记录发光信号。图30A和图30B是光输出的量(针对两小时和20小时培育时间两者)和从第二测试得到的目标细胞回收的量(单位:百分比“菌落形成单位”)的图表。图31A是示出针对每个单独的测试运行(标记为测试S30、S32和S60)的光输出结果的表,且图31B是在图31A中的表中示出的数据的图表。如第二测试的结果示出,对于两个小时培育时间,相比卷绕或植绒拭子,泡沫拭子导致产生更多的光输出。因此,尽管一些化验利用卷绕拭子(为了可能改进的样本收集特性)或植绒拭子(为了在样本收集和/或细胞转移中可能改进的性能)进行,但是令人惊讶的结果是使用具有由泡沫材料构造的收集部分的收集工具能够产生更大信号。在方法涉及低细胞负载和/或低名义光输出(这是本文中所述的许多方法的情形)的情况下,该优势尤其重要。类似地陈述,这些结果证明在低样本水平时(例如,在短时间段之后),泡沫拭子的性能优于植绒拭子的性能。因此,在一些实施例中,本文中所述的方法能够包括专门选定用于与产生低信号的培育时间一起使用的收集工具。在这样的实施例中,例如,在确定在短的培育时间内泡沫拭子充分地发挥作用和/或比其他拭子类型表现更好时,针对这样短的培育时间和/或在存在有限量的样本时,能够选择泡沫拭子。因为第二测试指示在某些条件下,使用泡沫拭子或植绒拭子优于使用卷绕拭子,所以进行了额外测试以评估植绒拭子在不同的运送培养基中的性能。尤其,使用两种不同类型的运送培养基进行第三测试以比较与包含目标细胞的溶液和“植绒”拭子相关联的信号输出(即,相对光单位,或RLU)。第一培养基被标记为BSSM64,且第二培养基被标记为TSBMod。两种培养基的组分在下文表1中指明。首先,在没有任何拭子的情况下对溶液进行化验,且每种溶液产生足够量的光。其次,利用已经安置在溶液内的植绒拭子进行化验。在该例子中,使用TSBMod培养基的溶液不能产生足够的光输出以完成化验。最后,用两种运送培养基中的每一种浸透植绒拭子,且然后用于将细胞转移到条件培养基。在该例子中,在TSBMod溶液中浸透的拭子不能产生足够的光输出以完成化验。因此,尽管植绒拭子在第二系列测试中被示出为与泡沫拭子相当,但是第三系列测试示出植绒拭子在与TSBMod运送培养基一起使用时不能充分地发挥作用。BSSM64每升TSB的组分克总量酪蛋白的酶解171.70%大豆膳食的酶解30.30%葡萄糖2.50.30%磷酸氢二钾2.50.30%氯化钠50.50%TSBModCaCl20.550.005MMgCl20.9520.01MBGP12.960.06M表1。最后,进行第四系列测试,来评估在经由鼻取样收集已知样本时植绒拭子和泡沫拭子的性能。进行第三测试,比较与从鼻样本收集的目标细胞相关联的信号输出(即,相对光单位,或RLU)。如下面在表2中指示的,使用植绒拭子比使用泡沫拭子平均多回收大约50,000CFU/ml细胞。底物的输送速率的分析上文中所述的方法包括以预定速率混合底物与样本。更具体地,在一些实施例中,能够采用细菌荧光素酶报告转导颗粒。这些报告体导致诸如来自生物体费氏弧菌的细菌荧光素酶的表达。细菌荧光素酶由编码LuxA和LuxB蛋白质(其组合以形成活性荧光素酶)的luxA和luxB基因构成。在氧气存在时,LuxAB催化发光反应,减少黄素单核苷酸(FMNH2,通过宿主细胞供应),和诸如十三醛的醛(外源地供应,且其容易渗透到活细菌细胞中)。因此,在这样的方法或化验期间,表达细菌荧光素酶,且荧光素酶分子复合FMNH2分子。这些复合体积聚,且在添加醛时,继续发光反应。理想地,优选的是引发所有复合的荧光素酶同时发射光子。以该方式,在短的时间段中发射大流量的光子-即,产生能容易检测的一道闪光,尤其在存在低负载的目标细胞时。应当理解如果复合的荧光素酶以非同步方式发射光,则光子在长时间段内发射,因此不产生闪光。因为光发射动力学通过醛(即,底物)的可用性介导,所以在理想条件下,期望将醛瞬间地输送到反应的整个体积。以快的速度将醛注射到反应中能够接近该理想状况。因此,能够推断更快的注射速度将导致更优的闪光反应。事实上,检查注射速度对光输出的影响的研究发现,在测量光产生的峰值时,增大注射速度导致更大的光输出。然而,在某一点,发现注射速度的增大导致更低光输出和/或结果的更大变化性。该现象归因于在反应中的飞溅和泡沫形成,其用于扰乱所产生的光的检测。因此,发现了在其中获得最大光输出的注射速度(被表达为致动器的速度)的期望范围。测试结果总结在图31中,图31是示出在以不同速度(速度以每秒的步数示出,其中,一步是0.0254mm)注射醛之后从荧光素酶表达细胞获得的平均最大RLU的柱状图。注意,RLU值被表达为在该研究中获得的百分比或最大RLU值。如图所示,最优RLU输出在3,200步/秒时观察到,其中,RLU值最大且光输出的变化性(表达为变化系数)最小。进一步的测试确定在大约2,500步/秒(63.5mm/秒)和大约3,200步/秒(81.3mm/秒)之间的最优范围。因此,在一些实施例中,通过以大约2,850步/秒(72.4mm/秒)的速率线性地移动致动器来混合底物。当前第1页1 2 3
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:N.德福雷斯特;W.弗里;D.雷;S.罗伊;S.舒克拉;R.C.格里斯沃尔德;K.G.奥尔森;B.J.理查森;V.H.耶;
- 技术所有人:经纬生物科技有限公司;
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、邢老师:1.机械设计及理论 2.生物医学材料及器械 3.声发射检测技术。
- 2、王老师:1.数字信号处理 2.传感器技术及应用 3.机电一体化产品开发 4.机械工程测试技术 5.逆向工程技术研究
- 3、王老师:1.机器人 2.嵌入式控制系统开发
- 4、张老师:1.机械设计的应力分析、强度校核的计算机仿真 2.生物反应器研制 3.生物力学
- 5、赵老师:检测与控制技术、机器人技术、机电一体化技术
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!