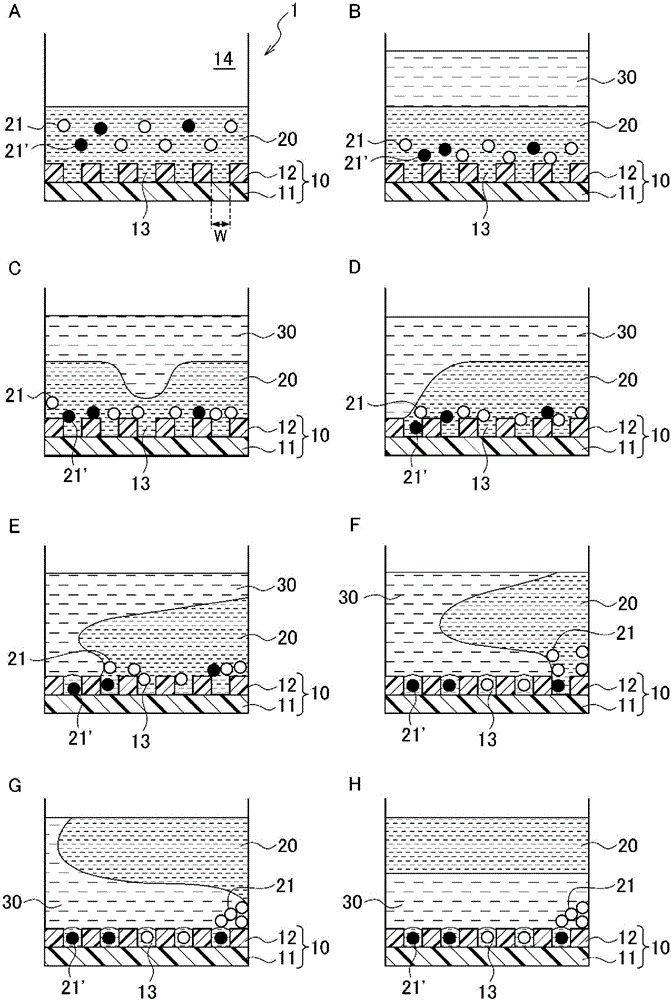
本发明涉及物质封入方法及检测靶分子的方法。
背景技术:
:作为通过以分别识别蛋白质、核酸等生物分子的方式来观察而进行各种测定的方法,已知有单分子测定。已知有若干种用于进行该单分子测定的方法。专利文献1中,记载有单分子酶活性检测中所用的微室。该微室具有可以将液滴封入、且该液滴能够填充的容量为1000fL(飞升)以下的容器部。容器部是通过使第一构件与第二构件贴合而至少由第一构件或第二构件所具有的凹处构成。通过在该液滴中进行酶反应,即使反应产物的分子数极少,也可以提高浓度,因此可以检测出酶单分子的活性。非专利文献1中记载有如下的方法,即,液滴被油所覆盖,使用能够从外部直接接近液滴的飞升级的液滴阵列,进行单分子酶测定。该阵列中,通过在亲水性表面形成高17nm的疏水性区域,而形成亲水性区域的图案。非专利文献2中,记载有使用单分子的酶联免疫吸附测定(ELISA)来检测蛋白质的方法。该方法中,利用由蛋白质特异性抗体覆盖的微细的珠粒捕捉微量的蛋白质,并利用荧光标记珠粒与蛋白质的复合物。利用离心力将含有该复合物的珠粒导入反应室中,通过计数捕捉到蛋白质的珠粒的个数,而对蛋白质进行定量测定。现有技术文献专利文献专利文献1:日本特开2004-309405号公报非专利文献非专利文献1:S.Sakakihara等,LabChip,2010,10,3355-3362非专利文献2:DavidMRissin等,NatureBiotechnology:doi:10.1038/nbt.1641技术实现要素:发明所要解决的问题为了检测出低浓度的疾病标记等,早期发现疾病、感染症等,要求生物传感技术的进一步高灵敏度化。例如,在标记蛋白从体积1mm3的肿瘤中所含的100万个癌细胞(每个细胞各100个分子)分泌到5L的血中时,该蛋白质的血液中浓度为30aM左右。因而希望有能够检测出此种非常低浓度的靶分子的技术。为了检测出此种靶分子,可以考虑使用上述的单分子酶测定以单分子单位的灵敏度进行检测的方法。即为如下的方法:将靶分子特异性地封入飞升级的液滴(超微小液滴)中后,将由酶标记了的抗体等与靶分子连接,利用上述的方法检测出标记酶的活性。作为将靶分子特异性地封入超微小液滴中的方法,可以考虑使用与靶分子特定结合的由其他抗体等标记了的珠粒等的方法。该方法中,在使靶分子与珠粒结合后,将珠粒封入超微小溶液中。此处,为了有效地检测出溶液中仅极微量地存在的靶分子、例如如上所述的30aM左右的靶分子等,需要准备100万个左右的非常多的超微小液滴阵列,在该阵列中捕捉珠粒。但是,非专利文献2中记载的方法中,需要利用强离心力将珠粒导入阵列中,需要花费时间和劳力。另外,非专利文献2中记载的方法中所用的阵列的个数为5万个左右,极难应用于100万个左右的阵列。因此,非专利文献2中记载的方法中,难以将大量珠粒有效地封入阵列中。另外,专利文献1及非专利文献1中,没有记载解决此种问题的方法。本发明的目的在于,提供一种将珠粒或核酸、蛋白质、病毒、细胞、脂质膜复合物等物质大量地有效地封入阵列中的技术。用于解决问题的方法为了解决上述的问题,本发明提供以下的物质封入方法等。[1]一种物质封入方法,包括:物质导入工序,向利用侧壁相互隔开地形成能够收容物质的多个收容部的基板上,导入含有该物质的第一溶剂;和物质收容工序,在所述物质导入工序之后,将比重大于所述第一溶剂的第二溶剂导入到所述第一溶剂上。[2]根据[1]中记载的物质封入方法,其中,所述第一溶剂及第二溶剂的至少一方含有表面活性剂。[3]根据[2]中记载的物质封入方法,其中,所述第一溶剂中的所述表面活性剂的浓度为0.01%~1%。[4]根据[2]或[3]中记载的物质封入方法,其中,所述表面活性剂为TWEEN20或TritonX-100。[5]根据[1]~[4]中任一项记载的物质封入方法,其中,所述第二溶剂是选自饱和烃、不饱和烃、芳香族烃、硅油、六氟环氧丙烷系聚合物、具有氢氟醚结构的聚合物、全氟聚醚、三氟氯乙烯聚合物及具有全氟碳结构的聚合物中的至少1种或含有它的混合物。[6]根据[1]~[5]中任一项记载的物质封入方法,其中,所述第一溶剂是选自水、亲水性醇、亲水性醚、酮、腈系溶剂、二甲亚砜、以及N,N-二甲基甲酰胺中的至少1种或含有它的混合物。[7]根据[5]或[6]中记载的物质封入方法,其中,所述侧壁具有包含氟系高分子树脂的疏水性的上表面,所述第二溶剂是具有全氟碳结构的聚合物。[8]根据[7]中记载的物质封入方法,其中,所述氟系高分子树脂是无定形氟树脂。[9]根据[1]~[8]中任一项记载的物质封入方法,其中,所述基板的包含所述收容部的区域被向外部开放。[10]根据[1]~[9]中任一项记载的物质封入方法,其中,所述物质是选自珠粒、核酸、蛋白质、病毒、细胞及脂质膜复合物中的1种以上。[11]一种检测靶分子的方法,包括:反应工序,使特异性地捕捉靶分子的珠粒与该靶分子反应;珠粒封入工序,在所述反应工序之后,使用所述珠粒实施[1]~[9]中任一项记载的物质封入方法;和检测工序,在所述珠粒封入工序之后,检测是否在各个所述收容部中收容有捕捉到所述靶分子的珠粒。[12]根据[11]中记载的检测靶分子的方法,其中,在所述珠粒上,结合有与所述靶分子特异性结合的分子。[13]一种物质封入方法,是通过向形成于基板上的收容部导入含有物质的亲水性溶剂、并将导入所述收容部的含有所述物质的亲水性溶剂用疏水性溶剂覆盖而将所述物质封入所述收容部内的方法,所述物质封入方法包括:物质导入工序,向所述利用侧壁相互隔开地形成能够收容物质的多个收容部的基板上,导入含有所述物质的亲水性溶剂;和物质收容工序,在所述物质导入工序之后,将比重大于所述亲水性溶剂的疏水性溶剂导入到所述亲水性溶剂上。[14]根据[13]中记载的物质封入方法,其中,所述亲水性溶剂及所述疏水性溶剂的至少一方含有表面活性剂。[15]根据[14]中记载的物质封入方法,其中,所述亲水性溶剂中的所述表面活性剂的浓度为0.01%~1%。[16]根据[14]或[15]中记载的物质封入方法,其中,所述表面活性剂为TWEEN20或TritonX-100。[17]根据[13]~[16]中任一项记载的物质封入方法,其中,所述疏水性溶剂是选自饱和烃、不饱和烃、芳香族烃、硅油、六氟环氧丙烷系聚合物、具有氢氟醚结构的聚合物、全氟聚醚、三氟氯乙烯聚合物及具有全氟碳结构的聚合物中的至少1种或含有它的混合物。[18]根据[13]~[17]中任一项记载的物质封入方法,其中,所述亲水性溶剂是选自水、亲水性醇、亲水性醚、酮、腈系溶剂、二甲亚砜、以及N,N-二甲基甲酰胺中的至少1种或含有它的混合物。[19]根据[17]或[18]中记载的物质封入方法,其中,所述侧壁具有包含氟系高分子树脂的疏水性的上表面,所述疏水性溶剂是具有全氟碳结构的聚合物。[20]根据[19]中记载的物质封入方法,其中,所述氟系高分子树脂是无定形氟树脂。[21]根据[13]~[20]中任一项记载的物质封入方法,其中,所述基板的包含所述收容部的区域被向外部开放。[22]根据[13]~[21]中任一项记载的物质封入方法,其中,所述物质是选自珠粒、核酸、蛋白质、病毒、细胞及脂质膜复合物中的1种以上。[23]一种检测靶分子的方法,包括:反应工序,使特异性地捕捉靶分子的珠粒与该靶分子反应;珠粒封入工序,在所述反应工序之后,使用所述珠粒实施[13]~[21]中任一项记载的物质封入方法;和检测工序,在所述珠粒封入工序之后,检测是否在各个所述收容部中收容有捕捉到所述靶分子的珠粒。[22]根据[21]中记载的检测靶分子的方法,其中,在所述珠粒上,结合有与所述靶分子特异性结合的分子。发明效果如果使用本发明的物质封入方法,则可以将珠粒或核酸、蛋白质、病毒、细胞、脂质膜复合物等物质大量地有效地封入阵列中,因此能够有助于可以高灵敏度地检测低浓度的靶分子的技术。附图说明图1是用于说明本发明的物质封入方法的步骤的示意图,表示阵列1的侧向剖视图。图2是示意性地表示本发明的靶分子检测装置的一个实施方式的图。具体实施方式以下,在参照附图的同时,对用于实施本发明的优选方式进行说明。而且,以下说明的实施方式表示本发明的代表性的实施方式的一例,并非由此来狭义地解释本发明的范围。本发明的物质封入方法中,封入形成于基板上的收容部的物质可以是珠粒、核酸、蛋白质、病毒、细胞及脂质膜复合物等,在以下的实施方式中采用珠粒例进行说明。1.珠粒封入方法参照图1,对本发明的珠粒封入方法进行说明。图1是用于说明本发明的珠粒封入方法的步骤的示意图,表示阵列1的侧向剖视图。本实施方式中,对将珠粒21、21’封入具备基板10的阵列1中的情况进行说明。基板10利用具有疏水性的上表面的侧壁12相互隔开地形成有能够仅收容1个珠粒21、21’的多个收容部13。此处,“珠粒”是与“粒子”同义地使用、在该
技术领域:
中常用的技术用语。珠粒的形状没有特别限定,然而通常视为球形。珠粒的材料也没有特别限定,为玻璃、硅胶、聚苯乙烯、聚丙烯、膜及磁性体等。作为具体的材料,可以举出纤维素、纤维素衍生物、丙烯酸类树脂、玻璃、硅胶、聚苯乙烯、明胶、聚乙烯基吡咯烷酮、乙烯基与丙烯酰胺的共聚物、与二乙烯基苯等交联了的聚苯乙烯、聚丙烯酰胺、胶乳凝胶、聚苯乙烯葡聚糖、橡胶、硅、塑料、硝基纤维素、纤维素、天然海绵、硅胶、玻璃、金属塑料、纤维素、交联葡聚糖(Sephadex(注册商标))及琼脂糖凝胶(Sepharose(注册商标))等。珠粒也可以是多孔性。珠粒优选平均粒径为5μm以下,例如设为1μm~4μm左右。由此,可以实现向阵列中的有效封入和阵列的高密度化。而且,所谓“平均粒径”,在此处是指使用电子显微镜观察或动态光散射法测定的数值。本实施方式中,对使用特异性地捕捉靶分子的珠粒的情况进行说明,然而本发明并不特别限定于此。本实施方式中,所封入的珠粒是没有捕捉到靶分子的珠粒21与捕捉到靶分子的珠粒21’的混合物。作为特异性地捕捉靶分子的珠粒,例如可以使用结合有用于特异性地捕捉靶分子的分子的珠粒。用于特异性地捕捉靶分子的分子例如可以借助连接键与位于珠粒的表面的修饰基团结合。例如,可以通过借助具有N-羟基琥珀酰亚胺(N―hydroxysuccinimide)等的交联剂与位于氨基修饰珠粒的表面的氨基共价键合而结合。所谓“靶分子”,是指作为检测对象的分子(目标分子),此处即为意图通过使珠粒将其捕捉而检测出的分子。作为靶分子,例如可以举出蛋白质、核酸、糖等生物分子、以及病毒粒子本身等。作为用于特异性地捕捉靶分子的分子(以下也称作“靶捕捉分子”。),只要根据靶分子选择即可,例如可以使用蛋白质、抗体、核酸等。而且,优选每1个珠粒结合有10万分子以上的靶捕捉分子。例如在靶捕捉分子为抗体的情况下,解离常数为nM级左右,然而如果是上述的构成,则可以充分地提高使珠粒与靶分子反应时的靶捕捉分子的浓度(例如,在珠粒的浓度为8×106粒子/mL的情况下,靶捕捉分子约为1nM)。本实施方式的珠粒封入方法包括珠粒导入工序、脱气工序、和珠粒收容工序。对于各工序,详细说明如下。[珠粒导入工序]参照图1A对珠粒导入工序进行说明。珠粒导入工序是向基板10上导入含有珠粒21、21’的第一溶剂20的工序。作为第一溶剂20的导入方法没有特别限定,然而可以采用将基板10的包括收容部13的区域14制成向外部开放的开口槽、从该开口向槽内导入第一溶剂20的方法。作为第一溶剂20,优选亲水性溶剂,例如可以合适地使用选自水、亲水性醇、亲水性醚、酮、腈系溶剂、二甲亚砜(DMSO)、以及N,N-二甲基甲酰胺(DMF)中的至少1种或含有它的混合物等。作为亲水性醇,例如可以举出乙醇、甲醇、丙醇、甘油等。作为亲水性醚,例如可以举出四氢呋喃、聚环氧乙烷、1,4-二噁烷等。作为酮,例如可以举出丙酮、甲乙酮等。作为腈系溶剂,例如可以举出乙腈等。第一溶剂20优选含有表面活性剂。在下面说明的珠粒收容工序中,向第一溶剂20上导入比重大于第一溶剂20的第二溶剂30(参照图1B)后,利用比重的差别使第一溶剂20与第二溶剂30置换,使第二溶剂30移动到第一溶剂20的下层(参照图1H)。此时,通过事先向第一溶剂2和/或第二溶剂30中添加表面活性剂,可以促进第一溶剂20与第二溶剂30的置换。表面活性剂没有特别限定,然而例如可以举出TWEEN20(CAS编号:9005-64-5、聚氧化乙烯失水山梨醇单月桂酸酯)及TritonX-100(CAS编号:9002-93-1、一般名:聚乙二醇单-4-辛基苯基醚(n≈10))等。向第一溶剂20中的表面活性剂的添加浓度没有特别限定,然而优选为0.01~1%。此外,作为表面活性剂,可以广泛地使用阴离子性表面活性剂、阳离子性表面活性剂、非离子性表面活性剂、两性离子表面活性剂、来自于天然的表面活性剂等。作为阴离子性表面活性剂,例如可以分类为羧酸型、硫酸酯型、磺酸型、磷酸酯型。其中,具体而言,例如可以举出十二烷基硫酸钠、月桂酸钠、α-磺基脂肪酸甲酯钠、十二烷基苯磺酸钠、乙氧基化十二烷基硫酸钠等,其中,优选使用十二烷基苯磺酸钠。作为阳离子性表面活性剂,例如可以分类为季铵盐型、烷基胺型、杂环胺型。具体而言,例如可以举出硬脂基三甲基氯化铵、二硬脂基二甲基氯化铵、二癸基二甲基氯化铵、十六烷基三氯化吡啶鎓、十二烷基二甲基苄基氯化铵等。作为非离子表面活性剂,例如可以举出聚氧化乙烯烷基醚、聚氧化乙烯硬化蓖麻油、聚氧化乙烯单脂肪酸酯、聚氧化乙烯失水山梨醇单脂肪酸酯、蔗糖脂肪酸酯、聚甘油脂肪酸酯、烷基聚葡糖苷、N-甲基烷基葡萄糖酰胺等。其中,优选十二烷基醇乙氧基化物、壬基苯酚乙氧基化物、月桂酰基二乙醇胺,此外还优选以TritonX(TritonX-100等)、Pluronic(注册商标)(PluronicF-123、F-68等)、Tween(Tween20、40、60、65、80、85等)、Brij(注册商标)(Brij35、58、98等)、Span(Span20、40、60、80、83、85)的名称在市场上销售的非离子表面活性剂。作为两性表面活性剂,例如有月桂基二甲基氨基乙酸甜菜碱、十二烷基氨基甲基二甲基磺丙基甜菜碱、3-(十四烷基二甲氨基)-1-丙磺酸盐等,然而优选使用3-[(3-胆酰胺丙基)二甲铵基]-1-丙磺酸盐(CHAPS)、3-[(3-胆酰胺丙基)二甲铵基]-2-羟基-1-丙磺酸盐(CHAPSO)等。作为来自于天然的表面活性剂,例如优选卵磷脂、皂甙,在被称作卵磷脂的化合物当中,具体而言,优选磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇、磷脂酰丝氨酸、磷脂酸、磷脂酰甘油等。另外,作为皂甙优选皂皮树皂苷。第一溶剂20也可以除了珠粒21、21’以外,还含有例如用于特异性地检测出由珠粒21’捕捉到的靶分子的物质。作为此种物质,例如可以是被结合在由珠粒21’捕捉到的靶分子上或与该靶分子特异性地结合的分子上的给定的酶分解、从而释放荧光物质的荧光底物等。作为与靶分子特异性地结合的分子,例如可以是二次抗体、核酸等。另外,作为给定的酶,例如可以举出β-半乳糖苷酶、过氧化物酶等。作为荧光底物,例如可以举出Fluorescein-di-β-galactopyranoside(FDG)、Amplexred(注册商标)等。[珠粒收容工序]参照图1B~H,对珠粒收容工序进行说明。珠粒收容工序是将比重大于第一溶剂20的第二溶剂30导入到第一溶剂20上的工序。作为第二溶剂30的导入方法没有特别限定,然而可以采用将基板10的包括收容部13的区域14制成向外部开放的开口槽、并从该开口向槽内导入第二溶剂30的方法。此时,第二溶剂30如图1B所示,优选层叠于第一溶剂20上地导入。第二溶剂30只要是比重大于珠粒导入工序中所用的第一溶剂20的溶剂即可。第一溶剂20与第二溶剂30优选为以能够进行层置换的程度相互具有亲媒性的溶剂,且需要彼此不相容。如果第一溶剂20与第二溶剂30之间的亲媒性过低,则不会产生第一溶剂20与第二溶剂30的层置换。另外,在第一溶剂20与第二溶剂30彼此相容的情况下,也不会产生第一溶剂20与第二溶剂30的层置换。为了防止第一溶剂20与第二溶剂30相互混杂,优选作为第一溶剂20使用亲水性溶剂,作为第二溶剂30使用疏水性溶剂。第二溶剂30也可以与第一溶剂20相同,为了促进层置换而含有表面活性剂。作为此种第二溶剂30,优选疏水性溶剂,例如可以合适地使用选自饱和烃、不饱和烃、芳香族烃、硅油、六氟环氧丙烷系聚合物、具有氢氟醚结构的聚合物、全氟聚醚、三氟氯乙烯聚合物及具有全氟碳结构的聚合物中的至少1种或含有它的混合物等。作为饱和烃,例如可以举出烷烃、环烷烃等。作为烷烃,例如可以举出癸烷、十六烷等。作为不饱和烃,例如可以举出角鲨烯等。作为芳香族烃,例如可以举出苯、甲苯等。作为六氟环氧丙烷系聚合物,例如可以举出Krytox143(Dupont公司制)、KrytoxGPL(Dupont公司制)等。作为具有氢氟醚结构的聚合物,例如可以举出AsahiklinAE3000(旭硝子公司制)、Novec7000(住友3M公司制)等。作为具有全氟碳结构的聚合物,例如可以举出FLUORINERTFC-40、FLUORINERTFC-43(住友3M公司制)等。由于被导入并层叠于第一溶剂20上的第二溶剂30的比重大于第一溶剂20,因此向第一溶剂20的下方移动。即,第一溶剂20与第二溶剂30被置换,从上层为第二溶剂30而下层为第一溶剂20的状态(参照图1B)变为上层为第一溶剂20而下层为第二溶剂30的状态(参照图1H)。将产生层置换的样子示意性地表示于图1C~G中。在该层置换中,沉降在区域14的底部的珠粒21、21’由向第一溶剂20的下方移动来的第二溶剂30推压而收容于各个收容部13(参照图1D~F)。其结果是,可以将珠粒高效率地封入各个在基板10上制作出的多个收容部13。在作为第一溶剂20使用亲水性溶剂、作为第二溶剂30使用疏水性溶剂的情况下,可以在各个收容部13有效地形成由第二溶剂30覆盖了的微滴(第一溶剂20的液滴)。此处,如果举出本发明的珠粒封入方法中所用的第一溶剂20和第二溶剂30的合适例,则如“表1”及“表2”所示。[表1][表1]第一溶剂密度水1.000g/mL在3.98℃(lit.)甲醇0.791g/mL在25℃(lit.)乙醇0.789g/mL在25℃(lit.)1-丙醇0.804g/mL在25℃(lit.)2-丙醇0.785g/mL在25℃(lit.)1-丁醇0.81g/mL在25℃(lit.)N,N-二甲基甲酰胺0.944g/mL(lit.)乙腈0.786g/mL在25℃(lit.)丙酮0.791g/mL在25℃(lit.)四氢呋喃0.889g/mL在25℃(lit.)[表2][表2]第二溶剂密度PF-50521.700g/mL在25℃FLUORINERTFC-721.680g/mL在25℃FLUORINERTFC-7701.790g/mL在25℃FLUORINERTFC-32831.830g/mL在25℃FLUORINERTFC-401.870g/mL在25℃FLUORINERTFC-431.880g/mL在25℃氯仿1.492g/mL在25℃(lit.)AsahiklinAE-30001.470g/mL在25℃Novec70001.400g/mLNovec71001.520g/mLNovec72001.430g/mLNovec73001.660g/mLKrytoxGPL-1001.87g/mL在0℃KrytoxGPL-1011.89g/mL在0℃KrytoxGPL-1021.91g/mL在0℃KrytoxGPL-1031.92g/mL在0℃KrytoxGPL-1041.93g/mL在0℃KrytoxGPL-1051.94g/mL在0℃KrytoxGPL-1061.95g/mL在0℃KrytoxGPL-1071.95g/mL在0℃在珠粒收容工序中,在使用具有磁性的材料作为珠粒21、21’的情况下,为了促进珠粒向收容部13内的移动,也可以使用磁性的机构。在珠粒导入工序中,在将含有珠粒21、21’的第一溶剂20导入包含收容部13的区域14中后,在本工序中,在将第二溶剂30导入第一溶剂20上之前或之后,对珠粒21、21’施加外部磁场。由此,就可以使朝向收容部13的力作用于珠粒21、21’,促进珠粒21、21’向收容部13内的移动。例如通过使磁铁接近基板10的设有收容部13的一侧的相反一侧(阵列1的底面侧)来进行磁场的施加即可。根据本实施方式,可以实现具有多个收容部的大面积的阵列。例如,即使是具有100万个以上的收容部的阵列,也可以有效地将珠粒21、21’封入各收容部。因而,如果是本实施方式,则可以高灵敏度地检测出靶分子,即使是10aM左右的浓度非常低的靶分子,也可以检测出。[脱气工序]基板10的包含收容部13的区域14如前所述,可以将上部设为开放空间,然而在将区域14设为封闭空间的情况下,可以在珠粒导入工序与珠粒收容工序之间,进行将区域14内脱气的脱气工序。作为脱气方法,例如可以合适地使用将阵列1放置于减压环境下的方法等。具体而言,是将阵列1在约0.1大气压的减压干燥器内放置约30秒的方法等。本发明中,脱气工序并非必需的工序,然而通过进行脱气工序,可以除去收容部13内的空气,将珠粒21、21’有效地导入收容部13内。2.检测靶分子的方法下面,对本发明的检测靶分子的方法进行说明。本发明的检测靶分子的方法包括反应工序、珠粒封入工序、和检测工序。本实施方式中,作为珠粒,使用特异性地捕捉靶分子的珠粒。例如,珠粒可以是结合有用于特异性地捕捉靶分子的分子的材料。而且,对于珠粒、靶分子、以及用于特异性地捕捉靶分子的分子,可以合适地使用与上述的珠粒封入方法的说明中例示的例子相同的物质。反应工序是使珠粒与靶分子反应的工序。例如可以通过使含有珠粒的溶液与含有靶分子的溶液混合而使之反应。珠粒封入工序是使用反应工序中反应了的珠粒进行上述的珠粒封入方法的工序。即,珠粒封入工序是包括珠粒导入工序和珠粒收容工序的工序,或者是包括珠粒导入工序、脱气工序、和珠粒收容工序的工序。而且,对于珠粒导入工序、脱气工序及珠粒收容工序,可以与上述的“珠粒封入方法”中的各工序相同地进行,因此此处省略说明。检测工序是在珠粒封入工序之后、检测是否在各个收容部13收容有捕捉到靶分子的珠粒21’的工序。作为检测是否收容有捕捉到靶分子的珠粒21’的方法,例如可以合适地使用抗原抗体反应、抗生蛋白链菌素-生物素反应、核酸的互补结合等公知的分子识别反应。例如,可以举出检测利用结合在靶分子上、或与该靶分子特异性结合的分子上的给定的酶将荧光底物分解而释放出的荧光物质的方法。作为荧光物质的检测方法,可以举出使用荧光显微镜、图像传感器等检测各收容部中的荧光强度的方法等。另外,在检测工序中,还优选检测是否在各收容部13收容有珠粒21或珠粒21’。作为检测是否在各收容部13收容有珠粒21或珠粒21’的方法,例如可以通过在显微镜下观察珠粒21或珠粒21’的有无来检测。另外,作为检测珠粒21、21’的有无的方法,还有检测由珠粒造成的散射光的方法、利用借助电场效应晶体管(FET)进行的电位计测的方法等。对于检测工序的结果,可以使用收容有珠粒21或珠粒21’的收容部13的个数、和收容有捕捉到靶分子的珠粒21’的收容部13的个数,计算珠粒的总数当中捕捉到靶分子的珠粒的个数的比例。由此,就可以将靶分子的浓度定量化。如果是本实施方式,则可以实现具有多个收容部的大面积的阵列,即使是具有100万个以上的收容部的阵列,也可以有效地将珠粒21、21’封入各收容部。因而,如果是本实施方式,就可以高灵敏度检测出靶分子,即使是10aM左右的浓度非常低的靶分子,也可以检测出。3.阵列下面,参照图1,对阵列1的构成进行详细说明。在阵列1中,基板10具备板状构件11和具有疏水性的上表面的侧壁12。基板10中,利用侧壁12相互隔开地形成多个收容部13。板状构件11优选具有亲水性表面。所谓“亲水性表面”,是指与亲水性溶剂的亲和性高于与疏水性溶剂的亲和性的表面。作为板状构件11,只要是固体材料即可,例如可以使用玻璃、硅、高分子树脂等。侧壁12设于板状构件11的表面上,优选设于亲水性表面上,将多个收容部13分别隔开。侧壁12具有疏水性的上表面。所谓“疏水性”,在此处是以与“亲油性”相同的意味使用,是指与疏水性溶剂的亲和性高于与亲水性溶剂的亲和性。而且,期望侧壁12的上表面为疏水性,侧面、即收容部13内的内壁无论是疏水性还是亲水性都可以。例如,侧壁12可以由亲水性的结构物、和形成于其上表面的疏水性层构成。作为亲水性的结构物,例如可以使用玻璃、硅、高分子树脂等。作为疏水性层,例如可以使用防水性的树脂、氟系高分子树脂等。作为氟系高分子树脂,例如可以举出无定形氟树脂等。无定形氟树脂由于具有高疏水性、并且对生物试样的毒性低的理由而优选使用。作为第二溶剂30,期望使用以不会溶解形成侧壁12的上表面的疏水性层的程度具有对疏水性层的亲和性的溶剂。如果第二溶剂30对疏水性层的亲和性低,则有可能阻碍与第一溶剂20的层置换。另外,如果第二溶剂30对疏水性层的亲和性过高,则疏水性层溶解,有可能无法维持侧壁12的形状。从此种观点考虑,在侧壁12的上表面由氟系高分子树脂形成的情况下,优选使用具有全氟碳结构的聚合物(FLUORINERTFC-40、FLUORINERTFC-43等)作为第二溶剂30。作为上述无定形氟树脂,例如可以合适地使用选自CYTOP(注册商标)、TEFLON(注册商标)AF2400、及TEFLON(注册商标)AF1600中的至少1种。其中,从容易微细加工的理由考虑,最优选CYTOP(注册商标)。另外,侧壁12也可以由疏水性的材料构成。作为侧壁12,例如可以使用氟系高分子树脂、对二甲苯系高分子树脂等。作为氟系高分子树脂,例如可以举出无定形氟树脂等。作为无定形氟树脂可以合适地使用上述的树脂。侧壁12只要以在板状构件11上形成多个收容部13的方式构成即可,例如可以是在形成收容部13的位置形成有孔的板形状的结构物。从板状构件11的表面算起的侧壁12的高度(垂直方向的厚度)只要是在珠粒收容工序中暂时收容于收容部13的珠粒21、21’不会被再次从收容部13排出的程度的高度即可。例如可以是收容于收容部13的珠粒21、21’的大部分、优选全部容纳于侧壁12的上表面之下的高度。而且,从将珠粒21、21’有效地收容于收容部13的观点考虑,侧壁12的高度优选为珠粒21、21’的平均粒径的1倍以上。另外,从仅将珠粒21、21’的1个收容于收容部13的观点考虑,侧壁12的高度优选为珠粒21、21’的平均粒径的1.5倍以下。多个收容部13是能够分别仅收容1个珠粒21、21’的凹部,彼此由侧壁12隔开。收容部13以板状构件11的表面的一部分作为底面,底面为亲水性。收容部13只要是可以仅收容1个珠粒21、21’的形状及大小即可。由收容部13的底面及侧面包围的区域的形状例如可以是圆柱形、方柱形等。各收容部13的水平方向的宽度w(如果水平方向的剖面是圆形,则为其直径,如果是正方形,则为其一边的长度等)只要大于珠粒21、21’的平均粒径即可,例如优选为珠粒21、21’的平均粒径的1倍~2倍。各收容部13的深度在本实施方式中与侧壁12的高度相同。而且,从将珠粒有效地收容于收容部的观点考虑,本发明的收容部的深度优选为珠粒的平均粒径的1倍以上。另外,从仅将1个珠粒收容于收容部的观点考虑,本发明的收容部的深度优选为珠粒的平均粒径的1.5倍以下。用于制成阵列1的光刻、蚀刻、基板层叠等技术与用于制成通用的微芯片、阵列的技术相同。本实施方式中,收容部13的底面为亲水性,并且侧壁12的上表面为疏水性。由此,在珠粒导入工序中使用亲水性的第一溶剂20的情况下,可以将含有珠粒21、21’的第一溶剂20更有效地导入收容部13中。此外,由于可以防止珠粒收容工序中所用的疏水性的第二溶剂30进入收容部13,因此可以将收容部13内的亲水性的第一溶剂20利用疏水性的第二溶剂30被覆并密闭,形成微滴(液滴)。作为本实施方式的阵列1的一例,例如为形成有100万个以上的收容部的阵列。即使是此种大面积的阵列,也可以通过使用本实施方式的珠粒封入方法或检测靶分子的方法,有效地将珠粒封入各收容部。因而,如果是本实施方式,则可以高灵敏度地检测靶分子,可以提供连10aM左右的浓度非常低的靶分子也可以检测出的阵列。4.试剂盒阵列1和珠粒21可以作为试剂盒构成。阵列1的各个收容部13是以可以仅收容1个该试剂盒所具备的珠粒21的方式构成。该试剂盒所具备的珠粒21可以是特异性地捕捉靶分子的珠粒,也可以是例如结合有与靶分子特异性结合的分子的珠粒。靶分子、以及与该靶分子特异性结合的分子,可以合适地使用前述的物质。另外,该试剂盒可以还具备用于特异性地检测靶分子的物质。作为用于特异性地检测靶分子的物质,可以合适地使用上述的物质。另外,试剂盒可以还具备第一溶剂、第二溶剂等。5.靶分子检测装置下面,参照图2,对本发明的靶分子检测装置50的构成进行说明。图2是示意性地表示本发明的靶分子检测装置的一个实施方式的图。本实施方式的靶分子检测装置50具备阵列1、图像传感器51、和光源52。此处,将阵列1作为多孔板表示。多孔板的各孔相当于图1的区域14。由于阵列1的构成如上所述,因此省略说明。图像传感器51是检测收容了捕捉到靶分子的珠粒时从各个收容部13发出的光的传感器。例如,可以是检测利用结合在靶分子上或结合在与该靶分子特异性结合的分子上的给定的酶将荧光底物分解而发出的荧光的传感器。作为图像传感器51,例如可以合适地使用CMOS图像传感器等。光源52是向阵列1照射光的光源。而且,图2中,光源52设于阵列1上,然而本发明并不特别限定于此,例如也可以是从阵列1的侧向照射光的光源。而且,也可以在阵列1与图像传感器51之间,设置干涉滤光片、光导阵列等。另外,也可以在光源52与阵列1之间设置激发滤光片等。如果是本实施方式,则由于阵列1与图像传感器51被直接连接,因此不用使用显微镜等其他装置,就可以容易地检测出是否在各收容部13收容有捕捉到靶分子的珠粒。因而,可以简便并且高速地检测。另外,可以作为廉价的商品提供。6.本发明的物质封入方法的应用例在本发明的物质封入方法中,封入形成于基板上的收容部的物质可以是珠粒、核酸、蛋白质、病毒、细胞及脂质膜复合物等。上述的实施方式中,采用珠粒例进行了说明。本发明中,在核酸中,包含DNA及RNA。另外,在蛋白质及病毒中,也包含它们的聚合物(寡聚物)、或它们与其他物质的复合物。细胞特别包含细菌细胞,脂质膜复合物特别包含脂质体及外来体(エキソソーム)、以及线粒体等细胞内小器官(细胞器)。在将封入对象设为核酸、蛋白质、病毒、细胞及脂质膜复合物等情况下,本发明的物质封入方法例如可以用于ELISA-PCR等应用中。产业上的可利用性本发明可以在用于检测低浓度的靶分子的方法、阵列、装置等中合适地使用。符号的说明1阵列,10基板,11板状构件,12侧壁,13收容部,14区域,20第一溶剂,21、21’珠粒,30第二溶剂。当前第1页1 2 3