CHKA蛋白在制备肝癌预后评估试剂盒中的应用、试剂盒及方法与流程
本发明涉及生物技术领域,具体而言,涉及CHKA蛋白在制备肝癌预后评估试剂盒中的应用、试剂盒及方法。
背景技术:
尽管这些年来对肝癌认识已有了长足的发展,但近年来肝癌相关的死亡率在全世界范围内呈现上升趋势,而且肝癌患者的5年总体生存率相比其他一些肿瘤仍然很低。绝大多数肝癌患者并非死于肿瘤原发灶,而主要是死于肿瘤的复发与转移。因此深入研究导致肝癌发生发展与转移的分子机制无疑对于改善目前的临床治疗方案有积极的意义。
胆碱激酶是生物体细胞内催化胆碱为磷酸胆碱,最终合成生物膜磷脂双分子层的主要成分磷脂酰胆碱过程中的第一步关键酶。该酶由胆碱激酶α(CHKA)和胆碱激酶β(CHKB)两个基因编码,二者通过同二聚体或异二聚体方式形成有活性的胆碱激酶。以往研究主要关注该酶在脂类代谢中的功能。然而近年来,不少研究结果显示胆碱激酶及其催化产物磷酸胆碱在包括乳腺癌、肺癌、结肠癌、膀胱癌、前列腺癌以及卵巢癌在内的多种肿瘤中呈高表达,并且发现CHKA的表达水平与乳腺癌、肺癌和膀胱癌患者的临床预后存在相关性。但CHKA在肝癌中的表达情况如何以及是否参与肝癌的恶性进展过程,目前国内外尚未见有系统报道。
技术实现要素:
本发明的目的在于提供CHKA蛋白在制备肝癌预后评估试剂盒中的应用,以CHKA蛋白为分子标记,检测其在肝癌组织中的相对表达量,根据其相对表达量,用于指导肝癌患者的术后评估。
本发明的另一目的在于提供一种用于肝癌预后评估的试剂盒,其能够快速检测肝癌组织中的CHKA蛋白的相对表达量,以指导肝癌患者的术后评估。
本发明的另一目的在于提供一种肝癌预后评估方法,该评估方法通过检测肝癌组织中的CHKA蛋白的相对表达量,对肝癌患者术后进行评估。
本发明解决其技术问题是采用以下技术方案来实现的。
CHKA蛋白在制备肝癌预后评估试剂盒中的应用,利用第一抗体,结合免疫组化试剂,检测CHKA蛋白在肝癌组织中的相对表达量,上述第一抗体为CHKA单克隆抗体或CHKA多克隆抗体。
一种用于肝癌预后评估的试剂盒,其包括:用于对肝癌组织中的CHKA蛋白的相对表达量进行免疫组化检测的第一抗体,上述第一抗体为CHKA单克隆抗体或CHKA多克隆抗体。
一种肝癌预后评估方法,首先,利用第一抗体,并结合免疫组化试剂,对肝癌组织切片进行免疫组化染色,该第一抗体为CHKA单克隆抗体或CHKA多克隆抗体;然后,分析上述肝癌组织切片的阳性信号强度,得到可用于评判上述肝癌组织切片中CHKA蛋白表达量的评分值;之后,根据上述评分值评估肝癌患者术后总体生存期和无瘤生存期。
本发明提供的CHKA蛋白在制备肝癌预后评估试剂盒中的应用以及肝癌预后评估试剂盒的有益效果是:本发明首次发现,CHKA蛋白在肝癌组织中的相对表达量与肝癌细胞微血管侵犯以及肝癌分期(BCLC分期)存在统计学意义的正相关性。进而以CHKA蛋白作为分子标记,利用CHKA单克隆抗体或CHKA多克隆抗体,配合免疫组化试剂采用免疫组化法检测肝癌组织中的CHKA蛋白的相对表达量,根据CHKA蛋白的相对表达量能够判断出肝癌患者术后总体生存期和无瘤生存期,因而,CHKA蛋白的相对表达量可用于指导肝癌预后的判断,为肝癌预后评估提供全新的思路和借鉴。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实施例提供的肝癌组织样本的CHKA蛋白印迹图;
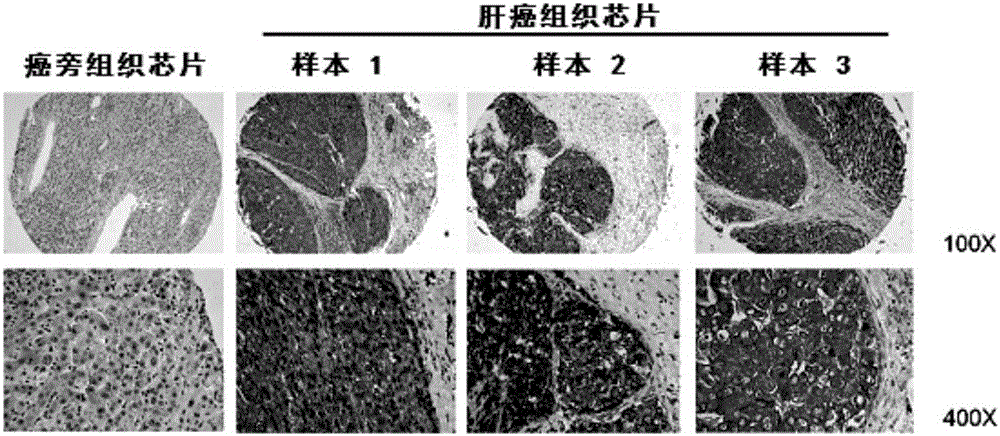
图2为本发明实施例提供的肝癌组织样本的免疫组化染色图;
图3为本发明实施例提供的CHKA蛋白相对表达量与肝癌相关临床指标的相关性;
图4为本发明实施例提供的根据CHKA蛋白表达高低将肝癌患者分组的总体生存曲线图;
图5为图4为本发明实施例提供的根据CHKA蛋白表达高低将肝癌患者分组的无瘤生存期曲线图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例的CHKA蛋白在制备肝癌预后评估试剂盒中的应用以及肝癌预后评估试剂盒进行具体说明。
本发明的发明人从临床肝癌患者的癌组织样本入手,首次发现,CHKA蛋白在肝癌组织中存在特异性高表达。该CHKA蛋白能增强肝癌细胞的迁移和侵袭能力,CHKA蛋白在肝细胞癌(hepatocellular carcinoma,HCC)的恶性进展过程中发挥了重要作用。并运用大样本HCC验证,得出临床肝癌组织中CHKA蛋白的高表达与临床肝癌微血管侵犯以及肝癌分期(BCLC分期)存在统计学意义的正相关性。因此,通过检测CHKA蛋白,可用于指导评估肝癌患者的术后效果。
基于上述发现,本发明实施例提供了CHKA蛋白在制备肝癌预后评估试剂盒中的应用。该应用是指利用CHKA单克隆抗体或CHKA多克隆抗体作为第一抗体,并结合免疫组化试剂,检测分子标记蛋白即CHKA蛋白在肝癌组织中的相对表达量。CHKA蛋白呈高表达的肝癌患者的术后生存期和无瘤生存期明显低于CHKA蛋白呈低表达的肝癌患者。
进一步地,上述CHKA多克隆抗体是用CHKA重组蛋白免疫兔子后制备得到的,该制备方法简单、快速,所得的CHKA多克隆抗体含量高。当然,CHKA多克隆抗体即第一抗体也可以是用CHKA重组蛋白免疫其他宿主动物如大鼠、小鼠、驴、羊或其他动物制备得到。
进一步地,上述免疫组化试剂包括带有过氧化物酶标记的第二抗体,优选地,过氧化物酶为辣根过氧化物酶,当然,也可以是碱性磷酸酶。只要是能够用于免疫组化染色的过氧化物酶均在本发明的保护范围之内。
此外,在基于第一抗体是CHKA重组蛋白免疫兔子后制备得到的情况下,本发明所用的第二抗体相应的也就是是羊抗兔IgG抗体。当然,第二抗体也可以是鼠抗兔IgG抗体,或者羊抗兔IgG抗体,或者驴抗兔IgG抗体,也就说第二抗体是相应第一抗体的IgG抗体即可。
此外,在基于上述发现的基础上,本发明实施例还提供了用于肝癌预后评估的试剂盒,该试剂盒包括用于对肝癌组织中的CHKA蛋白的相对表达量进行免疫组化检测的第一抗体,第一抗体为CHKA单克隆抗体或CHKA多克隆抗体。利用该试剂盒中的CHKA单克隆抗体或CHKA多克隆抗体,可对肝癌组织中的CHKA蛋白进行免疫组化检测,检测其相对表达量,根据CHKA蛋白的相对表达量,预判肝癌患者术后的总体生存期和无瘤生存期。
其中,CHKA多克隆抗体为利用CHKA重组蛋白免疫兔子后制备得到。
需要说明的是,该试剂盒还可包括相关的免疫组化试剂,该免疫组化试剂包括有过氧化物酶标记的第二抗体。其中,第二抗体优选为辣根过氧化物酶标记的羊抗兔IgG抗体。该免疫组化试剂还包括有二甲苯,乙醇,3%H2O2甲醇液,抗原修复液,封闭液,DAB显色试剂,甲基绿,0.01M PBS,中性树脂,苏木精-伊红等成分常规试剂。
利用本发明提供的试剂盒,可快速检测肝癌组织中的CHKA蛋白的相对表达量,根据检测结果,可用于指导评估肝癌患者术后的总体生存期和无瘤生存期。具体为,CHKA蛋白呈高表达的肝癌患者的术后生存期和无瘤生存期明显低于CHKA蛋白呈低表达的肝癌患者。
另外,本发明根据上述发现,提供了肝癌预后评估方法,该方法包括:
首先,利用CHKA单克隆抗体或CHKA多克隆抗体作为第一抗体,合免疫组化试剂,对肝癌组织切片进行免疫组化染色。
染色后,分析肝癌组织切片的阳性信号强度,具体包括肿瘤和癌旁组织的阳性信号强度,给出其对应的评分值,该评分值可用于评判所述肝癌组织切片中CHKA蛋白的相对表达量。
具体地,利用显微镜和成像装置将染色后的肝癌组织切片拍摄为数码照片,再利用生物图像处理软件分析该数码照片中显示的肿瘤和癌旁组织的阳性信号强度。
然后,根据所述评分值评估肝癌患者术后总体生存期和无瘤生存期。
具体地,以评分值与标准分值进行比较,若评分值大于或等于标准分值,则肝癌患者为高表达CHKA蛋白,若评分值小于标准分值,则肝癌患者为低表达CHKA蛋白,高表达CHKA蛋白的肝癌患者术后总体生存期和无瘤生存期低于低表达CHKA蛋白的肝癌患者。
需要说明的是,用于评价CHKA蛋白为高表达还是低表达所用的标准分值是以120例肝癌组织样本的表达评分的中位数“9”为界。评分值大于或等于9,为高表达CHKA蛋白;评分值小于9,为低表达CHKA蛋白。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
CHKA蛋白在癌组织及癌旁组织中的差异化表达
1.Western-blot检测肝癌及癌旁组织中CHKA的表达情况
从120例肝癌病例即120例肝癌组织样本中随机抽取42例,用CHKA多克隆抗体,通过Western-blot技术检测癌组织和癌旁组织中的CHKA蛋白的表达情况,结果如图1所示(图1中,C1~C42表示样本编号,T表示癌组织,N表示癌旁组织)。由图1可知,随机选取的43例肝癌样本中的癌组织的条带颜色较其对应的癌旁组织更深,由此表明,癌组织中的CHKA蛋白表达水平明显高于对应的癌旁组织。
需要说明的是,本实施例所用的120例肝癌样本为120例组织芯片原发性肝细胞癌标本,随机取自于2006年1月-2009年9月在第二军医大学东方肝胆外科医院接受肝切除手术的HCC病人。书面知情同意书均于术前获得。入组和排除的标准:术前体能评分WHO0-1;肝功能Child-Pugh分级为A级;没有远处转移;无肉眼可见腹水;无肝性脑病;术前未接受任何放化疗;均为根治性切除;所有病人术后病理均证实为肝细胞癌。按照国际抗癌联盟(UICC)2002第六版进行TNM分期。120例肝细胞癌患者中男性为106例,女性14例,男女比例为8:1;平均年龄49.9+10.9岁,范围为26-77岁;本实施例所用样本均为HBsAg阳性(120/120);无围手术期死亡病例。
2.免疫组化法检测癌组织及癌旁组织中CHKA的表达情况
利用CHKA多克隆抗体,结合免疫组化试剂,采用免疫组化染色方法(DAB法)检测120例肝癌组织样本的CHKA蛋白的表达情况,免疫组化法检测的具体步骤如下。
(1)取肝癌组织块,石蜡包埋,切片,于60℃烤箱过夜;
(2)切片脱腊、水合,按如下箭头所示的步骤操作:
二甲苯10min→二甲苯10min→二甲苯10min→100%乙醇5min→95%乙醇5min→85%乙醇5min→75%乙醇5min→双蒸水5min;
(3)3%H2O2甲醇液,室温放置20min,以去除内源性过氧化物酶;
(4)双蒸水洗三次,每次5min;
(5)抗原修复:切片放入0.01M柠檬酸盐缓冲液(pH6.0)中煮沸5min,停火10min,再煮沸5min;
(6)自然冷却至室温,双蒸水洗三次,每次5min;
(7)1%BSA封闭30min,37℃;
(8)甩去封闭液,不洗,直接加第一抗体即CHKA多克隆抗体,置入湿盒中30min,37℃,然后于4℃过夜16小时;
(9)4℃取出,室温下复温15min,用0.01M PBS洗四次,每次5min;
(10)滴加第二抗体即羊抗兔抗IgG抗体,湿盒中45min,37℃;
(11)用0.01M PBS洗四次,每次5min,DAB显色2-10min,镜下观察;
(12)双蒸水终止显色,用0.01M PBS洗1次,每次5min;
(13)苏木精-伊红复染2min,无水乙醇脱色5-10s;
(14)二甲苯脱水透明,滴中性树脂后盖玻片覆盖封片;
(15)显微镜下观察阳性染色,结果如图2所示;
(16)并分别于癌组织和癌旁组织随机选取3个视野,利用成像装置拍摄为数码照片。
(17)利用生物图像处理软件分析肝癌组织切片的阳性信号强度即癌组织和癌旁组织的阳性信号强度,得到评分值;具体为,采用Image Scope(Aperio公司)软件对组织样本进行扫描,利用该软件的Algorithms(Positive Pixel Count)程序对每个组织样本进行“阳性Pixel”计算,获得的计算数据如下表:
区域(Region)
长度(Length(μm))
面积(Area(μm2))
Text
弱阳性像素数量(Nwp=Number of Weak Positive)
阳性像素数量(Np=Number of Positive)
强阳性像素数量(Nsp=Number of Strong Positive)
弱阳性像素总强度(Iwp=Total Intensity of Weak Positive)
阳性像素总强度(Ip=Total Intensity of Positive)
强阳性像素总强度(Isp=Total Intensity ofStrong Positive)
阳性平均强度值(Iavg=(Iwp+Ip+Isp)/(Nwp+Np+Nsp))
强阳性平均强度值(Nsr=Nsp/(Nwp+Np+Nsp))
弱阳性平均强度值(Iwavg=(Iwp+Ip)/(Nwp+Np))
阴性像素数量(Nn=Number of Negative)
阴性像素总强度(In=Total Intensity of Negative)
显色总数量(NTotal=Total Number(Positive+Negative))
显色总面积(ATotal=Total Area(millimeter-squared))
阳性率(Positivity=NPositive/NTotal)
每个组织样本的组化染色后的评分计算方法为Log10[255/Iavg],其中,阳性平均强度值(Iavg)=(弱阳性象素总强度+阳性象素总强度+强阳性象素总强度)/(弱阳性象素数量+阳性象素数量+强阳性象素数量),Log10[255/Iavg]即为该组织样本的评分值,该评分值能够有效地评判CHKA蛋白在组织样本中的相对表达量。
由图2可知,癌组织的颜色相对于其癌旁组织更深,由此表明肝癌组织样本的癌组织中CHKA蛋白的表达水平明显高于对应的癌旁组织。并结合图1的分析结果可验证,120例的肝癌组织样品中CHKA蛋白在癌组织中的表达水平高于在癌旁组织的表达水平。
CHKA高低表达标准以上述120例肝癌组织样本中CHKA蛋白表达评分的中位数(9)为界,即以9作为标准分值。若肝癌组织的评分值评大于或等于9,为高表达CHKA蛋白;若评分值小于9,为低表达CHKA蛋白。因此,本实施例的120例组织样本分为CHKA蛋白高表达组和CHKA蛋白低表达组。
3.CHKA蛋白的表达与相关指标的相关性分析
结合上述120例肝癌组织样本的CHKA表达水平,通过对CHKA蛋白高表达组和CHKA蛋白低表达组的各种临床病例资料进行统计分析,结果如图3所示。由图3可知,CHKA蛋白的高表达与临床肝癌微血管侵犯(p=0.045)以及肝癌BCLC分期(p=0.028)存在统计学意义的正相关性。
本实施例通过Western-blot技术和免疫组化技术等多组实验的检测结果说明,CHKA蛋白在肝癌组织中存在特异性高表达。CHKA蛋白能增强肝癌细胞的迁移和侵袭能力,CHKA蛋白在HCC的恶性进展过程中发挥了重要作用。
实施例2
本实施例随机取120例肝癌患者手术切出组织,制备肝癌细胞患者肿瘤的组织切片,采用上述免疫组化方法检测CHKA蛋白在肝癌组织中的相对表达量。并采用实例1的CHKA蛋白相对表达量的评分计算方法得到各肝癌患者的评分值,根据评分值(评分值大于或等于9的为CHAK高表达组,评分值低于9的为CHAK低表达组)将肝癌患者分成两组,绘制出总体生存曲线图和无瘤生存曲线图(如图4和图5所示,图中n表示该组的样本数量,高表达组和低表达组的样本数量均为60)。由图4和图5可知,癌组织中CHAK呈高表达的患者手术后总体生存期和无瘤生存期明显短于癌组织中CHAK呈低表达的患者。
实施例3
本实施例提供了用于肝癌预后评估的试剂盒,该试剂盒包括用于对肝癌组织中的CHKA蛋白的相对表达量进行免疫组化检测的第一抗体即CHKA多克隆抗体,CHKA多克隆抗体由CHKA重组蛋白免疫兔子后制备得到。
该试剂盒可用于肝癌预后评估中,利用该试剂盒的CHKA多克隆抗体,并采用免疫组化染色法检测CHKA蛋白的在肝癌组织中的相对表达量。
当然,在其他的实施例中,该试剂盒还可以包括用于抗上述CHKA多克隆抗体的带有辣根过氧化物酶表达的羊抗兔抗IgG抗体。
本实施例中,该试剂盒还包括免疫组化试剂,该免疫组化试剂包括:甲苯,乙醇,3%H2O2甲醇液,抗原修复液,封闭液,DAB显色试剂,甲基绿,0.01M PBS,中性树脂,苏木精-伊红等试剂。
综上,本发明根据CHKA蛋白在癌组织中呈高表达的新性质,利用CHKA多克隆抗体,以CHKA蛋白作为分子标记,结合免疫组化试剂检测肝癌患者的CHKA蛋白在肝癌组织中的相对表达量,以CHKA蛋白的评分值大于或等于9作为高表达,以CHKA蛋白的评分值小于9作为低表达,对肝癌患者的术后总体生存期和无瘤生存期进行预判,高表达CHKA蛋白的患者后总体生存期和无瘤生存期明显低于低表达CHKA蛋白的患者。相应地,CHKA蛋白的抗体如CHKA单克隆抗体和CHKA多克隆抗体,均能够用于制备肝癌预后评估制剂或试剂盒。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种st2定量检测方法及试剂盒的制作方法
- 一种定量药粉取用盒的制作方法
- 一种层粘连蛋白(ln)测试试剂盒及其测试方法
- 一种抗核糖体P蛋白抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种阿胶胶液半成品或成品中驴、牛源性成分的定量检测方法、组合物及试剂盒的制作方法
- 一种抗PM-Scl抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种抗LKM-1抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种抗SLA/LP抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种快速定量检测h-fabp的时间分辨荧光免疫层析试剂及制备方法
- 一种定量检测液体样品中汞离子的方法及试剂盒的制作方法
- 一种定量药粉取用盒的制作方法
- 一种层粘连蛋白(ln)测试试剂盒及其测试方法
- 一种抗核糖体P蛋白抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种阿胶胶液半成品或成品中驴、牛源性成分的定量检测方法、组合物及试剂盒的制作方法
- 一种抗PM-Scl抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种抗LKM-1抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种抗SLA/LP抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种快速定量检测h-fabp的时间分辨荧光免疫层析试剂及制备方法
- 一种定量检测液体样品中汞离子的方法及试剂盒的制作方法
- 一种轴抑制蛋白2基因突变检测试剂及应用